Survival and Prognosis of Primary Mediastinal and Pulmonary Sarcoma Based on SEER Database
-
摘要:目的
利用SEER数据库分析影响原发性纵隔及肺部软组织肉瘤预后的相关因素。
方法收集SEER数据库376例患者数据,随机分为训练集(263例)与验证集(113例)。使用Kaplan-Meier法和Cox比例风险回归分析各变量与患者生存及预后的关系,建立列线图预测患者总生存期。采用校准曲线、一致性指数及ROC曲线评价列线图性能。
结果组织学类型、手术、化疗、肿瘤大小、肿瘤分期是影响原发性纵隔及肺部软组织肉瘤预后的因素。建立的列线图模型可以预测其6个月、1年及2年总生存率,校准曲线显示与实测值基本一致,训练集与验证集C指数分别为0.754与0.745,ROC的曲线下面积分别为0.849与0.924,说明具有良好的预测准确度。
结论本研究建立的列线图可以预测原发性纵隔及肺部软组织肉瘤患者6个月、1年及2年总生存率。
Abstract:ObjectiveTo analyze the factors affecting the prognosis of soft tissue sarcomas originating from the mediastinum and lung using relevant data from the SEER database.
MethodsThe data of 376 patients were collected from the SEER database, and were randomly divided into the train set (n=263) and validation set (n=113). The relationship between each variable and patient survival and prognosis was analyzed using the Kaplan-Meier method and Cox proportional risk regression to establish a nomogram, to predict the overall survival of patients. The calibration curves, consistency index, and ROC curves were used to evaluate the performance of the nomogram.
ResultsHistological type, surgery, chemotherapy, tumor size, and tumor stage were the factors affecting the prognosis of primary mediastinal and pulmonary soft tissue sarcomas. The established nomogram could predict the 6-month, 1-year, and 2-year overall survival of patients, and the calibration curves showed good prediction accuracy with measured values. C index of the train set and validation set were 0.754 and 0.745, respectively. The areas under the curve of ROC were 0.849 and 0.924.
ConclusionThe nomogram established in this study can predict 6-month, 1-year, and 2-year overall survival in patients with primary mediastinal and pulmonary soft tissue sarcoma.
-
0 引言
软组织肉瘤指来源于非上皮性骨外组织的一组具有高度异质性的恶性肿瘤,约占人类所有恶性肿瘤的0.72%~1.05%,可发生在多种解剖部位,原发性纵隔及肺部软组织肉瘤较为罕见[1]。到目前为止,针对原发性纵隔及肺部软组织肉瘤的研究大多数停留在小样本的回顾性分析或个案报道。因此,探索影响其生存及预后的因素,为临床诊疗提供更加细致精确的方案很有必要。SEER数据库收集了18个国家癌症登记处的癌症相关数据[2]。本文利用SEER数据库,探索与原发性纵隔及肺部软组织肉瘤生存及预后相关的因素,建立列线图(nomogram)模型预测生存时间,为其提供诊治及生存预测依据。
1 资料与方法
1.1 一般资料
从SEER官方网站中获取1992—2015年的原发性纵隔及肺部软组织肉瘤患者的临床信息,包括患者的性别、年龄、种族、病理类型、手术、放疗、化疗、诊断年份、原发部位、生存时间(月)、生存状态、肿瘤分期及肿瘤大小等数据。共搜集到1 291例患者数据。纳入标准:(1)组织学分类为软组织肉瘤;(2)原发部位为肺及纵隔。排除标准:(1)未经阳性组织学证实;(2)原发部位为胸腺、心脏;(3)数据库中肿瘤分期未知;(4)是否放疗未知;(5)生存时间未知。最终共纳入376例患者。以7:3的比例将其随机分为训练集与验证集,其中263例为训练集(train set),113例为验证集(validation set)。
1.2 统计学方法
使用R软件4.1.2版本对各变量进行数据分析。数据集的基本资料采用百分率表示,数值型变量采用t检验,因子型变量采用卡方检验,计算变量的P值。生存分析选择总生存时间(OS)作为主要生存指标,定义为从原发性纵隔及肺部软组织肉瘤确诊开始至(因任何原因)死亡的时间。对各个变量进行单因素Log rank分析,绘制Kaplan-Meier曲线。对相关变量进行多因素分析,利用Cox比例风险回归识别显著的预后因素,使用R软件中的forestplot包绘制森林图,P < 0.05为差异有统计学意义。基于多变量分析结果,使用R软件中的rms包构建列线图。通过bootstrap重采样法对模型进行内部(训练集)和外部验证(验证集),确定校准图,通过一致性指数(C指数)来评价模型的性能。绘制预测列线图的受试者工作特征(ROC)曲线,计算曲线下面积AUC,进一步评定模型的预测价值。
2 结果
2.1 患者基线特征
376例患中组织学类型占比前五位为平滑肌肉瘤、梭形细胞肉瘤、纤维组织肉瘤、脂肪肉瘤、滑膜肉瘤。年龄超过60岁者(> 60)有205例(54.5%),所占比例最高,见表 1。
表 1 原发性纵隔及肺部软组织肉瘤患者的基线特征Table 1 Baseline characteristics of patients with primary mediastinal and pulmonary soft tissue sarcomas
2.2 生存分析
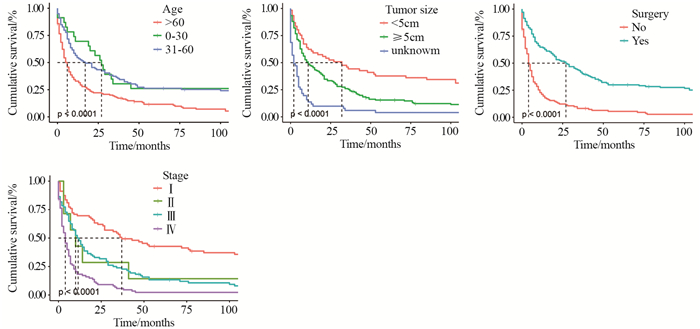
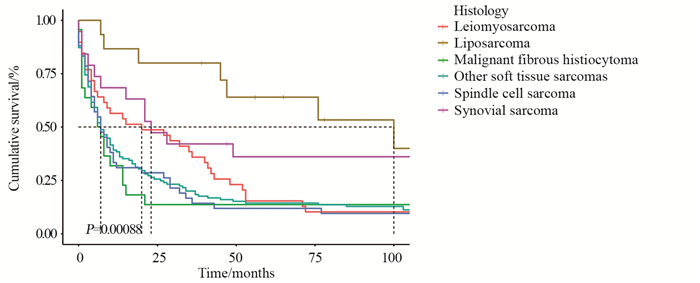
Kaplan-Meier曲线和Log rank分析显示,60岁以上、肿瘤最大径≥5 cm、未接受手术、临床分期为Ⅳ期的患者预后较差(均P < 0.001),见图 1。纤维组织肉瘤及梭形细胞肉瘤患者预后较差(P < 0.05),脂肪肉瘤预后较好,见图 2。而性别(P=0.89)、种族(P=0.21)、放疗(P=0.32)、化疗(P=0.83)和原发部位(P=0.45)与患者预后无显著相关性(图略)。
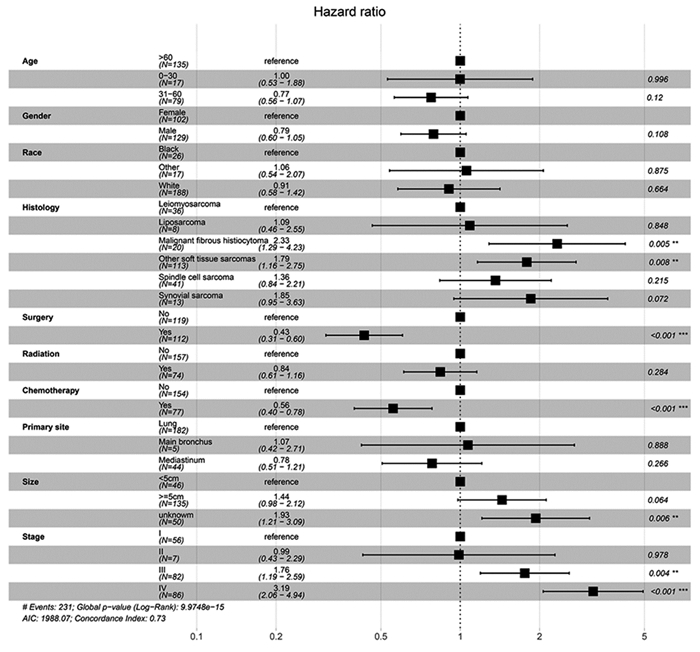
为了控制混杂变量,在多变量分析中进一步探讨单变量分析识别的危险因素。Cox比例风险回归分析显示,组织学类型(P=0.005)、手术(P < 0.001)、化疗(P < 0.001)、肿瘤大小(P=0.006)、肿瘤分期(P < 0.001)是影响预后的因素。其中,手术、化疗为保护因素;组织学类型为纤维组织肉瘤、肿瘤≥5cm、临床分期为Ⅲ期和Ⅳ期为危险因素,见图 3。
2.3 预测列线图及效果评价
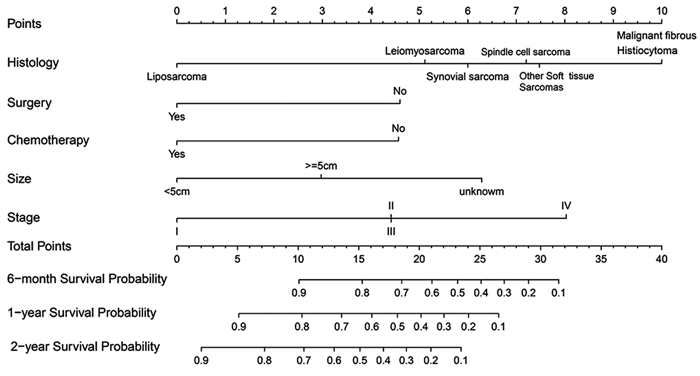
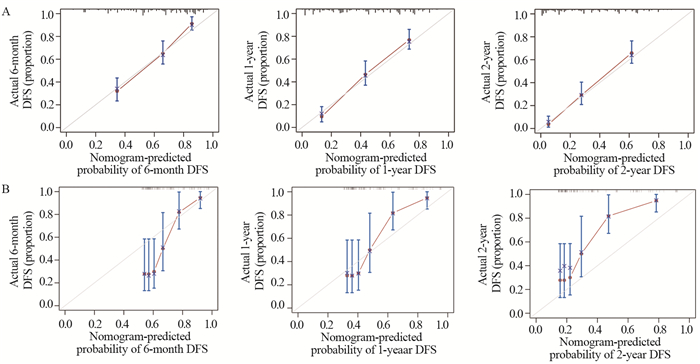
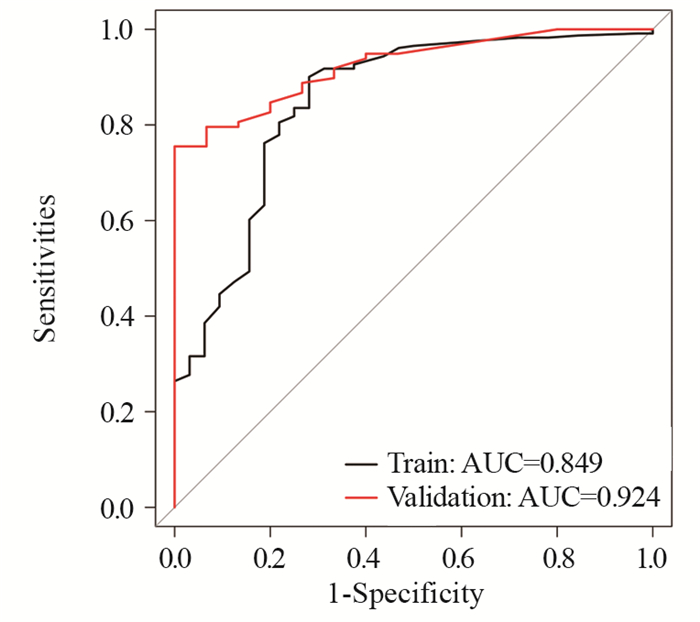
基于多因素分析发现的显著危险因素构建预测原发性纵隔及肺部软组织肉瘤6个月、1年及2年总生存率的列线图(nomogram)模型。根据列线图上的每个预后因素获得评分,通过分数相加获得的总分对应相应的量表来确定6个月、1年及2年的总生存率,见图 4。通过bootstrap重采样法对模型进行内部(训练集)及外部(验证集)验证,确定了校准图。校正曲线趋势接近理想曲线,显示了与实际生存的良好一致性。通过一致性指数(C指数)评价nomogram模型的性能,计算出nomogram模型的训练集及验证集C指数分别为0.754和0.745,显示对原发性纵隔及肺部软组织肉瘤患者总生存期的预测准确性较高,见图 5。ROC曲线显示,列线图模型预测训练集及验证集的曲线下面积(AUC)为0.849和0.924,提示列线图模型具有良好的精准度和区分度,见图 6。
3 讨论
软组织肉瘤是罕见的结缔组织恶性肿瘤,在欧洲平均年发病率为4/105~5/105,原发性纵隔及肺部软组织肉瘤更加罕见[3-4]。有研究表明,软组织肉瘤的中位总生存期为12~15个月[4],本研究显示原发性纵隔及肺部软组织肉瘤具有较短的中位生存时间,预后较差,这与之前的研究相一致。与四肢和躯干浅表部位不同,原发性纵隔及肺部软组织肉瘤起病隐匿[5],由于解剖结构特殊,早期手术可能较为困难;且针对纵隔及肺部软组织肉瘤的治疗尚无具体的指南,其早期诊断率及生存率仍然较低。原发性纵隔及肺部软组织肉瘤可表现出与其他原发性肺肿瘤相似的非特异性症状,常常需与原发性肺癌相鉴别。因此,深入了解原发性纵隔及肺部软组织肉瘤很有必要。由于其罕见性,大部分针对原发性纵隔及肺部软组织肉瘤的研究都停留在个案报道或小样本回顾分析,目前并无针对原发性纵隔及肺部软组织肉瘤相关预后模型的建立。对于这种高度异质性且预后差的肿瘤,针对每个病例采取个体化的治疗更加重要。本研究对其预后进行科学评估,建立列线图预测模型,从而选择对患者最有利的个体化诊治计划,避免过度医疗或不足。在实际应用中,若预测生存率高,采取积极治疗可使患者获益;若预测生存率低,则可以根据具体预测模型调整治疗方案,采取保守或姑息性治疗,进行个体化选择,尽可能延长患者生存时间,减轻患者痛苦。
本研究中,单因素分析显示年龄超过60岁是影响预后的危险因素,而多因素分析并未显示显著统计学差异,考虑老年患者各个器官功能下降,常常合并多种基础疾病,以及在治疗时倾向于保守策略等原因导致老年患者预后更差,Engelhardt等对美国国家癌症数据库的回顾性队列分析表明,更小年龄组纵隔肉瘤患者预后更好[3]。但年轻患者代谢较快,肿瘤的生长速度较快,易复发及转移,且年轻患者可能合并恶性度高的肿瘤,也可导致其预后更差,因此我们并未纳入年龄作为预后影响因素。本研究结果显示性别及种族与原发性纵隔及肺部软组织肉瘤预后无明显相关,既往也少有相关研究显示性别及种族与其预后的关系,其对预后的影响还需进一步验证。本研究显示,肿瘤最大径≥5 cm,预后差,这可能与肉瘤局部侵犯重要组织结构相关[6]。在本研究中,肿瘤分期也是原发性纵隔及肺部软组织肉瘤的独立预后因素。多年来,基于疾病的解剖范围及癌症分期等因素所定义的肿瘤分期,一直被认为是一个基本的决定肿瘤预后的因素,进一步证明了早期诊断在肿瘤诊治中的重要性[7]。
肉瘤的组织学类型是影响预后的一个重要因素。本研究中,脂肪肉瘤预后较好,纤维组织肉瘤及梭形细胞肉瘤预后更差。既往研究也表明,脂肪肉瘤的恶性程度较其他亚型肉瘤低[8]。软组织肿瘤有100多种不同的组织学亚型,基于组织学和分子遗传学的差异,不同软组织肉瘤预后也各不相同[9]。如在透明细胞肉瘤中,可有EWSR1-ATF1或EWSR1-CREB1融合基因的产生,使透明细胞肉瘤具有明显的临床特征,包括高转移性、区域淋巴结扩散以及局部复发的趋势。已有研究表明,利用癌症相关基因组图谱可以预测肿瘤预后。Gong等发现2-酮戊二酸5-双加氧酶超家族过表达的软组织肉瘤预后不良[10]。未来基于遗传学发展出的新的分类方式可能是软组织肉瘤治疗及预后的一个有前景的发展方向[11]。
在治疗方面,手术为影响原发性纵隔及肺部软组织肉瘤预后的一个重要因素[12]。手术是软组织肉瘤主要治疗方法,对于可切除的肿瘤,完整的手术切除可以提高生存率[1, 4]。本研究数据显示放疗与原发性纵隔及肺部软组织肉瘤的预后无明显相关,这可能是由不同组织学类型对放疗敏感度不同所致[13]。放疗作为软组织肉瘤生存率的独立预后影响因素,其证据并不十分充分[14]。在一项随机临床试验中,在可切除的脂肪肉瘤和高分化脂肪肉瘤中没有观察到术前放疗的疗效,而在低恶性分级亚组中能观察到效果[1]。放疗对生存率的影响仍需进一步探索。本研究结果显示,在单因素分析中化疗不是影响生存率的危险因素,但多因素分析显示化疗可以提高患者的生存率。这可能由于化疗与其他混杂因素存在一定关联,例如在早期患者中,可能采取手术切除的方式即可获得一定缓解,并未采取化疗,从而影响化疗对生存率的影响。通过多因素分析消除其他因素的影响后,证明其对生存影响具有独立作用。研究表明,不同类型肉瘤患者对化疗反应不同[15]。滑膜肉瘤被认为是软组织肉瘤中最具化疗敏感度的亚型之一。在脂肪肉瘤中,多形性和黏液样圆细胞脂肪肉瘤对化疗尤其敏感,非典型脂肪肉瘤或高分化脂肪肉瘤对化疗的反应较差[16]。化疗对肉瘤预后的影响与组织学类型有关。作为一类高度恶性的肿瘤,软组织肉瘤的治疗现已逐渐发展为包括手术、化疗、放疗、消融、栓塞治疗、免疫治疗及靶向治疗等多模式、多学科的联合治疗[17]。尽管采取多学科的联合诊治,原发性纵隔及肺部软组织肉瘤患者还是预后差。本研究通过纳入多个预后影响因素,建立列线图生存预测模型,有效预测原发性纵隔及肺部软组织肉瘤患者生存率,可为临床医生的诊疗决策方案提供有利选择。
本研究也存在一定局限性,首先,SEER数据库关于手术切缘、具体放疗、化疗方法等数据记录不完整,无法进行评估;其次,SEER数据库主要基于西欧和美洲人群数据,后续还需要进行进一步的多中心研究来验证我们的结论。
综上所述,组织学类型、手术、化疗、肿瘤大小、肿瘤分期是影响原发性纵隔及肺部软组织肉瘤预后的因素,本研究综合这些预后因素建立的列线图生存预测模型,可以预测患者6个月、1年及2年总生存率,具有良好的准确度。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:胡珍:数据收集、统计、分析及论文撰写李升锦:研究设计及文章审校 -
表 1 原发性纵隔及肺部软组织肉瘤患者的基线特征
Table 1 Baseline characteristics of patients with primary mediastinal and pulmonary soft tissue sarcomas

-
[1] Gronchi A, Miah AB, Dei Tos AP, et al. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(11): 1348-1365. doi: 10.1016/j.annonc.2021.07.006
[2] Wu WT, Li YJ, Feng AZ, et al. Data mining in clinical big data: the frequently used databases, steps, and methodological models[J]. Mil Med Res, 2021, 8(1): 44.
[3] Engelhardt KE, Decamp MM, Yang AD, et al. Treatment Approaches and Outcomes for Primary Mediastinal Sarcoma: Analysis of 976 Patients[J]. Ann Thorac Surg, 2018, 106(2): 333-339. doi: 10.1016/j.athoracsur.2018.03.068
[4] von Mehren M, Kane JM, Agulnik M, et al. Soft Tissue Sarcoma, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2022, 20(7): 815-833. doi: 10.6004/jnccn.2022.0035
[5] Khalil M, Ahmed MT, Abouelasaad M, et al. A Disastrous Huge Anterior Mediastinal Synovial Sarcoma[J]. Cardiovasc Revasc Med, 2022, 37: 153-155. doi: 10.1016/j.carrev.2021.10.002
[6] Collaud S, Stork T, Schildhaus HU, et al. Multimodality treatment including surgery for primary pulmonary sarcoma: Size does matter[J]. J Surg Oncol, 2020, 122(3): 506-514. doi: 10.1002/jso.25979
[7] Cates JMM. The AJCC 8th Edition Staging System for Soft Tissue Sarcoma of the Extremities or Trunk: A Cohort Study of the SEER Database[J]. J Natl Compr Canc Netw, 2018, 16(2): 144-152. doi: 10.6004/jnccn.2017.7042
[8] Lu J, Wood D, Ingley E, et al. Update on genomic and molecular landscapes of well-differentiated liposarcoma and dedifferentiated liposarcoma[J]. Mol Biol Rep, 2021, 48(4): 3637-3647. doi: 10.1007/s11033-021-06362-5
[9] Foersch S, Eckstein M, Wagner DC, et al. Deep learning for diagnosis and survival prediction in soft tissue sarcoma[J]. Ann Oncol, 2021, 32(9): 1178-1187. doi: 10.1016/j.annonc.2021.06.007
[10] Gong S, Schopow N, Duan Y, et al. PLOD Family: A Novel Biomarker for Prognosis and Personalized Treatment in Soft Tissue Sarcoma[J]. Genes (Basel), 2022, 13(5): 787. doi: 10.3390/genes13050787
[11] 牛晓辉, 徐海荣. 分子检测在骨与软组织肉瘤诊治中的必要性和迫切性[J]. 中华医学杂志, 2022, 102(31): 2399-2404. Niu XH, Xu HR. The necessity and urgency of molecular analysis in the diagnosis and treatment of bone and soft tissue sarcomas[J]. Zhonghua Yi Xue Za Zhi, 2022, 102(31): 2399-2404.
[12] Gronchi A. Surgery in soft tissue sarcoma: the thin line between a surgical or more conservative approach[J]. Future Oncol, 2021, 17(21s): 3-6. doi: 10.2217/fon-2021-0449
[13] Salerno KE. Radiation Therapy for Soft Tissue Sarcoma: Indications, Timing, Benefits, and Consequences[J]. Surg Clin North Am, 2022, 102(4): 567-582. doi: 10.1016/j.suc.2022.04.001
[14] Feng XY, Li J, Li AM, et al. Stereotactic body radiotherapy for recurrent and oligometastatic soft tissue sarcoma[J]. World J Surg Oncol, 2022, 20(1): 322. doi: 10.1186/s12957-022-02781-1
[15] Virgili Manrique AC, Salazar J, Arranz MJ, et al. Pharmacogenetic Profiling in High-Risk Soft Tissue Sarcomas Treated with Neoadjuvant Chemotherapy[J]. J Pers Med, 2022, 12(4): 618. doi: 10.3390/jpm12040618
[16] Meyer M, Seetharam M. First-Line Therapy for Metastatic Soft Tissue Sarcoma[J]. Curr Treat Options Oncol, 2019, 20(1): 6. doi: 10.1007/s11864-019-0606-9
[17] Panagi M, Pilavaki P, Constantinidou A, et al. Immunotherapy in soft tissue and bone sarcoma: unraveling the barriers to effectiveness[J]. Theranostics, 2022, 12(14): 6106-6129. doi: 10.7150/thno.72800
-
期刊类型引用(1)
1. 顾庆龙,王依晖,刘曙亮. 原发性肺脂肪肉瘤1例并文献复习. 肿瘤研究与临床. 2024(10): 784-786 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: