Application of 18F-FDG PET-CT Simulation Localization in Radiotherapy of Recurrent Abdominal and Pelvic Tumors
-
摘要:目的
探讨18F-FDG PET-CT模拟定位在复发腹盆腔肿瘤放疗中的临床价值。
方法采用18F-FDG PET-CT对38例治疗后复发的腹盆腔肿瘤患者进行模拟定位, 分别根据CT影像及18F-FDG PET-CT拟定全身治疗方案及放疗靶区勾画, 对比二者差异。
结果在38例患者中, 21.1%(8/38)发现了盆腹腔外远处转移, 改变了治疗方案。34例(89.5%)放射治疗靶区发生了改变。GTVPET-CT的均值为118.14 cm3, GTVCT的均值为148.53 cm3(P=0.044)。
结论18F-FDG PET-CT模拟定位对于复发盆腹腔肿瘤患者, 完善了肿瘤再分期, 改变了部分患者治疗方案, 更加精确放射治疗靶区。
-
关键词:
- 腹盆腔肿瘤 /
- 18F-FDGPET-CT模拟定位 /
- 放射治疗
Abstract:ObjectiveTo investigate the clinical application value of 18F-FDG PET-CT simulation localization in radiotherapy of recurrent abdominal and pelvic tumors.
Methods18F-FDG PET-CT was used to simulate positioning 38 patients with abdominal and pelvic tumors who relapsed after treatment.Based on both CT images and 18F-FDG PRT-CT, we drew up a systemic treatment plan and outlined the radiotherapy target area, and then compared the differences between the two methods.
ResultsIn 38 patients, 21.1%(3/8) of patients were found to have distal metastases outside the pelvic and abdominal cavity, and changed the systemic treatment plan.The radiotherapy target was altered in 34(89.5%) patients.The mean value of GTVPET-CT was 118.14cm3and the mean value of GTVCT was 148.53cm3(P=0.044).
ConclusionFor patients with recurrent abdominal and pelvic tumors, 18F-FDG PET-CT simulation localization treatment improves tumor re-staging, changes the integrated therapy for some patients, and makes the target area of radiotherapy more accurate.
-
0 引言
腹盆腔恶性肿瘤尽管采用了手术、放疗和化疗等综合性治疗手段,但治疗后局部失败率仍高达20%~77%[1]。目前,对于局部复发的腹盆腔恶性肿瘤患者,尤其是无法进行手术或存在化疗抵抗的患者,尚无有效的标准治疗方案[2]。姑息性放射治疗是可选择的方式之一,其目的是改善局部症状。但是由于局部复发腹盆腔肿瘤患者经过手术及放化疗,人体的解剖层次破坏,残余肠道与周围组织器官相对位置发生改变,外加瘢痕增生、炎性水肿等原因,瘢痕和肿瘤混合生长,CT及MRI难以区分肿瘤组织和正常组织及病灶周围的非肿瘤病变组织界限[3],造成放疗靶区难以精确化,致使放射性肠道损伤发生率高达50%,甚至2%~10%的患者发生了如肠管狭窄、纤维化和瘘管等严重损伤[4]。研究表明[5],PET-CT可以同时获得CT解剖图像和PET功能代谢图像,对于精确规划肿瘤生物靶区、降低不良反应比例具有重要意义:一是可以发现更多肿瘤外部侵犯和远处转移,从而扩大治疗计划;二是通过鉴别肿瘤组织周围的良性病变(如肺不张、组织坏死等)而缩小由CT确定的GTV,从而有效提高肿瘤控制、降低正常组织损伤。临床上一般使用模拟定位CT图像融合诊断PET-CT图像的方法进行靶区勾画,但是由于采集时间和体位不同,两者刚性配准可能会导致较大误差,这些差异可能会导致肿瘤照射剂量不足和危及器官过量[6]。全身PET-CT放疗模拟定位一次扫描即可完成患者全身影像诊断及局部放疗定位,具有评估腹盆腔外远处转移,精确局部放射治疗靶区的优势。本研究旨在探讨全身PET-CT放疗模拟定位在复发腹盆腔肿瘤中的应用,为进一步优化全身治疗方案及精确靶区勾画提供依据。
1 资料与方法
1.1 一般资料
选取2018年1月—2020年6月在我院治疗的复发腹盆腔肿瘤患者38例。年龄28~81岁(中位年龄58岁);其中男14例,女24例。局部放疗时间距离手术或放化疗后中位时间为14月(3~60月),具体临床特征见表 1。
表 1 38例复发腹盆腔肿瘤基本临床特征Table 1 Basic characteristics of 38 recurrent abdominal and pelvic tumors patients
1.2 PET-CT模拟定位
1.2.1 体位固定和制模
患者均采取仰卧位或俯卧位,使用热塑膜、真空垫、仰卧模架及俯卧体架(CIVCO公司,美国)进行体位固定和制模。
1.2.2 仪器设备与药物
飞利浦Ingenuity TF型PET-CT(荷兰飞利浦公司);18F-FDG(西安江源安迪科正电子技术有限公司)。
1.2.3 18F-FDG PET-CT模拟定位方法
患者禁食6 h以上,经静脉三通管注射18F-FDG 4.44 MBq/kg(0.12 mCi/kg),安静平卧休息45~60 min,排空小便后行PET-CT模拟定位显像。换用放疗定位专用平板碳纤维床(CIVIC,美国),水平尺测量校正,患者仰卧或俯卧于定位板上,给予热塑体膜或真空垫固定,三维激光在体表标记3个“十”字标,记录患者体位。行常规全身PET-CT显像。平静呼吸下先行CT扫描,采集条件为管电压120 kV、管电流150 mA、螺距1.75:1。PET图像三维采集,体部采集每投射野1 min,8个投射野;头部采集时每投射野1 min,1个投射野。以CT数据行衰减校正,迭代法重建后将PET-CT融合图像传至计划系统。
1.3 PET-CT图像分析
按常规诊断PET-CT分析图像,并出具诊断报告。所有18F-FDG PET-CT图像的报告经2位有经验的核医学医生阅片。
1.4 制定治疗方案及肿瘤靶区勾画
PET-CT和常规影像(conventional imaging, CI)数据通过医学数字成像及通信(digital imaging and communication of medicine, DICOM)格式输入放射治疗计划系统。制定治疗方案并勾画治疗靶区。定义大体肿瘤体积(gross tumor volume, GTV),包括影像学可见的转移肿瘤组织和转移淋巴结,GTVCT为基于常规CT模拟定位影像(可参考增强CT核磁超声等常规影像)制定的靶区。GTVPET-CT为基于18F-FDG PET-CT模拟定位制定的靶区,根据放疗医师的经验,使用临床常用的视觉分辨法勾画,即由肉眼最适地勾画出肿瘤高代谢范围。这种勾画方式存在较大的观察者差异,但由于目前从PET-CT图像工作站将图像传输至放疗计划系统后仅保留了PET影像的密度,其固有的SUV数据丢失,所以视觉分辨勾画PET靶区仍是临床常用的方法[7-8]。
1.5 统计学方法
采用SPSS20.0软件进行配对t检验,P < 0.05为差异有统计学意义。
2 结果
2.1 探测腹盆腔外转移灶行临床再分期
38例患者中,18F-FDG PET-CT模拟定位发现了8例腹盆腔外的转移灶,其中5例肺转移,1例胸椎骨转移,3例锁骨上淋巴结转移(其中1例合并肺转移)。6例患者临床分期上升至Ⅳ期,其中1例宫颈癌患者因分期上升改变了原盆腔清廓术手术计划。
2.2 GTVPET-CT与GTVCT勾画情况
与CT定位对比,34例患者(89.5%)18F-FDG PET-CT模拟定位的GTV发生了变化。GTVPET-CT的均值为118.14 cm3,GTVCT的均值为148.53 cm3,两者比较差异有统计学意义(P=0.044)。
34例GTV发生改变的患者中,14例体积增加,平均增加20.59 cm3(3.77~55.11 cm3)。20例体积减少,平均减少73.72 cm3(7.07~430.85 cm3)。
2.2.1 14例体积增加患者情况
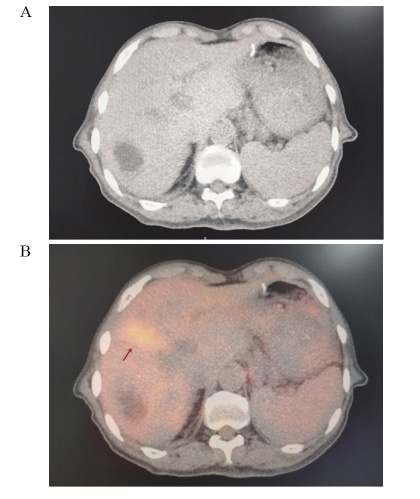
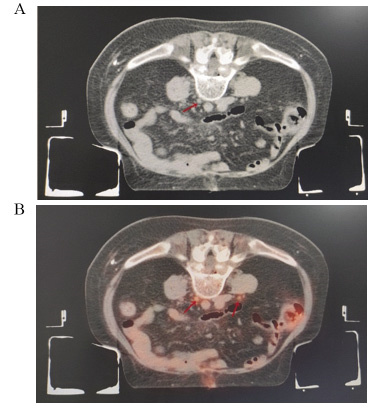
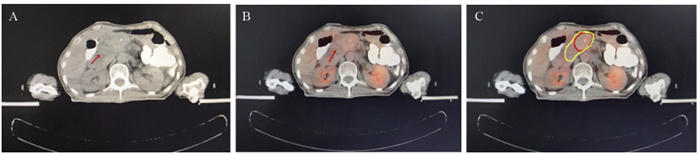
2例患者CT影像无形态学改变,PET-CT显示FDG代谢增高,其中1例为69岁男性胆囊癌R0术后,CA199为92.2 U/L。常规CT影像未发现异常。行18F-FDG PET-CT模拟定位时,发现瘤床区高代谢,见图 1;1例为结肠癌术后肝转移化疗后,肿瘤标志物正常,常规CT评价疗效稳定(stable disease, SD),而18F-FDG PET-CT模拟定位发现肝右叶包膜下高代谢,考虑肝转移瘤治疗后仍有活性。2例患者均给予立体定向放射治疗(stereotactic body radiation therapy, SBRT)。7例患者PET-CT影像发现微小转移淋巴结,典型病例影像见图 2。5例患者肿瘤生物靶区勾画边缘“Halo晕环”(PET-CT图像高代谢周围出现的厚度为2.0±0.5 mm的晕环)靶区扩大,典型病例影像见图 3。
![]() 图 2 18F-FDG PET-CT精准识别微小转移淋巴结Female, 69 years old, SCC=7.7ng/ml; SCC: squamous cell carcinoma antigen. A: CT images; B: 18F-FDG PET-CT scan showed a hypermetabolism region in lymph nodes with retroperitoneal diameter <1cm (red arrow).Figure 2 18F-FDG PET-CT accurately identified micro metastatic lymph nodes
图 2 18F-FDG PET-CT精准识别微小转移淋巴结Female, 69 years old, SCC=7.7ng/ml; SCC: squamous cell carcinoma antigen. A: CT images; B: 18F-FDG PET-CT scan showed a hypermetabolism region in lymph nodes with retroperitoneal diameter <1cm (red arrow).Figure 2 18F-FDG PET-CT accurately identified micro metastatic lymph nodes![]() 图 3 18F-FDG PET-CT精准识别肿瘤生物靶区边缘Female, 71 years old, SCC=0.37ng/ml. A: CT images; B, C: 18F-FDG PET-CT scan showed in situ recurrence of cervical cancer after concurrent radiotherapy and chemotherapy; yellow: GTVCT; red: GTVPET-CT.Figure 3 18F-FDG PET-CT accurately identified margin of tumor biological targets
图 3 18F-FDG PET-CT精准识别肿瘤生物靶区边缘Female, 71 years old, SCC=0.37ng/ml. A: CT images; B, C: 18F-FDG PET-CT scan showed in situ recurrence of cervical cancer after concurrent radiotherapy and chemotherapy; yellow: GTVCT; red: GTVPET-CT.Figure 3 18F-FDG PET-CT accurately identified margin of tumor biological targets2.2.2 20例体积减少患者情况
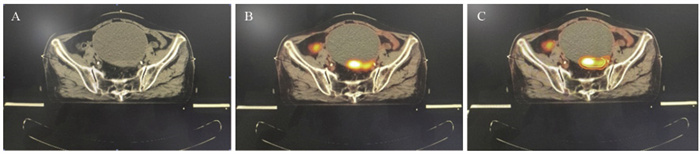
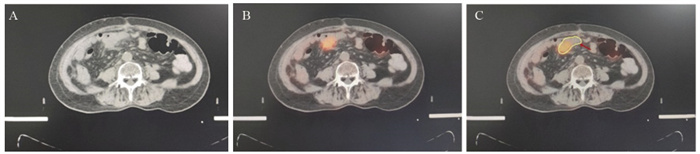
17例患者在18F-FDG PET-CT图像中,由于肿瘤与邻近肠管等正常组织分界更清晰,减少了GTV体积,典型病例影像见图 4,3例因为肿瘤坏死,常规CT显示低密度,而18F-FDG PET-CT显像无代谢而被排除在GTV以外,典型病例影像见图 5。
![]() 图 4 18F-FDG PET-CT精准分辨肿瘤与正常组织界限Female, 81 years old, CA199>554.81u/l. A: CT images; B, C: on 18F-FDG PET-CT scan, the boundary between tumor and adjacent intestinal canal was clearer; yellow: GTVCT; red: GTVPET-CT.Figure 4 18F-FDG PET-CT accurately distinguished boundary between tumor and normal tissue
图 4 18F-FDG PET-CT精准分辨肿瘤与正常组织界限Female, 81 years old, CA199>554.81u/l. A: CT images; B, C: on 18F-FDG PET-CT scan, the boundary between tumor and adjacent intestinal canal was clearer; yellow: GTVCT; red: GTVPET-CT.Figure 4 18F-FDG PET-CT accurately distinguished boundary between tumor and normal tissue![]() 图 5 18F-FDG PET-CT精准识别组织坏死区Female, 53 years old, CA199>2000u/L. Tumor necrosis in patients with pancreatic cancer after operation, conventional CT showed low density(A) and 18F-FDG PET-CT imaging was not hypermetabolism and excluded from GTV (B, C); yellow: GTVCT; red: GTVPET-CT.Figure 5 18F-FDG PET-CT accurately identified tissue necrosis area
图 5 18F-FDG PET-CT精准识别组织坏死区Female, 53 years old, CA199>2000u/L. Tumor necrosis in patients with pancreatic cancer after operation, conventional CT showed low density(A) and 18F-FDG PET-CT imaging was not hypermetabolism and excluded from GTV (B, C); yellow: GTVCT; red: GTVPET-CT.Figure 5 18F-FDG PET-CT accurately identified tissue necrosis area3 讨论
PET/CT可以将肿瘤病灶的代谢信息表达出来,以确定肿瘤组织和正常组织及病灶周围的非肿瘤病变组织的界限,以及肿瘤病灶内肿瘤细胞的分布情况,依据其标准摄取值大小,对肿瘤部位高放射性浓聚区勾画靶区,真正实现了根据生物靶区(BTV)制定放疗计划的目的,其靶区范围、大小等参数均与常规CT有一定区别[9]。Kruser等[10]研究发现应用18F-FDG PET-CT显像后,68%的患者在放射治疗靶区、范围、放射剂量或治疗方式等方面发生了变化。由此可见,PET/CT对于放疗靶区勾画具有重要指导意义,但是诊断PET-CT图像是在弧形扫描床上获取,患者无体表标记及热塑膜等固定装置,而定位CT图像是在平板床上进行,将两次图像刚性融合直接用于靶区勾画可能导致较大误差[11],同机扫描可最大限度减少图像配准误差[12],本研究利用18F-FDG PET-CT进行模拟定位并直接应用于放疗计划设计,避免了患者重复CT定位,消除了由于体位、固定及位置不同引起的误差,因此,直接使用PET-CT进行靶区定义是目前更推荐的方法[6]。
腹盆腔肿瘤局部复发,常常存在远处转移。18F-FDG PET-CT能提高常规影像发现远地转移的效能[13-16]。本研究中,21.1%(8/38)例患者发现了腹盆腔外的转移灶,可进一步行肿瘤再分期,精准综合治疗方案。
腹腔结构复杂,受病灶大小、位置、肿瘤形态、腹腔脂肪、肠道充盈情况等多因素影响,常规CT在准确评估腹腔淋巴结及脏器转移等方面容易出现漏诊[17]。常规CT成像软组织分辨率低,尤其是在弥漫性腹膜病变的患者中,腹膜转移的密度与周围软组织相似,导致CT诊断的敏感度和诊断性能降低[18]。多项研究表明,18F-FDG PET/CT在检测淋巴结转移及腹盆腔转移方面较常规影像学检查更有优势[17-20]。本研究中,14例出现靶区体积增加。2例患者CT影像无形态学改变,7例患者根据常规影像诊断标准未诊断出腹膜后微小淋巴结转移,而18F-FDG PET/CT模拟定位均显示了高代谢,漏诊率23.7%(9/38例)。另外5例由于“Halo晕环”致使GTV体积增加,根据此晕环边界勾画靶区,与手术切除大体标本病理结果更加一致[21-22]。由此可见,根据18F-FDG PET/CT模拟定位结果制定放疗计划防止了漏靶。
在肿瘤放射治疗过程中,正确的识别肿瘤区域与非肿瘤区域,如何在不发生靶区遗漏的前提下最大程度的缩小大体肿瘤靶区,这是放疗医生需面对的一个重要问题。腹盆腔肿瘤局部复发患者的肿瘤组织常常与肠管、术后瘢痕及坏死混杂一起,常规影像(包括内镜)难以明确其边界。目前,PET-CT模拟定位在合并肺不张的中心型肺癌中研究较多,18F-FDG PET/CT可以识别肺不张区域与肿瘤病变区域的边界,25%~100%患者GTV体积减小[10, 23-25]。本研究52.6%(20/38)的患者因18F-FDG PET/CT模拟定位缩小了靶区,其中85%(17/20)是因为明确了肿瘤与正常组织的边界,减少不必要的照射体积,降低正常组织的照射剂量。
本研究仍然存在一些不足,研究样本选取量较少,病种及复发部位比较分散,需通过前瞻性多中心大样本量的临床研究进一步探讨。
综上研究表明,采用18F-FDG PET-CT对复发的腹盆腔肿瘤患者进行模拟定位,可进行肿瘤再分期,调整综合治疗方案,精确靶区勾画,特别是可避让腹盆腔正常组织,减少不良反应。
Competing interests: The authors declare that they have no competing interests.作者贡献:金龙:病例收集、论文撰写、统计分析徐大蒙、周园园:图像采集、放疗模拟定位于娇:靶区勾画、论文修改 -
表 1 38例复发腹盆腔肿瘤基本临床特征
Table 1 Basic characteristics of 38 recurrent abdominal and pelvic tumors patients

-
[1] Halperin EC, Wazer DE, Perez CA, et al. Perez and Brady' s principles and practice of radiation oncology[M]. 6th ed. Waltham: Wolters Kluwer Health, 2013: 1521-1522.
[2] Wen X, Qiu H, Shao Z, et al. Pulsed low-dose rate radiotherapy has an improved therapeutic effect on abdominal and pelvic malignancies[J]. J Zhejiang Univ Sci B, 2021, 22(9): 774-781. doi: 10.1631/jzus.B2000793
[3] Cliffe H, Patel C, Prestwich R, et al. Radiotherapy response evaluation using FDG PET-CT- established and emerging applications[J]. Br J Radiol, 2016, 90(1071): 20160764.
[4] Kumagai T, Rahman F, Smith A. The microbiome and radiation induced-bowel injury: evidence for potential mechanistic role in disease pathogenesis[J]. Nutrients, 2018, 10(10): 1405. doi: 10.3390/nu10101405
[5] Mercieca S, Belderbos JSA, van Herk M. Challenges in the target volume definition of lung cancer radiotherapy[J]. Transl Lung Cancer Res, 2021, 10(4): 1983-1998. doi: 10.21037/tlcr-20-627
[6] Church J. The Role of PET-CT in Radiation Therapy Planning[J]. Radiol Technol, 2018, 89(4): 399-401.
[7] 朱苏雨, 胡炳强. PET-CT用于肿瘤精确放疗靶区勾画的困惑[J]. 国际放射医学核医学杂志, 2007, 31(4): 217-221. doi: 10.3760/cma.j.issn.1673-4114.2007.04.008 [Zhu SY, Hu BQ. The dilemma of the target delineation with PET-CT in the radiotherapy planning for malignant tumors[J]. Guo Ji Fang She Yi Xue He Yi Xue Za Zhi, 2007, 31(4): 217-221. ] doi: 10.3760/cma.j.issn.1673-4114.2007.04.008
[8] 朱苏雨, 席许平, 胡炳强. PET/CT用于肿瘤放疗计划靶区勾画的相关问题[J]. 中国肿瘤, 2010, 19(8): 494-499. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU201008003.htm [Zhu SY, Xi XP, Hu BQ. Issues on target delineation for radiation with PET/CT[J]. Zhongguo Zhong Liu, 2010, 19(8): 494-499. ] https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU201008003.htm
[9] Hanaoka K, Okumura M, Monzen H. PET/CT Simulation for Radiation Therapy Planning[J]. Igaku Butsuri, 2018, 38(2): 85-88.
[10] Kruser TJ, Bradley KA, Bentzen SM, et al. The impact of hybrid PET-CT scan on overall oncologic management, with a focus on radiotherapy planning: a prospective, blinded study[J]. Technol Cancer Res Treat, 2009, 8(2): 149-158. doi: 10.1177/153303460900800208
[11] 石景真, 李奉祥, 李建彬, 等. 诊断PET-CT用于食管癌原发肿瘤大体肿瘤体积勾画的比较研究[J]. 中华放射医学与防护杂志, 2020, 40(4): 290-295. https://cdmd.cnki.com.cn/Article/CDMD-10422-1020136018.htm [Shi JZ, Li FX, Li JB, et al. Comparison of the gross target volume based on diagnostic PET/CT for primary esophageal cancer[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2020, 40(4): 290-295. ] https://cdmd.cnki.com.cn/Article/CDMD-10422-1020136018.htm
[12] 张英杰, 李建彬. PET-CT应用于非小细胞肺癌放疗计划的研究进展[J]. 中华放射肿瘤学杂志, 2019, 28(11): 876-879. doi: 10.3760/cma.j.issn.1004-4221.2019.11.017 [Zhang YJ, Li JB. Research progress on PET-CT in radiotherapy planning for non-small cell lung cancer[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2019, 28(11): 876-879. ] doi: 10.3760/cma.j.issn.1004-4221.2019.11.017
[13] Akin EA, Qazi ZN, Osman M, et al. Clinical impact of FDG PET/CT in alimentary tract malignancies: an updated review[J]. Abdom Radiol(NY), 2020, 45(4): 1018-1035. doi: 10.1007/s00261-020-02447-0
[14] 胡晓燕, 李蕾, 倪茵, 等. 18F-FDG PET/CT诊断肝细胞癌及肝内胆管细胞癌[J]. 中国医学影像技术, 2018, 34(9): 1372-1376. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXX201809033.htm [Hu XY, Li L, Ni Y, et al. 18F-FDG PET/CT in diagnosis of hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2018, 34(9): 1372-1376. ] https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXX201809033.htm
[15] Monteil J, Le BrunLy V, Cachin F, et al. Comparison of 18FDG-PET/CT and conventional follow-up methods in colorectal cancer: A randomised prospective study[J]. Dig Liver Dis, 2021, 53(2): 231-237. doi: 10.1016/j.dld.2020.10.012
[16] 陈兰兰, 郝珊瑚, 张国旭, 等. PET/CT显像在妇科恶性肿瘤术后复发及转移中的临床应用价值[J]. 现代肿瘤医学, 2019, 27(4): 657-660. doi: 10.3969/j.issn.1672-4992.2019.04.029 [Chen LL, Hao SH, Zhang GX, et al. Clinical value of PET/CT imaging in the recurrence and metastasis of gynecologic malignant tumors postoperatively[J]. Xian Dai Zhong Liu Yi Xue, 2019, 27(4): 657-660. ] doi: 10.3969/j.issn.1672-4992.2019.04.029
[17] 胡鹏程, 石洪成, 顾宇参, 等. 18F-FDGPET/CT与增强CT诊断腹部肿瘤腹腔转移的对比研究[J]. 中华核医学与分子影像杂志, 2013, 33(3): 228-229. [Hu PC, Shi HC, Gu YS, et al. Comparative study of 18F-FDG PET/CT and enhanced CT in diagnosis of abdominal tumor metastasis[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Za Zhi, 2013, 33(3): 228-229. ]
[18] 黄世明, 吴思雨, 孙永锋, 等. 不同影像诊断方法对卵巢癌腹膜转移诊断价值的系统评价[J]. 中华介入放射学电子杂志, 2021, 9(2): 177-182. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHJR202102011.htm [Huang SM, Wu SY, Sun YF, et al. Meta-analysis of the diagnostic value of different imaging methods for peritoneal metastasis of ovarian cancer[J]. Zhonghua Jie Ru Fang She Xue Dian Zi Za Zhi, 2021, 9(2): 177-182. ] https://www.cnki.com.cn/Article/CJFDTOTAL-ZHJR202102011.htm
[19] Calles-Sastre L, Mucientes-Rasilla J, San-Frutos Llorente LM, et al. Prognostic significance of metabolic tumor volume and total lesion glycolysis in patients with advanced cervical carcinoma[J]. Rev Esp Med Nucl Imagen Mol(Engl ED), 2019, 38(1): 17-21. .
[20] Takagi H, Sasagawa T, Shibata T, et al. Association between 18F-fluorodeoxyglucose-PET/CT and histological grade of uterine endometrial carcinoma[J]. Taiwan J Obstet Gynecol, 2018, 57(2): 283-288. doi: 10.1016/j.tjog.2018.02.018
[21] Ashamalla H, Rafla S, Parikh K, et al. The contribution of integrated PET/CT to the evolving definition of treatment volumes in radiation treatment planning in lung cancer[J]. Int J Radiat Oncol Biol Phys, 2005, 63(4): 1016-1023. doi: 10.1016/j.ijrobp.2005.04.021
[22] Lin S, Han B, Yu L, et al. Comparison of PET-CT images with the histopathological picture of a resectable primary tumor for delineating GTV in nonsmall cell lung cancer[J]. Nucl Med Commun, 2011, 32(6): 479-85. doi: 10.1097/MNM.0b013e32834508d2
[23] 王天禄, 宋颖秋, 党军, 等. PET/CT对合并肺不张非小细胞肺癌治疗方案制定和放疗靶区勾画的影响[J]. 中华核医学与分子影像杂志, 2012, 32(2): 115-118. [Wang TL, Song YQ, Dang J, et al. Impact of PET/CT on the treatment planning and target volume delineation of radiotherapy in the patients with non-small-cell lung cancer complicated by atelectasis[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Za Zhi, 2012, 32(2): 115-118. ]
[24] 张红娇, 姜杰, 黄伟. 功能影像辅助伴肺不张肺癌放疗靶区勾画的研究进展[J]. 国际肿瘤学杂志, 2022, 49(1): 51-55. [Zhang HJ, Jiang J, Huang W. Research progress of functional imaging-assisted radiotherapy target delineation of lung cancer with atelectasis[J]. Guo Ji Zhong Liu Xue Za Zhi, 2022, 49(1): 51-55. ]
[25] 陈韦翔, 张余琴, 张煜. PET/CT图像分割技术在NSCLC患者放疗中的应用[J]. 中国CT和MRI杂志, 2021, 19(6): 55-57. https://www.cnki.com.cn/Article/CJFDTOTAL-CTMR202106018.htm [Chen WX, Zhang YQ, Zhang Y. Application of PET/CT Image Segmentation Technology in Radiotherapy of NSCLC Patients[J]. Zhongguo CT He MRI Za Zhi, 2021, 19(6): 55-57. ] https://www.cnki.com.cn/Article/CJFDTOTAL-CTMR202106018.htm
-
期刊类型引用(2)
1. 曹嘉伽,吴海健,王娟. 红外定位系统在胸部肿瘤放疗中的应用. 名医. 2024(14): 78-80 .  百度学术
百度学术
2. 吴烨,占丽娟. 分析舒适护理对肿瘤放疗患者睡眠质量的影响. 世界睡眠医学杂志. 2023(04): 933-935 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: