Correlation of RELL1 Expression with Clinical Pathological Characteristics and Prognosis of Patients with Colon Cancer
-
摘要:目的
探讨RELL1的表达与结肠癌患者临床病理特征以及预后的关系。
方法选择80例结肠癌组织及80例癌旁组织的组织芯片进行RELL1蛋白的免疫组织化学实验。比较RELL1蛋白不同表达水平与不同临床病理参数之间的关系,单因素和多因素Cox风险比例回归分析结肠癌患者生存的影响因素,Kaplan-Meier生存曲线分析RELL1表达与结肠癌患者生存率的关系,Log rank检验生存率差异。
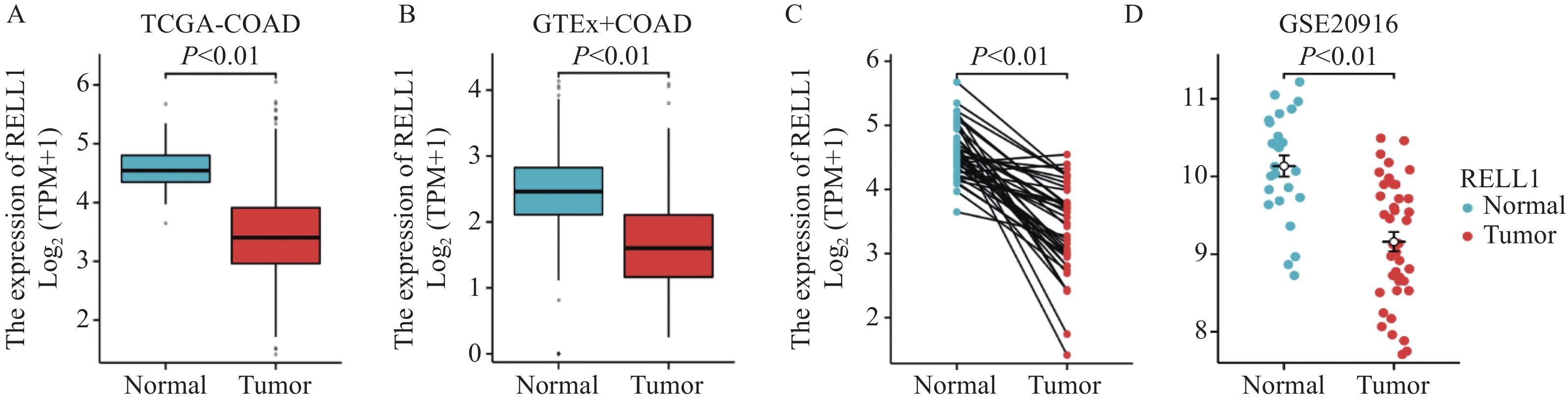
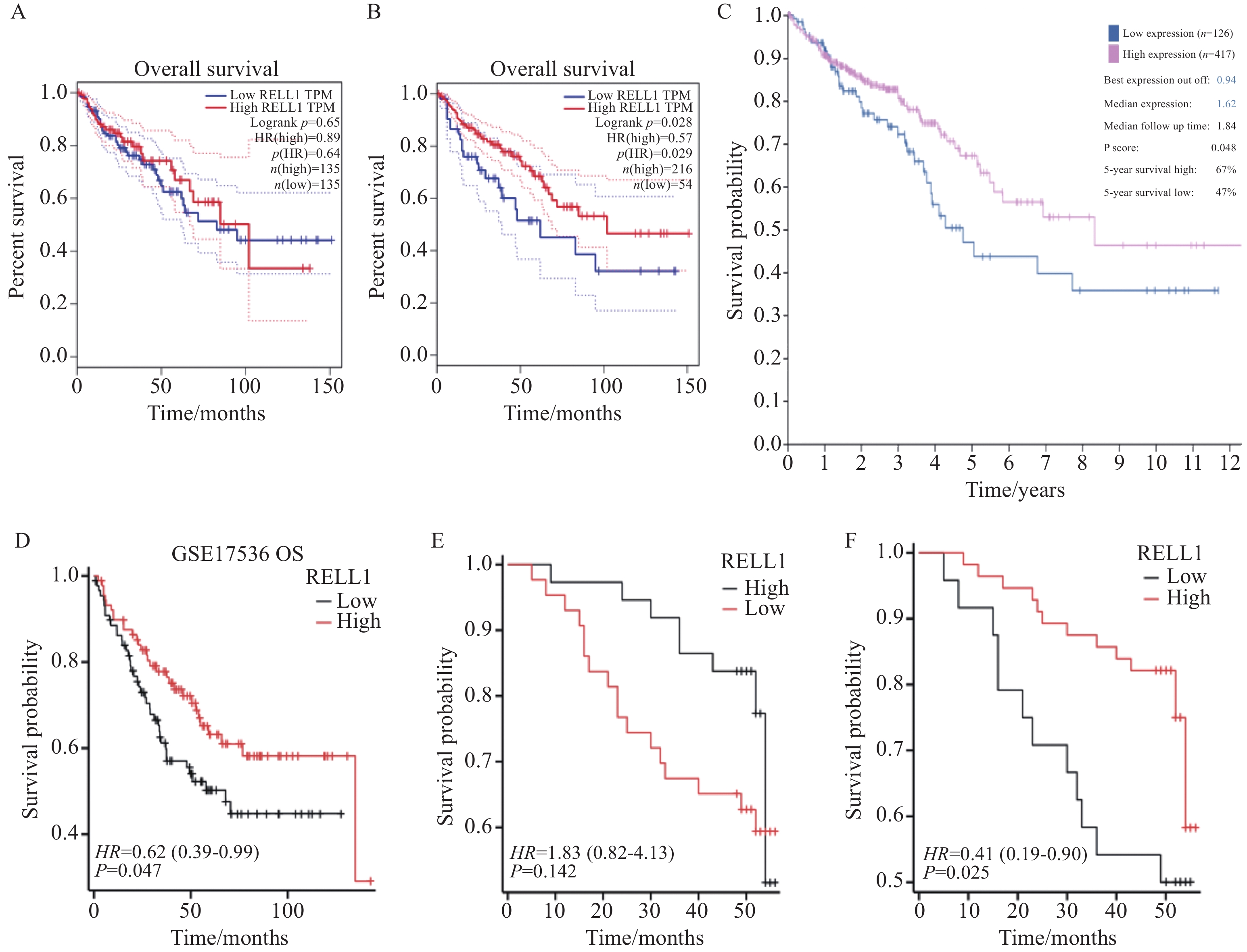
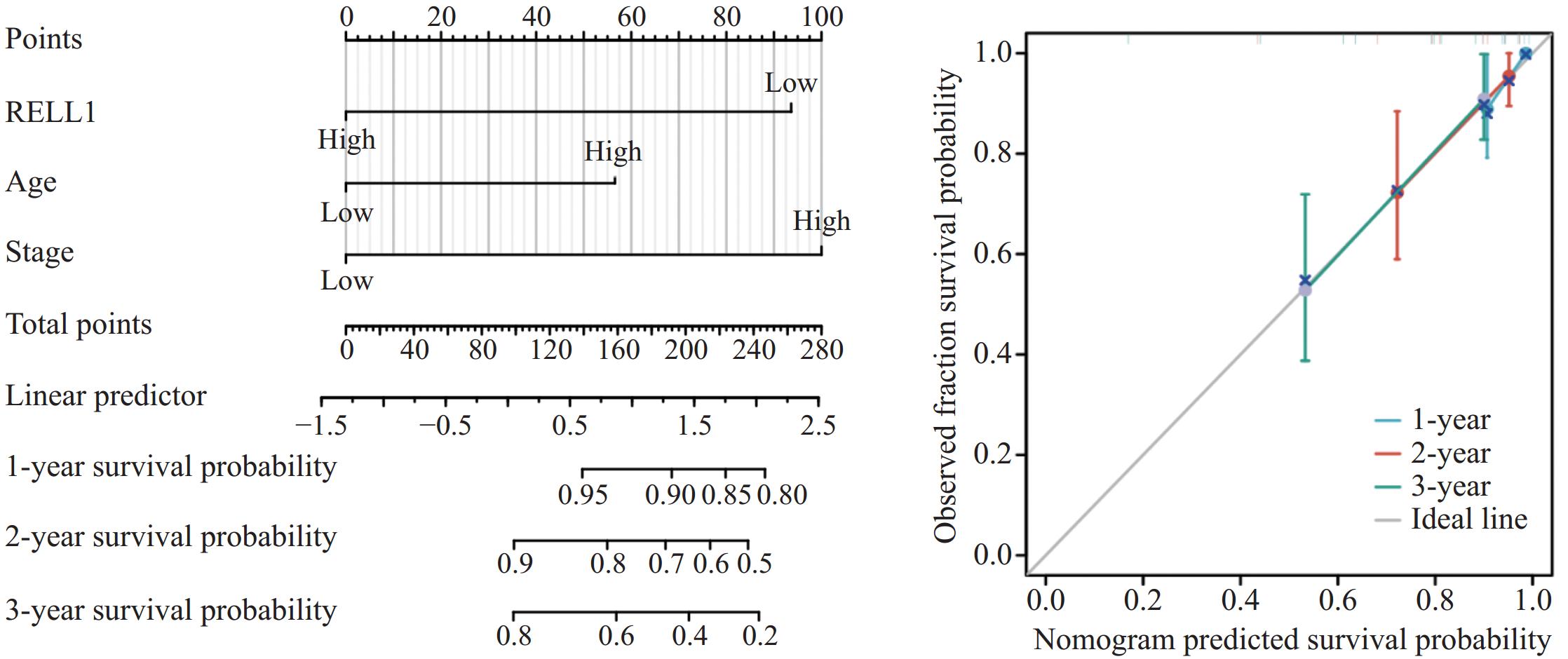
结果结肠癌组织中RELL1表达低于癌旁组织(P<0.05)。癌组织中RELL1的表达与TNM分期、N分期有一定相关性(P<0.05)。 RELL1高表达的结肠癌患者3年总生存率(OS)高于RELL1低表达的结肠癌患者(P<0.05)。多因素Cox回归分析显示,RELL1低表达、高龄及高TNM分期是结肠癌患者预后不良的危险因素(P<0.05)。
结论结肠癌组织中RELL1表达下调, RELL1低表达、高龄和高TNM期可导致患者不良结局。
Abstract:ObjectiveTo explore the correlation of RELL1 expression with clinical pathological features and prognosis of patients with colon cancer.
MethodsImmunohistochemical experiments of the RELL1 protein were performed on tissue chips from 80 colon cancer tissues and 80 adjacent tissues. The relationship between different expression levels of RELL1 protein and clinical pathological parameters was compared. Univariate and multivariate Cox risk proportional regression analyses were conducted on factors affecting the survival of patients with colon cancer. Kaplan-Meier survival curve analysis was conducted on the survival rates of patients with colon cancer and different levels of RELL1 expression. Log rank test was performed to evaluate differences in survival rates.
ResultsThe expression of RELL1 in colon cancer tissues was lower than that in adjacent tissues (P<0.05). The expression of RELL1 in cancer tissues is correlated with TNM stage and N stage (P<0.05). The 3-year overall survival (OS) rate of colon cancer patients with high RELL1 expression was higher than that of patients with low RELL1 expression (P<0.05). Multivariate Cox regression analysis showed that low RELL1 expression, advanced age, and high TNM stage were risk factors for poor prognosis in patients with colon cancer (P<0.05).
ConclusionThe expression of RELL1 is downregulated in colon cancer tissue, and the low RELL1 expression, advanced age, and high TNM stage can lead to adverse outcomes in patients.
-
Key words:
- Colon cancer /
- RELL1 /
- Clinical pathological features /
- Prognosis
-
0 引言
调强放射治疗是当前鼻咽癌放射治疗最重要的治疗手段,局部晚期鼻咽癌经放化疗综合治疗后总体5年生存率可达80%以上,10年生存率将近70%以上[1]。随着进入长期生存的患者不断增多,放疗相关的远期并发症问题也日益凸显。放射性脑损伤是放疗后的一种慢性、不可逆的神经系统损害,是鼻咽癌放疗后长期生存患者最为严重的并发症之一。目前,人们对于放射性脑损伤的认识仍不充分,研究人员在放射性脑损伤的分子病理机制及临床诊疗手段上做了大量的工作,本文将对近年来关于放射性脑损伤的研究进展进行综述。
1 放射性脑损伤的定义
放射性脑损伤(radiation-induced brain injury, RBI)最早在1930年由Fischer等提出,在文献中报道了1例45岁男性患者因太阳穴癌肿接受X射线照射出现放射性脑损伤的病理依据。根据中国专家共识,放射性脑损伤是指“电离辐射后出现的脑部损伤,可以发生在电离辐射后的任何时间,以照射结束后6~47个月最为常见。从广义上来说,放射性脑损伤是放射治疗后神经细胞和颅内血管受损后出现的一系列病理生理改变,影像学可见脑部病灶”[2]。放射性脑损伤根据出现的时间分为急性型(放疗过程中或放疗后1个月内)、早迟发反应型(放疗结束后1~6个月)和晚迟发反应型(放疗结束6个月后),可能因脑细胞为晚反应细胞,放射性脑损伤的最常见类型为晚迟发反应型,此时患者可表现头痛、认知功能障碍、癫痫等症状。Na等[3]统计鼻咽癌放疗后放射性脑损伤的4年累计发生率为1.9%~5%。麦春平等[4]在对74例鼻咽癌患者进行临床分析,结果发现放射性脑损伤发生在鼻咽癌放疗后11~56个月,平均发生时间为37.5个月。
2 放射性脑损伤的发病机制
放射性脑损伤是动态演变的过程,大多数学者认为可能是以下因素共同作用的结果:放射线对脑组织的直接损伤、血管损伤和免疫炎性反应,见图 1。
2.1 放射线对脑组织的直接损伤
神经胶质细胞具有分裂增殖能力,对射线比较敏感,放射线直接作用于射野区的脑组织区域引发电离和激发,产生氧自由基,导致单链和双链DNA损伤,可导致脑白质脱髓鞘、软化和萎缩。Andrews等[5]评估大脑照射恒河猴的后期影响,结果发现白质是迟发性辐射脑损伤的好发部位,并分析谷氨酸能神经传递受损可能发生在白质中最为突出。
2.2 血管损伤
在放疗后的最初24 h内,RBI始于放射诱发的血管损伤,随后是脑实质的损伤[6]。放射线主要作用于颅内中小动脉的内皮细胞,导致脑血管的通透性增加、血管周围水肿,是急性反应期的主要发病机制。损伤的血管因内皮细胞暴露启动凝血途径形成血栓,可导致细胞缺血缺氧。近年来发现血管内皮生长因子(VEGF)和缺氧诱导因子-1α(HIF-1α)在放射性脑损伤的发病机制中越来越突出。HIF-1α是VEGF的反式激活因子,其上调可导致星形胶质细胞产生VEGF增多,诱导血管生成,然而源自这种反应生成的血管不仅通透性大而且容易被破坏,易诱发二次损伤[7]。此外,Zhou等[8]研究表明VEGF的过表达可导致血管生成素-2(Ang-2)的上调,Ang-2可能是作为VEGF和微血管损伤之间的介导细胞因子。
2.3 免疫炎性反应
辐射诱导的神经炎症是多种促炎和抗炎细胞因子的交叉网络。Andrews等[9]在2017年评估放射性脑损伤的分子效应时证明巨噬细胞/小胶质细胞介导的神经炎症可能通过增加巨噬细胞趋化因子CCL2和巨噬细胞/小胶质细胞相关CD68的基因表达而导致放射性脑损伤。在2019年Andrews等[5]通过转录组学分析再次证实巨噬细胞/小胶质细胞介导的神经炎症确实存在于放射性脑损伤中,而且在神经炎症通路分析表明MHCⅡ类肽抗原呈递和补体系统在放射性脑损伤中发挥作用。研究表明10 Gy是激活小胶质细胞的最佳辐射剂量,此时激活的小胶质细胞有两种不同类型[10-11]:经典活化型M1和旁路活化型M2。M1型小胶质细胞不仅上调吞噬细胞机制而且能够诱导NF-κB等途径释放促炎分子如IL-1b、TNF-a、IL-6、ROS以及NO[12-13]。另一方面,M2型小胶质细胞与抗炎细胞因子相关,例如IL-10、胰岛素生长因子-1(IGF-1)和脑源性神经营养因子(BDNF),这些抗炎细胞因子限制神经元损伤并促进愈合。已有相关研究表明不规则趋化因子(FKN)CX3CL1与小胶质细胞上的CX3CR1结合后,小胶质细胞向M2型极化,对放射性脑损伤进行神经保护[14]。近期研究发现脑源性微粒(BDMP)可激活小胶质细胞,然后促进炎症因子的释放,至于具体的信号转导通路仍未明确[15]。
综上所述,放射线对脑组织的直接损伤、血管损伤、免疫炎性反应是放射性脑损伤的主要发病机制。随着不断地探索以及研究设备的升级,研究进入分子水平,目前免疫炎性反应更是研究热点,这对于放射性脑损伤的治疗也提供了新的思路。
3 放射性脑损伤的相关影响因素
放射性脑损伤的相关影响因素包括除了遗传易感性、年龄、动脉硬化、化疗等,更多的影响因素归因于接受放疗的照射剂量,接受的总剂量越多、发生放射性脑损伤的概率越大,见表 1。
表 1 放射性脑损伤的影响因素Table 1 Influencing factors of radiation-induced brain injury
4 放射性脑损伤的诊断方法
放射性脑损伤的诊断方法首先是患者的主诉,特别要注意患者的认知功能是否下降。目前临床上最常用的量表有蒙特利尔认知评估(MoCA)、简易精神状态量表(MMSE)。其次最常见的是以影像学作为诊断依据,主要有CT检查、磁共振成像(MRI)检查、正电子发射体层显像术(PET-CT)。目前MRI发展迅速,除了常规MRI检查,还有弥散加权成像(DWI)、扩散张量成像(DTI)、扩散峰度成像(DKI)、灌注加权成像(PWI)、磁共振波谱(MRS)和血氧水平依赖功能磁共振成像(BOLD-fMRI)。总结相关文献可知DTI和DKI对检测早期鼻咽癌放射性脑损伤的微观结构更敏感。DWI用参数表观扩散系数(ADC)表示,当出现弥散受限时,ADC值降低,但当病灶部位有出血或胶质增生时,ADC值也会减低,难以明确是鼻咽癌放射性脑损伤还是胶质瘤复发[28]。此时PWI、MRS可补充DWI的不足,在鉴别脑胶质瘤复发或假性进展和鼻咽癌放射性脑损伤有较高的诊断价值[29-30]。BOLD-fMRI是无创性的活体脑功能成像技术,通过该技术发现的“脑功能连接改变”可能成为发现放疗后出现脑功能损害以及认知障碍的潜在生物标志物[31]。
病理活检仍是诊断放射性脑损伤的金标准,但因脑组织活检困难,因此病理活检并非是诊断放射性脑损伤的必要条件。现诸多证明液体活检可能是颅内活检的替代方法,在外周血或脑脊液中通过检测生物标志物(包括循环肿瘤细胞、循环肿瘤核酸、microRNA等)可用于区分脑胶质瘤和鼻咽癌放射性脑损伤[32-34]。
近年来也有文章报道关于使用机器学习和影像组学方法来研究放射性脑损伤,如Yang等研究基于剂量分布和CT影像学提出用于预测辐射诱导的颞叶损伤和指导个体调强放疗的剂量组学风险模型,该剂量组学风险模型在预测放射性脑损伤风险方面优于传统模型(QUANTEC模型和Wen模型)[26]。
根据专家共识和临床经验总结诊断标准如下:(1)有头颈部放疗病史;(2)有相应的临床表现;(3)影像学检查支持;(4)排除颅内供血血管闭塞、颅内恶性肿瘤、血源性脑转移和脑脓肿等感染性病变。
5 放射性脑损伤的治疗
对于小而无症状的病变,通常建议刚发现时(每6~8周)较短的间隔内进行密切的影像学随访,直到病情稳定或病灶缩小为止,可根据具体情况增加或减少随访频率[35]。对于有症状的放射性脑损伤,其经典的治疗方案为手术治疗、糖皮质激素、抗凝剂[36]。随着对放射性脑损伤发病机制的进一步了解,其治疗方法也越来越多。
5.1 清除活性氧和抗血管损伤治疗
(1)自由基清除剂如维生素E、艾地苯醌、依达拉奉,可保护细胞膜免受脂质过氧化;(2)抗凝剂如肝素,可抑制放疗后导致血管损伤后的血小板聚集,减轻血管的狭窄;(3)高压氧:通过提高氧浓度,可刺激脑损伤处的血管生成,促进修复;(4)贝伐珠单抗:唯一有Ⅰ类医学证据的药物。从Anderson癌症中心Ⅱ期研究[37]到2011年Levin等[38]进行的随机双盲安慰剂对照研究证实了贝伐珠单抗的疗效。2018年Xu等[39]随机单盲前瞻性临床研究发现治疗8周后,贝伐珠单抗组患者与激素组患者的有效率为65.5%和31.5%。贝伐珠单抗治疗标准的治疗方案为4个疗程的5~7.5 mg/kg体重,每两周给药一次,Voss等[40]研究结果证明单次给药(定义为在至少6周的间隔内单次给药贝伐珠单抗而不进行第二次给药)和Tijtgat等[41]研究结果表明低剂量方案(总400 mg静脉负荷剂量,每4周一次静脉注射100 mg)均有可能是治疗RBI有效且降低成本的替代方案;(5)阿帕替尼:有研究表明可用于治疗放射性脑损伤,但有必要开展进一步的随机对照研究[42];(6)安罗替尼:可下调星形胶质细胞的活化,改善脑缺氧,减轻脑水肿,明显减轻急性RBI的不良影响,且呈剂量依赖性,但缺乏临床验证[43]。
5.2 促神经元修复和再生治疗
(1)神经生长因子(nerve growth factor, NGF):NGF可促进受损的神经元功能修复和再生。首例经NGF成功逆转的脑损伤病例是1例55岁的中国女性鼻咽癌患者(T3N1M0,Ⅲ期,AJCC 2002)接受放化疗,3年后复查发现双侧颞叶放射性脑损伤,该患者接受了鼠神经生长因子治疗(18 µg/d,肌肉注射),连续应用2个月,3个月后复查MRI,双侧颞叶损伤灶完全恢复,神经症状完全消失,随访时间3年以上,未见肿瘤复发、新病灶出现[44]。不久后Wang等[45]开展一项前瞻性随机对照Ⅱ期临床研究,研究最终入组共28例患者(NGF组14例和糖皮质激素对照组14例),结果发现NGF组治疗有效率高于对照组(85.7%和14.2%),该研究认为NGF能够有效地逆转鼻咽癌放疗后的颞叶损伤;(2)神经节苷脂:是一类含唾液酸的酸性糖鞘脂,与神经细胞的再生和转导有着密切的关系。目前最新研究表明神经节苷脂也是小胶质细胞炎性反应的重要调节剂,可用于治疗[46]。
5.3 抗免疫炎性反应治疗
(1)最经典的传统治疗:激素。激素对放射性脑损伤的治疗多基于临床经验、回顾性分析,缺乏大型的临床随机对照研究。糖皮质激素的作用是暂时的而非治愈性,长期使用可引发一系列的不良反应,可根据个体化调整剂量;(2)参芪扶正注射液可通过调节炎症因子减轻放射性脑损伤,特别是伴有记忆能力受损治疗效果更好[47];(3)电针:在中医方面,放射线相当于“热邪”。针灸可活血化瘀、疏通经络、消肿止痛,起到改善血液循环,达到调理气机。电针具有可控性强、刺激均匀持久等特点,可起到镇痛作用[48]。相关研究表明[49]辐射对海马CA1区突触结构和突触功能相关蛋白表达均有损伤,而电针干预可明显改善辐射引起的突触结构和功能损伤。
综上所述,放射性脑损伤的治疗主要包括提高放疗的收益比、清除活性氧、抗血管损伤治疗、促神经元恢复和再生以及抗免疫炎性反应治疗。随着对免疫炎性机制的进一步探索,近年针对抗免疫炎性机制研究出很多治疗药物,现主要在动物实验阶段,有待进一步临床试验,如槲皮素包涵体复合物[50]、双去甲氧基姜黄素[51]、普瑞巴林[52]、金纳米颗粒(AuNPs)和a-硫辛酸(ALA)混合物[53]、3-甲基腺嘌呤[54]、选择性COX-2塞来昔布[55]、褪黑素(MLT)[56]、人重组内皮抑素[57]、硫酸镁[58]、重组蛋白类rt-03[59]。其中槲皮素[50]属于类黄酮化合物,具有抗氧化、抗炎、抑菌特性,可调节肠道微生物。菌群-肠-脑轴调节肠道微生物治疗RBI是一个新概念。王怀清等[59]自主研发的rt-03重组蛋白类药物,具有抗炎和抗凋亡作用,可削弱巨噬细胞分泌TNF-α,缓解小鼠急性脑损伤。
6 总结和展望
放射性脑损伤是放疗剂量累积导致的脑损伤,照射剂量每增加1 Gy,出现放射性脑损伤的概率将增加4.4%[60]。提高肿瘤照射剂量,同时保护危及器官是放疗一直努力的方向。相对于二维时代、三维时代,调强放疗的出现使放射性脑损伤的发生率减少。目前粒子束治疗(质子、重离子)是最先进的放疗治疗系统,但因设备昂贵和治疗费用高,该技术在国内未获得广泛应用。提高放疗技术、勾画靶区时危及器官的处理亟待进一步优化。对于头颈部放疗的患者,要做到早发现、早诊断、早治疗。近年来根据中国专家的共识结合患者的身体情况进行个体化处理,取得一定的疗效。随着对其发病机制的深入了解,探索出更多的治疗药物,但很多药物还处于动物实验期,应鼓励更多的临床试验。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:冯 洁:课题设计,文章撰写与修改张亚男:实验实施程诺、楚艳、沈云海:数据分析统计,文献调研潘勤聪:课题指导,文章修改指导 -
表 1 RELL1表达与结肠癌患者临床病理参数的关系
Table 1 Relationship between RELL1 expression and clinical pathological parameters of colon cancer patients
Characteristics High RELL1
expression (n=56)Low RELL1
expression (n=24)P Gender 0.129 Female 29(36.2%) 8(10.0%) Male 27(33.8%) 16(20.0%) Age(years) 0.806 ≤60 31(38.8%) 14(17.5%) >60 25(31.2%) 10(12.5%) T stage 0.151 T1-2 11(13.8%) 1(1.2%) T3-4 45(56.2%) 23(28.7%) N stage 0.042 N0 37(46.2%) 10(12.5%) N1-2 19(23.8%) 14(17.5%) M stage 0.539 M0 49(61.3%) 19(23.8%) M1 7(8.8%) 5(6.2%) TNM stage 0.018 Ⅰ-Ⅱ 37(46.2%) 9(11.2%) Ⅲ-Ⅳ 19(23.8%) 15(18.8%) Tumor size(cm) 0.304 >5 28(35.0%) 15(18.8%) ≤5 28(35.0%) 9(11.2%) Differentiation 0.512 Well and moderate 43(53.8%) 20(25.0%) Poor 13(16.2%) 4(5.0%) 表 2 影响结肠癌患者预后的单因素及多因素Cox回归分析
Table 2 Univariate and multivariate Cox regression analyses of factors affecting the prognosis of patients with colon cancer
Characteristics n Univariate analysis Multivariate analysis HR(95%CI) P HR(95%CI) P RELL1 expression <0.001 <0.001 High 56 Reference Reference Low 24 4.080(2.002-8.316) 3.915(1.858-8.251) Gender 0.991 Female 37 Reference Male 43 1.004(0.493-2.045) Age(years) 0.089 0.031 ≤60 45 Reference Reference >60 35 1.861(0.910-3.804) 2.288(1.081-4.841) T stage 0.360 T1-2 12 Reference T3-4 68 1.746(0.529-5.762) N stage 0.009 0.177 N0 47 Reference Reference N1-2 33 2.627(1.279-5.392) 0.479(0.164-1.395) M stage 0.266 M0 68 Reference M1 12 1.662(0.679-4.067) TNM stage <0.001 <0.001 Ⅰ-Ⅱ 46 Reference Reference Ⅲ-Ⅳ 34 4.626(2.156-9.924) 6.867(2.221-21.228) Tumor size(cm) 0.135 >5 43 Reference ≤5 37 0.570(0.273-1.192) Differentiation 0.689 Well and moderate 63 Reference Poor 17 0.834(0.342-2.034) -
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. doi: 10.3322/caac.21492
[2] 中国抗癌协会大肠癌专业委员会中国结直肠肿瘤早诊筛查策略制订专家组. 中国结直肠肿瘤早诊筛查策略专家共识[J]. 中华胃肠外科杂志, 2018, 21(10): 1081-1086. [Expert Group of Early Diagnosis and Screening Strategies Development for Colorectal Tumors in China in the Colorectal Cancer Professional Committee of the Chinese Anti Cancer Association. Expert Consensus on Early Diagnosis and Screening Strategies for Colorectal Tumors in China[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2018, 21(10): 1081-1086.] Expert Group of Early Diagnosis and Screening Strategies Development for Colorectal Tumors in China in the Colorectal Cancer Professional Committee of the Chinese Anti Cancer Association. Expert Consensus on Early Diagnosis and Screening Strategies for Colorectal Tumors in China[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2018, 21(10): 1081-1086.
[3] Benson AB, Venook AP, Al-Hawary MM, et al. NCCN Guidelines Insights: Colon Cancer, Version 2. 2018[J]. J Natl Compr Canc Netw, 2018, 16(4): 359-369.
[4] Cusick JK, Alcaide J, Shi Y, et al. The RELT Family of Proteins: An Increasing Awareness of Their Importance for Cancer, the Immune System, and Development[J]. Biomedicines, 2023, 11(10): 2695. doi: 10.3390/biomedicines11102695
[5] Cusick JK, Xu LG, Bin LH, et al. Identification of RELT homologues that associate with RELT and are phosphorylated by OSR1[J]. Biochem Biophys Res Commun, 2006, 340(2): 535-543. doi: 10.1016/j.bbrc.2005.12.033
[6] Cusick JK, Alhomsy Y, Wong S, et al. RELT stains prominently in B-cell lymphomas and binds the hematopoietic transcription factor MDFIC[J]. Biochem Biophys Rep, 2020, 24: 100868.
[7] Dostert C, Grusdat M, Letellier E, et al. The TNF Family of Ligands and Receptors: Communication Modules in the Immune System and Beyond[J]. Physiol Rev, 2019, 99(1): 115-160. doi: 10.1152/physrev.00045.2017
[8] Sica GL, Zhu G, Tamada K, et al. RELT, a new member of the tumor necrosis factor receptor superfamily, is selectively expressed in hematopoietic tissues and activates transcription factor NF-kappaB[J]. Blood, 2001, 97(9): 2702-2707. doi: 10.1182/blood.V97.9.2702
[9] Moua P, Checketts M, Xu LG, et al. RELT family members activate p38 and induce apoptosis by a mechanism distinct from TNFR1[J]. Biochem Biophys Res Commun, 2017, 491(1): 25-32. doi: 10.1016/j.bbrc.2017.07.022
[10] Jin X, Xie H, Liu X, et al. RELL1, a novel oncogene, accelerates tumor progression and regulates immune infiltrates in glioma[J]. Int Immunopharmacol, 2020, 87: 106707. doi: 10.1016/j.intimp.2020.106707
[11] Rose M, Cardon T, Aboulouard S, et al. Surfaceome Proteomic of Glioblastoma Revealed Potential Targets for Immunotherapy[J]. Front Immunol, 2021, 12: 746168. doi: 10.3389/fimmu.2021.746168
[12] Zhao Y, Niu LT, Hu LJ, et al. Comprehensive analysis of ECHDC3 as a potential biomarker and therapeutic target for acute myeloid leukemia: Bioinformatic analysis and experimental verification[J]. Front Oncol, 2022, 12: 947492. doi: 10.3389/fonc.2022.947492
[13] Johansson J, Tabor V, Wikell A, et al. TGF-beta1-Induced Epithelial-Mesenchymal Transition Promotes Monocyte/Macrophage Properties in Breast Cancer Cells[J]. Front Oncol, 2015, 5: 3.
[14] Zhang Z, Wu P, Zhang C, et al. Tumor Necrosis Factor Family Member Profile Predicts Prognosis and Adjuvant Chemotherapy Benefit for Patients with Small-Cell Lung Cancer[J]. Front Immunol, 2021, 12: 745769.
[15] Cui Y, Shen T, Xu F, et al. KCNN4 may weaken anti-tumor immune response via raising Tregs and diminishing resting mast cells in clear cell renal cell carcinoma[J]. Cancer Cell Int, 2022, 22(1): 211. doi: 10.1186/s12935-022-02626-7
[16] Sang H, Zhang W, Peng L, et al. Exosomal circRELL1 serves as a miR-637 sponge to modulate gastric cancer progression via regulating autophagy activation[J]. Cell Death Dis, 2022, 13(1): 56. doi: 10.1038/s41419-021-04364-6
[17] Yao W, Chen Q, Li S, et al. RELT promotes the growth of esophageal squamous cell carcinoma by activating the NF-kappaB pathway[J]. Cell Cycle, 2021, 20(13): 1231-1241. doi: 10.1080/15384101.2021.1924451
[18] Tang SJ, Shen H, An O, et al. Cis-and trans-regulations of pre-mRNA splicing by RNA editing enzymes influence cancer development[J]. Nat Commun, 2020, 11(1): 799. doi: 10.1038/s41467-020-14621-5
[19] Li Z, Qin C, Zhao B, et al. DHX38 restricts chemoresistance by regulating the alternative pre-mRNA splicing of RELL2 in pancreatic ductal adenocarcinoma[J]. PLoS Genet, 2023, 19(7): e1010847. doi: 10.1371/journal.pgen.1010847
[20] Kadkhoda S, Darbeheshti F, Rezaei N, et al. Investigation of circRNA-miRNA-mRNA network in colorectal cancer using an integrative bioinformatics approach[J]. Gastroenterol Hepatol Bed Bench, 2021, 14(2): 141-153.




 下载:
下载: