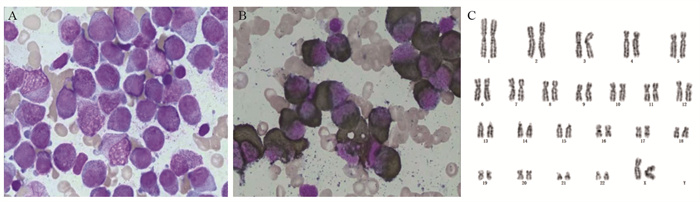
STAT3-RARa-positive Acute Promyelocytic Leukemia: A Case Report and Literature Review
-
-
关键词:
- 急性早幼粒细胞白血病 /
- 化疗 /
- STAT3-RARa
-
0 引言
胃癌(gastric cancer, GC)是严重威胁人类健康的恶性肿瘤之一。我国是胃癌高发国家,2020年胃癌新发病例数47.9万,死亡37.4万,约占全世界胃癌新发和死亡病例的44.0%和48.6%,防控形势十分严峻[1]。胃癌防治的最终目的是降低胃癌的发病率和死亡率,延长生命。由于目前对胃癌发生的复杂生物学过程和因素的理解尚不完全清楚,从根本上阻断致癌因素作用控制胃癌的发生在短时期难以突破。因此采用早期发现、早期诊断和早期治疗是降低胃癌患者死亡率、提高生存率和生存质量的重要途径。目前,胃镜是诊断胃癌的有效方法,但因其属侵入性检查,人群接受度较低,且费用较高,难以进行大规模普查。因此,急切需要开发一种可应用于胃癌早期筛查的简单可靠、无创或微创的大通量检查方法。多项研究表明,Dickkopf相关蛋白1(DKK1)在健康人群体内呈低表达,在肺癌、宫颈癌、肝癌、胰腺癌和胃癌等多种肿瘤患者中呈高表达,提示其可能作为一种潜在的肿瘤筛查标志物[2-6]。本研究探讨DKK1在胃癌患者和非胃癌者血清中的差异,并探索其与胃癌发生发展的关系,为评估其能否作为胃癌血清学筛查指标提供参考。
1 资料与方法
1.1 临床资料
选取2013年8月—2014年10月于中国医学科学院北京协和医学院肿瘤医院就诊、年龄范围40~69岁、经内镜检查及组织病理确诊为胃癌的患者170例,作为胃癌组。对照组来自同期本院体检科接受上消化道内镜检查且未诊断患胃癌者,且排除患有任何恶性肿瘤者,按照年龄(相差5岁以内)与胃癌病例进行随机1:1频数匹配。本研究经医院伦理委员会批准,所有受试者均签署知情同意书。所有研究对象的血液均为经过临床检测之后的剩余血标本,分离出1.5 ml血清,放入冻存管中,-80℃保存备用。采集血液时胃癌患者未经过放化疗或手术治疗。
1.2 检测方法
血清DKKl检测采用酶联免疫吸附实验(ELISA)。ELISA检测系统为美国R & D Systems公司生产的DKK100试剂盒,严格按照说明书进行操作。将100 μl的标准液或血清样品加入96孔酶标板中,室温孵育2 h,洗板。每孔加入200 μl DKK1结合液,室温孵育2 h,洗板。每孔加入200 μl的底物溶液,室温下避光孵育30 min,显色后加入50 μl的终止溶液并使用酶标仪检测450 nm处的光密度(optical density, OD)值。
1.3 统计学方法
采用SAS9.4进行数据整理与统计分析。血清DKK1浓度资料呈偏态分布,以中位数(四分位数)[M(P25, P75)]表示,两组间比较采用Wilcoxon秩和检验。分类资料以n(%)表示,采用Pearson χ2检验进行组间比较。血清DKK1浓度与胃癌患者的临床病理指标间的相关性比较采用Wilcoxon秩和检验或Kruskal-Wallis秩和检验。计算血清DKK1诊断胃癌的敏感度和特异性,绘制受试者工作特征ROC曲线,通过计算约登指数(Youden index)获取最佳诊断临界值。P < 0.05为差异有统计学意义。
2 结果
2.1 胃癌组与对照组的基本特征及血清DKK1浓度分布情况
胃癌组男性119例(70.00%),中位年龄59岁,对照组男性80例(47.06%),中位年龄58岁。两组在BMI、吸烟和饮酒的分布上差异无统计学意义(P > 0.05)。胃癌组患者血清DKK1的中位表达水平[266.4(182.1, 360.8)pg/ml]显著高于对照组[97.9(36.0, 145.1)pg/ml](P < 0.0001),见表 1。
表 1 胃癌组与对照组的基本特征及血清DKK1表达水平Table 1 Basic characteristics and expression of serum DKK1 in gastric cancer (GC) group and control group
2.2 血清DKK1在胃癌患者中的诊断意义
根据DKK1在胃癌组和对照组血清中的检测结果绘制ROC曲线,见图 1,曲线下面积为0.908(95%CI: 0.878~0.938)。根据约登指数最大确定诊断胃癌的最佳截断值为167.8 pg/ml。以DKK1浓度 > 167.8 pg/ml为DKK1阳性,诊断胃癌的敏感度为80.59%(95%CI: 76.64%~86.53%),特异性为84.71%(95%CI: 79.30%~90.12%),阳性预测值为84.05%(95%CI: 78.43%~89.67%),阴性预测值为81.36%(95%CI: 75.62%~87.09%)。
2.3 血清DKK1与胃癌患者临床病理指标的关系
血清DKK1与胃癌患者临床病理指标的关系见表 2。未发现血清DKK1浓度与胃癌患者的年龄、性别、民族、胃癌家族史、吸烟史、BMI、饮酒史、肿瘤大小、肝脏转移、血管浸润和远处转移之间存在相关性(均P > 0.05),但与肿瘤TNM分期、浸润深度、淋巴结转移和嗜神经侵袭明显相关(均P < 0.05)。
表 2 血清DKK1水平与胃癌患者临床病理特征的关系(M, P25-P75)Table 2 Relation between serum DKK1 level and clinicopathological characteristics of gastric cancer patients (M, P25-P75)
2.4 血清DKK1对胃癌患者临床病理特征的诊断价值
经ROC曲线分析,血清DKK1对胃癌浸润深度、淋巴结转移、嗜神经侵袭和TNM分期均具有一定的诊断意义(AUC=0.633、0.622、0.613、0.635)。根据约登指数,区分胃癌浸润深度(T3+T4 vs. T1+T2)、是否存在淋巴结转移、是否存在嗜神经侵袭、TNM分期(Ⅲ+Ⅳ vs.Ⅰ+Ⅱ)的最佳临界值分别为265.7、240.4、198.2、265.7 pg/ml,见表 3。
表 3 血清DKK1对胃癌临床病理特征的诊断价值Table 3 Diagnosis value of serum DKK1 on clinicopathological features of GC patients
3 讨论
21世纪以来,我国胃癌的发病率和死亡率均有所下降,生存率有所提高,但仍远低于日本与韩国等同样胃癌高发的国家,2010—2014年我国胃癌年龄标化5年生存率为35.9%,日本为60.3%,韩国最高,达到了68.9%[7]。而日本与韩国生存率提高的重要原因之一在于其所开展的全国性胃癌筛查项目。我国人口众多,目前还无法实现全民胃癌内镜普查,故通过胃癌的危险因素和一些标志物筛选高危人群进行内镜检查是符合我国国情的筛查策略[8]。目前,已知的胃癌血清标志物有胃蛋白酶原(PG)、胃泌素-17(G-17)、幽门螺杆菌抗体(Hp-IgG)、癌胚抗原(CEA)、CA199、CA724、微小RNA和环状RNA等,但尚没有一种被证实可作为胃癌筛查可靠的标志物[9]。2019年早期胃癌筛查专家共识中提出了一种新型胃癌筛查评分系统,通过性别、年龄与传统的血清学标志物PG、G-17和Hp-IgG五项指标浓缩高危人群行内镜精查,但其在真实世界人群中的筛查效果如何仍有待进一步研究评估[8]。故探索新的胃癌血清学标志物,对胃癌高危人群的筛选具有重要意义。
DKK1作为一种分泌蛋白,是有力的Wnt信号通路的拮抗剂[10]。Wnt信号通路为进化上非常保守的信号转导途径,在胚胎发育形成和维持成体组织的动态平衡中发挥重要作用,是调控细胞形态、生长、发育、增殖、迁移和分化的关键通路之一[11]。与正常干细胞一样,肿瘤干细胞也利用Wnt信号通道,这些通道的失调可能会导致肿瘤发生[12]。有研究发现,在正常胃腺和肠化生组织中,DKK1呈阴性或较低水平,而在胃癌细胞中通常呈中等或高度表达[6]。
本研究结果表明胃癌组血清DKK1的水平(266.4 pg/ml)显著高于对照组(97.9 pg/ml)(P < 0.0001)。多项研究也表明胃癌患者血清DKK1水平高于对照人群,提示血清DKK1具有作为胃癌筛查标志物的潜能[6, 13-16]。Lee等[6]对153例胃癌患者和173例健康对照者的血清DKK1进行检测,结果发现胃癌患者血清DKK1水平显著高于健康对照者(P < 0.0001)。唐丹等[13]比较了胃癌组、胃良性疾病组和健康对照组的血清DKK1水平,结果显示胃癌组 > 胃良性疾病组 > 健康对照组(P < 0.05),对胃癌具有较高的诊断价值(AUC=0.820)。Zhuang等[17]评估了90例胃癌患者、50例胃癌前疾病者与40例健康对照者的血清DKK1浓度,结果表明胃癌患者组血清DKK1浓度显著高于胃癌前疾病组和健康对照组(P < 0.01)。魏礼清等[14]对78例胃癌患者及38例健康对照者血清DKK1浓度进行检测,结果显示胃癌组平均水平(51.62±38.43 μg/ml)显著高于健康对照组(22.18±6.59 μg/ml),与本研究结果一致。而张小刚等[18]对34例胃癌患者和38例健康者血清DKK1检测的结果显示,胃癌患者血清中DKKl含量明显低于健康者(P < 0.01)。这与以上研究结果完全相反,可能是由于该研究样本量较小。
本研究还发现肿瘤分期晚、浸润深、存在神经侵袭与淋巴结转移者血清DKK-1水平更高,提示血清DKK1水平与胃癌恶性程度相关,与已发表的研究结果一致[17, 19-20]。Zhuang等[17]进一步研究发现血清DKK1水平与胃癌患者临床分期、血管浸润、浸润深度有关。卢起飞等[20]纳入132例胃癌患者、121例慢性胃炎患者及74例体检健康者的研究发现胃癌患者血清DKK-1水平与淋巴结转移、肿瘤分期有关(P < 0.05),不过该研究还发现血清DKK-1水平与肿瘤直径、肝脏转移有关,而未发现与肿瘤分化程度、浸润深度、血管转移情况相关(P > 0.05)。本研究并未发现血清DKK-1水平与肿瘤直径、肝脏转移、血管浸润有关(P > 0.05),考虑可能是发生肝脏转移和血管浸润的患者数较少或者受幽门螺杆菌感染、胃癌分型等混杂因素的影响,但仍需进一步研究验证。
本研究的局限性在于:(1)DKK1是一种非特异性的肿瘤标志物,并不适合单独用于胃癌筛查,而本研究仅分析了胃癌患者血清DKK1的表达水平,需结合PG、Hp-IgG等现有的胃癌血清标志物,进一步研究DKK1的加入是否可提高筛查的准确性;(2)本研究为一项单中心研究,未开展外部验证;(3)本研究胃癌患者与非胃癌者的性别构成存在差异,虽然按性别的分层分析显示男女血清DKK1浓度的曲线下面积比较接近,但对研究结果仍可能存在影响。今后将进一步完善研究方案,选择更具代表性的人群,以便更好地评估DKK1在胃癌筛查中的价值。
综上所述,血清DKK1作为胃癌标志物具有一定的价值,应开展进一步研究,探讨其在识别胃癌高危人群方面的作用。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:黄艳:收集资料、论文撰写与修改任宏波:论文修改刘颖:收集资料 -
表 1 STAT3-RARa融合基因阳性患者药物反应及预后
Table 1 Drug response and prognosis of STAT3-RARa fusion gene-positive patients

-
[1] Yao L, Wen L, Wang N, et al. Identification of novel recurrent STAT3-RARA fusions in acute promyelocytic leukemia lacking t (15; 17)(q22;q12)/PML-RARA[J]. Blood, 2018, 131(8): 935-939. doi: 10.1182/blood-2017-09-807370
[2] 徐欣欣, 吕振慧, 刘凯奇, 等. 伴STAT3-RARα阳性急性早幼粒细胞白血病一例报告并文献复习[J]. 中华血液学杂志, 2019, 40(8): 688-690. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLYS201709024.htm Xu X, Lyu Z, Liu K, et al. Acute promyelocytic leukemia with STAT3-RARαfusion gene: a case report and literature review[J]. Zhonghua Xue Ye Xue Za Zhi, 2019, 40(8): 688-690. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLYS201709024.htm
[3] Verhoeven Y, Tilborghs S, Jacobs J. The potential and controversy of targeting STAT family members in cancer[J]. Semin Cancer Biol, 2020, 60: 41-56. doi: 10.1016/j.semcancer.2019.10.002
[4] Jin W. Role of JAK/STAT3 Signaling in the Regulation of Metastasis, the Transition of Cancer Stem Cells, and Chemoresistance of Cancer by Epithelial-Mesenchymal Transition[J]. Cells, 2020, 9(1): 217. doi: 10.3390/cells9010217
[5] Kim BH, Yi EH, Ye SK. Signal transducer and activator of transcription 3 as a therapeutic target for cancer and the tumor microenvironment[J]. Arch Pharm Res, 2016, 39(8): 1085-1099. doi: 10.1007/s12272-016-0795-8
[6] Liquori A, Ibañez M, Sargas C, et al. Acute Promyelocytic Leukemia: A Constellation of Molecular Events around a Single PML-RARA Fusion Gene[J]. Cancers (Basel), 2020, 12(3): 624. doi: 10.3390/cancers12030624
[7] Jimenez JJ, Chale RS, Abad AC, et al. Acute promyelocytic leukemia (APL): a review of the literature[J]. Oncotarget, 2020, 11(11): 992-1003 doi: 10.18632/oncotarget.27513
[8] 陈一瑞. 急性早幼粒细胞白血病中维甲酸受体α融合基因的研究进展[J]. 国际输血及血液学杂志, 2013, 36 (4): 425-428. doi: 10.3760/cma.j.issn.1673-419X.2013.04.012 Chen YR. Research progress of retinoic acid receptor alpha fusion gene in acute promyelocytic leukemia[J]. Guo Ji Su Xue Ji Xue Ye Xue Za Zhi, 2013, 36(4): 425-428. doi: 10.3760/cma.j.issn.1673-419X.2013.04.012
[9] Katsumura KR, Mehta C, Hewitt KJ, et al. Human leukemia mutations corrupt but do not abrogate GATA-2 function[J]. Proc Natl Acad Sci U S A. 2018, 115(43): E10109-E10118.
[10] Leubolt G, Redondo Monte E, Greif PA. GATA2 mutations in myeloid malignancies: Two zinc fingers in many pies[J]. IUBMB Life, 2020, 72(1): 151-158. doi: 10.1002/iub.2204
[11] Katerndahl CDS, Rogers ORS, Day RB, et al. Tumor suppressor function of Gata2 in acute promyelocytic leukemia[J]. Blood, 2021, 138(13): 1148-1161. doi: 10.1182/blood.2021011758
[12] Lu W, Jia D, An S, et al. Calf Spleen Extractive Injection protects mice against cyclophosphamide-induced hematopoietic injury through G-CSF-mediated JAK2/STAT3signaling[J]. Sci Rep, 2017, 7(1): 8402.
-
期刊类型引用(8)
1. 冯娟,王少怡,冯思佳,柏强善,陈安. 肝细胞癌患者的血清外泌体长链非编码RNA Airn表达及其预后预测价值. 国际消化病杂志. 2025(01): 49-55 .  百度学术
百度学术
2. 王善平,贺程程,李志军,孙嫣. 浅谈消化内科学术型硕士研究生科研能力的培养. 现代消化及介入诊疗. 2025(03): 393-397 .  百度学术
百度学术
3. 宋慧霞,宋盈花,谷申森. 无痛理念下认知行为干预对腹腔镜肝切除术患者疼痛评分及心理状态的影响. 中国临床研究. 2024(01): 141-146 .  百度学术
百度学术
4. 宋振宇,杨丽超,廖舟翔,张起,温莎,黄雪静,何敏. lnc85通过调节CDC42的表达促进肝癌细胞增殖. 广西医科大学学报. 2024(02): 186-192 .  百度学术
百度学术
5. 杨帆,段昌虎,吴林,赵李飞,向俊西,段建峰. 帕博利珠单抗联合乐伐替尼转化治疗后序贯根治性手术在初始不可切除肝癌中的应用效果. 中国药物应用与监测. 2024(04): 385-389 .  百度学术
百度学术
6. 菅辉玲,高丽霞,李桂圆,朱海鹏,李砥,贾晓玲,胡军. 联合检测血清APE1、miR183在原发性肝癌诊断中的价值. 肝脏. 2024(12): 1498-1502+1516 .  百度学术
百度学术
7. 张建花,章志翔,李蓄涵,曹惟嘉,耿佳琦,于成云,阎新宇. 基于银纳米颗粒免疫比色法检测甲胎蛋白. 化学试剂. 2023(10): 40-45 .  百度学术
百度学术
8. 成晓梅,田红,李想,杨洁. HBV相关肝细胞癌患者血清miR-504、miR-200a、IL-24水平及其与肝癌的相关性. 肝脏. 2023(10): 1186-1190 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: