Identification of Drug-resistance Core Genes and Drug Targets in Lung Adenocarcinoma Patients Harboring ALK Fusion Gene
-
摘要:目的
探讨ALK融合基因阳性肺腺癌患者原发灶及转移灶基因表达谱的差异,从而探索转移灶耐药机制及相应的药物靶点分析。
方法GEO数据库中选取GSE125864,根据肿瘤组织取材部位不同分为原发灶组和转移灶组。首先,比较两组患者之间显著差异基因的表达,并分析这些显著差异基因在生物学功能和富集信号通路等方面的不同;其次,对显著差异基因进行蛋白-蛋白互作网络分析及关键模块、核心基因分析。最后,基于TCGA和癌症治疗反应门户数据库对筛选的10个关键核心进行预后、药物靶点预测等分析。
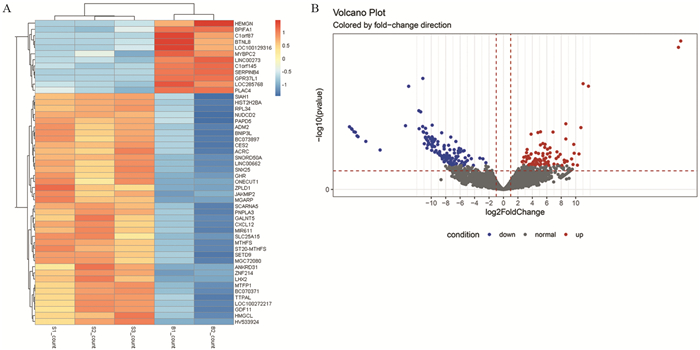
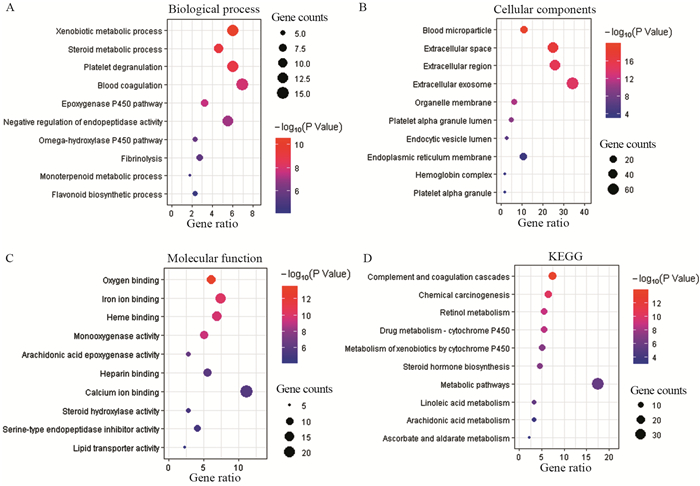
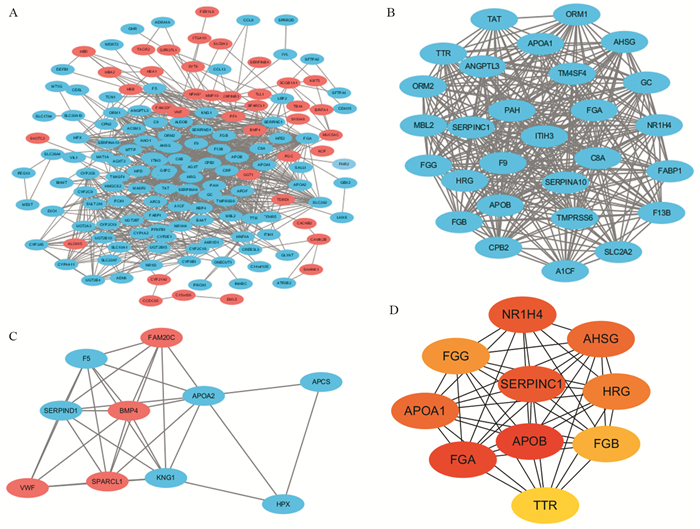
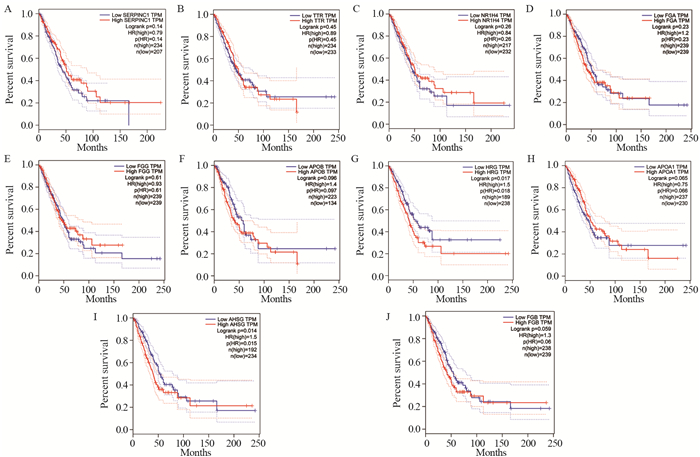
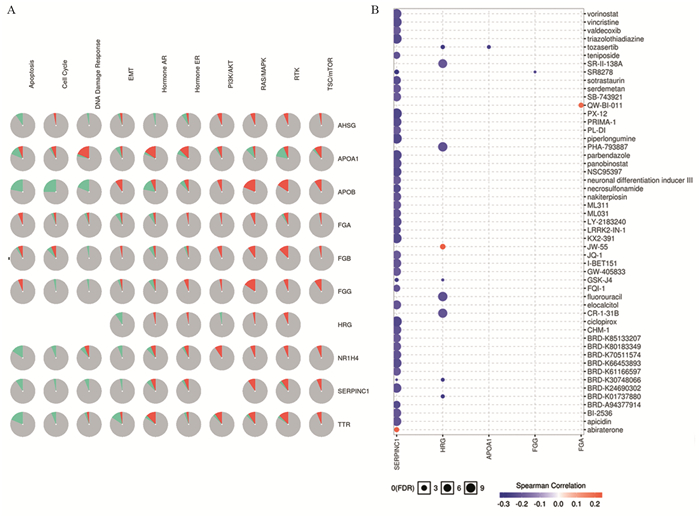
结果共筛选出227个差异基因,以肺腺癌原发灶为对照组,转移灶中共发现134个上调基因,93个下调差异基因;GO和KEGG富集分析显示,这些差异基因的功能主要涉及补体和凝血级联、化学致癌作用、视黄醇的新陈代谢等信号通路;通过蛋白-蛋白互作网络分析,筛选了10个核心基因,其中HRG、AHSG基因表达与肺腺癌不良预后相关,SERPINC1、HRG、APOA1、FGA、FGG等与多种潜在的小分子药物有一定相关性。
结论显著差异基因涉及的分子功能及信号通路可能引起ALK阳性肺腺癌患者转移灶耐药。
Abstract:ObjectiveTo compare DEGs between primary and metastatic lesions in lung adenocarcinoma patients with positive ALK fusion gene, and to explore the mechanism of drug-resistance and the potential drug targets in metastatic lesions of lung adenocarcinoma patients.
MethodsGSE125864 was obtained from GEO database. According to the different sampling sites of tumor tissue, two groups were divided: primary tumor lesions group and metastatic tumor lesions group. The DEGs between the two groups were compared, and the differences in biological functions and enrichment signaling pathways of these DEGs were analyzed. The protein-protein interaction network was constructed and applied to screen hub genes. Based on TCGA and cancer treatment response portal database, the prognosis and drug target prediction of the 10 key cores were analyzed.
ResultsIn total, 227 DEGs were identified, with 134 upregulated DEGs and 93 downregulated DEGs in the metastatic tumor lesions group, compared with primary tumor lesions group. GO and KEGG enrichment analyses showed that the functions of these DEGs were mainly involved in complement and coagulation cascade, chemical carcinogenesis and retinol metabolism pathways. The top 10 hub genes with the highest degree were analyzed in the protein-protein interaction network. The expression of HRG and AHSG genes were associated with poor prognosis of lung adenocarcinoma patients, and SERPINC1, HRG, ApoA1, FGA and FGG genes were correlated with a variety of potential small molecule drugs.
ConclusionThe molecular functions and signaling pathways involved in DEGs may induce drug-resistance in metastatic ALK-positive lung adenocarcinoma patients.
-
Key words:
- Lung adenocarcinoma /
- Positive ALK fusion gene /
- Bioinformatics /
- Heterogeneity /
- Drug targets
-
0 引言
食管癌(Esophageal cancer, EC)是全球最常见的消化道恶性肿瘤之一。据2022年全球癌症统计报告,食管癌新发病例51.07万(占总新发病例2.6%),死亡人数约44.51万(占癌症死亡总数4.6%),发病率和病死率分别位居全球恶性肿瘤第11位和第7位[1]。中国食管癌发病率和死亡率均超过全球的平均值[2],其中河北省是食管癌的高发地区,食管鳞癌(Esophageal squamous cell carcinoma, ESCC)为其主要发病类型,因早期发病隐匿,多数患者确诊时已为晚期,尽管免疫治疗方法在晚期食管鳞癌一线及后线的治疗已经确定,但仍存在免疫耐药、免疫治疗不良反应等问题,导致患者疗效欠佳,预后差。因此,本文将针对河北省晚期食管鳞癌免疫治疗的研究及热点问题进行总结及展望,为临床食管鳞癌治疗策略提供更多参考依据。
1 河北省食管癌的流行病学
20世纪70年代,我国河南林县、河北磁县、涉县及山西阳城县是食管癌的高发地区。其中河北磁县的发病率和死亡率均为全国平均水平的5~8倍[3],严重威胁人民生命健康。在过去的50年,河北省食管癌死亡率呈下降趋势,2018年食管癌世标死亡率较1973—1975年下降83.65%[4]。《2023河北省肿瘤登记年报》数据[5]显示,河北省食管癌的发病率为14.41/10万,新发病例约
9540 例。其中城市和农村发病率分别为9.18/10万和17.40/10万,农村发病率是城市的1.90倍。同期食管癌的死亡率为12.03/10万,城市死亡率为8.23/10万,农村死亡率为14.21/10万,农村是城市的1.73倍。河北省食管癌的病理类型87.93%为ESCC,其余为食管腺癌(Esophageal adenocarcinoma, EAC)和其他[6]。研究发现,磁县食管癌高发区水中硝酸盐氮和亚硝酸盐氮含量较高、食用高脂肪食物、腌制蔬菜、发霉食品等也和食管癌的发生相关,饮食过烫、食用速度过快可能是诱因之一[7-8]。通过对以食管癌为重点癌种的三级综合防控、发生发展机制的研究、医疗检查技术及新药的不断进展,河北省食管癌发病率和死亡率显著下降,但5年生存率仍较低[9],近几年,免疫治疗的出现打破了晚期食管鳞癌的治疗瓶颈,患者疗效显著提高,生存延长,成为当前研究的热点。2 免疫治疗在恶性肿瘤中的作用机制
在肿瘤的发生和发展中,免疫系统的抑制和重新编程起着关键作用。免疫治疗的目的是重新激活抗肿瘤免疫细胞,克服肿瘤的免疫逃逸机制。研究最多的是针对PD-1/PD-L1和CTLA-4/B7-1/2这两个免疫检查点通路的抑制剂来增强机体免疫系统的特异性抗肿瘤作用[10]。PD-1是CD28受体家族的成员之一,是一种共抑制受体,在T细胞上高表达,能抑制T淋巴细胞的功能,这对控制自身免疫反应至关重要。PD-1的配体PD-L1(最初被确定为B7-H1),在多种类型的癌细胞上高度表达,可与PD-1结合并介导肿瘤的免疫逃逸。因此,PD-1抑制剂可以特异性与PD-1结合,减弱对T淋巴细胞的免疫抑制,使T淋巴细胞能够杀伤肿瘤细胞[11-12]。临床常用的PD-1/PD-L1抑制剂有帕博利珠单抗(Pembrolizumab)、纳武利尤单抗(Nivolumab)、卡瑞利珠单抗 (Camrelizumab)、信迪利单抗(Sintilimab)、阿替利珠单抗(Atezolizumab)等。CTLA-4(CD152)是一种跨膜蛋白,在活化的CD4+和CD8+T细胞中表达,可以和CD80/CD86结合抑制T细胞的激活,引起肿瘤细胞的免疫逃逸。因此,阻断CTLA-4可以下调效应性T细胞的抑制信号,减少Tregs的抑制作用,从而提高T细胞的抗肿瘤作用。临床常用药物有伊匹木单抗(Ipilimumab),可阻断CTLA-4来增强抗肿瘤作用[13-14]。
3 免疫治疗在晚期食管鳞癌一线治疗的研究进展
免疫治疗的出现为晚期ESCC的治疗带来了巨大的突破,多项临床研究已证实一线免疫联合化疗方案的疗效和安全性,成为晚期ESCC治疗的新标准。截至目前,根据KEYNOTE-590[15]、CHECKMATE-648[16]、ESCORT-1st[17]、JUPITER-06[18]、ORIENT-15[19]、RATIONALE 306[20]、ASTRUM-007[21] 、GEMSTONE-304[22]八个大型随机对照研究结果显示,进口的帕博利珠单抗、纳武利尤单抗及国产的卡瑞利珠单抗、特瑞普利单抗、信迪利单抗、替雷利珠单抗、斯鲁利单抗共七个PD-1抑制剂及舒格利单抗一个PD-L1抑制剂在分别联合化疗一线治疗晚期ESCC的疗效优于传统双药化疗方案,因此,免疫联合化疗成为了ESCC诊疗指南的Ⅰ级推荐方案(1A类),成为晚期ESCC一线治疗的新标准,具体研究内容及结果见表1。
表 1 晚期ESCC一线免疫治疗的Ⅲ期研究Table 1 Phase Ⅲ study of first-line immunotherapy for advanced ESCCTrials Sample
sizesTreatments ORR(%) mPFS(m) mOS(m) ≥Grade 3 adverse
reactions (%)Keynote-590
(All groups)373/376 Pembrolizumab +
chemo (cis + 5-Fu)
vs. chemo (cis + 5-Fu)45.0 vs. 29.3 6.3 vs. 5.8
HR=0.65
95%CI:
(0.55–0.76)12.4 vs. 9.8
HR=0.73
95%CI:
(0.62–0.86)71.9 vs. 67.6 Keynote-590
(China)51/55 Pembrolizumab +
chemo (cis + 5-Fu)
vs. chemo (cis + 5-Fu)37.3 vs. 20.0 6.2 vs. 4.6
HR=0.60
95%CI:
(0.39–0.92)10.5 vs. 8.0
HR=0.51
95%CI:
(0.32–0.81)74.5 vs. 66.7 Checkmate-648 321/324 Nivolumab+
chemo (cis + 5-Fu)
vs. chemo (cis + 5-Fu)47.0 vs. 27.0 5.8 vs. 5.6
HR=0.83
95%CI:
(0.68–1.00)12.8 vs. 10.7
HR=0.78
95%CI:
(0.65–0.93)49.0 vs. 36.0 RATIONALE-306 326/323 Tislelizumab +
chemo (ptx + cis/cis + 5-Fu)
vs. chemo (ptx + cis/cis + 5-Fu)63.5 vs. 42.4 7.3 vs. 5.6
HR=0.62
95%CI:
(0.52–0.75)17.2 vs. 10.6
HR=0.66
95%CI:
(0.54–0.80)67.0 vs. 64.0 ESCORT-1st 298/297 Camrelizumab +
chemo (ptx + cis)
vs. chemo (ptx + cis)72.1 vs. 62.1 6.9 vs. 5.6
HR=0.56
95%CI:
(0.46–0.68)15.3 vs. 12
HR=0.70
95%CI:
(0.56–0.88)63.4 vs. 67.7 ORIENT-15 327/332 Sintilimab + chemo (ptx +
cis / 5-FU + cis)vs.
chemo (ptx + cis/5-FU + cis)66.1 vs. 45.5 7.2 vs. 5.7
HR=0.56
95%CI:
(0.46–0.68)17.4 vs. 12.8
HR=0.66
95%CI:
(0.55–0.79)59.9 vs. 54.5 JUPITER-06 257/257 Toripalimab +
chemo (ptx + cis)
vs. chemo (ptx + cis)69.3 vs. 52.1 5.7 vs. 5.5
HR=0.58
95%CI:
(0.46–0.74)17 vs. 11
HR=0.58
95%CI:
(0.43–0.78)64.6 vs. 56.0 ASTRUM-007 368/183 Serplulimab +
chemo (cis + 5-Fu)
vs. chemo (cis + 5-Fu)57.6 vs. 42.1 5.8 vs. 5.3
HR=0.60
95%CI:
(0.48–0.75)15.3 vs. 11.8
HR=0.68
95%CI:
(0.53–0.87)64.0 vs. 59.0 GEMSTONE-304 358/182 Sugemalimab +
chemo (cis + 5-Fu)
vs. chemo (cis + 5-Fu)60.1 vs. 45.2 6.2 vs. 5.4
HR=0.67
95%CI:
(0.54–0.82)15.3 vs. 11.5
HR=0.70
95%CI:
(0.55–0.90)51.3 vs. 48.4 Notes: ESCC: esophageal squamous cell carcinoma; Chemo: chemotherapy; cis: cisplatin; 5-FU: 5-Fluorouracil; ptx: paclitaxel; ORR: objective response rate; mPFS: median progression-free survival; mOS: median overall survival; HR: hazard ratio. 尽管免疫联合化疗方案为晚期ESCC患者带来的生存获益提高,但仍不满足目前临床的需要,鉴于晚期ESCC患者仅一次最佳初治的时机,为获得更好的疗效,满足更多患者的个体化精准治疗,因此,对晚期ESCC患者初始治疗方案的探索尤为重要。目前晚期ESCC一线治疗方案探索方向有以下两方面。
一是在免疫联合化疗基础上,增加其他类型药物来增强疗效,比如血管内皮生长因子酪氨酸激酶抑制剂、TIGIT抗体等药物。LEAP-014研究是评估仑伐替尼+帕博利珠单抗+化疗在未经治疗的转移性ESCC患者的疗效和安全性的Ⅲ期临床研究,第一阶段的研究结果显示了在免疫联合化疗基础上增加仑伐替尼的治疗方案安全性是可耐受的[23]。同样,在一项安罗替尼联合卡瑞利珠单抗联合紫杉醇和卡铂一线治疗晚期ESCC疗效和安全性的Ⅱ期研究中[24],结果显示在免疫联合化疗中加入安罗替尼后客观缓解率(Objective response rate, ORR)为90%,疾病控制率(Disease control rate, DCR)为100%,中位无进展生存期(Progression-free survival, PFS)达13.4个月,未发生4级或5级不良反应,整体安全性可控。TQB2450-II-13研究[25]为安罗替尼联合贝莫苏拜单抗(PD-L1抑制剂)+化疗一线治疗转移性ESCC的疗效和安全性研究,结果显示,安罗替尼联合免疫及化疗的ORR达82.2%、DCR为100.0%,中位PFS尚未达到,3~4级不良反应发生率为66%,未发生5级不良反应。SKYSCRAPER-08研究[26]为TIGIT单抗Tiragolumab联合阿替利珠单抗联合化疗一线治疗ESCC疗效和安全性研究,结果显示,Tiragolumab+阿替利珠单抗组和安慰剂组的中位总生存期(Overall survival, OS)分别为15.7个月和11.1个月(HR=0.70,95%CI: 0.55~0.88,P=0.0024)。两组的中位PFS分别为6.2个月和5.4个月(HR=0.56,95%CI: 0.45~0.70,P<0.0001)。总体安全性方面,两组均有98.2%的患者发生任何级别的治疗相关不良事件(Treatment-related adverse events, TRAE)。两组分别有59.6%和56.4%的患者发生3~4级TRAE,分别有2.6%和0.9%发生5级TRAE。除上述研究外,还有免疫联合化疗联合TIGIT的AdvanTIG-105研究[27]、联合FGFR抑制剂[28]及联合EGFR抑制剂[29]小样本Ⅰ~Ⅱ期研究,均显示出初步的抗肿瘤活性。尽管上述研究显示,在免疫治疗联合化疗标准一线方案基础上联合其他类型药物的“加法”方案显示出一定的疗效和安全性,但样本量均较少,且OS结果还未报道。期待更大样本的Ⅲ期临床研究探索这种治疗模式在晚期ESCC一线治疗的OS能否优于免疫联合化疗标准治疗方案。
二是鉴于某些患者不适合化疗联合免疫治疗,采用单纯化疗或免疫治疗无法获得更好的疗效,因此采用免疫联合抗血管生成治疗、化疗联合抗血管生成治疗或双免疫治疗等作为晚期ESCC一线治疗方案。最新的研究进展如下,ALTER-E003研究[30]是探索安罗替尼联合贝莫苏拜单抗(TQB2450, PD-L1抑制剂)一线治疗晚期ESCC的疗效和安全性的Ⅱ期研究,结果显示,安罗替尼联合贝莫苏拜单抗一线治疗晚期ESCC的ORR为69.6%,DCR为91.3%,mPFS达15.44个月,TRAE的发生率为93%(43/46),3级及以上TRAE仅为26%(12/46)。ALTER-E002研究[31]是探索安罗替尼联合紫杉醇+顺铂一线治疗晚期ESCC的疗效和安全性的Ⅱ期研究,结果显示安罗替尼联合紫杉醇+顺铂一线治疗晚期ESCC的ORR为76.1%,mPFS为8.38个月,mOS为18.53个月,且不良反应多为1~2级,因此,该方案在2022版CSCO《食管癌诊疗指南》中入选了一线治疗Ⅲ级推荐(3A类)。CheckMate 648[16]旨在评估纳武利尤单抗联合化疗或双免疫检查点抑制剂(纳武利尤单抗+伊匹单抗)联合治疗一线治疗晚期ESCC的有效性及安全性的Ⅲ期临床试验,结果显示,在总体人群中,双免治疗组中位OS为12.8个月,化疗组为10.7个月(HR=0.78, 98.2%CI: 0.62~0.98, P=0.011)。两组中位缓解持续时间(Duration of response, DoR)分别为11.1月和7.1月。在PD-L1≥1%患者中,双免治疗组的OS 也显著长于单纯化疗组化疗(13.7 vs. 9.1个月;HR=0.64,98.6%CI: 0.46~0.90;P=0.001)。两组中位DoR分别是11.8个月和5.7个月,两组3级或4级TRAE发生率为32%和36%,任何级别TRAE发生率为32%和16%。
4 免疫治疗在晚期食管鳞癌二线及后线治疗的研究进展
免疫治疗在晚期ESCC探索始于二线及后线治疗研究,目前根据KEYNOTE-181[32]、ATTRACTION-3[33]、ESCORT[34]及RATIONALE 302[35]等研究的结果,帕博利珠单抗、纳武利尤单抗、卡瑞利珠单抗、替雷利珠单抗单药治疗被国内CSCO指南纳入晚期ESCC二线治疗Ⅰ级1A类推荐,见表2。
表 2 晚期ESCC的二线免疫治疗的Ⅲ期临床研究Table 2 Phase Ⅲ study of second-line immunotherapy for advanced ESCCTrials Subjects Sample sizes Treatments ORR (%) mPFS (m) mOS (m) ≥Grade 3 adverse
reactions (%)Keynote-181
(China)ESCC 62 vs. 61 Pembrolizumab
vs. chemo (ptx/ doc/
CPT-11)/ 2.5 vs. 2.8
HR=0.84
95%CI:
(0.58–1.23)8.4 vs. 5.6
HR=0.55
95%CI:
(0.36–0.82)21.0 vs. 42.4 Keynote-181
(PD-L1 CPS≥10)ESCC/EAC 107 vs. 115 Pembrolizumab
vs. chemo (ptx/ doc/
CPT-11)21.5 vs. 6.1 2.6 vs. 3.0
HR=0.73
95%CI:
(0.54–0.97)9.3 vs. 6.7
HR=0.69
95%CI:
(0.52–0.93)18.0 vs. 40.9 Attraction-3 ESCC 210 vs. 209 Nivolumab
vs. chemo (ptx/ doc)19.3 vs. 21.5 1.7 vs. 3.4
HR =1.07
95%CI:
(0.87–1.33)10.9 vs. 8.5
HR=0.79
95%CI:
(0.64–0.97)19.1 vs. 63.9 ESCORT ESCC 228 vs. 220 Camrelizumab
vs. chemo (doc/
CPT-11)20.2 vs. 6.4 1.9 vs. 1.9
HR=0.69
95%CI:
(0.56–0.86)8.3 vs. 6.2
HR=0.71
95%CI:
(0.57–0.87)19.0 vs. 40.0 RATIONALE-302 ESCC 256 vs. 256 Tislelizumab
vs. chemo (ptx/ doc/
CPT-11)20.3 vs. 9.8 1.6 vs. 2.1
HR=0.83
95%CI:
(0.67–1.01)8.6 vs. 6.3
HR=0.70
95%CI:
(0.57–0.85)18.8 vs. 55.8 Notes: EAC: esophageal adenocarcinoma; PD-L1: programmed cell death ligand 1; CPS: combined positive score; doc: docetaxel; CPT-11: irinotecan; /: not available. 鉴于食管癌免疫治疗获得性耐药比例约为50%[36],耐药后的治疗策略目前尚无标准指南推荐。因此二线治疗后新的治疗药物及治疗模式的探索非常关键。CAP02研究[37]旨在评估卡瑞利珠单抗联合阿帕替尼(“双艾”方案)作为ESCC二线治疗的疗效和安全性。结果显示一线免疫治疗失败食管癌患者接受“双艾”方案治疗后ORR达41%,提示“双艾”协同增效,可作为免疫耐药后再挑战的选择。ALTER-E-006研究[38]是一项针对既往经过PD-1/PD-L1/CTLA-4药物(单药或联合)治疗,但未经过抗血管药物治疗的晚期ESCC患者的多中心、回顾性的真实世界研究,用安罗替尼联合免疫检查点抑制剂(不限制产品)进行免疫再挑战治疗,结果显示ORR为29.6%,DCR为91.5%,mPFS为6.31个月,mOS达到10.97个月。AdvanTIG-203研究[39]是一项TIGIT抑制剂Ociperlimab联合替雷利珠单抗(实验组)对比安慰剂联合替雷利珠单抗(对照组)治疗PD-L1 TAP≥10%的一线化疗进展后的晚期ESCC患者的Ⅱ期研究,结果显示实验组的ORR为30.6%,而对照组为20.6%,差异无统计学意义(P=0.2114),两组PFS结果接近(3.4个月vs. 3.5个月,HR=0.93,95%CI: 0.61~1.43)。在一项评估HLX07(抗EGFR单抗)单一疗法或联合疗法作为一线或后线治疗局部晚期、不可切除或转移性ESCC的疗效的Ⅱ期研究中[29],一线治疗联合组共有30例,用药方案包括HLX07联合斯鲁利单抗和化疗;二线治疗单药组共有19例,用药方案为HLX07单药。结果显示,一线联合组和二线单药组ORR分别为55.2%和23.1%;两组中位PFS分别为未达到和1.5个月。因此,对于晚期ESCC患者,HLX07有一定的疗效。
5 免疫治疗的不良反应及预防策略的进展
免疫治疗的安全性在食管鳞癌治疗过程中非常重要。最近的一项荟萃分析报道了食管癌免疫治疗的TRAEs[40],与化疗组相比,免疫治疗组的严重TRAEs发生率相对较高(22.66% vs. 11.46%,P=0.059),显著增加了所有级别TRAEs(44.6% vs. 11.09%,P<0.001)和3~5级的免疫相关TRAEs(7.35% vs. 2.25%,P<0.001)发生率。免疫治疗常见不良反应有皮肤、胃肠道、肝脏、内分泌毒性及肺炎等,罕见有神经、眼、心脏毒性等。在大多数研究中,免疫治疗的安全性是可控的,但也有研究报道了严重的心肌炎、肺炎等危及患者生命。因此对于合并自身免疫系统疾病、肝炎、高龄等特殊人群免疫治疗,需要充分评估免疫治疗的耐受性及预期的获益[41]。针对出现的免疫毒性,需评估毒性级别,给予相应处理,并结合恢复情况决定是否再次启动免疫治疗。目前尚无有效的免疫治疗不良反应相关预测生物标志物,需积极探索并寻找更有效的方法进行监测和管理,防止出现严重不良反应。
6 讨论及展望
近年来,免疫治疗全面布局ESCC领域,从二线到一线,从单药到联合,彻底改变了晚期ESCC的治疗格局。然而各种挑战仍然存在:首先,需要寻找新的综合治疗模式,筛选治疗优势人群。免疫联合化疗作为晚期ESCC一线标准治疗,但仍不能满足目前治疗需要。为更好改善预后,在化免基础上探索了联合VEGF-TKI、FGFR抑制剂、 TIGIT单抗及EGFR抑制剂等“加法”研究。同时探索了双免、免疫联合抗血管及化疗联合抗血管治疗的“减法”研究。尽管上述研究部分PFS或ORR获益,但是仍未观察到OS获益,因此需要在早期研究基础上开展探索优势人群综合治疗模式的研究;其次,寻找精准免疫标志物,探索免疫耐药机制,为免疫联合治疗方案提供理论基础。总之,未来还需要开展更多以免疫治疗为基础的相关临床研究来解决上述问题,为晚期ESCC患者带来更大的生存获益。
Competing interests: The authors declare that they have no competing interests.作者贡献:祁春艳:课题思路设计、数据分析及文章撰写吴涛:数据筛选和分析齐晓光:文章思路设计、审阅文章数据及校对工作 -
-
[1] Woo CG, Seo S, Kim SW, et al. Differential protein stability and clinical responses of EML4-ALK fusion variants to various ALK inhibitors in advanced ALK-rearranged non-small cell lung cancer[J]. Ann Oncol, 2017, 28(4): 791-797. doi: 10.1093/annonc/mdw693
[2] Cancer Genome Atlas Research Network. Comprehensive molecular profiling of lung adenocarcinoma[J]. Nature, 2014, 511(7511): 543-550. doi: 10.1038/nature13385
[3] Neumann MP, González MV, Pitiot AS, et al. TP53 p. R72P genotype is a marker of poor prognosis in lung cancer[J]. Cancer Biomark, 2018, 21(4): 747-754. doi: 10.3233/CBM-170230
[4] Kuroda H, Yoshida T, Arimura T, et al. Contribution of smoking habit to the prognosis of stage I KRAS-mutated non-small cell lung cancer[J]. Cancer Biomark, 2018, 23(3): 419-426. doi: 10.3233/CBM-181483
[5] Chen XL, Xie KX, Yang ZL, et al. Expression of FXR and HRG and their clinicopathological significance in benign and malignant pancreatic lesions[J]. Int J Clin ExpPathol, 2019, 12(6): 2111-2120. http://www.ncbi.nlm.nih.gov/pubmed/31934033
[6] Bogoevska V, Wolters-Eisfeld G, Hofmann BT, et al. HRG/HER2/HER3 signaling promotes AhR-mediated Memo-1 expression and migration in colorectal cancer[J]. Oncogene, 2017, 36(17): 2394-2404. doi: 10.1038/onc.2016.390
[7] Fogarty FM, O'Keeffe J, Zhadanov A, et al. HRG-1 enhances cancer cell invasive potential and couples glucose metabolism to cytosolic/extracellular pH gradient regulation by the vacuolar-H+ ATPase[J]. Oncogene, 2014, 33(38): 4653-4663. doi: 10.1038/onc.2013.403
[8] Niu L, Song X, Wang N, et al. Tumor-derived exosomal proteins as diagnostic biomarkers in non-small cell lung cancer[J]. Cancer Sci, 2019, 110(1): 433-442. doi: 10.1111/cas.13862



 下载:
下载: