Association Between Single Nucleotide Polymorphisms in ESR Pathway and Risk of Brain Metastasis in NSCLC with EGFR Mutation
-
摘要:目的
探讨雌激素受体信号通路中基因的单核苷酸多态性与EGFR敏感突变的非小细胞肺癌脑转移发生风险的相关性。
方法提取105例EGFR敏感突变的非小细胞肺癌患者全血样本的基因组DNA。选择雌激素受体信号通路中ESR1和ESR2基因的7个单核苷酸多态性(SNP)位点并检测这7个SNPs位点的基因型。通过Kaplan-Meier分析评估基因型与累积脑转移发生率的相关性。采用多因素Cox回归分析来评估基因型与脑转移发生风险之间的相关性。
结果发现ESR1:rs2982685的GA/AA基因型和ESR2:rs3020443的AC/CC基因型会增加脑转移风险(HR=5.845, 95%CI: 1.979-17.263, P=0.001; HR=5.288, 95%CI: 1.859-15.036, P=0.002)。
结论雌激素受体信号通路上的基因变异可预测EGFR敏感突变的非小细胞肺癌患者脑转移发生风险。
Abstract:ObjectiveTo explore the relation between the single nucleotide polymorphism of genes in estrogen receptor signaling pathway and the risk of brain metastasis in NSCLC with EGFR mutation.
MethodsGenomic DNA was extracted from 105 whole blood samples of NSCLC with EGFR mutation. Seven SNPs in ESR1 and ESR2 genes were selected. Subsequently, the genotypes of these seven SNPs in 105 patients were detected. Kaplan-Meier analysis was used to assess the association between genotype and cumulative brain metastasis rate. Multivariate Cox regression analysis was used to analyze the correlation between genotype variants and the occurrence of brain metastasis.
ResultsThe GA/AA genotype of ESR1: rs2982685 and AC/CC genotype of ESR2: rs3020443 were associated with high risk of brain metastasis (HR=5.845, 95%CI: 1.979-17.263, P=0.001; HR=5.288, 95%CI: 1.859-15.036, P=0.002).
ConclusionGene mutations in the estrogen receptor signaling pathway can predict the risk of brain metastases in NSCLC patients with EGFR mutations.
-
Key words:
- NSCLC /
- EGFR-TKI /
- SNP /
- Estrogen receptor /
- Brain metastasis
-
0 引言
表皮生长因子受体(epidermal growth factor receptor, EGFR)敏感突变的肺癌患者,表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)是一种有效的治疗选择[1]。但这部分患者脑转移发生率更高,其脑转移发生率高达30%~50%[2-3]。一旦发生脑转移,患者的预后极差,中位生存时间只有1~5月[4]。前期研究表明,对非小细胞肺癌(NSCLC)进行预防性颅脑照射(prophylactic cranial irradiation, PCI)可以降低脑转移的发生率,但并没有生存获益[5-6]。EGFR突变状态联合其他预测因素可能可以预测脑转移发生风险,从而为今后进行相关的前瞻性研究提供患者分层治疗的依据。雌激素受体系统在NSCLC的发生发展中发挥着重要作用。最新研究发现,雌激素受体(estrogen receptor, ER)与EGFR信号通路存在广泛的相互调控,在EGFR的信号通路中发挥着重要的作用[7]。因此,该通路上的基因变异可能成为潜在的脑转移风险预测因子。
1 资料与方法
1.1 研究人群和资料收集
本研究中105例患者均为2008—2011年间在华中科技大学同济医学院附属同济医院肿瘤中心诊治的、经组织学证实的原发性或转移性非小细胞肺癌患者。这些患者均存在EGFR敏感突变(21外显子L858R或19Del),并进行EGFR-TKI治疗。患者年龄、性别及疾病分期均不限,但所有患者都必须有可用于分析的血液样本。所有患者的Karnofsky体能评分(KPS)≥70分,且预计生存期≥6月。每位患者在治疗开始前均行头部或磁共振成像(MRI)扫描或计算机断层扫描(CT)作为疾病分期的一部分。所有患者在治疗结束后2~3年内每2~3月到医院复查(包括胸部和腹部的CT扫描)一次,之后每6月复查一次。如出现神经系统症状则应复查头部MRI或进行CT扫描。肿瘤分期依据美国癌症联合委员会制定的肿瘤诊疗指南中的“原发灶/淋巴结/远处转移”分期系统(第六版,2002)。吸烟状态分为一直吸烟、既往吸烟和从不吸烟,具体分类标准见文献[8]。所有患者在采集血液样本前都签署了知情同意书。本研究获得同济医学院伦理委员会的批准。
1.2 主要细胞及试剂
EGFR敏感突变肺腺癌细胞株H1975(中国科学院上海细胞库)。QuickGene DNA全血抽提试剂盒(日本Film Fuji公司); iPLEX® DNA质谱基因型检测试剂盒(5 u/ml Hotstar Taq及buffer、25 mmol/L dNTP、1.7 u/L SAP及buffer、iPLEX酶、PLEX延伸混合物、纯化树脂及SpectroCHIP质谱芯片)(美国SEQUENOM公司); 无内毒素质粒大提试剂盒(北京天根生化科技有限公司,批号:DP117);Lipofectamine® 3000转染试剂盒(美国英俊公司,批号:L3000075);无缝克隆试剂盒(湖北百奥斯生物科技有限公司,批号:BA0510);高保真热启动DNA连接酶及克隆试剂盒(美国赛默飞世尔科技公司,批号:F-549S)。
1.3 主要仪器
基质辅助激光解吸附电离飞行时间质谱分析质谱仪源自北京博奥生物技术有限公司,芯片点样采用美国SEQUENOM公司MassARRAY Nanodispenser RS1000点样仪; 质谱检测及分析使用美国SEQUENOM公司MassARRAY Analyzer Compact系统。其他实验仪器包括:低温高速离心机(德国Eppendorf公司); 台式高速离心机(德国Eppendorf公司); 水平电泳仪、电泳槽(北京六一仪器厂); 凝胶成像仪Gel Doc2000(美国BIO-RAD公司); NanoDrop 2000c分光光度仪(美国赛默飞世尔科技公司); 7900HT型实时荧光定量PCR仪(美国ABI公司)等。
1.4 DNA提取
采用QuickGene DNA全血试剂盒(日本Fuji Film公司)提取外周血淋巴细胞中的DNA,-80℃保存备用。
1.5 基因多态性位点选择
在ESR1和ESR2这2个基因内及距离5 kb以内的侧翼区选择SNPs位点。选择标准:(1)在中国人群中的等位基因频率大于0.1,该数据基于人类基因组单体型计划(www.hapmap.org)中检测到的人类样本的多态性数据; (2)r2阈值为0.8;(3)文献报道与肿瘤转移或非小细胞肺癌生存相关。根据以上标准共选择出7个SNPs位点,见表 1
表 1 筛选出的基因和单核苷酸多态性(SNPs)位点Table 1 Genes and single nucleotide polymorphisms selected for analysis
1.6 基因分型
SNPs位点的分型采用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight, MALDI-TOF)分析。TYPERs软件(Sequenom, Inc.,版本4.0)对检测结果进行分型输出。所有检测的SNP位点在全部样本中的检出成功率为95%以上。
1.7 双荧光素酶实验对ESR1: rs298268多态性进行功能评估
以ESR1-rs2982685G野生型质粒为模板,用PCR法构建突变型ESR1-rs2982685A(ESR1-mut)。PCR反应条件为:98℃预变性30 s后进入PCR循环; 循环参数为:98℃变性7 s、60℃复性30 s、72℃延伸6 min,共22个循环,循环结束后进行72℃ 5 min的后延伸。PCR结束后产物4℃保存。用H1975细胞进行转染。H1975细胞在T25瓶中长到80%左右时,吸弃培养液,并用PBS液洗细胞2次。加1 ml Trypsin-EDTA溶液混匀,消化30 s。加入5 ml含10%FBS的DMEM(H)培养基终止消化。调整细胞密度为每毫升2×105个。按每孔100 μl接种到96孔板中。共接种25孔。细胞在37℃、5%CO2环境下培养4~6 h至细胞贴壁。按每孔100 ng质粒、0.2 μl P3000、0.3 μl Lipofectamine®3000 Transfection Reagent的量进行转染。分别将每管质粒和转染试剂混合,并轻轻混匀。将各管混匀好的试剂室温孵育10 min。将孵育好的复合物按每孔10 μl加入到96孔板中。每组设5个复孔。37℃、5%CO2环境下继续培养24 h后进行双荧光素酶报告基因检测。
1.8 统计学方法
采用SPSS16.0和GraphPad Prism 8.0软件进行统计分析。Cox比例风险模型用来计算风险比(HRs)和95%置信区间(CIs),以评估基因型与脑转移风险的相关性。多因素分析调整了性别、年龄、疾病分期、组织学类型、KPS评分和吸烟状态。Kaplan-Meier曲线评估累积脑转移率,Log rank检验比较不同组间的差异。组间均数比较采用单因素方差分析。取双侧检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 患者临床病理特征与脑转移的相关性分析
105名患者的临床特征,见表 2。患者的中位年龄为57岁(26~82岁)。81%的患者为腺癌,45%的患者有吸烟史(其中男性患者的吸烟率为68.7%,女性为7.3%)。初诊时Ⅰ~Ⅲ期48例,按治疗规范行手术及术后辅助放化疗后定期复查,入组前均发生了包括骨、肺、肾上腺、肝、非区域淋巴结等部位的转移,随访中9例发生脑转移; Ⅳ期57例患者初诊时即存在远处转移(不包括脑),随访中16例发生脑转移。从确诊NSCLC到发生脑转移的中位时间为11月。对肿瘤的临床病理学特征与脑转移进行单因素及多因素分析,结果表明:疾病分期与脑转移发生风险相关,Ⅳ期患者的脑转移发生风险更高(P=0.019)。在单因素分析中,从不吸烟的患者脑转移发生风险较低(P=0.026),但是,在多因素分析中,这种差异没有达到统计学意义。本研究未发现性别、年龄、体能状况评分(KPS)及肿瘤组织学类型与脑转移存在相关性,见表 2。
表 2 患者的临床病理学特征及与脑转移发生的相关性Table 2 Patient- and disease-related characteristics and their association with brain metastasis
2.2 单个SNP位点与脑转移发生风险
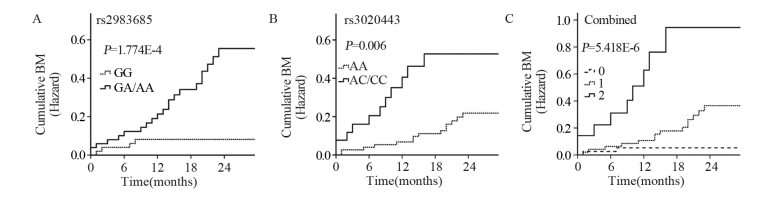
利用Kaplan-Meier及多因素Cox比例风险分析评估ESR1和ESR2基因中的7个SNP与脑转移风险的相关性。结果显示,ESR1: rs2982685和ESR2: rs3020443这两个位点的单核苷酸多态性与脑转移风险显著相关。Kaplan-Meier及Log rank检验发现,ESR1: rs2982685 GA/AA基因型(40%, P=1.774E-4)或ESR2: rs3020443 AC/CC基因型(41%, P=0.006)比GG(8%)或AA基因型(18%)患者累积脑转移发生率更高,见图 1。进一步行Cox比例风险分析发现,ESR1: rs2982685的GA/AA基因型和ESR2: rs3020443的AC/CC基因型导致脑转移风险增加,HR分别为5.845(95%CI: 1.979~17.263, P=0.001)和5.288(95%CI: 1.859~15.036, P=0.002),见表 3。多因素分析中参与调节的因素包括性别、年龄、疾病分期、肿瘤组织学类型、KPS评分和吸烟状态。在分析人群中,有13例患者组织学类型为鳞癌。由于鳞癌患者接受TKI治疗的疗效与非鳞癌患者存在显著差异,因此,本研究在非鳞癌患者中也做了同样的分析,结果与前一致,见表 4。将另外5个SNPs与脑转移风险也做了类似的分析,没有发现基因型与脑转移发生风险间的关联。同时,将与脑转移发生风险相关的两个位点与其他部位转移(除去脑转移)也进行了同样的分析,没有发现相关性。
![]() 图 1 非小细胞肺癌患者的Kaplan-Meier生存曲线(累积脑转移发生率)Figure 1 Kaplan-Meier survival curves of NSCLC patients (cumulative probability of brain metastasis)The GA/AA genotype at rs2982685 and the AC/CC genotype at rs3020443 are defines as unfavoraide genotype. They were associated with higher cumulative probability of brain metastasis than other genotypes. Patients with these two unfavorable genotypes had the highest risk of brain metastasis. 0, 1, 2: number of unfavorable genotypes.表 3 105例患者基因型与脑转移发生风险的单因素和多因素分析Table 3 Associations between genotypes and risk of brain metastases of 105 patients by uni- and multi-variate analyses
图 1 非小细胞肺癌患者的Kaplan-Meier生存曲线(累积脑转移发生率)Figure 1 Kaplan-Meier survival curves of NSCLC patients (cumulative probability of brain metastasis)The GA/AA genotype at rs2982685 and the AC/CC genotype at rs3020443 are defines as unfavoraide genotype. They were associated with higher cumulative probability of brain metastasis than other genotypes. Patients with these two unfavorable genotypes had the highest risk of brain metastasis. 0, 1, 2: number of unfavorable genotypes.表 3 105例患者基因型与脑转移发生风险的单因素和多因素分析Table 3 Associations between genotypes and risk of brain metastases of 105 patients by uni- and multi-variate analyses 表 4 非鳞癌患者基因型与脑转移发生风险的关系Table 4 Associations between genotypes and risk of brain metastases in non-squamous cell lung cancer
表 4 非鳞癌患者基因型与脑转移发生风险的关系Table 4 Associations between genotypes and risk of brain metastases in non-squamous cell lung cancer
2.3 多个SNP位点的累积效应
将ESR1: rs2982685的GA/AA和ESR2: rs3020443的AC/CC这些与脑转移风险增加相关的基因型定义为“不利”基因型。根据不利基因型的数目(即0、1或2)将患者进行分组后发现,不利基因型数目和脑转移发生率呈正相关。同时携带2个不利基因型的患者脑转移发生率为60%,携带1个的为29%,不携带者为5%。Kaplan-Meier和Log rank检验证实,同时携带2个不利基因型的患者脑转移风险增加,差异有统计学意义(P=5.418E-6),见图 1。多变量Cox比例风险分析显示,携带1个不利基因型的脑转移风险比为5.757(95%CI: 1.261~26.271, P=0.024),对于同时携带两种不利基因型的患者,这种风险增加到30倍以上(HR=30.305; 95%CI: 5.921~155.111, P=4.227E-5)。这些结果表明,ESR1和ESR2遗传变异对脑转移风险具有累加效应,见表 5。
表 5 基因型与脑转移风险(ESR1: rs2982685和ESR2: rs3020443两个位点结合分析)Table 5 Associations between genotypes and risk of brain metastases (ESR1: rs2982685 and ESR2: rs3020443 were combined for analysis)
2.4 ESR1: rs298268多态性的功能评估
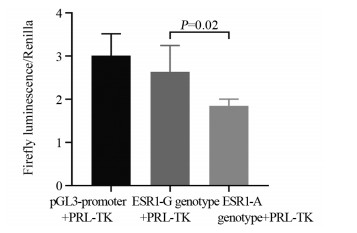
在肺癌H1975细胞系中检测了ESR1: rs2982685的调节作用。相对荧光素酶表达试验表明,克隆到pGL3b-rs2982685G构建体或pGL3b-rs2982685A构建体中的内含子区显示出启动子活性。这表明在rs2982685多态性周围可能存在一个启动子区域。进一步检测与脑转移风险相关的多态性位点rs2982685的等位基因是否对启动子活性具有特异性作用发现,与表达G等位基因报告基团的细胞相比,用ESR1: rs2982685A等位基因报告基团转染的H1975细胞显示出更低的荧光素酶活性(P=0.02),见图 2。
3 讨论
雌激素及其受体与NSCLC的发生、发展有着一定的相关性[9]。雌激素受体可分为ERα和ERβ,广泛存在于乳腺癌、子宫内膜癌、肺癌及正常肺组织中,这些受体蛋白可以调控细胞周期、控制细胞信号转导和影响细胞生存[10]。本研究探讨了雌激素及其受体的基因单核苷酸多态性是否与EGFR敏感突变的非小细胞肺癌脑转移风险相关。结果显示,ESR1: rs2982685和ESR2: rs3020443的单核苷酸多态性与脑转移风险相关。如能得到验证,有望为今后进行相关的前瞻性研究提供患者分层治疗的依据。
单核苷酸多态性(SNP)是人类基因组中最常见的序列变异。位于外显子区域的SNP可能改变蛋白质功能,而基因启动子中的SNP可以改变基因表达水平[11]。研究显示,参与雌激素生物合成、代谢和信号转导的基因多态性在激素依赖性肿瘤中起着重要作用[12]。近年来,已鉴定出ESR1和ESR2基因中的多个SNPs,并且已发表了不同的基因型-表型关联研究[13]。
本研究发现与脑转移风险相关的两个SNP位点分别位于ESR1和ESR2基因上。雌激素通过多种组织中的雌激素受体(ER)介导的信号转导来调控许多生理功能[14]。ER包含两个亚型,即ERα和ERβ,它们分别由ESR1和ESR2基因编码[15]。ER途径是乳腺癌中研究得较为深入的途径之一。近年来,有关ER信号在肺癌中的研究逐渐增加。有研究发现,绝经后妇女补充雌激素和孕激素的治疗组(HRT)与不进行激素替代疗法组比较,HRT组肺癌的发生风险及死亡风险均增加[16]。多项研究证实ERα信号途径在肿瘤转移中发挥重要作用。乳腺癌中,超过80%的转移淋巴结和65%~70%的远处转移灶过表达ERα[17]。另外,有研究表明,ER在EGFR的信号转导通路中发挥着重要作用[18]。
本研究中,ESR1: rs2982685显示与脑转移风险密切相关。ESR1: rs2982685的变异可能会影响基因转录,从而改变蛋白质水平。在肺癌细胞系中的功能检测表明,转染了ESR1: rs2982685A的H1975细胞与表达G等位基因报告基团的细胞相比,萤光素酶活性显著降低。众多学者对NSCLC患者ER表达情况和预后相关性进行研究发现,ER的表达和肿瘤的预后有着极为密切的关系[19]。肿瘤远处转移,尤其是脑转移,是影响肿瘤预后的一个重要因素。综上所述,ESR基因单核苷酸多态性可能与肿瘤转移,包括中枢神经系统转移相关。
综上所述,本研究发现2个SNPs(ESR1: rs2982685和ESR2: rs3020443)与脑转移风险相关。由于样本量较小,尚需进一步扩大样本量,以及通过多中心研究进一步加以验证。另外本研究对脑转移的诊断基于出现神经系统症状时进行的MRI或CT扫描,这样可能漏掉部分无症状的脑转移患者。实际上,这也是在同类研究中公认的可能限制分子标记精确性的一个缺陷,结果需要在独立的样本库中进行验证,如能得到证实,这些SNPs位点可能成为有价值的生物标志物,用于结合临床病理学的因素识别可能受益于PCI的脑转移高危患者。
Competing interests: The authors declare that they have no competing interests.作者贡献吴毕力:实验实施、数据分析及论文写作金玉:资料收集周潇:实验实施袁响林:实验设计李倩侠:实验设计、论文修改及审核 -
表 1 筛选出的基因和单核苷酸多态性(SNPs)位点
Table 1 Genes and single nucleotide polymorphisms selected for analysis

表 2 患者的临床病理学特征及与脑转移发生的相关性
Table 2 Patient- and disease-related characteristics and their association with brain metastasis

表 3 105例患者基因型与脑转移发生风险的单因素和多因素分析
Table 3 Associations between genotypes and risk of brain metastases of 105 patients by uni- and multi-variate analyses

表 4 非鳞癌患者基因型与脑转移发生风险的关系
Table 4 Associations between genotypes and risk of brain metastases in non-squamous cell lung cancer

表 5 基因型与脑转移风险(ESR1: rs2982685和ESR2: rs3020443两个位点结合分析)
Table 5 Associations between genotypes and risk of brain metastases (ESR1: rs2982685 and ESR2: rs3020443 were combined for analysis)

-
[1] Noronha V, Patil VM, Joshi A, et al. Gefitinib Versus Gefitinib Plus Pemetrexed and Carboplatin Chemotherapy in EGFR-Mutated Lung Cancer[J]. J Clin Oncol, 2020, 38(2): 124-136. http://www.researchgate.net/publication/335201766_Gefitinib_Versus_Gefitinib_Plus_Pemetrexed_and_Carboplatin_Chemotherapy_in_EGFR-Mutated_Lung_Cancer
[2] Hsu F, De Caluwe A, Anderson D, et al. EGFR mutation status on brain metastases from non-small cell lung cancer[J]. Lung Cancer, 2016, 96: 101-107. http://www.sciencedirect.com/science/article/pii/S0169500216302744
[3] Patel SH, Rimner A, Foster A, et al. Patterns of initial and intracranial failure in metastatic EGFR-mutant non-small cell lung cancer treated with erlotinib[J]. Lung Cancer, 2017, 108: 109-114. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=a2c413b662edefe980c25fd2b5a48cc7
[4] Hoffknecht P, Tufman A, Wehler T, et al. Efficacy of the irreversible ErbB family blocker afatinib in epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor (TKI)-pretreated non-small-cell lung cancer patients with brain metastases or leptomeningeal disease[J]. J Thorac Oncol, 2015, 10(1): 156-163. http://www.ncbi.nlm.nih.gov/pubmed/25247337
[5] Gore EM, Bae K, Wong SJ, et al. Phase Ⅲ comparison of prophylactic cranial irradiation versus observation in patients with locally advanced non-small-cell lung cancer: primary analysis of radiation therapy oncology group study RTOG 0214[J]. J Clin Oncol, 2011, 29(3): 272-278.
[6] Sun A, Hu C, Wong SJ, et al. Prophylactic Cranial Irradiation vs Observation in Patients With Locally Advanced Non-Small Cell Lung Cancer: A Long-term Update of the NRG Oncology/RTOG 0214 Phase 3 Randomized Clinical Trial[J]. JAMA Oncol, 2019, 5(6): 847-855. http://www.ncbi.nlm.nih.gov/pubmed/30869743
[7] Deng F, Li M, Shan WL, et al. Correlation between epidermal growth factor receptor mutations and the expression of estrogen receptor-beta in advanced non-small cell lung cancer[J]. Oncol Lett, 2017, 13(4): 2359-2365. http://www.ncbi.nlm.nih.gov/pubmed/28454404
[8] Li Q, Wu H, Chen B, et al. SNPs in the TGF-beta signaling pathway are associated with increased risk of brain metastasis in patients with non-small-cell lung cancer[J]. PLoS One, 2012, 7(12): e51713. http://annonc.oxfordjournals.org/external-ref?access_num=10.1371/journal.pone.0051713&link_type=DOI
[9] Gao X, Cai Y, Wang Z, et al. Estrogen receptors promote NSCLC progression by modulating the membrane receptor signaling network: a systems biology perspective[J]. J Transl Med, 2019, 17(1):308. doi: 10.1186/s12967-019-2056-3
[10] 李琳, 王晖, 杜俊, 等.雌激素受体α和β及表皮生长因子受体的表达与非小细胞肺癌临床病理特点关系[J].现代肿瘤医学, 2013, 21(3): 539-543. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=sxzlyx201303028 Li L, Wang H, Du J, et al. Expressions and clinicopathological characteristics of estrogen receptor α, β and epidermal growth factor receptor in non-small cell lung cancer[J]. Xian Dai Zhong Liu Yi Xue, 2013, 21(3): 539-543. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=sxzlyx201303028
[11] Harendza S, Lovett DH, Panzer U, et al. Linked common polymorphisms in the gelatinase a promoter are associated with diminished transcriptional response to estrogen and genetic fitness[J]. J Biol Chem, 2003, 278(23): 20490-20499. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=369ae48760de60beb88fe4c91251332a
[12] Chen KY, Hsiao CF, Chang GC, et al. Estrogen Receptor Gene Polymorphisms and Lung Adenocarcinoma Risk in Never-Smoking Women[J]. J Thorac Oncol, 2015, 10(10): 1413-1420. http://smartsearch.nstl.gov.cn/paper_detail.html?id=9f9dc43ad125359ccad694e9d28397fc
[13] Lattrich C, Häring J, Schüler S, et al. Polymorphisms in the promoter region of estrogen receptor beta gene in endometrial cancer[J]. Arch Gynecol Obstet, 2014, 289(3): 631-635. doi: 10.1007/s00404-013-3012-8
[14] Siegfried JM, Farooqui M, Rothenberger NJ, et al. Interaction between the estrogen receptor and fibroblast growth factor receptor pathways in non-small cell lung cancer[J]. Oncotarget, 2017, 8(15): 24063-24076. http://pubmedcentralcanada.ca/pmcc/articles/PMC5421827/
[15] Häring J, Skrzypczak M, Stegerer A, et al. Estrogen receptor beta transcript variants associate with oncogene expression in endometrial cancer[J]. Int J Mol Med, 2012, 29(6): 1127-1136. http://europepmc.org/abstract/MED/22378275
[16] Miller KD, Siegel RL, Lin CC, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4): 271-289. http://esmoopen.bmj.com/lookup/external-ref?access_num=10.3322/caac.21349&link_type=DOI
[17] Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study[J]. J Clin Oncol, 2011, 29(2): 134-141. http://pubmedcentralcanada.ca/pmcc/articles/PMC3058272/
[18] Fu S, Liu C, Huang Q, et al. Estrogen receptor beta1 activation accelerates resistance to epidermal growth factor receptor-tyrosine kinase inhibitors in non-small cell lung cancer[J]. Oncol Rep, 2018, 39(3): 1313-1321. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=a4da4bf679e3aee114089cbdb3c9aae6
[19] 井晓婷, 何芳, 钱盼盼, 等.肺癌组织中雌激素受体α和雌激素受体β的表达及临床意义[J].中国现代医生, 2018, 56(16): 1-4. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhzl201309008 Jin XT, He F, Qian PP, et al. Clinicopathological and prognostic significance of ERα and ERβ expression in lung carcinomas: a tissue microarray study[J]. Zhongguo Xian Dai Yi Sheng, 2018, 56(16): 1-4. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhzl201309008
-
期刊类型引用(7)
1. 尹松,周汨,陈熙,丁融. 基于网络药理学与分子对接方法探究中医扶正治疗肺癌的机制. 智慧健康. 2025(01): 76-80 .  百度学术
百度学术
2. 罗子悦,李逸轩,周静,祝朝勇,刘凯,刘舒月,谢甜,肖莎. ESR1、ESR2基因单核苷酸多态性与海南地区肺癌发生风险的关联研究. 中国热带医学. 2025(06): 682-689 .  百度学术
百度学术
3. 张松,赵宁. 基于网络药理学探索百部异病同治肺癌与咳嗽的共同作用机制. 中华养生保健. 2024(08): 64-67 .  百度学术
百度学术
4. 李辉,蒋婷,周宗正. 卡瑞利珠单抗对晚期非小细胞肺癌脑转移患者的疗效及驱动基因突变关联分析. 中国药物应用与监测. 2024(03): 216-220 .  百度学术
百度学术
5. 游志鑫,刘爱民,冯小伟,赵改花,郝美静,霍红旗. PET/CT代谢参数与肺腺癌生物学特征关系分析及对脑转移的预测价值. 中国临床新医学. 2023(07): 700-704 .  百度学术
百度学术
6. 钟晓琴,宁振求,王凯,蔡粤芳,邓敏贞. 基于网络药理学、分子对接技术与实验验证探讨定志小丸干预阿尔兹海默病的机制研究. 中药药理与临床. 2023(07): 2-9 .  百度学术
百度学术
7. 杨伟涛. 六味地黄丸加减辅治干燥综合征疗效观察. 实用中医药杂志. 2021(12): 2042-2043 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: