CXCL5 Promotes Gastric Cancer via Modulating NF-κB and Wnt/β-catenin Signaling-mediated Inhibition of Tumor Immune
-
摘要:目的
探讨CXC趋化因子配体-5(CXCL5)促进胃癌的作用及其潜在分子机制。
方法纳入胃癌患者83例,另选取健康者40例作为对照。比较两者的血清CXCL5水平; 比较癌组织及癌旁正常组织中CXCL5与CXCR2的表达。检测CXCL5对胃癌细胞ERK/MAPK、PI3K/AKT、NF-κB及Wnt/β-catenin信号通路的影响。用对照与过表达CXCL5的MFC细胞建立胃癌移植瘤模型,记录肿瘤生长和小鼠生存曲线; 检测各组小鼠移植瘤中CXCL5、p-NF-κB与p-β-catenin的表达及CD4+T、CD8+T与CD56+CD16+NK细胞数量。
结果胃癌患者的血清CXCL5水平较健康者显著升高(P < 0.05)。癌组织中CXCL5与CXCR2的表达较癌旁正常组织显著升高(P < 0.05)。CXCL5能显著增加SNU216与MFC细胞p-NF-κB与p-β-catenin的表达(均P < 0.05)。与对照组小鼠相比,过表达CXCL5组小鼠的肿瘤体积显著增高(P < 0.05),生存期显著降低(P < 0.05),癌组织中CXCL5、p-NF-κB与p-β-catenin的表达显著升高(P < 0.05),癌组织中CD4+T、CD8+T与CD56+CD16+NK细胞数量均显著降低(均P < 0.05)。
结论CXCL5可能通过调控NF-κB与Wnt/β-catenin信号通路抑制肿瘤免疫从而发挥促进胃癌的作用。
-
关键词:
- CXC趋化因子配体-5 /
- NF-κB /
- Wnt /
- β-catenin /
- 胃癌
Abstract:ObjectiveTo investigate the role of CXCL5 in promoting gastric cancer and the potential molecular mechanisms.
MethodsWe selected 83 gastric cancer patients as study objects and 40 healthy people who underwent physical examination as control. We compared the serum levels of CXCL5 between gastric cancer patients and healthy control, and the expression of CXCL5 and CXCR2 between tumor and paracarcinoma tissues. The effect of CXCL5 on ERK/MAPK, PI3K/AKT, NF-κB and WNT/β-catenin signals were examined. CXCL5-overexpressed and control MFC cells were injected subcutaneously into C57 mice to establish xenograft model. Tumor growth and survival curves were drawn. The expression of CXCL5, p-NF-κB and p-β-catenin and the number of CD4+ T, CD8+ T and CD56+CD16+ NK cells in xenograft tumor tissue were determined.
ResultsCXCL5 expression in the serum of gastric cancer patients was significant higher than that in healthy controls (P < 0.05). The expression of CXCL5 and CXCR2 in tumor tissues were significantly higher than those in paracarcinoma normal tissues (P < 0.05). CXCL5 increased the expression of p-NF-κB and p-β-catenin in SNU126 and MFC cells (P < 0.05). In CXCL5 overexpression group, the tumor volume significantly increased and the survival of mice were significantly decreased, the expression levels of CXCL5, p-NF-κB and p-β-catenin were significantly higher, the number of CD4+T, CD8+T and CD56+CD16+ NK cells were significantly higher, compared with control mice (all P < 0.05).
ConclusionCXCL5 may promote gastric cancer via modulating NF-κB and Wnt/β-catenin signaling-mediated inhibition of tumor immune.
-
Key words:
- CXCL5 /
- NF-κB /
- Wnt /
- β-catenin /
- Gastric cancer
-
0 引言
胃癌是我国最常见的消化道恶性肿瘤之一,其发病率和死亡率位居全球肿瘤发病率和死亡率的第二位[1-2]。胃癌的早期诊断率低,临床诊治时常被延误[2-3]。肿瘤标志物的出现为早期胃癌的诊断带来了新的希望[4-5]。虽然目前已发现多种用于胃癌检测的肿瘤标志物,但其特异性均不高,敏感度也不甚理想[6]。晚期胃癌患者的临床治疗手段仍以化疗为主,至今仍没有公认的治疗标准[7-8]。近些年,免疫治疗已成为肿瘤研究的热点,多项研究提示免疫治疗在未来的肿瘤治疗中有巨大前景[8-10]。报道指出,多种细胞因子在肿瘤免疫中发挥作用,已被用于肿瘤的免疫治疗[11-12]。CXC趋化因子配体-5(CXC chemokine ligand-5, CXCL5),又称为上皮中性粒细胞活化肽78(ENA78),是CXC趋化因子家族的成员之一[13-14]。作为炎性介质,CXCL5对中性粒细胞有很强的趋化作用[15]。此外,CXCL5可与其特异性受体CXCR2结合,介导一系列生物学效应进而影响肿瘤的生长与转移[15]。研究指出,CXCL5与非小细胞肺癌、膀胱癌、肝癌等的发生与发展密切相关[16-19]。而CXCL5在胃癌中的确切作用机制尚无报道,本研究探讨CXCL5对胃癌肿瘤免疫的影响及其潜在分子机制。
1 资料与方法
1.1 资料来源
本研究共纳入华中科技大学协和深圳医院胃肠外科于2018年7月—2019年4月收治的83例胃癌患者作为研究对象进行回顾性研究; 患者年龄在23~79岁之间,平均年龄51.3±13.8岁; 所有患者中男55例、女28例。所有患者均为首次被诊断为胃癌,均经病理学或影像学(或内镜)确诊。排除复发性胃癌患者、放化疗史的患者、并发其他恶性肿瘤的患者、近期服用影响机体免疫药物的患者、伴有全身感染性疾病的患者、临床资料不全无法进行统计的患者、伴有严重脏器功能障碍的患者、妊娠期或哺乳期女性。胃癌患者的基本信息见表 1。
表 1 83例胃癌患者的基本信息Table 1 Basic data of 83 gastric cancer patients
另选取同期在我院体检科体检的健康者40例作为对照; 年龄在29~67岁之间,平均年龄48.6±14.1岁,其中男27例、女13例。两组年龄与性别相比差异均无统计学意义(均P > 0.05),有可比性。所有纳入者均签署知情同意书,均知晓本研究的目的与方法,本研究获得医院伦理委员会批准。
1.2 材料与设备
DMEM培养基(美国Gibco公司); 胎牛血清(FBS)、青霉素和链霉素(美国Hyclone公司)。人胃癌细胞株SNU216和小鼠胃癌细胞株MFC购自武汉大学细胞库。Lipofectamine® 2000转染试剂(美国Thermo Fisher公司)。小鼠淋巴细胞分离液(深圳达科为生物技术有限公司)。人CXCL5 ELISA试剂盒(武汉华美生物工程有限公司)。重组人CXCL5蛋白(上海美迪西生物医药股份有限公司)。SDS-PAGE试剂(上海生工生物工程股份有限公司)。CXCL5抗体、CXCR2抗体、p-ERK1/2抗体、p-MAPK抗体、p-β-catenin抗体(美国Santa Cruz公司); p-PI3K抗体、p-AKT抗体、p-NF-κB抗体(美国CST公司); MAPK抗体、PI3K抗体、NF-κB抗体、β-catenin抗体(美国Abcam公司); ERK1/2抗体、AKT抗体、β-actin抗体(武汉三鹰生物技术有限公司)。NF-κB信号通路抑制剂BAY 11-7082(美国MCE公司),Wnt/β-catenin信号通路抑制剂XAV939(美国Selleckchem公司)。流式细胞术抗体:FITC标记的CD4抗体、APC标记的CD8抗体、FITC标记的CD56抗体、PE标记的CD16抗体(美国BioLegend公司)。pLVX-Tight-Puro质粒(美国Invitrogen公司)。Taq酶(武汉擎科生物技术有限公司)。内切酶BamHⅠ与EcoRⅠ(美国Thermo Fisher公司)。T4 DNA连接酶(日本TaKaRa公司)。C57小鼠购自武汉大学实验动物中心。主要设备有生物安全柜、CO2培养箱、垂直电泳仪、化学发光成像系统、流式细胞仪、Tecan酶标仪等。
1.3 酶联免疫检测CXCL5水平
分别抽取胃癌患者和健康者的空腹静脉血10 ml,置于促凝管中,自然凝固,2 600 r/min离心15 min,取上清液储存于-80℃备用。CXCL5 ELISA试剂盒检测血清中CXCL5的水平,检测过程严格按照产品说明书进行。用Tecan酶标仪测量450 nm处的OD值。绘制标准曲线,计算CXCL5浓度。
1.4 Western blot检测CXCL5、CXCR2及NF-κB、β-catenin、ERK和PI3K/AKT信号通路
取新鲜或-80℃冻存的患者肿瘤组织、癌旁正常组织和小鼠肿瘤组织,碾磨后用含cocktail蛋白酶抑制剂的RIPA裂解液进行裂解,超声后1 2000 r/min离心,取上清液即为总蛋白。贴壁细胞用PBS润洗,吸弃后加入含cocktail蛋白酶抑制剂的RIPA裂解液进行裂解,收集裂解液,超声后12 000 r/min离心,取上清液即为总蛋白。组织与细胞样品的蛋白浓度均用BCA试剂盒进行测定。SDS-PAGE电泳用5%的浓缩胶与12%的分离胶进行,每孔上蛋白样80~100 μg。电泳后将蛋白转至PVDF膜,用5%BSA封闭,一抗4℃孵育过夜。洗涤,二抗室温孵育,洗涤,DAB显色。
1.5 免疫组织化学染色检测CXCL5与CXCR2
采用SP法检测胃癌患者肿瘤及癌旁正常组织中CXCL5与其受体CXCR2的表达。将10%甲醛溶液固定过夜的组织进行石蜡包埋与切片,所有切片常规脱蜡至水,加0.01 mol/L枸橼酸缓冲液(pH6.0),用高压锅进行抗原热修复,加3%H2O2室温避光孵育30 min,PBS洗涤3次。滴加10%的正常非免疫羊血清,37℃孵育60 min,PBS洗涤3次。滴加CXCL5或CXCR2一抗工作液(稀释比例为1:50),4℃孵育过夜,PBS洗涤3次。滴加二抗工作液(稀释比例为1:200),37℃孵育60 min,PBS洗涤3次。滴加辣根过氧化物酶(HRP)标记的链霉卵白素,37℃孵育60 min,PBS洗涤3次。用DAB显色、苏木精对比染色、脱水、二甲苯透明、中性树胶封片。显微镜下观察,每个切片随机选取5个视野进行拍照。用Image Pro Plus软件计算阳性染色的平均吸光度。
1.6 质粒构建与稳定表达细胞株建立
根据人CXCL5的mRNA序列(NM_002994.5)和pLVX-Tight-Puro载体图谱,设计引物序列,上游引物:5’-CCGGGATCCATGAGCCTCCTGTCCAGC-3’(BamHⅠ); 下游引物:5’-CCCGGTAGAATTCGTTTTCCTTGTTTCCACC-3’(EcoRⅠ)。从人胃癌细胞株SNU216中提取总RNA并反转录为cDNA。以cDNA为模板,根据Taq酶的说明书进行PCR扩增。扩增产物经鉴定、纯化后备用。用BamHⅠ和EcoRⅠ酶对pLVX-Tight-Puro质粒进行双酶切,酶切产物经鉴定、纯化后备用。根据T4连接酶的说明书将cDNA扩增产物与酶切质粒进行连接,连接产物经转化与鉴定后提取质粒备用。pLVX-CXCL5质粒构建成功后根据pLVX-Tight-Puro的说明书包装慢病毒。慢病毒感染SNU216或MFC细胞,用嘌呤霉素筛选稳定表达CXCL5的细胞。
1.7 小鼠移植瘤模型的建立
将30只C57小鼠随机分为CXCL5过表达组和对照组,每组15只。将对数期生长的稳定过表达CXCL5或对照小鼠胃癌MFC细胞消化、离心、PBS重悬、计数后调整细胞浓度至1.0×107/ml,无菌条件下将细胞接种于C57小鼠左前肢腋窝结合部皮下,每只0.1 ml。接种后第3天起隔天记录各小鼠的肿瘤大小,绘制肿瘤生长与生存曲线。用Western blot分析各组小鼠肿瘤组织中CXCL5、磷酸化NF-κB与磷酸化β-catenin的表达水平。分离小鼠胃癌移植瘤细胞。用流式细胞术检测移植瘤中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞比例。
1.8 流式细胞术检测CD4+T、CD8+T与CD56+CD16+NK细胞
分离小鼠胃癌移植瘤组织切块,置于RPMI1640培养基中消化过夜、研磨、过不锈钢网过筛,经PBS洗涤后制成单细胞悬液,计数并将细胞浓度调整到1.0×107/ml,取0.5 ml细胞悬液加入离心管。根据抗体的使用说明书将待测抗体(CD4、CD8、CD56或CD16)以适当比例加入离心管中。涡旋混匀并将离心管置于避光处室温孵育30 min。低速离心机1 500 r/min离心5 min后弃上清液,并用PBS洗涤3次。再次弃上清液后加入0.3 ml的PBS重悬。涡旋混匀后上流式细胞仪进行检测。
1.9 统计学方法
所有数据分析均采用SPSS20.0进行。采用Graph Pad Prism 5.0进行作图。计数资料用频数和百分比(n(%))表示,计量资料用均数±标准差(x±s)表示。采用t检验或Mann-Whitney U检验分析两独立样本之间的差异,采用χ2检验或Fisher精确检验进行计数资料分析。所有统计学分析均为双尾检验,P < 0.05为差异有统计学意义。
2 结果
2.1 胃癌患者血清及组织中CXCL5水平分析
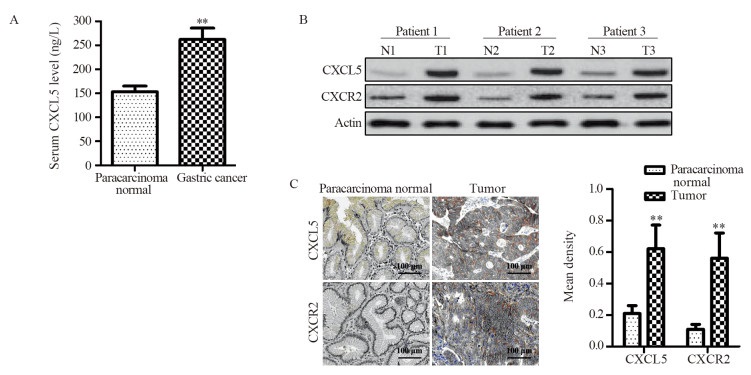
共纳入83例胃癌患者。ELISA分析显示胃癌患者的血清CXCL5水平为(263.1±37.9)ng/L,显著高于健康者的(158.6±18.3)ng/L。Western blot与免疫组织化学分析显示,胃癌患者肿瘤组织中的CXCL5及其受体CXCR2的水平均显著高于癌旁正常组织,见图 1。
2.2 CXCL5水平与临床特征的关系
根据患者肿瘤组织中CXCL5的表达水平,以所有患者的平均吸光度值为界限将所有患者分为CXCL5低表达组(CXCL5Low)与CXCL5高表达组(CXCL5High)。CXCL5低表达组26例、CXCL5高表达组57例。胃癌患者中CXCL5高表达与CXCL5低表达组的年龄、性别、组织学类型与浆膜浸润相比差异均无统计学意义(均P > 0.05)。CXCL5高表达组患者的分化程度显著低于CXCL5低表达组(P < 0.05),淋巴结转移、肝转移和TNM分期均显著高于CXCL5低表达组(均P < 0.05),见表 2。
表 2 CXCL5的表达与胃癌患者临床特征的关系Table 2 Relation between CXCL5 expression and clinical characteristics of gastric cancer patients
2.3 CXCL5对胃癌细胞信号通路的影响
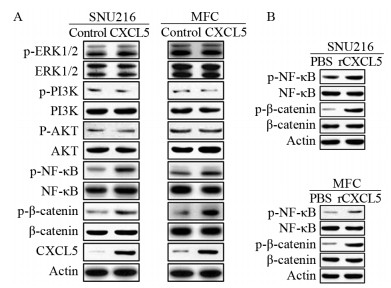
Western blot显示CXCL5过表达能显著增加SNU216与MFC细胞中p-NF-κB与p-β-catenin的表达水平,而不影响p-ERK、p-PI3K与p-AKT的表达水平,见图 2A。进一步分析显示,重组CXCL5蛋白(rCXCL5)也能显著增加SNU216与MFC细胞中p-NF-κB与p-β-catenin的表达水平,见图 2B。
2.4 小鼠模型的建立与分析
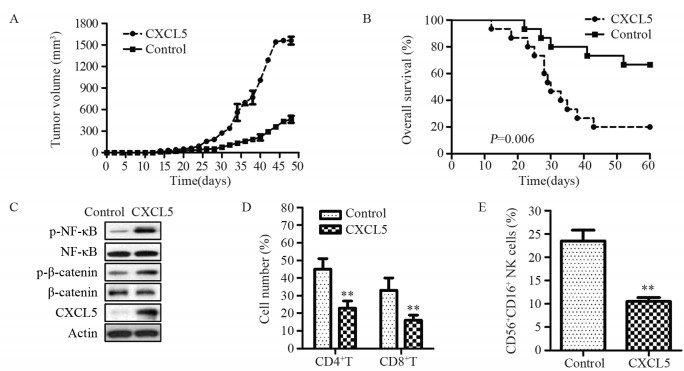
与对照组相比,CXCL5过表达组胃癌移植瘤小鼠的肿瘤体积显著增高(P < 0.05),见图 3A; 生存期显著降低(P=0.006),见图 3B。Western blot结果显示CXCL5过表达组中CXCL5、p-NF-κB与p-β-catenin的表达水平均显著高于对照组,见图 3C。流式分析结果显示CXCL5过表达组中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞数量均显著低于对照组,见图 3D~E。
3 讨论
胃癌的病理学发生机制涉及多种基因与信号通路的改变,而其确切的发病机制尚未被完全阐明。因此,进一步研究胃癌的发病机制,寻找新的生物指标和治疗靶点至关重要。CXCL5可通过其ELR功能区与CXCR2结合,进而介导肿瘤的生长、浸润与转移[15-16]。研究指出,CXCL5与非小细胞肺癌、膀胱癌、肝癌等的发病机制密切相关[16-18]。多项报道指出胃癌患者的血清CXCL5水平高于健康者[19]。而CXCL5在胃癌中的确切作用机制尚无报道。本研究结果显示,胃癌患者血清与肿瘤组织中的CXCL5水平均出现显著升高。同时,与对照组小鼠相比,过表达CXCL5组胃癌移植瘤小鼠的肿瘤体积显著增高,生存期显著降低。这些结果提示CXCL5可能参与胃癌的发生与发展机制。
胃癌肿瘤组织中NF-κB的表达水平显著高于癌旁正常组织,且NF-κB的表达与胃癌的分化程度和淋巴结转移密切相关[20]。Wnt/β-catenin信号通路作用广泛,Wnt/β-catenin信号通路亦与胃癌密切相关[21]。近年的研究发现,多种靶向Wnt/β-catenin信号通路的治疗均能有效抑制胃癌细胞的增殖与转移[21]。本研究中CXCL5过表达与重组CXCL5蛋白处理均能显著增加SNU216与MFC细胞的p-NF-κB与p-β-catenin的表达水平,而不影响p-ERK、p-PI3K与p-AKT的表达水平,提示CXCL5可能通过NF-κB与Wnt/β-catenin信号通路发挥促胃癌的作用。
免疫治疗利用肿瘤的免疫学特性杀灭肿瘤细胞和肿瘤组织[9-10],现已成为肿瘤治疗的热点之一[8]。肿瘤的免疫治疗通过调动宿主的免疫系统,使宿主对肿瘤的杀伤能力增强,进而消灭肿瘤细胞[8-9]。研究指出,与健康者相比,胃癌患者免疫细胞(如CD4+T细胞等)的数量均出现显著降低[22]。本研究中,CXCL5过表达组胃癌移植瘤小鼠的肿瘤组织中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞的数量均显著低于对照组。因此,CXCL5可能通过NF-κB与Wnt/β-catenin信号通路发挥抑制胃癌肿瘤免疫的作用。
综上所述,胃癌患者肿瘤组织及血清中CXCL5水平均显著升高,CXCL5可能通过激活NF-κB与Wnt/β-catenin信号通路抑制胃癌的肿瘤免疫活性进而发挥促进胃癌的作用。
作者贡献刘立:实验设计与实施、文章写作盖金娜:文献查阅、数据分析尹作文:数据分析陈琴华:课题整体设计、文章修改 -
表 1 83例胃癌患者的基本信息
Table 1 Basic data of 83 gastric cancer patients

表 2 CXCL5的表达与胃癌患者临床特征的关系
Table 2 Relation between CXCL5 expression and clinical characteristics of gastric cancer patients

-
[1] 左婷婷, 郑荣寿, 曾红梅, 等.中国胃癌流行病学现状[J].中国肿瘤临床, 2017, 44(1): 52-58. doi: 10.3969/j.issn.1000-8179.2017.01.881 Zuo TT, Zheng RS, Zeng HM, et al. Epidemiology of stomach cancer in China[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(1): 52-58. doi: 10.3969/j.issn.1000-8179.2017.01.881
[2] Zong L, Abe M, Seto Y, et al. The challenge of screening for early gastric cancer in China[J]. Lancet, 2016, 388(10060): 2606. doi: 10.1016/S0140-6736(16)32226-7
[3] Yoon H, Kim N. Diagnosis and management of high risk group for gastric cancer[J]. Gut Liver, 2015, 9(1): 5-17. doi: 10.5009/gnl14118
[4] Baretton GB, Aust DE. Current biomarkers for gastric cancer[J]. Pathologe, 2017, 38(2): 93-97. doi: 10.1007/s00292-017-0271-3
[5] 关晓英, 王芙蓉.胃黏膜瘤变过程中差异蛋白的表达[J].肿瘤防治研究, 2018, 45(8): 576-582. doi: 10.3971/j.issn.1000-8578.2018.17.1439 Guan XY, Wang FR. Proteomics Research on Gastric Intraepithelial Neoplasia[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(8): 576-582. doi: 10.3971/j.issn.1000-8578.2018.17.1439
[6] Venerito M, Vasapolli R, Malfertheiner P. Prevention, early diagnosis and therapy of gastric cancer[J]. MMW Fortschr Med, 2016, 158(13): 39-43. doi: 10.1007/s15006-016-8513-5
[7] Strong VE. Progress in gastric cancer[J]. Updates Surg, 2018, 70(2): 157-159. doi: 10.1007/s13304-018-0543-3
[8] Niccolai E, Taddei A, Prisco D, et al. Gastric cancer and the epoch of immunotherapy approaches[J]. World J Gastroenterol, 2015, 21(19): 5778-5793. doi: 10.3748/wjg.v21.i19.5778
[9] Bonotto M, Garattini SK, Basile D, et al. Immunotherapy for gastric cancers: emerging role and future perspectives[J]. Expert Rev Clin Pharmacol, 2017, 10(6): 609-619. doi: 10.1080/17512433.2017.1313113
[10] Zhao Q, Cao L, Guan L, et al. Immunotherapy for gastric cancer: dilemmas and prospect[J]. Brief Funct Genomics, 2019, 18(2): 107-112. doi: 10.1093/bfgp/ely019
[11] Gerson JN, Skariah S, Denlinger CS, et al. Perspectives of HER2-targeting in gastric and esophageal cancer[J]. Expert Opin Investig Drugs, 2017, 26(5): 531-540. doi: 10.1080/13543784.2017.1315406
[12] Gu L, Chen M, Guo D, et al. PD-L1 and gastric cancer prognosis: A systematic review and meta-analysis[J]. PLoS One, 2017, 12(8): e0182692. doi: 10.1371/journal.pone.0182692
[13] Nagarsheth N, Wicha MS, Zou W. Chemokines in the cancer microenvironment and their relevance in cancer immunotherapy[J]. Nat Rev Immunol, 2017, 17(9): 559-572. doi: 10.1038/nri.2017.49
[14] Roca H, Jones JD, Purica MC, et al. Apoptosis-induced CXCL5 accelerates inflammation and growth of prostate tumor metastases in bone[J]. J Clin Invest, 2018, 128(1): 248-266. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=f3ea5c9ad6afb9c8e10a0cc0a12f6894
[15] Yildirim K, Colak E, Aktimur R, et al. Clinical value of CXCL5 for determining of colorectal cancer[J]. Asian Pac J Cancer Prev, 2018, 19(9): 2481-2484. http://cn.bing.com/academic/profile?id=4cdde1694920c4d67dbedb24792540d3&encoded=0&v=paper_preview&mkt=zh-cn
[16] Wang L, Shi L, Gu J, et al. CXCL5 regulation of proliferation and migration in human non-small cell lung cancer cells[J]. J Physiol Biochem, 2018, 74(2): 313-324. doi: 10.1007/s13105-018-0619-z
[17] Qi Y, Zhao W, Li M, et al. High C-X-C motif chemokine 5 expression is associated with malignant phenotypes of prostate cancer cells via autocrine and paracrine pathways[J]. Int J Oncol, 2018, 53(1): 358-370. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=4917fb21b34da60fb339d5e338b0d61e
[18] Zhou SL, Zhou ZJ, Hu ZQ, et al. CXCR2/CXCL5 axis contributes to epithelial-mesenchymal transition of HCC cells through activating PI3K/Akt/GSK-3β/Snail signaling[J]. Cancer Lett, 2015, 358(2): 124-135. doi: 10.1016/j.canlet.2014.11.044
[19] Lim JB, Chung HW. Serum ENA78/CXCL5, SDF-1/CXCL12, and their combinations as potential biomarkers for prediction of the presence and distant metastasis of primary gastric cancer[J]. Cytokine, 2015, 73(1): 16-22. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=3a7aec14b08ee991367560ca9ba0e950
[20] Sokolova O, Naumann M. NF-κB Signaling in Gastric Cancer[J]. Toxins (Basel), 2017, 9(4): pii: E119. doi: 10.3390/toxins9040119
[21] Molaei F, Forghanifard MM, Fahim Y, et al. Molecular Signaling in Tumorigenesis of Gastric Cancer[J]. Iran Biomed J, 2018, 22(4): 217-230. doi: 10.29252/ibj.22.4.217
[22] Takaya S, Saito H, Ikeguchi M. Upregulation of Immune Checkpoint Molecules, PD-1 and LAG-3, on CD4+ and CD8+ T Cells after Gastric Cancer Surgery[J]. Yonago Acta Med, 2015, 58(1): 39-44. doi: 10.1006/jcec.2000.1673
-
期刊类型引用(7)
1. 贺阿敏,侯绍章. CXCL5在2型糖尿病与恶性肿瘤相关性研究进展. 西南医科大学学报. 2024(02): 111-116 .  百度学术
百度学术
2. 张佳奇,高慧娟,张乐乐,李双芳,刘生杰. PI3K/Akt/mTOR、Wnt/-catenin、JAK/STAT信号通路及黄酮类物质对胃癌的影响. 阜阳师范大学学报(自然科学版). 2024(02): 44-49 .  百度学术
百度学术
3. 张丽柯,徐全晓,李媛媛,杨卫. 胃癌组织中NF-κB、PD-1、PD-L1的表达及其临床意义. 国际医药卫生导报. 2024(15): 2519-2523 .  百度学术
百度学术
4. 林允斌,李小霞,卢爱薇,卓德祥,朱虹,罗碧琚,陈龙,肖首浩. β-catenin和PD-L1在非小细胞肺癌的表达及其临床意义分析. 中国卫生标准管理. 2022(08): 93-96 .  百度学术
百度学术
5. 成坤,刘晓军. FGFR3基因表达下调对子宫内膜癌细胞活性和免疫逃逸的影响及相关机制. 北华大学学报(自然科学版). 2022(03): 325-329 .  百度学术
百度学术
6. 陆伟辉,刘威,王聪,王正林. CXCR2对胃癌细胞侵袭、迁移及凋亡的影响. 外科理论与实践. 2021(05): 430-436 .  百度学术
百度学术
7. 许静,梁翼,杨茂益,李强. ZNRF3在类风湿关节炎滑膜组织与细胞表达及意义. 青岛大学学报(医学版). 2021(05): 697-702 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: