-
摘要:目的
探讨骨髓瘤过表达基因MYEOV在人胰腺癌细胞中的表达情况及其下调对胰腺癌SW1990细胞增殖和迁移能力的影响。
方法构建慢病毒载体GV248,转染胰腺癌细胞株SW1990获得SW1990-sh1和SW1990-sh2两个实验组,以空白质粒转染作为阴性对照组,未干预细胞为空白对照组。qPCR和Western blot检测转染前后MYEOV mRNA与蛋白的表达水平;CCK-8法测定细胞增殖能力;划痕实验分析细胞迁移能力。qPCR检测TGF-β/SMAD通路中相关SMADs mRNA表达水平。
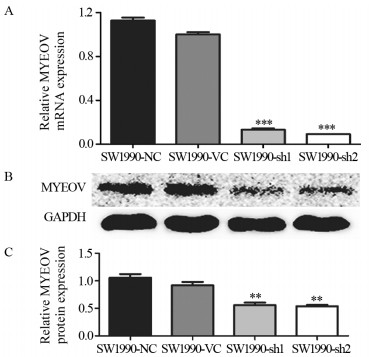
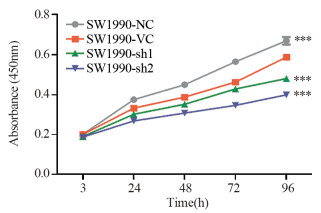
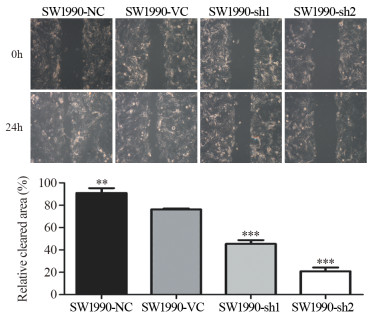
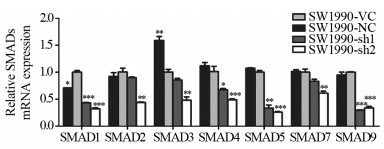
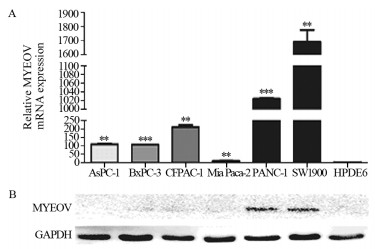
结果与正常胰腺导管上皮细胞系HPDE6相比,MYEOV mRNA在6株胰腺癌细胞中表达水平明显增加(P < 0.01);但仅在PANC-1和SW1990细胞系中检测到低水平MYEOV蛋白表达。实验组中MYEOV mRNA和蛋白表达均明显下调。与对照组相比,SW1990细胞的增殖和迁移能力明显下降(P < 0.001)。下调MYEOV能降低TGF-β通路中SMAD1、SMAD4、SMAD5和SMAD9 mRNA表达(P < 0.01),而SMAD2、SMAD3和SMAD7 mRNA仅在SW1990-sh2组中表达下调(P < 0.01)。
结论MYEOV在胰腺癌细胞系中转录水平高,MYEOV可通过TGF-β/SMAD通路促进胰腺癌细胞的增殖和迁移能力。
Abstract:ObjectiveTo investigate the expression of MYEOV in human pancreatic cancer cells and its effect on the proliferation and migration of pancreatic cancer SW1990 cells after knockdown.
MethodsThe lentiviral vector GV248 was constructed and infected SW1990 cells to obtain two experimental groups (SW1990-sh1 and SW1990-sh2), while the blank plasmid was transfected as a negative control group and the untreated cells were taken as blank control group. MYEOV mRNA and protein expression were detected by qPCR and Western blot before and after transfection. The cells proliferation was determined by CCK-8 assay; the cell migration ability was analyzed by scratch test; The mRNA expression of SMADs in the TGF-β/SMAD signaling pathway was detected by qPCR.
ResultsCompared with the pancreatic ductal epithelium cell line HPDE6, the mRNA expression of MYEOV in six pancreatic cancer cells were significantly increased (P < 0.01). However, low expression of MYEOV protein was detected only in PANC-1 and SW1990 cells. The mRNA and protein expression of MYEOV in the experimental groups were significantly downregulated. The proliferation and migration of SW1990 cells were lower than the control group (P < 0.001). MYEOV knockdown could reduce the mRNA expression of SMAD1, SMAD4, SMAD5 and SMAD9 in TGF-β pathway, while the expression of SMAD2, SMAD3 and SMAD7 mRNA were only down-regulated in the SW1990-sh2 group (P < 0.001).
ConclusionMYEOV mRNA is overexpressed in pancreatic cancer cells. MYEOV could promote the proliferation and migration of pancreatic cancer cells via TGF-β/SMAD pathway.
-
Key words:
- Pancreatic cancer /
- MYEOV /
- Orphan gene /
- TGF-β pathway /
- Proliferation /
- Migration
-
0 引言
我国结直肠癌发病率和死亡率呈逐年上升趋势[1],国际癌症研究机构(international agency for research on cancer, IARC)Globocan数据库报告显示,2020年我国新发恶性肿瘤约456.9万,其中约55.5万为结直肠癌,相较于欧美国家,我国患者以中低位直肠癌较为多见,且年轻患者为数众多[2],手术仍是中低位直肠癌的首选治疗方法,因此保肛吻合技术的需求一直存在。直肠癌低位保肛手术最早可追溯到1948年Dixon施行的经腹前切除术(anterior resection, AR),术中采用手工间断缝合完成结肠-直肠端-端吻合[3],随后,Parks于1982年报道了结肠肛管吻合术[4],1984年,Schiessel将括约肌间沟分离的概念与Parks提出的结肠肛管吻合技术相结合,提出了低位直肠癌经内、外括约肌间切除的手术方式(intersphincteric resection, ISR),并于1994年进行相关报道[5]。开放和腹腔镜直肠癌保肛吻合技术的基础都是全直肠系膜切除(total mesorectal excision, TME),维持括约肌复合体的完整性和尽可能保留肛管直肠黏膜、齿状线是手术的操作关键,而环周切缘(circumferential resection margin, CRM)阴性则是保肛吻合的前提条件[6]。Williams等[7]的研究将直肠癌远切缘从5 cm降至2 cm,Bujko等[8]的研究则发现大部分低位直肠癌肛侧浸润扩散的距离小于1 cm,使1 cm甚至5 mm成为低位直肠癌的远端安全切缘。这一系列解剖学和生物学探索以及新型外科设备器械的广泛应用,增加了低位直肠癌保肛吻合的可能性,也使吻合技术不断进步。
1 直肠癌低位前切除吻合技术
因低位前切除(low anterior resection, LAR)吻合技术保留了肛门内括约肌和肛管直肠环以及与排便功能密切相关的神经等,较好的保存了肛门的控制排便功能,是低位直肠癌保肛吻合手术的首选术式。根据术中吻合口位置的不同,分为低位前切除吻合(腹膜返折以下)和超低位前切除吻合(肛提肌上缘与齿状线之间),按照TME原则,术中需切除肿瘤远端至少1~2 cm直肠及全部直肠系膜,因此该术式不适用于接近齿状线的超低位直肠癌[9]。国内外较多采用端端吻合(straight colorectal anastomosis, SCA)方式作为肿瘤切除后消化道重建的方式,但因此种吻合方式使患者失去原有直肠储便功能,80%~90%的患者术后出现不同程度的排便功能障碍,统称为低位前切除术后综合征(low anterior resection syndrome, LARS),严重影响患者生活质量。为了改善LARS,临床提出了三种优化吻合方式,即结肠J型储袋吻合术(colonic J-pouch anastomosis, CJP)、结肠横向成型吻合术(transverse coloplasty pouch anastomosis, TCP)、端侧吻合术(side-to-end anastomosis, SEA)[10]。
1.1 端端吻合术
直肠癌低位前切除吻合以往多采用手工吻合或单吻合器吻合,目前建议使用直线型切割吻合器和圆形吻合器,基于“双吻合技术(double stapling technique, DST)”完成直肠的闭合、离断和吻合[9]。Griffen等[11]于1990年首次报道DST,术中首先使用直线型闭合器闭合肿瘤远端直肠,然后使用端-端吻合器进行吻合,实现了安全、便捷的低位吻合。Kawada等[12]通过对154例接受了腹腔镜低位前切除DST直肠癌患者的回顾性分析发现,吻合器激发前的预压时间是术后吻合口漏的独立危险因素,且离断直肠时使用直线型切割吻合器的数目与术后早期吻合口漏亦有相关性。2021年《中低位直肠癌手术消化道重建中国专家共识》(以下简称《共识》)建议,在直线型切割吻合器及圆形吻合器击发前保持夹闭15 s,击发时保持器械稳定,减少对肠管的牵拉,并争取击发≤2次完成闭合切断直肠,如切割闭合直肠过程中使用钉仓数量≥2个,尽量将中心杆于缝钉闭合线交角附近穿出,以切除缝钉闭合线交角。吻合后可不常规加固缝合吻合口,如吻合不满意,可经腹或经肛“8”字或间断加固缝合[9]。为避免吻合周围积液及尽早发现吻合口漏等并发症,吻合口周围可常规放置引流管,对于有吻合口漏高风险因素,如男性、术前放化疗、肿瘤晚期、低位吻合、围手术期出血等相关患者,必要时需行预防性造口[13],而该术后是否留置肛门减压管仍存在争议。
1.2 结肠J型储袋吻合术
Lazorthes和Parc等[14-15]于1986年提出了CJP,通过扩大“新直肠”的体积显著改善了术后的肠道功能,在储袋的大小方面,Hida等[16]通过一项前瞻性随机对照研究发现,与10 cm大储袋相比,5 cm J型小储袋在不影响排空的情况下也可以提供足够的储便功能。CJP操作过程中以直线型切割吻合器对返折段行侧-侧吻合形成J型肠袢,继而以圆形吻合器或手工缝合的方式对J型肠袢转角与远端残余直肠或肛管行端-侧吻合并关闭储袋顶端。器械吻合要点与端-端吻合一致,手工缝合时可借助经肛盘状拉钩暴露近端和远端肠管的断端,确保肠壁的全层缝合,针间距为0.3~0.5 cm[9]。CJP手术操作难度较大,术中需充分游离近端结肠及脾曲,部分肥胖男性患者,因骨盆狭窄、肠系膜肥大,导致J型储袋肥大且与直肠或肛管吻合困难[17],该术式也因其解剖特点更易出现贮粪袋破裂、排便困难、大便淤积等术后并发症。
1.3 结肠横向式型吻合术
TCP是另一种结肠储袋重建术式,该术式最早由Z’graggen等[17]于1999年提出并进行了猪的动物实验,目前已在临床开展20年余,相比CJP的高技术要求,TCP操作较简单,无需过多游离结肠,且对手术空间要求较小。关于重建储袋的位置及大小的设计,国内外的研究虽存在差异,但均以保证结肠切口及断端血运良好为前提。传统的TCP一般在结肠系膜对侧距离结肠断端至少2~3 cm处做6~10 cm的纵行切口,然后横向缝合以形成新的“壶腹部”,再将结肠断端和残留的远端直肠或肛管通过吻合器或手工进行直接端-端吻合。Grimaldi等[18]对TCP加以改进,提出TCP改善排粪功能的机制并不仅是扩充了新直肠的容量,更重要的是切断肌层后肠道蠕动波发生了改变,因此5 cm的纵行小切口足以改善排粪功能,与CJP及传统TCP相比,具有更好的功能效果和生活质量。
两种储袋重建术式并发症及疗效方面的优劣尚无定论,Biondo等[19]的研究发现,TCP在近期和远期疗效上与CJP相似,且两种重建方式吻合口漏的发生率均为1.9%。
1.4 端侧吻合术
SEA由Baker[20]于1950年首次提出,其在近期和远期的排粪功能、排尿功能和性功能均不劣于CJP和SCA,且具有良好的安全性[21],其吻合技术因吻合器抵钉座与中心杆的位置不同而略有差异。目前采用较多的吻合方式为闭合直肠残端,圆形吻合器由肛门置入,与结肠内抵钉座吻合,该方式SEA吻合口瘘的发生率明显低于SCA[22]。在黄宝裕等[23-24]的研究中,远端直肠用荷包缝合器关闭缝合后置入抵钉座并扎紧,圆形吻合器由近侧结肠残端置入结肠内,距切缘4~5 cm处截孔穿出,与直肠内抵钉座扣合并完成结肠-直肠侧-端吻合术。
为了评估以上四种吻合方式功能保护的有效性以及手术安全性,Liu等[25]通过荟萃分析发现,SCA明显导致排便频率增加,术后6个月,CJP和SEA排便频率相同,其他肠功能指标相似,TCP易发生并发症,SEA并发症风险最低、安全性最好。Mathew等[26]则发现,CJP是直肠远端肿瘤切除后重建的最佳选择,患者可在消化道重建后的1年内获得更好的肛门功能,而四种吻合方式的长期疗效一致。
2 经肛门外翻直肠癌切除吻合技术
盆腔手术操作空间的限制增加了低位直肠癌保肛吻合的难度,且远切缘阴性难以保证,经自然腔道取标本手术(natural orifice specimen extraction surgery, NOSES)很好的解决了这一问题,并最大限度的保留直肠末段黏膜及肛门括约肌的完整性,实现创伤最小化。Franklin等[27]于1993年首次报道腹腔镜结肠切除经肛门取出标本的手术方式,因其有效降低手术并发症、增加微创效果而迅速发展,2021年中国开展NOSES的医院有373家,共开展20 799例,其中结直肠肿瘤占85.8%[28]。《结直肠肿瘤经自然腔道取标本手术指南(2023版)》推荐的NOSE术式共10种,适用于浸润深度T2~T3、标本最大环周直径 < 5 cm的肿瘤。中低位直肠癌NOSES包括3种,其中NOSESⅠ式即为腹部无辅助切口经肛门取标本的腹腔镜下低位直肠前切除术(癌根治术),A法、B法、F法为经肛门外翻直肠癌切除吻合技术,适用于下缘距齿状线2 cm~5 cm、侵犯肠管 < 1/2周的肿瘤[29]。直肠NOSES手术消化道重建首选结肠-直肠或肛管端-端吻合(I式F法采用的为侧-端吻合),吻合必要时采取经肛门吻合口加固缝合[29]。《共识》指出,经肛门外翻直肠癌切除吻合时,需于肿瘤对侧将抵钉座经肛门置入近端乙状结肠,使用腔内直线型切割吻合器于预切线处切断乙状结肠,使用反穿刺法将抵钉座妥善固定于乙状结肠断端,使用卵圆钳将远端直肠外翻拖出体外后在肿瘤远端1~2 cm处切断直肠,将直肠残端送回腹腔后再经肛门置入圆形吻合器完成吻合[9]。
3 经肛门拖出直肠癌切除吻合技术
1888年欧洲外科医师通过经骶骨入路的方式行直肠癌切除术并Ⅰ期恢复肠道的连续性,但受限于单纯手工端-端吻合方式及围术期支持治疗方法不足等,术后多出现严重并发症。随后,维也纳医师Hochenegg首次通过将上段直肠拖套入下端直肠中形成内陷并缝合固定的方式进行保肛吻合,后有医师在此基础上改进、推广,分别提出了Maunsell-Weir术、Welch手术等手术方式[30],自拖出吻合术式问世的一百余年来,外科医师对其进行反复的修改,随着经肛全直肠系膜切除术(trans-anal total mesorectal excision, taTME)“自下而上”的手术方式的广泛推行,增加了中下段直肠癌患者低位及超低位保肛的可能,目前应用广泛的保肛吻合方式包括改良Bacon术、Parks术及在此基础上的改良术式。
3.1 改良Bacon术
Bacon[31]在1945年介绍了拖出式手术并于1971年对其进行了调整,Bacon术式需切除肛提肌和坐骨同肛管之间的脂肪组织,除去肛管黏膜从而形成创面,使其与拖出结肠的浆膜间愈合后,Ⅱ期将肛门外多余的结肠切除。上海市瑞金医院的周锡庚团队[32]自1954年起便对Bacon手术前后进行4次改进,发展出改良Bacon术,保留了提肛肌及提肛肌平面下的解剖结构,保留了齿状线及以上1 cm的黏膜。改良Bacon术的切除吻合方式与NOSESⅠ式E法一致,其最大优势在于不存在传统意义上的吻合口,避免了吻合口漏的发生。术中需将近端结肠连同系膜在无张力状态下拖出肛门外约5 cm,并将肛管切缘或肛缘处皮肤与结肠浆肌层间断缝合固定,术后8~12天待结肠与肛管的创面粘连紧密后切除肛缘外的结肠,并将结肠断端与肛管作间断缝合完成肛门成形[33]。
3.2 Parks术
1982年,外科医生Parks提出结肠肛管吻合术,保留了提肛肌及提肛肌平面下的解剖结构,在会阴部采用手Ⅰ缝合的方法完成结肠与肛管吻合[4]。NOSESⅠ式C法即Parks法,术中按照TME原则游离直肠及系膜达肛提肌平面后,于肿瘤下方离断直肠,后于会阴部将残余直肠黏膜剥除,近端结肠断端与齿状线处肛管吻合。腹腔镜辅助机械吻合时,直肠残端的“远端荷包”缝合质量是决定吻合质量的重要因素,对于超低位吻合,建议经肛手工全层间断缝合[9]。
3.3 套袖式吻合
介于Parks术操作难度大、术后并发症多,周海涛团队[34]于2018年提出“套袖式吻合”技术,其特点在于近端结肠经直肠(或肛管)残端套入拖出肛门外约2 cm后吻合,结肠浆肌层与直肠(或肛管)内口黏膜间断缝合固定,并将结肠残端与肛周皮肤间断缝合固定,通过内口、外口的双层缝合方式减少吻合口漏的发生。在低位直肠癌新辅助放化疗后NOSES手术中利用套袖式吻合技术同样安全可行,避免了预防性造口,经对症指导治疗肛门功能恢复满意,具有较好的近期疗效,远期疗效待进一步随访观察[35]。
4 经括约肌间直肠癌切除吻合技术
作为目前最理想的保肛方式,ISR将直肠的切除范围进一步扩展,肛门内括约肌被部分或完全切除,切除下界拓展至齿线下方1 cm。ISR在切除内括约肌的同时,可能影响肌间神经进而影响肛门功能,因此为了更好的保留肛门功能,张卫团队[36]提出以肿瘤远端1 cm作为肿瘤侧切除线,以高于肿瘤侧切除线2~3 cm作为肿瘤对侧切除线,利用对侧多保留的肠壁与近端肠管吻合的方法进行适型切除保肛手术(conformal sphincter-preserving operation, CSPO)。ISR的手术过程中多采用结肠-肛管端-端手工间断缝合的吻合方式,其操作要点与Parks手术一致,吻合前需确认近端肠管血运及吻合口有无张力。CSPO中将吻合口做在保留更多肠壁的一侧,提升了吻合口距肛缘的距离,改善了术后肛门功能[37]。因ISR操作较为复杂,易出现吻合口愈合不良、慢性狭窄等并发症,同时影响肛门功能,建议常规行预防性造口。
除常规的端-端吻合外,有外科医生在ISR手术中采用其他吻合方式,赵丽花等[38]在一项腹腔镜ISR与腹腔镜ISR联合套袖式吻合在低位直肠癌保肛术中疗效比较的随机对照研究发现,套袖式吻合联合肛门引流管降低了术后吻合口漏的风险。Ulrich等[39]通过一项随机对照研究ISR术中CJP与TCP两种消化道重建方式的功能、围手术期死亡率和并发症率发现,ISR手术中两种消化道重建方式疗效相当。储袋吻合技术在ISR的应用中仍存在不足,储袋的构建需要有足够长度的近端结肠,并盆底肛缘附近完成无张力吻合,部分患者特别是肥胖、系膜较短、盆腔狭窄的患者操作难度大,此外,对于ISR患者,J型储袋肛管吻合位于肛门括约肌环中,储袋易受到括约肌环的挤压,导致缺血等并发症[40],因此储袋式吻合技术在ISR手术中未得到广泛应用。
5 总结与展望
综合以上低位保肛吻合技术,SCA易于操作,在LAR、NOSES等手术中广泛应用,LAR中多采用DST,超低位直肠癌NOSES中多采用手工间断全层缝合,但因SCA不能解决中低位病变直肠切除后储便功能问题,术后LARS发生率高。其优化吻合方案CJP、TCP、SEA可在不同程度上改善LARS,但尚缺乏大型随机对照研究,仍存在争议。套袖式吻合等改良的吻合技术陆续展现出良好的可操作性和安全性,有较好的近期疗效。期待更多低位吻合技术的改进与发展,解决术后吻合口及肛门功能等诸多问题,在肿瘤根治前提下提高患者保肛率及生活质量。
作者贡献吕根:设计与实施实验、收集与分析数据、撰写论文严俊:分析核对数据任龙飞:指导实验技术及论文写作周文策:指导实验设计、修改和审核论文 -
表 1 qPCR特异性引物序列
Table 1 Specific primer sequence of qPCR

-
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. doi: 10.3322/caac.21551
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. doi: 10.3322/caac.21338
[3] Patel N, Khorolsky C, Benipal B. Incidence of Pancreatic Adenocarcinoma in the United States from 2001 to 2015: A United States Cancer Statistics Analysis of 50 States[J]. Cureus, 2018, 10(12): e3796. http://cn.bing.com/academic/profile?id=6c73dea94dc56f429f3a9820e7781e61&encoded=0&v=paper_preview&mkt=zh-cn
[4] 张驰, 任庆兰.外泌体在胰腺癌诊治中的研究进展[J].肿瘤防治研究, 2019, 46(8): 737-740. doi: 10.3971/j.issn.1000-8578.2019.19.0046 Zhang C, Ren QL. Advances of exosomes in diagnosis and treatment of pancreatic cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(8): 737-740. doi: 10.3971/j.issn.1000-8578.2019.19.0046
[5] Yoneyama T, Ohtsuki S, Honda K, et al. Identification of IGFBP2 and IGFBP3 As Compensatory Biomarkers for CA19-9 in Early-Stage Pancreatic Cancer Using a Combination of Antibody-Based and LC-MS/MS-Based Proteomics[J]. PLoS One, 2016, 11(8): e0161009. doi: 10.1371/journal.pone.0161009
[6] 张焕萍, 尹佟明.谱系特有基因研究进展[J].遗传, 2015, 37(6): 544-553. http://d.old.wanfangdata.com.cn/Periodical/yc201506006 Zhang HP, Yin TM. Advances in lineage-specific genes[J]. Yi Chuan, 2015, 37(6): 544-553. http://d.old.wanfangdata.com.cn/Periodical/yc201506006
[7] McLysaght A, Hurst LD. Open questions in the study of de novo genes: what, how and why[J]. Nat Rev Genet, 2016, 17(9): 567-578. doi: 10.1038/nrg.2016.78
[8] Xie C, Zhang YE, Chen JY, et al. Hominoid-specific de novo protein-coding genes originating from long non-coding RNAs[J]. PLoS Genet, 2012, 8(9): e1002942. doi: 10.1371/journal.pgen.1002942
[9] Papamichos SI, Margaritis D, Kotsianidis I. Adaptive Evolution Coupled with Retrotransposon Exaptation Allowed for the Generation of a Human-Protein-Specific Coding Gene That Promotes Cancer Cell Proliferation and Metastasis in Both Haematological Malignancies and Solid Tumours: The Extraordinary Case of MYEOV Gene[J]. Scientifica(Cairo), 2015, 2015: 984706.
[10] Puente XS, Velasco G, Gutiérrez-Fernández A, et al. Comparative analysis of cancer genes in the human and chimpanzee genomes[J]. Bmc Genomics, 2006, 7: 15. doi: 10.1186/1471-2164-7-15
[11] Janssen JW, Imoto I, Inoue J, et al. MYEOV, a gene at 11q13, is coamplified with CCND1, but epigenetically inactivated in a subset of esophageal squamous cell carcinomas[J]. J Hum Genet, 2002, 47(9): 460-464. doi: 10.1007/s100380200065
[12] Leyden J, Murray D, Moss A, et al. Net1 and Myeov: computationally identified mediators of gastric cancer[J]. Br J Cancer, 2006, 94(8): 1204-1212. doi: 10.1038/sj.bjc.6603054
[13] Janssen JW, Cuny M, Orsetti B, et al. MYEOV: a candidate gene for DNA amplification events occurring centromeric to CCND1 in breast cancer[J]. Int J Cancer, 2002, 102(6): 608-614. doi: 10.1002/ijc.10765
[14] Moss AC, Lawlor G, Murray D, et al. ETV4 and Myeov knockdown impairs colon cancer cell line proliferation and invasion[J]. Biochem Biophys Res commun, 2006, 345(1): 216-221. doi: 10.1016/j.bbrc.2006.04.094
[15] Lawlor G, Doran PP, MacMathuna P, et al. MYEOV (myeloma overexpressed gene) drives colon cancer cell migration and is regulated by PGE2[J]. J Exp Clin Cancer Res, 2010, 29: 81. doi: 10.1186/1756-9966-29-81
[16] Horie M, Kaczkowski B, Ohshima M, et al. Integrative CAGE and DNA Methylation Profiling Identify Epigenetically Regulated Genes in NSCLC[J]. Mol Cancer Res, 2017, 15(10): 1354-1365. doi: 10.1158/1541-7786.MCR-17-0191
[17] Fang L, Wu S, Zhu X, et al. MYEOV functions as an amplified competing endogenous RNA in promoting metastasis by activating TGF-beta pathway in NSCLC[J]. Oncogene, 2019, 38(6): 896-912. doi: 10.1038/s41388-018-0484-9
[18] Janssen JW, Vaandrager JW, Heuser T, et al. Concurrent activation of a novel putative transforming gene, myeov, and cyclin D1 in a subset of multiple myeloma cell lines with t(11;14)(q13;q32)[J]. Blood, 2000, 95(8): 2691-2698. http://cn.bing.com/academic/profile?id=aa17489be9605be05bd5d436b27b4479&encoded=0&v=paper_preview&mkt=zh-cn
[19] Moreaux J, Hose D, Bonnefond A, et al. MYEOV is a prognostic factor in multiple myeloma[J]. Exp Hematol, 2010, 38(12): 1189-1198. doi: 10.1016/j.exphem.2010.09.002
[20] Tang Z, Li C, Kang B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(W1): W98-W102. doi: 10.1093/nar/gkx247
[21] de Almeida RA, Heuser T, Blaschke R, et al. Control of MYEOV protein synthesis by upstream open reading frames[J]. J Biol Chem, 2006, 281(2): 695-704. doi: 10.1074/jbc.M511467200
[22] Weingarten-Gabbay S, Elias-Kirma S, Nir R, et al. Comparative genetics. Systematic discovery of cap-independent translation sequences in human and viral genomes[J]. Science, 2016, 351(6270). pii: aad4939. doi: 10.1126/science.aad4939
[23] Leppek K, Das R, Barna M. Functional 5'-UTR mRNA structures in eukaryotic translation regulation and how to find them[J]. Nat Rev Mol Cell Biol, 2018, 19(3): 158-174. doi: 10.1038/nrm.2017.103
[24] Massagué J. TGFbeta in Cancer[J]. Cell, 2008, 134(2): 215-230. doi: 10.1016/j.cell.2008.07.001
[25] Ikushima H, Miyazono K. TGFbeta signalling: a complex web in cancer progression[J]. Nat Rev Cancer, 2010, 10(6): 415-424. doi: 10.1038/nrc2853
[26] Neuzillet C, Tijeras-Raballand A, Cohen R, et al. Targeting the TGFβ pathway for cancer therapy[J]. Pharmacol Ther, 2015, 147: 22-31. doi: 10.1016/j.pharmthera.2014.11.001
-
期刊类型引用(5)
1. 王影,任欢,李猛,谢玲,林林,房彦乐. 根因分析法联合品管圈管理对肠造口患者自护能力的影响. 河北医药. 2025(03): 509-512 .  百度学术
百度学术
2. 程巩,曹岩,冯亚光. 保肛手术治疗低位直肠癌的临床疗效. 深圳中西医结合杂志. 2024(10): 72-75 .  百度学术
百度学术
3. 魏哲威,刘宝忆,周皓,雷天翔,孙开宇,宋武. 基于荷包缝合腹腔镜NOSES在乙状结肠癌及上段直肠癌治疗中的应用价值. 中华消化外科杂志. 2024(06): 853-858 .  百度学术
百度学术
4. 闫成秋,包晗,郭桐桐,陈亮. 冷冻疗法治疗低位直肠癌. 吉林中医药. 2024(08): 946-950 .  百度学术
百度学术
5. 胡柏庚,张哲,刘跃,孙亮. 腹腔内消化道重建在腹腔镜结直肠癌手术中的发展与现状. 腹腔镜外科杂志. 2024(09): 707-712 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: