Predictive Value of Preoperative Hematologic Inflammatory Markers in Prognostic of Glioma Patients
-
摘要:目的
探讨术前血液学炎性反应标志物(中性粒细胞与淋巴细胞比率(NLR)、单核细胞与淋巴细胞比率(MLR)和血小板与淋巴细胞比率(PLR))在胶质瘤患者临床预后中的预测价值。
方法纳入180例胶质瘤患者。应用ROC曲线确定NLR、MLR和PLR的最佳临床分界值并分组。变量组间比较采用χ2检验,通过Kaplan-Meier法和Log rank检验分析患者术后生存情况。Cox多因素回归分析预后因素。Pearson’s相关系数检验标志物间的相关性。
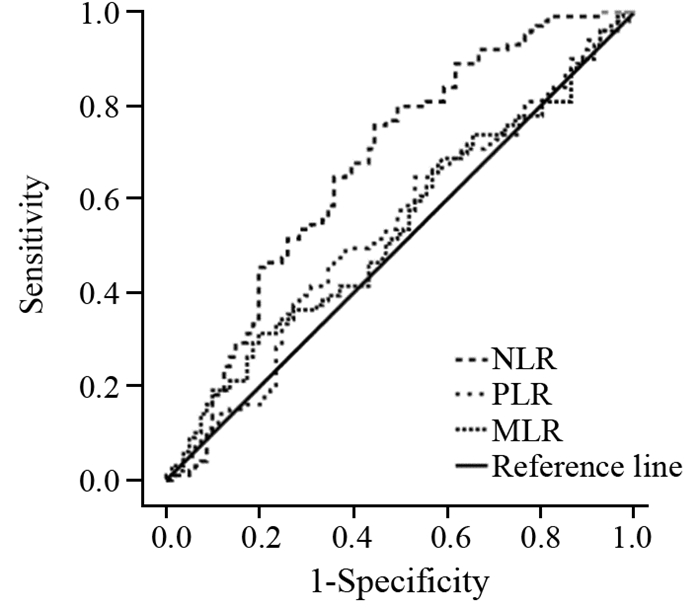
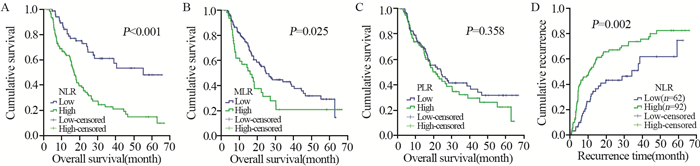
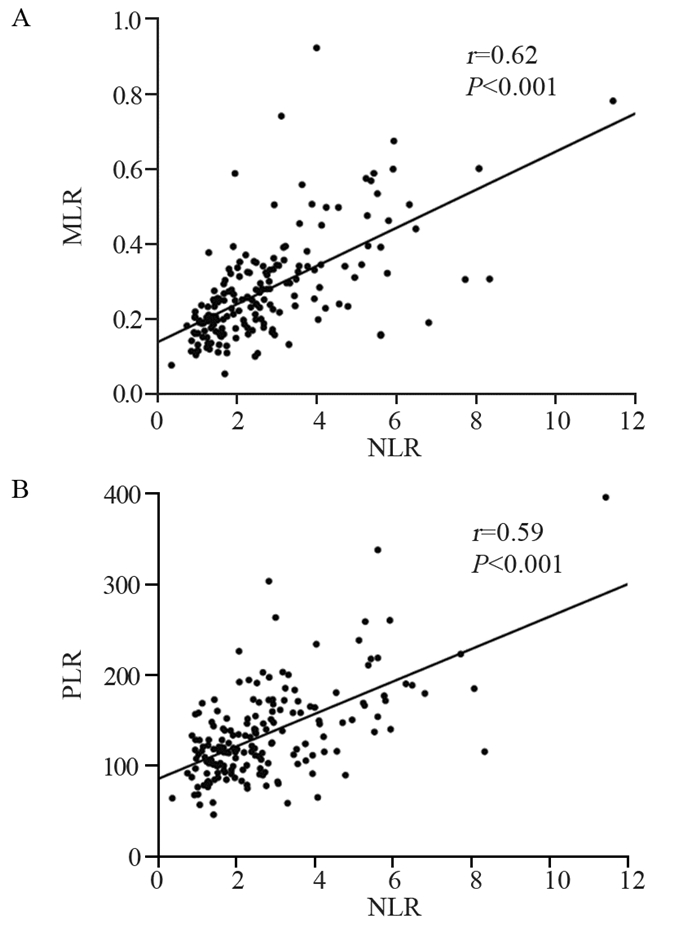
结果NLR、MLR和PLR的最佳分界值分别为1.90、0.33和133.38。高NLR和MLR组患者中位总生存期分别为16.8和14.8月,低NLR和MLR组分别为40.5和24.6月(均P < 0.05)。高NLR组中位肿瘤复发时间为10.3月,低NLR组为28.8月(P=0.002)。NLR是胶质瘤患者的独立危险因素(HR=1.725, 95%CI: 1.042~2.853, P=0.034)。且NLR与MLR(r=0.62, P < 0.001)和PLR(r=0.59, P < 0.001)具有相关性。
结论术前高NLR、MLR与胶质瘤患者不良预后相关,且NLR是患者生存的独立预后因素,与肿瘤复发率密切相关。
-
关键词:
- 胶质瘤 /
- 炎性反应 /
- 中性粒细胞与淋巴细胞比率 /
- 预后因素
Abstract:ObjectiveTo explore the predictive value of pre-operative hematologic inflammatory markers NLR, MLR and PLR in the clinical prognosis of glioma patients.
MethodsWe enrolled 180 patients with glioma. ROC curve was used to determine the optimal cutoff values of NLR, MLR and PLR and we divided groups accordingly. The differences of parameters were analyzed by χ2 test. The Kaplan-Meier and Log rank methods were used to analyze patients' survival after operation. The independent prognostic factors were evaluated by multivariate Cox regression analyses. Pearson's correlation coefficient tested the correlations among these hematologic inflammatory markers.
ResultsThe optimal cutoff values of NLR, MLR and PLR were 1.90, 0.33 and 133.38, respectively. The median overall survival time of the patients with high NLR and MLR were 16.8 and 14.8 months, and those with low NLR and MLR were 40.5 and 24.6 months, respectively (all P < 0.05). The median tumor recurrence time were 10.3 and 28.8 months in the high and low NLR groups, respectively (P=0.002). NLR was an independent risk factor for glioma patients (HR=1.725; 95%CI: 1.042-2.853; P=0.034). NLR was correlated with MLR (r=0.62; P < 0.001) and PLR (r=0.59; P < 0.001).
ConclusionPreoperative high NLR and MLR are related to poor prognosis of patients with glioma, and NLR is an independent prognostic factor and closely related to tumor recurrence rate.
-
Key words:
- Glioma /
- Inflammation /
- Neutrophil-to-lymphocyte ratio /
- Prognosis factors
-
0 引言
肺癌是当今世界上对人类健康和生命危害最大的恶性肿瘤之一,中国国家癌症中心2015年发布的数据显示,2006年—2011年我国肺癌5年患病率是130.2(1/10万)。其中男性84.6(1/10万),居恶性肿瘤第2位;女性45.6(1/10万),居恶性肿瘤第4位[1]。云南省宣威市与个旧市肺癌发病率仍在世界前列,尤其是宣威市女性肺腺癌的发病率高居世界首位。肿瘤的异质性是恶性肿瘤最为重要的生物学特征之一,从而导致云南高发的宣威市肺腺癌具有显著的地域性特点,在我国的肺癌防治中占有特殊地位。新近发现的CD151基因在多种人类肿瘤中广泛表达且与肿瘤的进展、预后、治疗等有密切的关系[2]。前期研究发现,CD151在肺腺癌病理组织中的表达高于其他病理类型[3-4]。本研究中,我们构建了针对人CD151基因的RNAi序列,通过体外细胞培养,筛选出抑制效应最强的干扰序列建立稳转株。利用裸鼠尾静脉注射干扰前后宣威肺腺癌XWLC-05细胞建立肺转移的老鼠动物模型,旨在探讨靶向CD151基因RNA干扰对裸鼠肺腺癌XWLC-05细胞肺转移的影响,为云南省宣威肺腺癌的发病机制提供理论基础,为治疗提供可能的新靶点和思路。
1 材料与方法
1.1 真核表达质粒的构建
根据Genbank中CD151基因的序列(NM-004357)及相关设计原则,设计3对RNAi序列,构建shRNA,并插入真核表达载体pGPU6/GFP/Neo,构建3个阳性CD151-shRNA表达质粒,分别为pGPU6/GFP/Neo-CD151-271(靶序列:GCCCTCAAGAGTGACTACATC);pGPU6/GFP/Neo-CD151-450(靶序列:GCTGGAGATCATCGCTGGTAT);pGPU6/GFP/Neo-CD151-728(靶序列:GAGACCATGCCTCCAACATCT)。设立无关序列阴性对照pGPU6/GFP/Neo-shNC和空白对照组。以上由上海吉玛制药技术有限公司设计及合成。
1.2 细胞转染
选取处于对数生长期的宣威肺腺癌XWLC-05细胞株,按4×105个每孔接种6孔板,将各组重组质粒2 μg和5 μl脂质体LipofectamineTM 2000混合物,加入各孔中。37℃、5%CO2培养箱中培养4 h,弃培养液,含10%小牛血清RPMI1640继续培养,经筛选、培养、扩增,于荧光显微镜下观察转染效率。
1.3 荧光定量PCR检测CD151 mRNA在转染细胞株中的表达
CD151上游引物:5’-ACTTCATCCTGCTCCTCATCAT-3’,下游引物:5’-TCCGTGTTCAGCTGCTGGTA-3’,扩增片段长度为85 kb。内参基因hRPS13,上游引物:5’-GTTGCTGTTCGAAAGCATCTTG-3’,下游引物:5’-AATATCGAGCCAAACGGTGAA-3’,扩增片段长度为89 kb。TRIzol法提取总RNA,按BIO-RAD公司试剂盒说明书反转录成cDNA并配置PCR反应体系,应用EvaGreen Dye荧光染料扩增待测基因及内参基因。反应体系总体积20 μl;反应条件:预变性95℃,1 min,其后95℃ 15 s,59℃ 1 min,40个循环,最后进行溶解、扩增曲线分析。
1.4 Western blot检测CD151蛋白在转染细胞株中的表达
转染24 h后获取细胞,提取蛋白,按上海碧云天生物技术公司提供的Western blot操作流程进行蛋白电泳。根据干扰效果,选择pGPU6/GFP/Neo-CD151-271质粒为干扰质粒做后续实验研究。
1.5 MTT检测细胞增殖能力
调整细胞悬液的浓度,以(3~4)×103个每孔的密度分别将细胞接种于96孔板内,每孔加200 μl完全培养基,置于细胞培养箱内培养。24 h后,每孔细胞加入MTT液10 μl,连续孵育4 h,终止培养。每孔加入DMSO 100 μl,避光摇晃,酶标检测仪测定570 nm的吸光度值(A)。
1.6 划痕实验检测细胞迁移能力
用200 μl移液器枪头在6孔板背后,沿直尺均匀划线,并以PBS清洗漂浮细胞。更换培养液后,放入CO2培养箱中继续培养,24、48、72 h拍照取样。使用Image J软件分析划痕弥合的程度,以细胞平均迁移距离进行统计分析。
1.7 Transwell实验检测细胞侵袭能力
调整细胞浓度为(2~3)×105个每毫升的密度,分别取200 μl接种于Transwell上室,下室加入含15%胎牛血清的完全培养基,37℃、5%CO2条件下继续培养。培养24 h后,用棉签刮除上室的Matrigel胶及未迁移的细胞,取出Transwell小室,无水乙醇在室温下固定10 min,用0.1%结晶紫染色30 min。PBS清洗、倒置室温下风干。光学显微镜下观察转膜细胞数,随机计数5个视野的细胞,计算平均值。
1.8 建立裸小鼠荷XWLC-05宣威肺腺癌细胞尾静脉注射肺移植瘤模型
SPF级BALB/c裸小鼠,鼠龄7~8周,体质量20~24 g,雌性。购自北京维通利华实验动物技术有限公司(生产许可证号为SCXX(京)2012-000)。随机分为3组,每组8只,一次性分别接种XWLC-05-shRNA(稳定转染了阳性干扰质粒pGPU6/GFP/Neo-CD151-271的XWLC-05细胞)、XWLC-05-shNC(转染了阴性对照质粒pGPU6/GFP/Neo-shNC的XWLC-05细胞)和XWLC-05-Blank(空白对照),继续传代培养。用1 ml注射器吸取100 μl浓度约1×106/100 μl的细胞悬液,每只裸鼠通过尾静脉接种量为1×106个细胞。定期观察裸小鼠的精神、饮食、排便、体重和活动等情况。
1.9 移植瘤的病理学检测
30天根据实验动物伦理法,脱颈法处死并解剖小鼠。取出肺脏移植瘤及内脏器官。Bouin's液浸泡24 h后,再用4%多聚甲醛固定24 h以上、拍照,常规制作病理切片,HE染色,在光学显微镜下观察病理组织。
1.10 统计学方法
采用SPSS16.0软件进行统计学分析,计量资料用(x±s)表示,计数资料以频数表达。组间资料用单因素方差分析和t检验。对非正态分布或方差不齐的数据,改用秩和检验进行统计分析。P < 0.05为差异有统计学意义。
2 结果
2.1 重组质粒测序结果
将重组质粒pGPU6/GFP/Neo-CD151-271,pGPU6/GFP/Neo-CD151-450,pGPU6/GFP/Neo-CD151-728,pGPU6/GFP/Neo-shNC送DNA测序,测序结果完全符合设计要求,pGPU6/GFP/Neo-CD151-271部分测序结果图略。
2.2 荧光定量PCR和检测细胞转染后CD151 mRNA的表达
RT-PCR检测结果显示,转染pGPU6/GFP/Neo-CD151-271、450、728均能不同程度下调XWLC-05细胞中CD151 mRNA的表达。pGPU6/GFP/Neo-CD151-271的干扰效果最理想,见表 1、图 1。
表 1 实时荧光定量PCR检测XWLC-05细胞系CD151基因的干扰效果Table 1 Relative expression of CD151 mRNA in XWLC-05 cells after transfection tested by qPCR
2.3 Western blot检测细胞转染后CD151蛋白的表达
结果显示,XWLC-05细胞系中,pGPU6/GFP/Neo-CD151-271的干扰效果最理想,见表 2、图 2。
表 2 Western blot检测各组细胞CD151蛋白表达水平灰度值Table 2 Gray value of CD151 protein expression detected by Western blot
![]() 图 2 Blank、pGPU6/GFP/Neo-CD151-271、450、728和shNC转染XWLC-05后CD151蛋白的变化Figure 2 CD151 protein expression in XWLC-05 cells transfected with Blank, pGPU6/GFP/Neo-CD151-271, 450, 728 and shNC measured by Western blot1: Blank; 2: pGPU6/GFP/Neo-CD151-271; 3: pGPU6/GFP/Neo-CD151-450; 4: pGPU6/GFP/Neo-CD151-728; 5: pGPU6/GFP/Neo-shNC
图 2 Blank、pGPU6/GFP/Neo-CD151-271、450、728和shNC转染XWLC-05后CD151蛋白的变化Figure 2 CD151 protein expression in XWLC-05 cells transfected with Blank, pGPU6/GFP/Neo-CD151-271, 450, 728 and shNC measured by Western blot1: Blank; 2: pGPU6/GFP/Neo-CD151-271; 3: pGPU6/GFP/Neo-CD151-450; 4: pGPU6/GFP/Neo-CD151-728; 5: pGPU6/GFP/Neo-shNC2.4 MTT检测细胞增殖能力的结果
各细胞生长状态良好,呈均一贴壁生长,细胞增殖速度、生长密度及大体形态未观察到明显差异;各组细胞在传代24、48、72 h后经MTT检验结果显示各组细胞株增殖情况差异无统计学意义(P > 0.05),见表 3。
表 3 MTT法测定抑制CD151基因表达对XWLC-05细胞增殖能力的影响Table 3 Influence of inhibiting CD151 gene expression on proliferation ability of XWLC-05 cells by MTT test
2.5 划痕实验检测细胞迁移能力
72 h可见抑制CD151基因表达组细胞的迁移距离(60.51±2.46)明显短于空白对照组(90.17±0.97)(P=0.000),提示抑制细胞中CD151基因的表达在体外实验中可降低肿瘤细胞的迁移能力,见图 3。
2.6 Transwell实验检测细胞侵袭能力
XWLC-05-shRNA组穿膜细胞数(31.2±3.5)与XWLC-05-Blank组(91±4)和XWLC-05-shNC组(88.7±3)比较,差异均有统计学意义(P=0.000)。XWLC-05-Blank与XWLC-05-shNC组比较差异无统计学意义。说明RNA干扰抑制CD151基因表达可能抑制宣威肺腺癌XWLC-05细胞体外侵袭,见图 4。
2.7 裸鼠一般情况
实验终点各组小鼠均存活,老鼠一般情况、活动及饮食等指标的观察无明显差别。
2.8 动物模型的观察及测量
定期观察裸小鼠的精神、饮食、排便、体重和活动等情况。即刻取出XWLC-05荷瘤鼠新鲜肺组织病理标本,胸膜和肺实质均可见白色点状转移病灶,肉眼难以分辨,见图 5。病理标本Bouin's液浸泡24 h后,肺组织呈现棕黄色,清晰可见黑色点状肺转移病灶,见图 6。XWLC-05荷瘤鼠肺转移病灶,镜下HE染色可发现:转移瘤与来源细胞系特征吻合,呈腺癌样、巢样分布,部分有癌巢内出血。肺转移瘤在肺内和胸膜上分布、大小不均,肿瘤细胞大小不等、胞质丰富、核不规则深染,可见多核细胞,异型性明显;转移瘤边界不清,部分肺组织结构被破坏,肺泡结构消失,见图 7。
XWLC-05-shRNA、XWLC-05-shNC、XWLC-05-Blank各组裸鼠肺转移率及肺组织上的转移病灶数依次是75%(6/8)与(5.2±1.2)、100%(8/8)与(9.8±1.6)以及87.5%(7/8)与(9.1±1.2)。转移病灶数相比较,XWLC-05-shNC与XWLC-05-Blank组差异无统计学意义(P=0.423),XWLC-05-shRNA与XWLC-05-shNC(P=0.000)、XWLC-05-Blank组比较(P=0.000),差异有统计学意义。其他如肝脏、肾脏等器官,均未发现肿瘤性病灶。
3 讨论
CD151是四跨膜蛋白TM4SF(transmembrane 4 superfamily)成员之一,在人体全身多个组织、细胞中广泛表达;参与信号转导,细胞激活、生长、增殖和运动、细胞黏附与移动、血小板的凝血、病理血管新生等。对其功能研究最多的是其参与了肿瘤细胞的侵袭与转移。肿瘤细胞的侵袭与转移能力与恶性肿瘤的预后密切相关,常常是临床抗肿瘤治疗失效和患者复发甚至死亡的主要原因之一。
云南高发的宣威肺癌具有其显著的地域性特点,肿瘤的异质性导致其发生、发展规律、侵袭、转移能力、对治疗的反应及预后都与其他肺癌不同。深入探讨其发病机制及治疗策略成为研究的热点。宣威肺腺癌XWLC-05细胞系由昆明医科大学病理教研室于2007年建立,取自宣威当地一位68岁的女性肺腺癌患者,她被诊断为“右肺中分化腺癌”,XWLC-05细胞系是目前唯一一株以宣威女性肺癌为来源建立的细胞株,相关实验表明,该细胞株维持了原肿瘤的表型特征,在相当程度上能反应宣威肺腺癌的生物学特征[5-6]。
本研究中的划痕实验和Transwell实验表明RNA干扰抑制CD151基因表达可能抑制宣威肺腺癌XWLC-05细胞体外迁移和侵袭作用,同Ang的研究结果类似,体外细胞实验证实干扰CD151主要影响肿瘤细胞的侵袭和转移,但对增殖鲜有影响[7]。
进一步研究表明,体内CD151参与肿瘤的侵袭和转移诸多过程,如肿瘤信号转导、肿瘤细胞与细胞外基质的黏附,胞外基质的降解,肿瘤病理血管新生等与肿瘤预后关系密切[8-13]。本实验构建了干扰CD151表达重组质粒并建立稳转细胞株;利用尾静脉注射法建立人工肺转移的老鼠动物模型进一步研究CD151基因表达对裸鼠肺腺癌XWLC-05细胞肺转移的影响。肿瘤的转移是指肿瘤细胞通过血管、淋巴管等途径,在远离原发肿瘤部位的器官内形成继发肿瘤的过程[14];是一个多阶段、多步骤、多因素、多基因相互作用的一系列连续的、相互关联的复杂过程[10]。综合相关动物实验研究,CD151基因缺陷的老鼠,在基质胶栓模型、角膜新生血管实验、肿瘤种植等体内外试验中均观察到病理性血管生成[15]。CD151基因敲除的老鼠模型中,Takeda将黑色素瘤细胞B16F10和肺癌细胞Lewis通过尾静脉注射导入CD151基因敲除的裸鼠中,由于CD151基因的敲除导致肿瘤细胞-宿主内皮细胞间黏附功能和跨内皮迁移功能缺陷,从而明显降低了肺转移灶的生成[16]。在CD151基因敲除小鼠前列腺癌动物模型上发现,CD151基因的敲除不影响原发肿瘤的生长、凋亡和血管形成,但肺转移病灶减少[17]。
本研究利用尾静脉注射法建立人工肺转移的老鼠动物模型,一定程度体现了肿瘤细胞进入血液循环以后发生转移的步骤和环节。结果显示干扰组较阴性对照组和空白对照组,肺转移阳性率比较无差异,但肺转移病灶数目比较有差异,干扰组较阴性对照组和空白对照组肺转移病灶减少;阴性对照组和空白组之间无论肺转移阳性率比较还是病灶数均无差别,同Takeda等的研究结果类似[16]。肺转移病灶数比较有差异而肺转移阳性率比较无差异,考虑可能是样本量小所致。我们通过相关研究表明,干扰CD151表达能减少裸鼠体内肺癌转移。在其他器官,如肝脏、肾脏等,均未发现肿瘤性病灶。如果适当延长裸鼠饲养时间,可能在其他器官也有转移性病灶,这需要在后续序列研究中进一步完善。
本研究表明,RNA干扰抑制CD151基因表达可能抑制宣威肺腺癌的侵袭和转移,CD151可能成为肺腺癌一个潜在的治疗靶点,为宣威肺腺癌的发病机制提供可供参考理论基础和治疗思路。
作者贡献于雪迪:数据整理、分析和论文撰写佘春华:论文设计孙增峰:统计学分析指导刘敬敬:临床病例收集马莉:论文修订李文良:论文指导 -
表 1 高、低NLR、MLR和PLR组患者的临床病理特征
Table 1 Clinicopathological features of glioma patients with high and low NLR, MLR and PLR

表 2 预测患者总生存时间的单因素和多因素分析
Table 2 Univariate and multivariate Cox Regression analyses of variables predicting overall survival time of glioma patients

-
[1] Yi GQ, Gu B, Chen LK. The safety and efficacy of magnetic nano-iron hyperthermia therapy on rat brain glioma[J]. Tumour Biol, 2014, 35(3): 2445-2449. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=0233c1de8927108581a6ed5aa1a3842f
[2] Ostrom QT, Gittleman H, Xu J, et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2009-2013[J]. Neuro Oncol, 2016, 18(suppl_5):v1-v75. doi: 10.1093/neuonc/now207
[3] Angelopoulou E, Piperi C. Emerging role of plexins signaling in glioma progression and therapy[J]. Cancer Lett, 2018, 414: 81-87. doi: 10.1016/j.canlet.2017.11.010
[4] Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. doi: 10.1007/s00401-016-1545-1
[5] Shi J, Hou S, Huang J, et al. An MSN-PEG-IP drug delivery system and IL13Rα2 as targeted therapy for glioma[J]. Nanoscale, 2017, 9(26): 8970-8981. doi: 10.1039/C6NR08786H
[6] Fuentes HE, Oramas DM, Paz LH, et al. Venous Thromboembolism Is an Independent Predictor of Mortality Among Patients with Gastric Cancer[J]. J Gastrointest Cancer, 2018, 49(4): 415-421. doi: 10.1007/s12029-017-9981-2
[7] Templeton AJ, McNamara MG, Šeruga B, et al. Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors: a systematic review and meta-analysis[J]. J Natl Cancer Inst, 2014, 106(6): dju124. http://cn.bing.com/academic/profile?id=ffc64eaea251f8ef4310402608be03c4&encoded=0&v=paper_preview&mkt=zh-cn
[8] Reni M, Mazza E, Zanon S, et al. Central nervous system gliomas[J]. Crit Rev Oncol Hematol, 2017, 113: 213-234. doi: 10.1016/j.critrevonc.2017.03.021
[9] Eckel-Passow JE, Lachance DH, Molinaro AM, et al. Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors[J]. N Engl J Med, 2015, 372(26): 2499-2508. doi: 10.1056/NEJMoa1407279
[10] Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-899. doi: 10.1016/j.cell.2010.01.025
[11] Jin X, Kim SH, Jeon HM, et al. Interferon regulatory factor 7 regulates glioma stem cells via interleukin-6 and Notch signaling[J]. Brain, 2012, 135(Pt4): 1055-1069. http://cn.bing.com/academic/profile?id=44ee506a88894b7e8c26fb0d768ec4c4&encoded=0&v=paper_preview&mkt=zh-cn
[12] Khan AA, Akritidis G, Pring T, et al. The Neutrophil-to-Lymphocyte Ratio as a Marker of Lymph Node Status in Patients with Rectal Cancer[J]. Oncology, 2016, 91(2): 69-77. doi: 10.1159/000443504
[13] Hu H, Yao X, Xie X, et al. Prognostic value of preoperative NLR, dNLR, PLR and CRP in surgical renal cell carcinoma patients[J]. World J Urol, 2017, 35(2): 261-270. doi: 10.1007/s00345-016-1864-9
[14] Müller I, Munder M, Kropf P, et al. Polymorphonuclear neutrophils and T lymphocytes: strange bedfellows or brothers in arms[J]. Trends Immunol, 2009, 30(11): 522-530. doi: 10.1016/j.it.2009.07.007
[15] Michelson N, Rincon-Torroella J, Quiñones-Hinojosa A, et al. Exploring the role of inflammation in the malignant transformation of low-grade gliomas[J]. J Neuroimmunol, 2016, 297: 132-140. doi: 10.1016/j.jneuroim.2016.05.019
[16] Guthrie GJ, Charles KA, Roxburgh CS, et al. The systemic inflammation-based neutrophil-lymphocyte ratio: experience in patients with cancer[J]. Crit Rev Oncol Hematol, 2013, 88(1): 218-230. doi: 10.1016/j.critrevonc.2013.03.010
[17] Weng W, Chen X, Gong S, et al. Preoperative neutrophil-lymphocyte ratio correlated with glioma grading and glioblastoma survival[J]. Neurol Res, 2018, 40(11): 917-922. doi: 10.1080/01616412.2018.1497271
[18] Server A, Kulle B, Gadmar ØB, et al. Measurements of diagnostic examination performance using quantitative apparent diffusion coefficient and proton MR spectroscopic imaging in the preoperative evaluation of tumor grade in cerebral gliomas[J]. Eur J Radiol, 2011, 80(2): 462-470. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=495ea5a0a149c9119bc1c5107407c1bc
[19] Shimada H, Takiguchi N, Kainuma O, et al. High preoperative neutrophil-lymphocyte ratio predicts poor survival in patients with gastric cancer[J]. Gastric Cancer, 2010, 13(3): 170-176. doi: 10.1007/s10120-010-0554-3
[20] Chen J, Deng Q, Pan Y, et al. Prognostic value of neutrophil-to-lymphocyte ratio in breast cancer[J]. FEBS Open Bio, 2015, 5: 502-507. doi: 10.1016/j.fob.2015.05.003
[21] Ferrucci PF, Ascierto PA, Pigozzo J, et al. Baseline neutrophils and derived neutrophil-to-lymphocyte ratio: prognostic relevance in metastatic melanoma patients receiving ipilimumab[J]. Ann Oncol, 2018, 29(2): 524. doi: 10.1093/annonc/mdx059
[22] el-Hag A, Clark RA. Immunosuppression by activated human neutrophils. Dependence on the myeloperoxidase system[J]. J Immunol, 1987, 139(7): 2406-2413. http://cn.bing.com/academic/profile?id=615791ddd7c7b0abba05128881dad2dc&encoded=0&v=paper_preview&mkt=zh-cn
[23] Massara M, Persico P, Bonavita O, et al. Neutrophils in Gliomas[J]. Front Immunol, 2017, 8: 1349. doi: 10.3389/fimmu.2017.01349
[24] Bambace NM, Holmes CE. The platelet contribution to cancer progression[J]. J Thromb Haemost, 2011, 9(2): 237-249. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_165004
[25] Di Vito C, Navone SE, Marfia G, et al. Platelets from glioblastoma patients promote angiogenesis of tumor endothelial cells and exhibit increased VEGF content and release[J]. Platelets, 2017, 28(6): 585-594. doi: 10.1080/09537104.2016.1247208
[26] Lindholm PF, Sivapurapu N, Jovanovic B, et al. Monocyte-Induced Prostate Cancer Cell Invasion is Mediated by Chemokine ligand 2 and Nuclear Factor-κB Activity[J]. J Clin Cell Immunol, 2015, 6(2). pii: 308. http://cn.bing.com/academic/profile?id=6d214c8434f39cd8dbb7c79a299c766b&encoded=0&v=paper_preview&mkt=zh-cn
[27] Feng JF, Huang Y, Liu JS. Combination of neutrophil lymphocyte ratio and platelet lymphocyte ratio is a useful predictor of postoperative survival in patients with esophageal squamous cell carcinoma[J]. Onco Targets Ther, 2013, 6: 1605-1612. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Doaj000003275162
[28] Alexandrakis MG, Passam FH, Moschandrea IA, et al. Levels of serum cytokines and acute phase proteins in patients with essential and cancer-related thrombocytosis[J]. Am J Clin Oncol, 2003, 26(2): 135-140. doi: 10.1097/01.COC.0000017093.79897.DE
[29] Klinger MH, Jelkmann W. Role of blood platelets in infection and inflammation[J]. J Interferon Cytokine Res, 2002, 22(9): 913-922. doi: 10.1089/10799900260286623
[30] Ouyang W, Liu Y, Deng D, et al. The change in peripheral blood monocyte count: A predictor to make the management of chemotherapy-induced neutropenia[J]. J Cancer Res Ther, 2018, 14(Supplement): S565-S570. http://cn.bing.com/academic/profile?id=85b1f0ccb65d1c43758d8ade8b09a9c2&encoded=0&v=paper_preview&mkt=zh-cn
[31] Lemée JM, Clavreul A, Menei P. Intratumoral heterogeneity in glioblastoma: don't forget the peritumoral brain zone[J]. Neuro Oncol, 2015, 17(10): 1322-1332. doi: 10.1093/neuonc/nov119
[32] Hamard L, Ratel D, Selek L, et al. The brain tissue response to surgical injury and its possible contribution to glioma recurrence[J]. J Neurooncol, 2016, 128(1): 1-8. doi: 10.1007/s11060-016-2096-y



 下载:
下载: