-
摘要:目的
探讨滑膜肉瘤患者以手术为主综合治疗的临床疗效及生存预后影响因素。
方法回顾性分析95例滑膜肉瘤患者的病历资料,统计分析患者治疗后复发、转移及生存情况,并通过Log rank法和Cox比例风险回归模型分别进行生存预后相关影响因素分析。
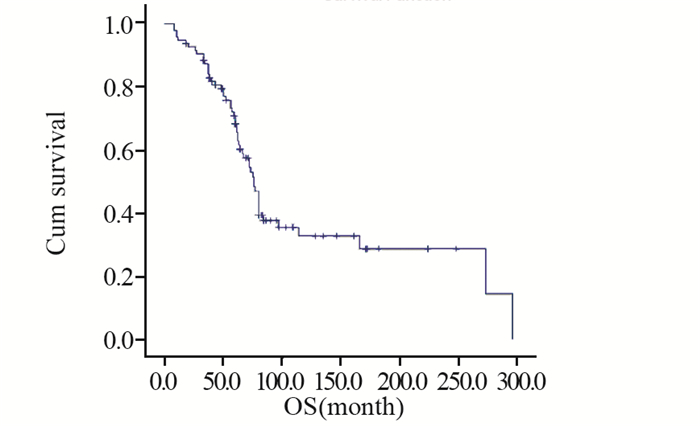
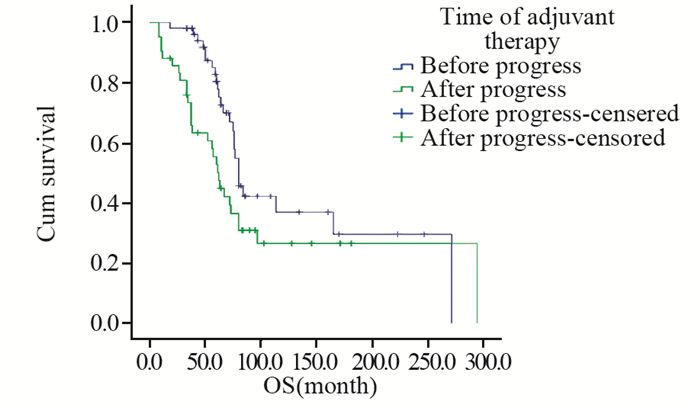
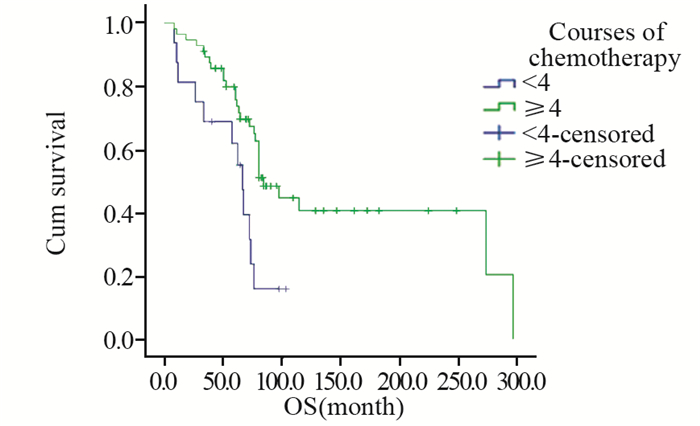
结果患者随访时间为8~296月,中位随访时间为62月。所有患者的中位总体生存期为76月(95%CI: 67.9~84.1),5年生存率70.7%,5年无进展生存率22.5%。多因素分析显示AJCC分期(P < 0.001)、肿瘤发病部位(P=0.027)、肿瘤大小(P=0.015)、辅助治疗时机(P=0.004)、治疗方案(P=0.005)和复发与转移(P=0.016)均为滑膜肉瘤的独立生存预后因素。化疗周期数≥4和 < 4的患者中位生存时间分别为84和66月(P=0.007)。
结论多种因素能够影响滑膜肉瘤的生存预后情况;术后辅助化疗、放疗、联合放化疗均能延长患者生存时间,术后随即联合辅助治疗的效果更佳;化疗患者接受4个及以上化疗周期治疗效果更佳。
Abstract:ObjectiveTo investigate prognostic factors and the efficacy of surgery-based comprehensive treatment for patients with synovial sarcoma.
MethodsWe retrospectively analyzed the medical records of 95 synovial sarcoma patients. Factors associated with survival were identified with univariate analysis by log-rank test and multivariate analysis by Cox proportional hazard regression model. Kaplan-Meier method was applied to do the survival analysis.
ResultsPatients were followed up for 8-296 months and the median follow-up time was 62 months. The median overall survival time of all patients was 76 months (95%CI: 67.9-84.1 months). The 5-year OS and PFS of this cohort were 70.7% and 22.5%, respectively. Multivariable analysis indicated that AJCC staging at diagnosis (P < 0.001), primary tumor site (P=0.027), tumor size (P=0.015), time of adjuvant therapy (P=0.004), therapeutic regimen (P=0.005) and recurrence and metastasis (P=0.016) were independent prognostic factors of OS. Kaplan-Meier method showed that the median overall survival time of patients with more than 4 courses chemotherapy was 84 months, significantly better than 66 months of those patients with less than 4 courses(P=0.007).
ConclusionSeveral clinical features could affect the prognosis of synovial sarcoma. Adjuvant chemotherapy, adjuvant radiotherapy and combining radiotherapy and chemotherapy are all effective for prolonging patients' survival time. After surgery, a sooner adjuvant therapy before disease progression could achieve better treatment effect. For patients accepting chemotherapy, 4 and above chemotherapy courses are favorable to obtain better therapeutic results.
-
Key words:
- Synovial sarcoma /
- Surgery /
- Chemotherapy /
- Radiotherapy /
- Prognostic factors
-
0 引言
结直肠癌(colorectal cancer, CRC)是常见的消化道恶性肿瘤之一,全球发病率和死亡率分别高居第3、第4位[1],预后较差。中国是CRC高发国家,每年新确诊病例约有120万人,其发病和死亡例数分别占全球例数的18.6%、20.1%[2],而CRC患者五年生存率尚未达到60%[3],这凸显出治疗该病的紧迫性与重要性。
肿瘤微环境是恶性肿瘤发生发展最重要的因素之一,并与能量代谢密切相关。以有氧代谢为主的葡萄糖代谢是细胞获取能量的主要方式,但在正常细胞向肿瘤细胞转化的过程中往往伴随着代谢途径的重塑[4]。无论氧供充足与否,CRC细胞更依赖糖酵解途径(embden-meyerhof-parnas, EMP),优先选择EMP而非氧化磷酸化途径(oxidative phosphorylation, CXPHOS)供能[5],这体现出EMP在CRC中的重要性。因此,抑制EMP关键酶、信号通路及转录因子是治疗CRC的有效策略之一。
1 EMP在CRC中的地位
葡萄糖(glucose, Glu)在生命进程中起到提供能量和碳源的作用。作为能量代谢的关键步骤,EMP指将Glu分解为丙酮酸(pyruvic acid, PA),释放NADH和H+,生成少量ATP的过程。无论有氧或无氧条件下,Glu首先通过EMP产生PA。不同的是,理想状态下[6]PA在线粒体内生成30/32分子ATP;而乏氧环境中,PA则在胞质内由乳酸脱氢酶催化为乳酸(lactic acid, LA),1分子Glu生成2分子LA和3分子ATP。
人体正常组织约90%的ATP源于线粒体CXPHOS[7]。而CRC由于能量代谢方式的转换,要求其优先通过EMP供能,故约50%的ATP由之供给[8](见图 1红框内)。即使在氧供充足的情况下仍主要依赖EMP促进肿瘤生长增殖、侵袭转移,这也被称作“Warburg”效应。
CRC细胞具有无限增殖的生物学特性,而瘤体组织内部常处于缺氧状态,选择EMP可有效提高乏氧耐受,避免CXPHOS导致的增殖抑制和诱导凋亡[9]。此外,LA并非只充当代谢终产物,更能直接为肿瘤细胞供能,节约了Glu的利用[10]。由于瘤体局部灌注差,LA难以及时清除,肿瘤微环境pH低[11],更易引起细胞突变、侵袭转移增强及免疫逃逸的发生。
2 抑制EMP关键酶
EMP关键酶表达水平的提高是EMP增强的主要原因,并与CRC放疗抵抗、化疗耐药密切相关[12]。近年来的研究表明降低关键酶活性能够有效抑制CRC细胞的增殖。己糖激酶、磷酸果糖激酶及丙酮酸激酶等在CRC患者中高表达,成为基于EMP治疗CRC的关键靶点(见图 1虚线框内)。
2.1 己糖激酶Ⅱ(HKⅡ)
己糖激酶(hexokinase, HK)是EMP第1个限速酶。4种分布不同的亚型中,HKⅡ与恶性肿瘤最为相关[13],高表达于CRC[14]。一方面HKⅡ的疏水性N端磷酸化后与线粒体外膜上的电压依赖性阴离子通道(VDAC)相结合,促进EMP;另一方面两者的结合拮抗了促凋亡蛋白Bax与VDAC的结合,降低了跨膜电位并减少细胞色素C的释放,发挥抗凋亡作用。相关研究表明在CRC细胞系HT-29、SW480、HCT-15、RKO和HCT-116中沉默HKⅡ,能够有效阻滞其增殖及高EMP作用[15]。临床试验[16]则发现HKⅡ的表达水平与CRC肿瘤体积、浸润深度、分期和淋巴结转移相关。因此,HKⅡ可作为CRC的预后指标和治疗靶点之一。
2.2 磷酸果糖激酶(PFK)
磷酸果糖激酶(phosphofructokinase, PFK)是EMP最重要的限速酶,分为PFK1和PFK2。PFK2的亚型PFKFB3在CRC等多类恶性肿瘤中高表达,其调节机制与ras[17]、cdh1[18]等原癌基因的活化有关。Han等[19]发现抗白介素6(interleukin-6, IL-6)抗体可以干扰EMP来降低CRC恶性趋势:经IL-6刺激的CRC细胞EMP关键基因转录上调,促进增殖转移;而敲除PFKFB3后可消除IL-6的上述作用。另外,EMP增强的肿瘤组织中PFK1明显增加,表达水平与EMP的代谢效率呈正相关[20]。以PFK为抗肿瘤靶点所开发的药物越来越受到学者的关注,但其在组织中的作用方式及抑制EMP的分子机制仍有待深入研究。
2.3 丙酮酸激酶(PK)
丙酮酸激酶(pyruvate kinase, PK)使磷酸烯醇式丙酮酸(phosphoenolpyruvic acid, PEP)去磷酸化为PA产生ATP,是另一途径的限速酶。目前已知的PKL、PKR、PKM1、PKM2四种同工酶中,主要以PKM2的形式存在于大部分肿瘤细胞[21]。PKM2除促进EMP外,其催化的低速率EMP导致中间产物大量积累,并转向磷酸戊糖代谢途径进行大分子生物合成,加快肿瘤细胞增殖[22]。CRC细胞敲减PTBP1后PKM2转变为PKM1,高比例PKM1/PKM2降低EMP速率,抑制细胞生长并诱导凋亡[23]。Ginés等[24]在HT29、SW480、HCT116中沉默PKM2后,CRC细胞对奥沙利铂的敏感度显著提高,其程度与PKM2的敲减水平正相关。由此可见,通过下调限速酶PKM2抑制EMP来恢复化疗敏感度是逆转CRC化疗耐药的策略之一。
2.4 乳酸脱氢酶(LDH)
乳酸脱氢酶(lactate dehydrogenase, LDH)分为A、B、C三种亚型,LDHA在CRC组织中高表达[25],及时将催化PA产生的LA转运至胞外,减少LA积累,促进高效EMP。Kim等[26]发现肉豆蔻提取物可以靶向抑制LDHA从而调节CRC细胞的EMP速率,降低ATP产量,减少Glu摄取。与亲本CRC细胞相比,5-Fu耐药细胞株LDHA显著上调,而miR-34a对LDHA的直接抑制可以逆转5-Fu耐药,表明抑制LDHA介导的EMP能够实现5-Fu致敏[27]。抑制LDHA有望成为解决CRC耐药的方法之一,为肿瘤细胞能量代谢的治疗靶点提供了新思路。
2.5 葡萄糖转运蛋白(Glut)
葡萄糖转运蛋白(glucose transporter protein, Glut)是一类分布在胞膜上的Glu转运载体,通过协助Glu顺浓度梯度穿过脂质双分子层实现Glu的摄取。Glut1与糖代谢最为相关,在多种实体瘤中过表达[28]。通过抑制转录因子HIF-1α及其信号通路,能够下调CRC细胞Glut1的转录水平,减少Glu摄取并诱导凋亡[29]。Glut1参与多药耐药机制主要体现在:上调P-gp、MRP提高药物转运能力,使胞内药物蓄积低于有效浓度;提高Bcl-2/Bax比值,增强抗凋亡。与亲本细胞相比,Glut1在耐药CRC细胞中过表达,低浓度5-Fu干预可诱导Glut1产生剂量依赖性的表达,并促进肿瘤细胞摄取Glu,使用特异性抑制剂WZB117沉默Glut1,耐药细胞恢复对5-Fu的敏感度[30]。作为CRC治疗的潜在靶点,Glut1具有重要的临床价值,对其研究有望为诊治CRC提供重要的分子生物学信息。
3 抑制CRC中EMP关键信号通路
3.1 AKT信号通路
AKT又称作蛋白激酶B(protein kinase, BPKB),是PI3K的下游信号分子,具有丝氨酸/苏氨酸激酶活性,在CRC细胞能量代谢中起到重要调节作用。AKT可以通过增加Glut1的表达来提高胞膜转运速率,促进Glu摄取。在CRC细胞中抑制TGF-β/PI3K-AKT-mTOR信号通路能下调Glut1,显著降低Glu摄取量,从而阻断EMP[31]。另一方面,AKT能够激活细胞代谢的另一重要转录因子HIF-1α,影响EMP相关基因如HKⅡ、PDHK1、LDHA等表达。Wang等[32]报道,汉黄芩素能够逆转CRC细胞获得性耐药,其机制是通过抑制PI3K/AKT信号通路下调HIF-1α的表达,以沉默CRC细胞代谢相关基因,降低肿瘤细胞在缺氧环境中的耐受力。AKT还能直接磷酸化激活限速酶PK,增强EMP。由此可见,AKT是细胞能量代谢过程中的重要基因,能够调节CRC细胞的EMP。通过阻断AKT相关通路可以抑制CRC细胞的能量代谢,起到“饿死”肿瘤的作用。
3.2 AMPK信号通路
AMP激活的蛋白激酶(AMP-activated protein kinase, AMPK)是由催化亚基α(α1/α2)和调节亚基β(β1/β2)、γ(γ1/γ2/γ3)组成的高度保守的异源三聚体,是细胞内重要的能量感受器和代谢稳态调节因子,具有调控ATP产生和消耗的作用。活化的AMPK可磷酸化下游底物,上调Glut1,增加Glu摄取;AMPK依赖的mTOR通路也能够促进CRC细胞EMP。除高水平的AMP能够上调AMPK外,Glu减少时也能激活AMPK[33],从而促进合成代谢转向分解代谢,维持机体的能量和物质代谢的平衡。在CRC细胞中,脂肪分解激活因子可以促进脂肪利用而抑制Glu代谢,但其缺陷时则可通过抑制AMPKα/p53信号通路促进代谢转化,诱导磷酸甘油酸变位酶(phos-phoglycerate mutase, PGM)转录表达,增加EMP,其缺陷程度与EMP效率及CRC恶性程度正相关[34]。除此之外,AMPK还能通过调节Glut[35]和其他EMP限速酶如PFK的表达活性,影响CRC细胞EMP及Glu摄取。这些研究结果确立了CRC中AMPK通路与EMP的联系,揭示出CRC细胞可以通过影响AMPK的活性介导EMP来调节能量代谢的机制。
3.3 mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种高度保守的丝氨酸/苏氨酸蛋白激酶,在胞内主要以mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)两种形式存在,能够调节包括细胞增殖、蛋白质转录合成在内的一系列细胞行为。mTORC1由mTOR、Raptor、AKTS1和mLST8/GβL构成,主要调控细胞的营养生长、能量代谢等。mTORC2包括mTOR、mLST8/GβL、Rictor和Sin1等,主要功能是调节细胞的骨架生成和细胞存活。目前有研究发现CRC组织可以发生诱导mTOR信号通路过度激活的体细胞突变,大约有40%的CRC存在mTOR通路上下游分子的异常表达[36]。通过PI3K/AKT的调节,mTORC1能够上调Glut1的活性,刺激胞膜对Glu的转运。mTORC1还可以靶向调控HIF-1α介导的EMP来调节HT-29细胞的能量代谢[37],故有效抑制mTOR/HIF-1α轴是抗CRC的重要手段之一。另外,mTORC2干预CRC细胞EMP的过程除了与上游AKT的过度激活有关,还与mTORC2诱导原癌基因c-Myc的上调密切相关[38]。因此,mTOR相关信号通路是CRC治疗中的极其重要的靶标,抑制mTOR的活性可以阻断CRC的能量代谢,抑制EMP,控制肿瘤细胞的增殖转移。
4 抑制CRC中EMP关键转录因子
4.1 p53
p53是经典的抑癌基因,在调控细胞周期和诱导细胞凋亡中起重要作用。p53还参与了恶性肿瘤的能量重编程,通过调节糖代谢维持肿瘤细胞有氧代谢和EMP间的平衡。TP53诱导的EMP和凋亡调节因子(TP53-induced glycolysis and apoptosis regulator, TIGAR)是近年来新发现的p53诱导型基因,能够有效抑制EMP,使能量利用转向磷酸戊糖途径。有研究发现,果糖2, 6-二磷酸(FRU-2, 6-P2)能够使能量代谢向EMP方向进行,同时抑制糖异生,而TIGAR可以降低细胞中的FRU-2, 6-P2从而促使糖代谢转向生物合成,抑制EMP,提高NADPH水平[39]。问题是肿瘤细胞中p53经常出现突变或缺失。与野生型相比,p53沉默后的CRC细胞EMP变得更加活跃,从而促进细胞从G2~M期向G1期转变并主要依赖EMP供能[40]。此外,PGM是p53的另一个靶基因,在EMP中具有催化作用,p53下调时可以通过诱导升高PGM促进EMP [41]。
4.2 c-Myc
c-Myc是一种常见的原癌基因,参与谷氨酰胺、丝氨酸和糖原等多种代谢途径的调节。大约70%的CRC患者中都存在c-Myc的过表达[42],c-Myc磷酸化是肿瘤细胞在快速生长的缺氧过程中保持增殖活性的重要条件之一。在利用丙酮醛下调c-Myc的表达后,可以通过抑制下游EMP途径的激活使CRC细胞无法产生充足的能量以维持肿瘤细胞的无限增殖[43]。c-Myc还参与调控Glut1、PKM2及LDHA等多个EMP关键酶[44],增加肿瘤细胞对Glu的摄取和PA的生成。此外,c-Myc还通过其他代谢途径参与肿瘤细胞能量代谢的调节。有研究发现,缺氧条件下NDRG2通过调控CRC细胞中谷氨酰胺转运蛋白ASCT2和谷氨酸酶Ⅰ抑制Glu摄取及LA产生,减少谷氨酰胺的摄取和利用,最终导致EMP途径被阻断,而这些代谢酶的表达减少主要是通过NDRG2调控β-catenin进而下调c-Myc所引起的[45]。这些研究说明c-Myc参与了CRC细胞能量代谢的过程,促进EMP产能,从而提高CRC细胞对能量缺乏的耐受。因此,利用c-Myc抑制剂或将c-Myc作为治疗靶点来杀灭CRC细胞具有潜在的临床价值。
4.3 HIF-1α
HIF-1α是乏氧状态下产生的一种转录因子,使细胞对于低氧或者缺氧条件具有适应能力。肿瘤细胞因其无限增殖的特性容易形成缺氧的肿瘤微环境,故HIF-1α在肿瘤组织中大多过表达,通过诱导EMP相关基因和酶的表达以提供充足的能量。有研究表明,CRC细胞摄取Glu进行糖代谢的过程是通过Glut1和Glut4介导的,并受HIF-1α的调节[46]。另外,HIF-1α在microRNA的诱导下,与Smad3相互作用,通过靶向上调HKⅡ和MCT4的转录水平促进CRC细胞的能量代谢转向EMP,从而满足能量需求[47]。在通过抑制剂IDF-11774沉默HIF-1α后,发现HCT116细胞EMP水平受到抑制,其终产物LA和ATP的转化水平也随之降低,而AMP/ATP比值显著上升[48]。以上研究表明在CRC能量重编程的过程中HIF-1α起到了重要作用,故HIF-1α有望作为CRC的另一个有效靶点,从CRC细胞能量代谢的角度进行治疗。
5 总结与展望
CRC细胞EMP中的相关酶与肿瘤微环境的变化密切相关,且部分EMP抑制剂可降低CRC的放疗抵抗和化疗耐药,故以关键酶为靶点的治疗方式有望成为CRC治疗的新方向。然而仅抑制EMP中某一个靶点可能不足以抑制CRC细胞的增殖甚至会引起肿瘤细胞的多药耐药,因此,联合多个EMP关键酶靶点,开发靶向抗CRC药物具有重要意义。另外,虽然EMP已被普遍认可是CRC细胞能量代谢的主要途径,但大多数的肿瘤细胞仍然保留有线粒体功能,并不完全依赖EMP提供代谢所需的能量,CRC细胞通过CXPHOS途径代偿提供能量会削弱抑制EMP靶向药物对CRC的疗效。因此,以EMP关键酶为治疗靶点并不是唯一的治疗方向,如三羧酸循环、磷酸戊糖途径、谷氨酰胺代谢等都是具有研究价值的CRC能量代谢途径。与此同时,对于某些以EMP为主要能量来源的正常组织如大脑、视网膜、睾丸等,EMP抑制剂可能会对其生理功能造成一定的毒副作用。如何特异性阻断CRC细胞EMP,抑制增殖但不影响正常细胞功能,并针对这些特异性通路进行多靶点的联合治疗有待进一步研究。
作者贡献陶芳:文章撰写、资料采集、随访及统计学分析王国文、马育林:文章审校韩秀鑫:资料采集张超:资料随访李丽丽:统计学分析 -
表 1 AI和MAID两种化疗方案基本用法
Table 1 Information of AI and MAID chemotherapy regimens

表 2 生存预后相关的单因素和多因素分析
Table 2 Prognostic factors in univariate and multivariate analyses

表 3 滑膜肉瘤患者化疗单因素分析结果
Table 3 Univariate analysis of chemotheray outcomes of synovial sarcoma patients

-
[1] Zöllner SK, Rössig C, Toretsky JA. Synovial sarcoma is a gateway to the role of chromatin remodeling in cancer[J]. Cancer Metastasis Rev, 2015, 34(3): 417-28. doi: 10.1007/s10555-015-9575-z
[2] Yaser S, Salah S, AL-Shatti M, et al. Prognostic factors that govern localized synovial sarcoma: a single institution retrospective study on 51 patients[J]. Med Oncol, 2014, 31(6): 958. doi: 10.1007/s12032-014-0958-8
[3] Wang S, Song R, Sun T, et al. Survival changes in Patients with Synovial Sarcoma, 1983-2012[J]. J Cancer, 2017, 8(10): 1759-68. doi: 10.7150/jca.17349
[4] Wu Y, Bi W, Han G, et al. Influence of neoadjuvant chemotherapy on prognosis of patients with synovial sarcoma[J]. World J Surg Oncol, 2017, 15(1): 101. doi: 10.1186/s12957-017-1165-9
[5] Vining CC, Sinnamon AJ, Ecker BL, et al. Adjuvant chemotherapy in resectable synovial sarcoma[J]. J Surg Oncol, 2017, 116(4): 550-8. doi: 10.1002/jso.v116.4
[6] Noujaim J, Constantinidou A, Messiou C, et al. Successful ifosfamide rechallenge in soft-tissue sarcoma[J]. Am J Clin Oncol, 2018, 41(2): 147-51. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=4f9c4f60e38187d6ed144961613219f0
[7] Gronchi A, Ferrari S, Quagliuolo V, et al. Histotype-tailored neoadjuvant chemotherapy versus standard chemotherapy in patients with high-risk soft-tissue sarcomas (ISG-STS 1001): an international, open-label, randomised, controlled, phase 3, multicentre trial[J]. Lancet Oncol, 2017, 18(6): 812-22. doi: 10.1016/S1470-2045(17)30334-0
[8] Mullen JT, Kobayashi W, Wang JJ, et al. Long-term follow-up of patients treated with neoadjuvant chemotherapy and radiotherapy for large, extremity soft tissue sarcomas[J]. Cancer, 2012, 118(15): 3758-65. doi: 10.1002/cncr.26696
[9] Kandel RA, Yao X, Dickson BC, et al. Molecular analyses in the diagnosis and prediction of prognosis in non-GIST soft tissue sarcomas: A systematic review and meta-analysis[J]. Cancer Treat Rev, 2018, 66: 74-81. doi: 10.1016/j.ctrv.2018.04.005
[10] Tap WD, Jones RL, Van Tine BA, et al. Olaratumab and doxorubicin versus doxorubicin alone for treatment of soft-tissue sarcoma: an open-label phase 1b and randomised phase 2 trial[J]. Lancet, 2016, 388(10043): 488-97. doi: 10.1016/S0140-6736(16)30587-6
[11] Kotecki N, Le Cesne A, Tresch-Bruneel E, et al. Impact of Trabectedin Interruption and Subsequent Rechallenge on Progression in Patients With Advanced Soft Tissue Sarcoma: Long-term Follow-up of the T-DIS trial[J]. Ame J Clin Oncol, 2018. [Epub ahead of print]
[12] Sugitani A, Asai K, Kojima K, et al. Primary pleural synovial sarcoma treated with pazopanib[J]. Intern Med, 2015, 54(16): 2051-5. doi: 10.2169/internalmedicine.54.3570
[13] Chi Y, Fang Z, Hong X, et al. Safety and Efficacy of Anlotinib, a Multikinase Angiogenesis Inhibitor, in Patients With Refractory Metastatic Soft Tissue Sarcoma[J]. Clin Cancer Res, 2018, 24(21): 5233-8. http://cn.bing.com/academic/profile?id=12f855da5e51e05d681c2383ba0ed8ae&encoded=0&v=paper_preview&mkt=zh-cn
[14] Robbins PF, Morgan RA, Feldman SA, et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1[J]. J Clin Oncol, 2011, 29(7): 917-24. doi: 10.1200/JCO.2010.32.2537
[15] Pan M, Merchant M. Risk Factors Including Age, Stage and Anatomic Location that Impact the Outcomes of Patients with Synovial Sarcoma[J]. Med Sci (Basel), 2018, 6(1). Pii: E21. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=medsci-06-00021
[16] Bianchi G, Sambri A, Righi A, et al. Histology and grading are important prognostic factors in synovial sarcoma[J]. Eur J Surg Oncol, 2017, 43(9): 1733-9. doi: 10.1016/j.ejso.2017.05.020
[17] De Silva MV, Mcmahon AD, Reid R. Prognostic factors associated with local recurrence, metastases, and tumor-related death in patients with synovial sarcoma[J]. Am J Clin Oncol, 2004, 27(2): 113-21. http://cn.bing.com/academic/profile?id=b7422d0797368a5f367e5dfc098727e4&encoded=0&v=paper_preview&mkt=zh-cn
[18] Von Mehren M, Randall RL, Benjamin RS, et al. Soft Tissue Sarcoma, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2018, 16(5): 536-63. doi: 10.6004/jnccn.2018.0025
[19] Song S, Park J, Kim HJ, et al. Effects of adjuvant radiotherapy in patients with synovial sarcoma[J]. Am J Clin Oncol, 2017, 40(3): 306-11. doi: 10.1097/COC.0000000000000148
[20] Naing KW, Monjazeb AM, Li CS, et al. Perioperative radiotherapy is associated with improved survival among patients with synovial sarcoma: a SEER analysis[J]. J Surg Oncol, 2015, 111(2): 158-64. doi: 10.1002/jso.v111.2
[21] Kawaguchi N, Ahmed AR, Matsumoto S, et al. The concept of curative margin in surgery for bone and soft tissue sarcoma[J]. Clin Orthop Relat Res, 2004, 419: 165-72. doi: 10.1097/00003086-200402000-00027
[22] Canter RJ, Qin LX, MakI RG, et al. A synovial sarcoma-specific preoperative nomogram supports a survival benefit to ifosfamide-based chemotherapy and improves risk stratification for patients[J]. Clin Cancer Res, 2008, 14(24): 8191-7. doi: 10.1158/1078-0432.CCR-08-0843
[23] Chen Y, Yang Y, Wang C, et al. Adjuvant chemotherapy decreases and postpones distant metastasis in extremity stage IIB/III synovial sarcoma patients[J]. J Surg Oncol, 2012, 106(2): 162-8. doi: 10.1002/jso.v106.2
[24] Eilber FC, Brennan MF, Eilber FR, et al. Chemotherapy is associated with improved survival in adult patients with primary extremity synovial sarcoma[J]. Ann Surg, 2007, 246(1): 105-13. doi: 10.1097/01.sla.0000262787.88639.2b
[25] Italiano A, Penel N, Robin YM, et al. Neo/adjuvant chemotherapy does not improve outcome in resected primary synovial sarcoma: a study of the French Sarcoma Group[J]. Ann Oncol, 2009, 20(3): 425-30. http://cn.bing.com/academic/profile?id=1738c99768a0575a83a31dd08c432383&encoded=0&v=paper_preview&mkt=zh-cn
[26] Gronchi A, Stacchiotti S, Verderio P, et al. Short, full-dose adjuvant chemotherapy (CT) in high-risk adult soft tissue sarcomas (STS): long-term follow-up of a randomized clinical trial from the Italian Sarcoma Group and the Spanish Sarcoma Group[J]. Ann Oncol, 2016, 27(12): 2283-8. doi: 10.1093/annonc/mdw430
[27] Vlenterie M, Litière S, Rizzo E, et al. Outcome of chemotherapy in advanced synovial sarcoma patients: Review of 15 clinical trials from the European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group; setting a new landmark for studies in this entity[J]. Eur J Cancer, 2016, 58: 62-72. doi: 10.1016/j.ejca.2016.02.002
[28] Desar IM, Fleuren ED, Van der Graaf WTA. Systemic Treatment for Adults with Synovial Sarcoma[J]. Curr Treat Options Oncol, 2018, 19(2):13. doi: 10.1007/s11864-018-0525-1




 下载:
下载: