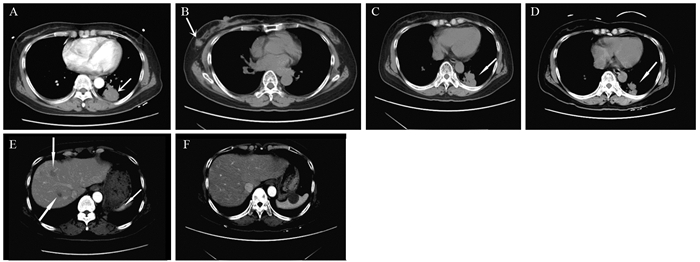
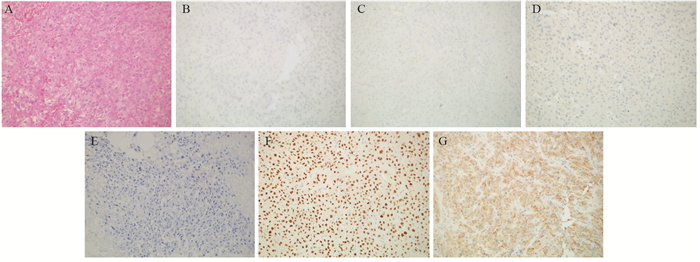
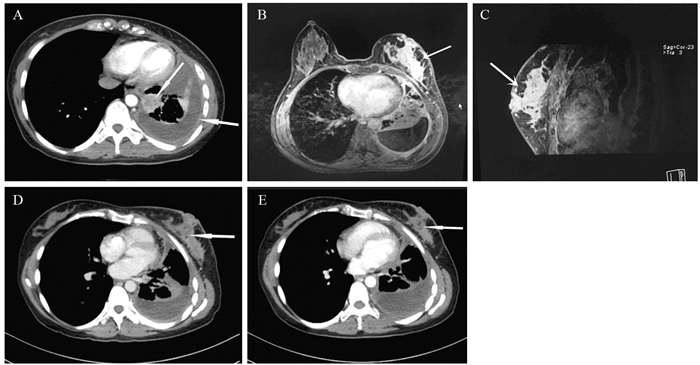
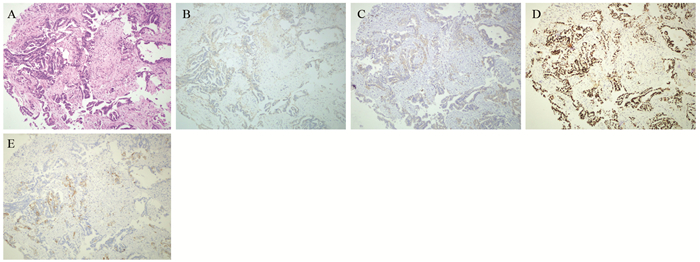
Breast Metastasis of Primary Pulmonary Adenocarcinoma: A Report of Two Cases and Literature Review
-
-
0 引言
脑胶质瘤是中枢神经系统最常见的原发性恶性脑肿瘤,占原发性恶性脑肿瘤的80%[1]。2016版中枢神经系统肿瘤WHO分类将异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)和1p19q等基因检测纳入弥漫星形细胞瘤和少突胶质细胞瘤的诊断标准,而2021年WHO更新了中枢神经系统肿瘤分类,将成人弥漫性胶质瘤分为星形细胞瘤-IDH突变型、少突胶质细胞瘤-IDH突变伴1p19q联合缺失型及胶质母细胞瘤-IDH野生型,并提出了组织学和分子病理学的整合诊断理念。目前胶质瘤分子病理学研究主要依赖于病理活检或手术病理,但部分患者无法手术或拒绝有创方法。弥散加权成像(diffusion weighted imaging, DWI)是MRI常用的功能性成像技术,通过定量检测肿瘤组织内水分子的自由扩散信息,反映肿瘤异质性和细胞增殖状况等。表观弥散系数(apparent diffusion coefficient, ADC)是DWI的定量参数,能够客观反映胶质瘤的细胞增殖、细胞外间隙等病理学特征,从而有望应用于无创性评价胶质瘤的分子病理学信息,进而指导临床治疗并预测患者预后。研究[2-4]表明DWIADC值与胶质瘤基因型(IDH/1p19q)间存在相关性、且与胶质瘤的预后相关,然而有关DWI与Ⅱ/Ⅲ级胶质瘤基因型间的相关性研究较少。本研究旨在观察ADC值与Ⅱ/Ⅲ级胶质瘤基因型(IDH-1、1p19q)间的相关性,探讨ADC值在无创性预测胶质瘤分子分型中的临床价值,从而为ADC辅助制定治疗方案、预测患者预后提供依据。
1 资料与方法
1.1 研究对象
收集2013年3月—2020年12月在兰州大学第二医院就诊且临床资料完整的69例胶质瘤患者的临床资料。其中男34例、女35例,年龄18~72岁(42.24±14.73)岁;WHOⅡ级胶质瘤33例,WHO Ⅲ级胶质瘤36例。分子病理学检测:IDH-1基因检测48例(WHOⅡ级22例、Ⅲ级26例)、1p19q基因检测27例(WHOⅡ级13例、Ⅲ级14例)。所有患者术前均行常规MRI、DWI、FLAIR及MR增强检查。该研究中胶质瘤的诊断标准基于2007版和2016版WHO中枢神经系统肿瘤分类。本研究获得兰州大学第二医院医学伦理委员会批准(编号:2022A-497)。
1.2 MR设备与扫描方法
采用Siemens 3.0 T Verio MR扫描仪。所有患者术前均行常规T1WI、T2WI、FLAIR序列及DWI序列扫描,MRI平扫后行增强扫描。扫描序列及参数:(1)GRE T1WITR550 ms,TE 11 ms,层厚5.0 mm,层间距1.5 mm,视野(FOV)260 mm×260 mm,矩阵256×256;(2)TSE T2WITR2200 ms,TE 96 ms,回波时间10 ms,回波链长度8,激励次数2;(3)DWI(SE序列)TR4500 ms,TE 98 ms,层厚5.0 mm,层距1.5 mm,矩阵256×256,b=0、1000 s/mm2;(4)FLAIR TR 9000 ms,TE 110.0 ms,层厚5.0 mm,层间距1.5 mm;(5)MR增强扫描:经肘静脉团注钆喷葡胺注射液(Gd-DTPA),剂量0.1 mmol/kg、流速3 ml/s。
1.3 DWI数据测量与分析
1.3.1 ROI的界定
肿瘤实性部分或正常脑白质区勾画ROI区,避开肿瘤囊变、坏死、出血及水肿等区域;ROI面积取10~20 mm2。
1.3.2 ADC值的测量
在ST-PACS医学图像工作站(北京思创贯宇科技开发有限公司)上选取肿瘤最大层面相邻的三个层面,利用自由形标记工具在ADC图上手工绘制ROI,在b=1 000s/mm2下测量平均ADC值(ADCmean)、最小ADC值(ADCmin),每个层面测量3次,并计算平均值。相对ADC值(rADC)=瘤体区ADC值/对侧脑白质ADC值,见图 1。
![]() 图 1 少突胶质细胞瘤(WHOⅢ级;IDH-1突变/1p19q共缺失)MRI和病理学表现Figure 1 MRI and pathological manifestations of oligodendrocytoma (WHO gradeⅢ) with IDH-1 mutation/1p19q co-deletionA, B: the lesions in the right temporal-parietal lobe showed heterogeneous low signal and high signal on T1WI and T2WI, respectively; C, D: DWI presented as an inhomogeneous equal-slightly higher signal (mild diffusion restricted) (C) and ADC map showed an inhomogeneous low-slightly higher signal (D); E: the measurement method of ADC value to select three ROI (10-20 mm2) in lesions and take their average values as well as select the contralateral normal brain white matter to calculate rADC; F: tumor cells were arranged in diffuse pieces, the nucleus with obvious atypia was large, and numerous necrotic regions were found in the lesions (HE ×200).
图 1 少突胶质细胞瘤(WHOⅢ级;IDH-1突变/1p19q共缺失)MRI和病理学表现Figure 1 MRI and pathological manifestations of oligodendrocytoma (WHO gradeⅢ) with IDH-1 mutation/1p19q co-deletionA, B: the lesions in the right temporal-parietal lobe showed heterogeneous low signal and high signal on T1WI and T2WI, respectively; C, D: DWI presented as an inhomogeneous equal-slightly higher signal (mild diffusion restricted) (C) and ADC map showed an inhomogeneous low-slightly higher signal (D); E: the measurement method of ADC value to select three ROI (10-20 mm2) in lesions and take their average values as well as select the contralateral normal brain white matter to calculate rADC; F: tumor cells were arranged in diffuse pieces, the nucleus with obvious atypia was large, and numerous necrotic regions were found in the lesions (HE ×200).1.4 统计学方法
采用SPSS23.0统计学软件进行统计分析。计量资料组间比较采用独立样本t检验,计数资料组间比较采用卡方检验。胶质瘤ADC值/rADC值与IDH-1/1p19q的相关性采用卡方检验及独立样本t检验。采用受试者工作特征曲线(receiver operator characteristic curve, ROC)评价ADC值(ADCmean、ADCmin、rADCmean、rADCmin)对胶质瘤基因型的诊断性能。利用统计软件获得ROC曲线下面积(AUC),AUC值越接近1提示诊断效能越好,并分别计算敏感度、特异性等;采用Medcalc统计软件分析ADC参数值间诊断效能的差异性。P < 0.05为差异有统计学意义。
2 结果
IDH-1突变组ADCmean、ADCmin、rADCmean、rADCmin值均显著高于IDH-1野生组(P < 0.05),而1p19q共缺失与非共缺失间的ADC值差异无统计学意义(P > 0.05),见表 1。
表 1 ADC值与IDH-1/1p19q基因型间的相关性Table 1 Correlation between ADC values and IDH-1/1p19q genotype of glioma
ROC曲线:ADCmean、ADCmin、rADCmean和rADCmin诊断胶质瘤IDH-1基因型的阈值及其敏感度、特异性、PPV、NPV及AUC见表 2、图 2,其中rADCmin诊断胶质瘤IDH-1基因型的效能最高。Medcalc软件分析显示ADCmean、ADCmin、rADCmean、rADCmin在诊断胶质瘤IDH-1基因型效能方面各组间比较差异无统计学意义(P > 0.05),见表 3。
表 2 ADC值对胶质瘤IDH-1-mut和IDH-1-wt的诊断效能Table 2 Diagnostic efficacy of ADC values in IDH-1-mut and IDH-1-wt gliomas 表 3 ADC参数值对胶质瘤IDH-1基因型诊断效能的组间差异性Table 3 Differences between diagnostic efficacy of DWI-ADC values in IDH-1 genotype of glioma
表 3 ADC参数值对胶质瘤IDH-1基因型诊断效能的组间差异性Table 3 Differences between diagnostic efficacy of DWI-ADC values in IDH-1 genotype of glioma
3 讨论
最大程度地安全切除并辅以放疗、化疗为主的综合治疗是脑胶质瘤的标准治疗策略,而脑胶质瘤的WHO分级、分子分型影响其治疗决策和预后[5]。WHOⅠ、Ⅱ级为低级别胶质瘤(low-grade glioma, LGG),Ⅲ、Ⅳ级为高级别胶质瘤(high-grade glioma, HGG)。HGG具有高度侵袭性,中位生存期仅14.6个月,而LGG中位生存期可达13.0年[6]。少突胶质细胞瘤占所有原发性中枢神经系统肿瘤的2%~5%、占胶质细胞瘤的5%~20%[7],其预后相对较好,WHOⅡ级少突胶质细胞瘤、少突星形胶质瘤的5年生存率分别为84%和68%,而Ⅲ级少突胶质细胞瘤、星形细胞瘤的5年生存率仅为66%和32%[8]。
IDH是细胞能量代谢过程中的重要限速酶,参与细胞代谢、表观遗传调节、氧化还原和DNA损伤修复,可分为IDH-1、IDH-2和IDH-3三个亚型。IDH突变可改变IDH酶的活性,导致胶质瘤细胞代谢和微观结构发生一系列改变,从而影响胶质瘤的治疗疗效和预后。IDH-1主要分布于细胞质和过氧化物酶体,而IDH-2主要分布于线粒体[9];IDH-1突变型HGG的预后显著好于IDH野生型,中位生存期分别为24个月和10个月[10]。WHOⅡ级少突胶质细胞瘤lp/19q共缺失阳性率高达80%~90%,而WHOⅢ级阳性率为50%~70%,且1p19q共缺失型胶质瘤对烷化剂等化疗药物敏感[11]。此外,IDH-1突变型和1p19q共缺失型Ⅱ级弥漫型胶质瘤预后好于IDH-1野生型,且IDH-1突变型和1p19q共缺失型少突胶质细胞瘤患者较IDH-1突变型和1p19q未缺失/单缺失型预后更好[2]。另外,研究[12-13]表明ADC值在预测脑胶质瘤基因型及预后方面具有重要的临床价值。因此,探讨预测Ⅱ /Ⅲ级胶质瘤IDH/1p19q基因型的常规DWI技术,有助于术前无创性评估胶质瘤IDH/1p19q基因型,进而辅助临床制定有效的治疗方案。
WHOⅡ级弥漫型胶质瘤DWI与基因型间的相关性研究[2]证实低ADC值与IDH野生型独立相关,且IDH野生型胶质瘤伴低ADCmin时临床预后更差,提示IDH突变状况联合ADC值可以更准确预测Ⅱ级弥漫型胶质瘤的临床预后。标准临床DWI序列可评价胶质瘤IDH基因型和临床预后,如IDH野生型胶质瘤的rADCmean显著低于IDH突变型,且不论WHO分级,低rADCmean(< 1.08)的IDH突变型和野生型胶质瘤的预后显著差于高rADCmean(> 1.08)的IDH突变型和野生型,而低rADCmean的IDH突变型与野生型胶质瘤间的mOS无差异[3]。另有研究[4]显示基于标准临床DWI序列,肿瘤平均ADC值/正常脑白质ADC值联合形态学特征、年龄能够准确预测Ⅱ/Ⅲ级胶质瘤的IDH突变状况。鉴于胶质瘤的异质性,肿瘤局部ADC值预测IDH突变状况可能有一定的局限性。研究[13]证实肿瘤区域标准化ADCmean在预测Ⅱ ~Ⅲ级实性胶质瘤IDH突变状况方面不劣于容积标准化ADCmean,但就非实性胶质瘤而言,容积ADC值优于区域ADC值。因此,临床实践中ADC值测量中ROI的选择至关重要,可能影响ADC值预测胶质瘤基因型的准确性。
Park等[14]证实IDH-1突变/1p/19q共缺失Ⅱ级胶质瘤较IDH-1突变/1p/19q非共缺失胶质瘤呈现出高-中ADC混杂模式,说明ADC值可以预测IDH-1突变低级别胶质瘤的1p/19q基因型。目前,有关ADC值在预测胶质瘤1p/19q基因型方面的价值存在争议[14-16]。本研究显示1p19q共缺失型与1p19q单缺失或不缺失型胶质瘤的ADC值间差异无统计学意义,分析原因可能与肿瘤区水肿、新生血管生成及ADC值测量的兴趣区选择、肿瘤异质性等因素相关,该假设有待于临床研究证实。此外,本研究提示ADC值可以鉴别IDH-1突变型和IDH-1野生型胶质瘤,与文献[2, 13, 16]报道一致。
近年来,ADC直方图分析和MR影像组学在胶质瘤基因型预测中的研究倍受关注,其能够较全面反映胶质瘤的异质性。刘丹等[17]探讨了Ⅱ/Ⅲ级弥漫性胶质瘤的ADC直方图特征,结果显示IDH突变型胶质瘤ADC(75%、90%、95%,Max、范围、标准差及不均一性)显著低于IDH野生型,而IDH突变型胶质瘤ADCmin和峰度显著高于IDH野生型;IDH突变/1p19q未缺失型胶质瘤ADC(Mean,5%、10%、25%、50%、75%,众数)显著高于IDH突变/1p19q缺失型。此外,ADC不均一性鉴别IDH突变型和IDH野生型胶质瘤的效能最高,而众数鉴别IDH突变/1p19q未缺失型和IDH突变/1p19q缺失型胶质瘤的效能最高。同样,亦有研究[15]证实低级别胶质瘤ADC值与IDH-1突变状态显著相关。另有学者评价了ADC直方图图像分割方式对Ⅱ/Ⅲ级弥漫型胶质瘤基因型分类的影响,结果表明ADC直方图有助于分类IDH野生型和突变型胶质瘤,尤其去除囊变/坏死时更有助于评价肿瘤异质性和分类IDH野生型胶质瘤,然而在预测1p19q基因型方面价值有限[16]。多序列MRI整合影像组学能够预测胶质瘤IDH和1p/19q状况,如基于T1WI增强和ADC的影像组学预测IDH突变型胶质瘤的效能最佳,而T1WI增强影像组学预测1p/19q共缺失型胶质瘤的效能最佳[18]。
本研究的主要局限性在于仅探讨了肿瘤局部,如胶质瘤最大层面的ADC值与IDH-1/1p19q基因型间的相关性。鉴于胶质瘤的异质性,肿瘤局部DWI(ADC值)特征可能并不能反映肿瘤整体弥散特征,进而影响ADC值预测胶质瘤基因型的价值。此外,本研究纳入的样本量较小亦可能影响结论的客观性。综上所述,常规临床DWI技术(ADC值)一定程度上可以预测WHOⅡ /Ⅲ级胶质瘤的IDH-1/1p19q突变状况,尽管ADC直方图分析、MR多模态影像组学可能更能有效预测IDH-1/1p19q基因型,然而ADC值不失为预测IDH- 1/1p19q基因型和预后的实用影像学生物标志物,值得临床推广。
作者贡献段丽群:论文撰写;毕建平、黎艳萍:病例资料收集;张用:文献资料收集;王明伟:病理资料收集;孙文佳:免疫组织化学补充;胡德胜:论文指导;皮国良:论文修改 -
-
[1] Ota T, Hasegawa Y, Okimura A, et al. Breast metastasis from EGFR-mutated lung adenocarcinoma:A case report and review of the literature[J]. Clin Case Rep, 2018, 6(8):1510-16. doi: 10.1002/ccr3.2018.6.issue-8
[2] Ali RH, Taraboanta C, Mohammad T, et al. Metastatic non-small cell lung carcinoma a mimic of primary breast carcinoma-case series and literature review[J]. Virchows Arch, 2018, 472(5):771-77. doi: 10.1007/s00428-017-2262-4
[3] Troxell ML. Merkel cell carcinoma, melanoma, metastatic mimics of breast cancer[J]. Semin Diagn Pathol, 2017, 34(5):479-95. doi: 10.1053/j.semdp.2017.05.009
[4] Lee SK, Kim WW, Kim SH, et al. Characteristics of metastasis in the breast from extramammary malignancies[J]. J Surg Oncol, 2010, 101(2):137-40. doi: 10.1002/jso.v101:2
[5] Shen YM, Sui YX, Zhang XM, et al. Ipsilateral breast metastasis from a pulmonary adenocarcinoma:a case report and a focused review of the literature[J]. Int J Clin Exp Pathol, 2015, 8(8):9647-54.
[6] Mirrielees JA, Kapur JH, Szalkucki LM, et al. Metastasis of primary lung carcinoma to the breast:a systematic review of the literature[J]. J Surg Res, 2014, 188(2):419-31. doi: 10.1016/j.jss.2014.01.024
[7] DeLair DF, Corben AD, Catalano JP, et al. Non-mammary metastases to the breast and axilla:a study of 85 cases[J]. Mod Pathol, 2013, 26(3):343-9. doi: 10.1038/modpathol.2012.191
[8] Ninan J, Naik V, George GM. 'Inflammatory breast cancer' due to metastatic adenocarcinoma of lung[J]. BMJ Case Rep, 2016, pii:bcr2016215857. doi: 10.1136/bcr-2016-215857
[9] Vitkovski T, Chaudhary S, Sison C, et al. Aberrant Expression of Napsin A in Breast Carcinoma With Apocrine Features[J]. Int J Surg Pathol, 2016, 24(5):377-81. doi: 10.1177/1066896916629781
[10] Planchard D, Popat S, Kerr K, et al. Metastatic non-small cell lung cancer:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Onco, 2018, 29(Supplement_4):iv192-237. doi: 10.1093/annonc/mdy275




 下载:
下载: