Application of 68Ga-PSMA-617 Molecular Probe for Micro-PET Imaging of Gliomas Model
-
摘要:目的
探讨68Ga-PSMA-617在神经胶质瘤U87MG荷瘤鼠的显像情况。
方法将靶向前列腺特异性膜抗原(prostate specific membrane antigen, PSMA)的新型探针DKFZ-PSMA-617进行68Ga核素标记,利用Radio-TLC对68Ga-PSMA-617的放射化学纯度进行快速质控,然后进行细胞水平实验,尾静脉注射5和40 min后对U87MG荷瘤鼠进行micro-PET显像,同时对PSMA阻滞剂ZJ-43(25 mg/kg)共注射组进行注射后40 min的图像采集。
结果Radio-TLC对68Ga-PSMA-617的标记率及放化纯测定可在10 min内完成,放化纯高达(99.0±1.9)%,细胞水平实验显示68Ga-PSMA-617分子探针的特异性,同时也显示U87MG细胞表面仅有较少量PSMA表达,而U87MG荷瘤鼠的micro-PET显像可见随时间延长肿瘤对PSMA靶向分子探针的放射性摄取的逐渐增高,靶与非靶比值从1.85±0.02(5 min)增长至3.62±0.175(40 min),且肿瘤对该探针的摄取可被PSMA阻滞剂ZJ-43所抑制。
结论68Ga-PSMA-617不仅可应用于前列腺癌的诊断,也有望应用于新生血管丰富的神经胶质瘤的诊断。
Abstract:ObjectiveTo investigate the application of 68Ga-PSMA-617 molecular probe for micro-PET imaging of gliomas tumor model.
MethodsDKFZ-PSMA-617, an effective prostate specific membrane antigen (PSMA) targeted probes, was chosen to be the precursor to be radiolabelled with 68Ga. The radio-chemical yield of 68Ga-PSMA-617 was analyzed by Radio-TLC. Cell uptake experiments were performed on PSMA (+) LNCaP, PSMA (-) PC-3 and U87MG cells. Nude mice bearing U87MG were injected with 68Ga-PSMA-617(7.4 MBq) via the tail vein. Micro-PET imaging was performed 5 and 40 min after the injection. Blocking studies were also performed in U87MG tumor-bearing mice after 40 min of co-injection of 68Ga-PSMA-617 with the PSMA inhibitor (S)-2-(3-((S)-1-carboxy-3-methylbutyl)ureido) pentanedioic acid (ZJ-43) (25 mg/kg).
ResultsThe radiotracer had a good radio-chemical yield of (99.0±1.9)% quickly tested by Radio-TLC. In cell uptake experiments, the specificity of 68Ga-PSMA-617 was confirmed in PSMA (+) LNCaP cells and PSMA (-) PC-3 cells; meanwhile, it proved the low expression level of PSMA in gliomas U87MG cell line. From micro-PET imaging, U87MG xenografts tumors were visualized and it showed good tumor-to-background value from 1.85±0.02 (5 min) to 3.62±0.175 (40 min) which could be blocked by ZJ-43.
Conclusion68Ga-PSMA-617 has the potential to be used not only in prostate cancer but also in gliomas tumor model.
-
Key words:
- Prostate specific membrane antigen /
- Neo-vasculature /
- PET /
- Glioma /
- Gallium-68
-
0 引言
神经胶质瘤为颅内最常见的恶性肿瘤之一,占全部颅内肿瘤的40%~50%[1],但由于病变并无明显特异性改变,诊断的特异性较低[2]。核医学分子探针显像可在分子学水平对疾病进行诊断,可在一定程度提高病变诊断的准确性,而目前常用的糖代谢显像剂18F-FDG作为糖代谢显像剂在正常脑组织也有大量积聚,影响神经胶质瘤病灶的诊断[3-4],迫切需要靶向特异性的分子探针对肿瘤进行诊断和分期。因此分子探针靶向结合至新生血管的高表达抗体即可对肿瘤进行定位和诊断,而前列腺特异性膜抗原(prostate specific membrane antigen, PSMA)即为该种抗体。
PSMA不仅高特异性表达于前列腺癌细胞膜表面[5-7],在肿瘤的新生血管内皮细胞中也有较高程度表达[8-12],对神经胶质瘤患者的病灶进行组织学水平研究,证实PSMA在神经胶质瘤肿瘤新生血管中的表达[13]。因此PSMA靶向分子探针除可对前列腺癌进行显像外,还可对新生血管丰富的实体瘤进行放射性显像从而对病灶进行诊断及准确定位。
新型PSMA抑制剂DKFZ-PSMA-617与PSMA的亲和力较高,且体内清除较快,因此本研究选择该新型PSMA靶向抑制剂DKFZ-PSMA-617[14]进行正电子核素标记以制备核医学分子探针,目前68Ga[15]、177Lu[16-18]、225Ac[19]标记该抑制剂已应用于前列腺癌的临床前研究,此外,64Cu标记化合物也有报道[20]。考虑到正电子核素68Ga可由锗镓发生器制备,且核素性质较好,因此本研究在前期工作基础上[21],对DKFZ-PSMA-617进行正电子核素68Ga标记,并对细胞水平的放射性摄取及神经胶质瘤U87MG荷瘤鼠显像进行研究,从而对68Ga-PSMA-617应用于神经胶质瘤的临床诊断提供一定程度的指导。
1 材料与方法
1.1 试剂与仪器
DKFZ-PSMA-617(ABX,德国),乙醇(北京化学试剂有限公司,中国),三氟乙酸、醋酸钠(中国国药集团有限公司,中国),乙腈(Merck,美国),DMEM培养基、RPMI 1640培养基和FBS(Gibco,美国),胰蛋白酶-EDTA消化液(北京索莱宝科技有限公司,中国),0.9%氯化钠溶液(北京原子高科股份有限公司,中国),所有试剂均为分析纯级别。BALB/c裸鼠(6周,雌性,北京华阜康生物科技股份有限公司,中国),U87MG细胞株(北京协和细胞库,中国),异氟烷(河北一品制药股份有限公司,中国),ZJ-43(Tocris Bioscience,英国)。
锗镓发生器(加兴同位素技术有限公司,德国),10、200、1 000 µl移液枪(Eppendorf,德国),C-18柱(Waters公司,德国),高效液相色谱仪(HPLC,1200系列,安捷伦公司,美国),放射性薄层色谱扫描仪(Radio-TLC,Biosan-AR2000,默克公司,德国),Hypersil BDS C-18反向色谱柱(5 µm,250.0 mm×4.6 mm,株式会社YMC,日本),全自动伽玛计数仪(多探头,Wizard2,美国),放射性测量活度计(Capintec,美国),小动物PET/CT(Sedecal,西班牙),Matrx VIP 3000麻醉系统(Mismark,美国)。
1.2 实验方法
1.2.1 68Ga-PSMA-617的制备及纯化
取10 µl浓度为2 mg/ml的DKFZ-PSMA-617于EP管中,加入65 µl 0.05 mol/L NaAc,备用。取2 ml 0.1 mol/L HCl于2 ml注射器中,缓慢推注至锗镓发生器,获得68Ga淋洗液,移液枪准确量取1 000 µl移至EP管中,置于孵育器中于95℃条件下反应10 min。反应结束后待体系温度降至室温,2 ml注射器取出反应产物,加至已活化的C-18柱,再用3 ml H2O冲洗,取0.5 ml 80%乙醇淋洗获得纯化后的标记产物68Ga-PSMA-617。
1.2.2 68Ga-PSMA-617标记化合物的验证
与上述反应及纯化过程相同,将冷镓化合物GaCl3与相同量的前体反应,冷标记化合物标记完成后即刻进行MALDI-TOF-MS(基质辅助激光解吸电离飞行时间质谱法)分析,验证标记化合物在对应分子量处是否出现。
此外,将标记前体与放射性标记产物共进样行HPLC分析,进样量为99 µl,柱温为25℃,观察280 nm紫外峰保留时间与放射峰保留时间是否一致。
1.2.3 68Ga-PSMA-617 radio-TLC快速分析
纯化前后分别取3 µl反应产物滴至滤纸(宽度为1 cm)下端1 cm处,置于展开体系(甲醇:醋酸铵=1:1)中,待产物展开至距下端10 cm处时取出晾干,进行快速薄层扫描分析。
1.2.4 细胞水平实验
选择PSMA高表达的前列腺癌LNCaP细胞、PSMA低表达的前列腺癌PC-3细胞作为对照,以研究U87MG细胞对PSMA靶向分子探针是否有摄取,从而判断该细胞有无PSMA高表达。将处于对数生长期的LNCaP、PC-3以及U87MG细胞进行胰酶消化,收集细胞后进行细胞计数,取2×105~1×106细胞加至24孔板中并于37℃、4%CO2培养箱中孵育24~48 h,之后进行标记化合物68Ga-PSMA-617在LNCaP、PC-3以及U87MG细胞株中的细胞摄取实验。实验前2 h将含FBS的培养液更换为不含FBS的RPMI 1640和DMEM培养液,阻滞组加入每孔1 mg PSMA抑制剂ZJ-43以评价分子探针68Ga-PSMA-617的PSMA靶向特异性。在24孔板的每孔中加入37 kBq(1 µCi)68Ga-PSMA-617后置于CO2培养箱分别孵育5、30、90、120 min,便用冷PBS(0.5 ml×2次)冲洗以结束摄取进程,后消化细胞并收集至γ-counter管中进行放射性计数测定。同时取0.37 kBq(0.01 µCi)68Ga-PSMA-617作为参考进行放射性计数测定,用Prism 6.0软件进行数据分析。使用独立样本t检验对计量资料间有无统计学差异进行分析。
1.2.5 小动物显像
取肿瘤直径为1 cm的U87MG荷瘤鼠进行68Ga-PSMA-617显像分析。将标记产物吹干后溶解于0.9%氯化钠溶液中并进行放射性活度测定,取7.4 MBq(200 µCi)68Ga-PSMA-617进行荷瘤鼠尾静脉注射,进行异氟烷气体麻醉,注射后5 min和40 min进行micro-PET显像,对共注射7.4 MBq 68Ga-PSMA-617和PSMA阻滞剂ZJ-43(25 mg/Kg)的荷瘤鼠同样在40 min时进行micro-PET/CT融合显像,与仅注射68Ga-PSMA-617显像结果进行对比。首先进行PET图像采集,时间为10 min,然后在电压45 keV,电流300 mA条件下进行15 s CT图像采集,图像采集过程中以小流量异氟烷持续麻醉。图像重建后在MMWS软件中进行图像分析并进行图像保存,此外,对肿瘤及肌肉部位勾画ROI进行半定量分析。
2 结果
2.1 68Ga-PSMA-617的制备、纯化及radio-TLC快速分析
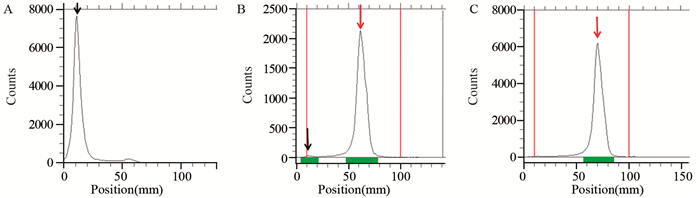
整个标记及纯化过程可在15 min内完成,纯化前后经radio-TLC点样可对产物进行快速分析,可见标记化合物68Ga-PSMA-617的标记率可达(98.2±0.7)%,纯化后放射化学纯度在(99.0±1.9)%(n=4),见图 1。整个制备过程较短,且可对产物进行快速的检测分析,与HPLC分析相比可大幅缩减分析所耗时长。
![]() 图 1 68GaCl3以及68Ga-PSMA-617标记产物纯化前后的radio-TLC分析Figure 1 Radio-TLC analysis of 68GaCl3 and 68Ga-PSMA-617 before and after purificationThe black arrow showed the distance of 68Ga3+ peak position to the point; The red arrow represented the 68Ga-PSMA-617 peak position; A: 68GaCl3; B: 68Ga-PSMA-617 before purification (98.85%); C: 68Ga-PSMA-617 after purification(99.99%)
图 1 68GaCl3以及68Ga-PSMA-617标记产物纯化前后的radio-TLC分析Figure 1 Radio-TLC analysis of 68GaCl3 and 68Ga-PSMA-617 before and after purificationThe black arrow showed the distance of 68Ga3+ peak position to the point; The red arrow represented the 68Ga-PSMA-617 peak position; A: 68GaCl3; B: 68Ga-PSMA-617 before purification (98.85%); C: 68Ga-PSMA-617 after purification(99.99%)2.2 68Ga-PSMA-617标记化合物的验证
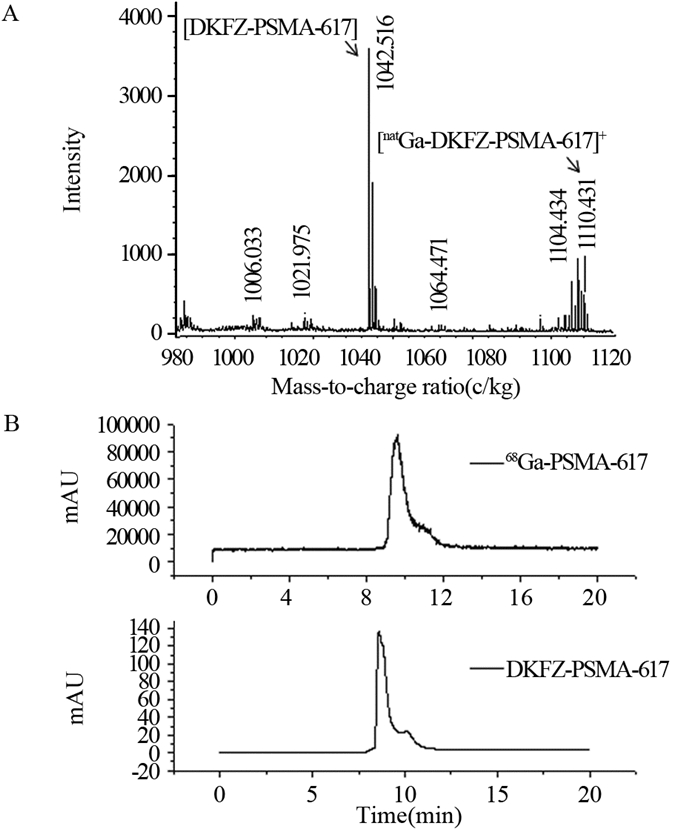
将冷镓标记化合物进行MALDI-TOF-MS分析,在对应分子质量处可见标记化合物,证实镓与前体的良好结合,见图 2A。此外,将前体DKFZ-PSMA-617与放射性标记产物共进样进行HPLC分析,可见放射性出峰时间(t=9.647)与前体的紫外出峰时间(t=8.598)的一致性,证实68Ga与前体DKFZ-PSMA-617的结合,见图 2B。
![]() 图 2 natGa-PSMA-617的质谱分析及68Ga-PSMA-617的HPLC分析Figure 2 MALDI-TOF-MS analysis of natGa-PSMA-617 and HPLC analysis of 68Ga-PSMA-617 compoundA: MALDI-TOF-MS analysis of natGa labeled DKFZ-PSMA-617. The arrows in the figure represented DKFZ-PSMA-617 and natGa-PSMA-617; B: HPLC analysis of precursor DKFZ-PSMA-617 (UV retention time was 8.598) and 68Ga-PSMA-617(radioactivity retention time was 9.647)
图 2 natGa-PSMA-617的质谱分析及68Ga-PSMA-617的HPLC分析Figure 2 MALDI-TOF-MS analysis of natGa-PSMA-617 and HPLC analysis of 68Ga-PSMA-617 compoundA: MALDI-TOF-MS analysis of natGa labeled DKFZ-PSMA-617. The arrows in the figure represented DKFZ-PSMA-617 and natGa-PSMA-617; B: HPLC analysis of precursor DKFZ-PSMA-617 (UV retention time was 8.598) and 68Ga-PSMA-617(radioactivity retention time was 9.647)2.3 68Ga-PSMA-617在细胞水平的摄取
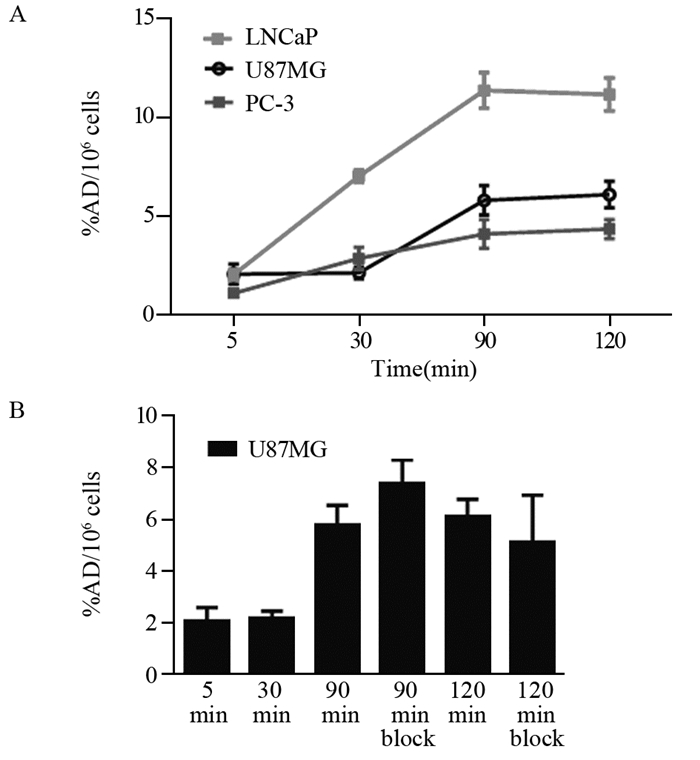
细胞孵育5、30、90、120 min后细胞裂解液经全自动伽马计数仪测定,LNCaP、U87MG和PC-3细胞随时间延长68Ga-PSMA-617的放射性摄取逐渐增高,而且细胞膜表面有PSMA阳性表达的LNCaP细胞对68Ga-PSMA-617放射性摄取明显高于细胞表面PSMA表达程度较低的PC-3和U87MG细胞(P=7.71×10-6, 8.05×10-5),见图 3A。结果表明U87MG细胞表面PSMA表达程度较低,而且U87MG细胞对68Ga-PSMA-617的摄取并不能被PSMA抑制剂ZJ-43所抑制,1.5 h和2 h两个时间点的阻滞组与非阻滞组之间差异均无统计学意义(P= 0.60, 0.51),见图 3B,进一步证实了U87MG细胞对分子探针的非特异性摄取,即U87MG细胞膜表面并无PSMA大量表达。
![]() 图 3 68Ga-PSMA-617在LNCaP、PC-3和U87MG的细胞摄取分析(n=4)Figure 3 Cell uptake of 68Ga-PSMA-617 in LNCaP, PC-3 and U87MG cell lines (n=4)A: cell uptake of prostate cancer cells PSMA(+) LNCaP, PSMA(-) PC-3 cells and neuroendocrine tumor U87MG cells after 5, 30, 90, 120 min of incubation; B: cell uptake of U87MG cells after 5, 30, 90, 120 min of incubation, and cell uptake data of PSMA inhibitor ZJ-43 block groups after 90 min and 120 min of incubation
图 3 68Ga-PSMA-617在LNCaP、PC-3和U87MG的细胞摄取分析(n=4)Figure 3 Cell uptake of 68Ga-PSMA-617 in LNCaP, PC-3 and U87MG cell lines (n=4)A: cell uptake of prostate cancer cells PSMA(+) LNCaP, PSMA(-) PC-3 cells and neuroendocrine tumor U87MG cells after 5, 30, 90, 120 min of incubation; B: cell uptake of U87MG cells after 5, 30, 90, 120 min of incubation, and cell uptake data of PSMA inhibitor ZJ-43 block groups after 90 min and 120 min of incubation2.4 68Ga-PSMA-617在神经胶质瘤U87MG荷瘤鼠的micro-PET显像
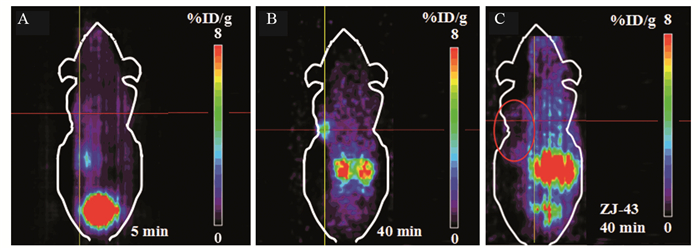
对U87MG荷瘤鼠进行micro-PET/CT显像,尾静脉注射后在5、40 min进行放射性计数采集,5 min时肿瘤部位并无明显放射性摄取,至40 min显像时腋下异种移植瘤的放射性摄取明显增加,T/M值由1.85±0.02增至3.62±0.17(n=4),见图 4。
![]() 图 4 68Ga-PSMA-617在U87MG的micro-PET显像Figure 4 Micro-PET images of 68Ga-PSMA-617 in U87MG bearing miceA, B: the PET images of U87MG mice were obtained 5 min and 40 min after tail injection of 7.4 MBq 68Ga-PSMA-617; C: PET imaging of U87MG mice was obtained 40 min after co-injection of PSMA inhibitor ZJ-43 and 68Ga-PSMA-617. The cross showed the center of tumor in A and B, and the margin of the tumor in C; the circle in C showed the whole tumor outline
图 4 68Ga-PSMA-617在U87MG的micro-PET显像Figure 4 Micro-PET images of 68Ga-PSMA-617 in U87MG bearing miceA, B: the PET images of U87MG mice were obtained 5 min and 40 min after tail injection of 7.4 MBq 68Ga-PSMA-617; C: PET imaging of U87MG mice was obtained 40 min after co-injection of PSMA inhibitor ZJ-43 and 68Ga-PSMA-617. The cross showed the center of tumor in A and B, and the margin of the tumor in C; the circle in C showed the whole tumor outline40 min时对PSMA阻滞剂共注射组进行显像,见肿瘤部位的摄取与未注射ZJ-43荷瘤鼠相比明显降低,见图 4B、C,证实了肿瘤部位对68Ga-PSMA-617的特异性摄取。将PET与CT图像融合可见肿瘤部位与放射性高摄取部位的重合,进一步证实放射性在肿瘤部位的摄取,见图 5。
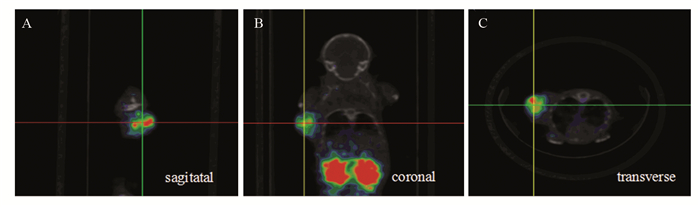
![]() 图 5 利用micro-PET/CT对U87MG荷瘤鼠的68Ga-PSMA-617分布进行融合显像(40 min)Figure 5 micro-PET/CT images of 68Ga-PSMA-617 in U87MG bearing mice obtained 40 min after injectionThe cross showed the tumor position. The PET and CT fusion imaging of U87MG mice were obtained 40 min after 68Ga-PSMA-617 injection; A: the sagittal plane; B: the coronal plane; C: the transverse plane
图 5 利用micro-PET/CT对U87MG荷瘤鼠的68Ga-PSMA-617分布进行融合显像(40 min)Figure 5 micro-PET/CT images of 68Ga-PSMA-617 in U87MG bearing mice obtained 40 min after injectionThe cross showed the tumor position. The PET and CT fusion imaging of U87MG mice were obtained 40 min after 68Ga-PSMA-617 injection; A: the sagittal plane; B: the coronal plane; C: the transverse plane3 讨论
PSMA作为当前较广泛应用于前列腺癌靶向诊断的特异性抗原位点,并非仅在前列腺癌细胞膜表面呈较高程度表达,在肿瘤新生血管内皮细胞也有较高程度的表达,因此有望成为新生血管丰富肿瘤诊断的特异性位点。目前已有用PSMA靶向分子探针对肾透明细胞癌[11]、乳腺癌[12]患者进行诊断的病例报道及大样本分析,初步表明PSMA靶向分子探针应用于非前列腺癌的肿瘤领域的价值。
神经胶质瘤作为新生血管较丰富的肿瘤之一,其发生发展与新生血管密切相关[13],美国食品药品监督局(FDA)于2009年5月批准贝伐单抗应用于复发型恶性胶质瘤患者的单药治疗,正是由于该单抗可选择性抑制新生血管生成。Nomura等[13]报道的19例神经胶质瘤患者病灶活检的免疫组织化学检测结果,证实PSMA在神经胶质瘤的肿瘤新生血管中表达,且在较高分化肿瘤中其表达程度更高。因此本研究对PSMA靶向分子探针进行放射性核素标记后,对神经胶质瘤肿瘤模型进行动物学水平研究,为PSMA靶向分子探针在神经胶质瘤的诊断提供更多临床前依据。
目前靶向PSMA的抑制剂主要包含单抗、单抗片段、小分子物质等,其中小分子物质与单抗相比体内清除较快,因此本底放射性水平较低,而且较易制得,展现出分子探针应用的优势,小分子物质中的新型PSMA抑制剂DKFZ-PSMA-617体内清除速率较快,显像中靶与非靶比值较高,因此本研究选取DKFZ-PSMA-617进行68Ga核素标记,对神经胶质瘤U87MG荷瘤鼠模型进行显像,可见PSMA靶向分子探针在肿瘤部位的显像与定位。
通过细胞水平的PSMA阳性表达细胞与阴性表达细胞对放射性分子探针的摄取研究,表明PSMA靶向分子探针68Ga-PSMA-617的靶向特异性。对U87MG荷瘤鼠进行68Ga-PSMA-617显像研究发现,随着时间的延长,肿瘤部位放射性摄取逐渐增高。而且,ZJ-43共注射组与未共同注射ZJ-43组相比,异种移植瘤部位的放射性摄取明显降低,证实了肿瘤部位对PSMA靶向分子探针摄取的特异性,同时进一步证实肿瘤部位PSMA的高表达。
为增强诊断的准确性,同时对荷瘤鼠进行了CT图像采集,获得micro-PET/CT融合图像,更清晰地显示肿瘤部位,进一步证实PSMA靶向分子探针在肿瘤部位的高摄取。
通过细胞及动物水平研究,本研究初步证实68Ga-PSMA-617应用于PSMA阳性表达的肿瘤新生血管部位的诊断的可能性,有望为新生血管丰富的神经胶质瘤的显像提供临床前依据。本研究的不足之处在于未进行神经胶质瘤PSMA表达部位与新生血管部位一致性的免疫组织化学水平研究,此外,未进行多种神经胶质瘤细胞的研究,从而判断PSMA靶向分子探针在各种神经胶质瘤诊断应用中的价值,本研究小组会在后续工作中进一步研究。
-
-
[1] Okada H, Scheurer ME, Sarkar SN, et al. Integration of epidemiology, immunobiology, and translational research for brain tumors[J]. Ann N Y Acad Sci, 2013, 1284: 17-23. doi: 10.1111/nyas.2013.1284.issue-1
[2] Santra A, Kumar R, Sharma P, et al. F-18 FDG PET-CT in patients with recurrent glioma: comparison with contrast enhanced MRI[J]. Eur J Radiol, 2012, 81(3): 508-13. doi: 10.1016/j.ejrad.2011.01.080
[3] Herholz K. Brain tumors: an update on clinical pet research in gliomas[J]. Semin Nucl Med, 2017, 47(1): 5-17. doi: 10.1053/j.semnuclmed.2016.09.004
[4] Singhal T, Narayanan TK, Jain V, et al. 11C-L-methionine positron emission tomography in the clinical management of cerebral gliomas[J]. Mol Imaging Biol, 2008, 10(1): 1-18. http://cn.bing.com/academic/profile?id=9849b3fd1d7122f966590d36b37660e3&encoded=0&v=paper_preview&mkt=zh-cn
[5] Ristau BT, O'Keefe DS, Bacich DJ. The prostate-specific membrane antigen: lessons and current clinical implications from 20 years of research[J]. Urol Oncol, 2014, 32(3): 272-9. doi: 10.1016/j.urolonc.2013.09.003
[6] Santoni M, Scarpelli M, Mazzucchelli R, et al. Targeting prostate-specific membrane antigen for personalized therapies in prostate cancer: morphologic and molecular backgrounds and future promises[J]. J Biol Regul Homeost Agents, 2014, 28(4): 555-63. http://cn.bing.com/academic/profile?id=aaa3f1734561cd3f234175af4893e0f8&encoded=0&v=paper_preview&mkt=zh-cn
[7] Haberkorn U, Eder M, Kopka K, et al. New strategies in prostate cancer: prostate-specific membrane antigen (PSMA) ligands for diagnosis and therapy[J]. Clin Cancer Res, 2016, 22(1): 9-15. doi: 10.1158/1078-0432.CCR-15-0820
[8] Kiess AP, Banerjee SR, Mease RC, et al. Prostate-specific membrane antigen as a target for cancer imaging and therapy[J]. Q J Nucl Med Mol Imaging, 2015, 59(3): 241-68. http://cn.bing.com/academic/profile?id=7e6831a15f1359f599238fc1abe0cb5f&encoded=0&v=paper_preview&mkt=zh-cn
[9] Sathekge M, Modiselle M, Vorster M, et al. 68Ga-PSMA imaging of metastatic breast cancer[J]. Eur J Nucl Med Mol Imaging, 2015, 42(9): 1482-3. doi: 10.1007/s00259-015-3066-x
[10] Pandit-Taskar N, O'Donoghue JA, Divgi CR, et al. Indium 111-labeled J591 anti-PSMA antibody for vascular targeted imaging in progressive solid tumors[J]. EJNMMI Res, 2015, 5: 28. doi: 10.1186/s13550-015-0104-4
[11] Sawicki LM, Buchbender C, Boos J, et al. Diagnostic potential of PET/CT using a Ga-labelled prostate-specific membrane antigen ligand in whole-body staging of renal cell carcinoma: initial experience[J]. Eur J Nucl Med Mol Imaging, 2017, 44(1): 102-7. doi: 10.1007/s00259-016-3360-2
[12] Wernicke AG, Varma S, Greenwood EA, et al. Prostate-specific membrane antigen expression in tumor-associated vasculature of breast cancers[J]. APMIS, 2014, 122(6): 482-9. doi: 10.1111/apm.2014.122.issue-6
[13] Nomura N, Pastorino S, Jiang P, et al. Prostate-specific membrane antigen (PSMA) expression in primary gliomas and breast cancer brain metastases[J]. Cancer Cell Int, 2014, 14(1): 26. doi: 10.1186/1475-2867-14-26
[14] Benešová M, Schäfer M, Bauder-Wüst U, et al. Preclinical evaluation of a tailor-made dota-conjugated psma inhibitor with optimized linker moiety for imaging and endoradiotherapy of prostate cancer[J]. J Nucl Med, 2015, 56(6): 914-20. doi: 10.2967/jnumed.114.147413
[15] Afshar-Oromieh A, Hetzheim H, Kratochwil C, et al. The theranostic PSMA ligand psma-617 in the diagnosis of prostate cancer by PET/CT: biodistribution in humans, radiation dosimetry, and first evaluation of tumor lesions[J]. J Nucl Med, 2015, 56(11): 1697-705. doi: 10.2967/jnumed.115.161299
[16] Rahbar K, Ahmadzadehfar H, Kratochwil C, et al. German multicenter study investigating 177Lu-PSMA-617 radioligand therapy in advanced prostate cancer patients[J]. J Nucl Med, 2017, 58(1): 85-90. doi: 10.2967/jnumed.116.183194
[17] Delker A, Fendler WP, Kratochwil C, et al. Dosimetry for (177)Lu-DKFZ-PSMA-617: a new radiopharmaceutical for the treatment of metastatic prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2016, 43(1): 42-51. doi: 10.1007/s00259-015-3174-7
[18] Kabasakal L, AbuQbeitah M, Aygün A, et al. Pre-therapeutic dosimetry of normal organs and tissues of (177)Lu-PSMA-617 prostate-specific membrane antigen (PSMA) inhibitor in patients with castration-resistant prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2015, 42(13): 1976-83. doi: 10.1007/s00259-015-3125-3
[19] Kratochwil C, Bruchertseifer F, Giesel FL, et al. 225Ac-PSMA-617 for PSMA targeting α-radiation therapy of metastatic castration-resistant prostate cancer[J]. J Nucl Med, 2016, 57(12): 1941-4. doi: 10.2967/jnumed.116.178673
[20] Grubmüller B, Baum RP, Capasso E, et al. 64Cu-PSMA-617 PET/CT imaging of prostate adenocarcinoma: first in-human studies[J]. Cancer Biother Radiopharm, 2016. [Epub ahead of print]
[21] Zhu H, Zhao C, Liu F, et al. Radiolabeling and evaluation of (64)Cu-DOTA-F56 peptide targeting vascular endothelial growth factor receptor 1 in the molecular imaging of gastric cancer[J]. Am J Cancer Res, 2015, 5(11): 3301-10.



 下载:
下载: