-
摘要:目的
探讨大气细颗粒物(particulate matter,PM)PM2.5致肺部病变机制。
方法采用实时PM2.5采集器进行PM2.5收集,Wistar大鼠饲养于PM2.5的全身暴露染毒系统,Wistar大鼠每日染毒4小时,共染毒9月,设立实验组及对照组;观察肺组织大体结构及HE染色观察;流式细胞术检测Wistar大鼠T细胞免疫功能、肺组织细胞凋亡、细胞周期及DNA指数;ELISA实验检测Wistar大鼠血清及肺灌洗液中CEA、CA125及SccAg表达水平。
结果实验组肺组织以支气管向外周辐射状颜色发暗、偏黑,多处可见白色斑点和泡状凸起,边缘不规则白色隆起;HE染色结果,实验组肺组织纤维化,肺实变严重,肺泡充血,见大量炎性反应增生;实验组CD4/CD8比值显著高于对照组(P < 0.05),血清及肺灌洗液中CA125的表达显著高于对照组(P < 0.05),实验组肺组织细胞凋亡率显著低于对照组,而DNA指数显著增高(均P < 0.05)。
结论长期接触PM2.5会造成肺组织出现不同程度结节,肺组织出现大范围炎性反应病变。
Abstract:ObjectiveTo investigate the mechanism of lung lesions caused by fine particulate matter PM2.5.
MethodsReal-time PM2.5 collector was used to collect PM2.5. Wistar rats were fed on the systemic exposure system of PM2.5. Wistar rats were exposed to 4 hours daily for 9 months. PM2.5 experimental group and control group were set up. General structure of lung tissue and HE staining result were observed. T cell immune function, lung cell apoptosis, cell cycle and DNA index in Wistar rats were detected by flow cytometry. The expression levels of CEA, CA125 and SccAg in serum and lung lavage fluid of Wistar rats were detected by ELISA.
ResultsLung tissues of experimental group were radiated from the periphery of the bronchus with dark, visible white spots and bubble like protrusions with irregular white ridges. HE staining results showed that lung tissues of experimental group were fibrotic, severe consolidation of lung, alveolar hyperemia and massive inflammaroty reactive hyperplasia. CD4/CD8 ratio in experimental group was significantly higher than that in control group(P < 0.05). The expression of CA125 in serum and lung lavage fluid was significantly higher than that in control group(P < 0.05). The apoptosis rate of lung tissues in experimental group was significantly lower than that in control group, but DNA index was significantly higher (P < 0.05).
ConclusionLong-term exposure to PM2.5 results in different degrees of nodules and a large range of inflammatory reaction in lung tissues.
-
Key words:
- Fine particulate matter /
- Smog /
- Pulmonary lesions /
- DNA index /
- Cell proliferation
-
0 引言
随着我国近年来工农业、交通运输业等大力发展以及煤炭石油等能源的大规模开发利用,造成环境污染问题日益严峻。雾霾是空气污染和气象因素共同作用的结果,雾霾天气,大气能见度下降,大气中颗粒物(particulate matter, PM)特别是细颗粒物(PM2.5)是导致能见度降低的主要因素[1]。PM粒径≤2.5 μm的称为细颗粒物,即PM2.5。因PM2.5粒径细小,相对表面积较大,在大气中停留时间较长,可吸附大量对身体有害的物质,并直接深入细支气管和肺泡形成沉积,对身体造成多种病变,多引起心血管及肺部病变等[2-4]。大量PM2.5在肺部沉积造成肺部不同病变,PM2.5上携带的多环芳烃和重金属成分等具有致细胞突变和致癌性[5]。本实验对石家庄市空气中PM2.5致Wistar大鼠肺部病变进行研究,探讨石家庄市空气中PM2.5是否具有致肺部癌变作用。
1 材料与方法
1.1 实验动物及分组
Wistar大鼠:购于河北省实验动物中心,生产许可证编号:SCXK(冀)2010-1-003;饲养于河北医科大学第四医院实验动物中心清洁环境,温度:22℃~24℃;湿度:30%~70%;换气次数:15次/小时。
动物分组:实验组:PM2.5采集器,按抽气量50 L/min,完全PM2.5富集量,理论PM2.5浓度为外部空气中PM2.5浓度的10倍;对照组:正常饲养,大鼠饲养于PM2.5 < 35 μg/m3的洁净环境中。染毒动物每日染毒4 h,一周染毒5次。每组Wistar大鼠20只,共染毒9月,其余时间与对照组饲养于同一环境中。每日观察大鼠饮食及饮水情况,每周测量大鼠体重。
1.2 主要试剂及仪器
PM2.5采集器及全身暴露染毒系统(北京慧荣和科技有限公司);FC500型流式细胞仪(美国Beckman Coulter公司);DNA染液(美国BD公司);大鼠癌胚抗原(CEA)、卵巢癌抗原(CA125)及鳞状细胞癌相关抗原(SccAg)均用ELISA试剂盒检测(北京冬歌生物公司)。
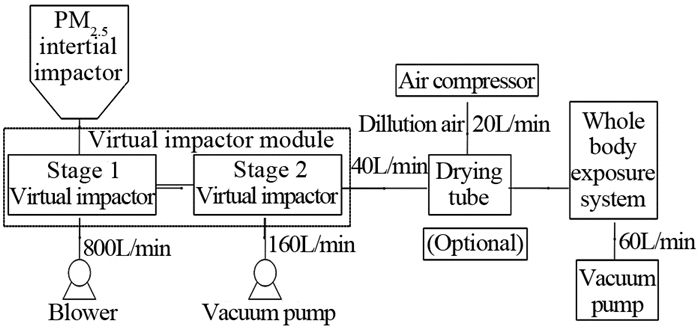
1.3 动物全身PM2.5暴露系统设备连接及气体流向,见图 1。
1.4 肺组织HE染色
将福尔马林固定的肺组织,常规石蜡包埋,4 μm切片后将组织切片置80℃烤箱1 h,冷却后入二甲苯Ⅰ及Ⅱ各10 min,过梯度酒精后苏木精对比染色3 min,取出后自来水冲洗,盐酸酒精分化,氨水返蓝,伊红染色,过梯度酒精及二甲苯后,中性树胶封片。显微镜下观察。
1.5 Wistar大鼠静脉血CD3、CD4、CD8表达水平
实验结束后,取大鼠静脉血0.5 ml,抗凝,分别取0.1 ml抗凝静脉血加入两个流式样品管中,其中一管加入10 μl CD4-FITC及10 μl CD8-PE抗体,另一管中加入10 μl CD3-FITC抗体,同时设置同型对照组,室温避光放置30 min后裂解红细胞,流式细胞仪检测。
1.6 ELISA实验检测Wistar大鼠血清及肺灌洗液中CEA、CA125及SccAg表达水平
Wistar大鼠血清收集:抽取Wistar大鼠静脉血,促凝后室温放置1 h,以3 000 r/min离心15 min,取上层血清至无菌EP管中,-20℃保存备用。
肺灌洗液收集:将肺完整剥离时带2~3 cm气管,置于冰上的无菌玻璃皿中,注射器抽取5 ml 0.9%氯化钠溶液,将针头插入气管中,用镊子夹闭后将0.9%氯化钠溶液灌入肺中,反复抽吸3次,将抽出灌洗液装入无菌EP管中,-20℃保存备用。
ELISA实验步骤:按试剂盒说明书操作,分别设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μl,然后再加待测样品10 μl。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;每孔加入酶标试剂100 μl,用封板膜封板后置37℃温育60 min。将20倍浓缩洗涤液用蒸馏水20倍稀释后备用;小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复洗涤5次,拍干。每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,轻轻振荡混匀,37℃避光显色15 min。每孔加终止液50 μl,终止反应。以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15 min内进行。用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.7 网挫法制备肺组织单细胞悬液
将70%乙醇固定的肺组织,用冷0.9%氯化钠溶液冲洗一次,利用网挫法制备单细胞悬液,调整细胞浓度为1×107个/毫升。
1.8 流式细胞术检测Wistar大鼠肺组织细胞凋亡、细胞周期及DNA指数
取制备好的单细胞悬液100 μl,加入0.5 ml DNA染液,4℃冰箱内避光染色30 min,0.9%氯化钠溶液洗涤细胞一次后,加入1 ml 0.9%氯化钠溶液悬浮细胞,流式细胞仪检测。细胞增殖状态以增殖指数(proliferation index, PI)表示,PI=(S+G2/M)/(G0/G1+S+G2/M)。DNA含量以DNA指数(DNA index, DI)表示,DI=(实验组细胞G0/G1期均道值)/(正常细胞G0/G1期均道值)
1.9 统计学方法
应用SPSS11.5软件对数据进行统计分析,计量资料以均数±标准差(x±s)表示,多组样本均数比较采用单因素方差分析,其中两两比较采用LSD检验,以P < 0.05为差异有统计学意义。
2 结果
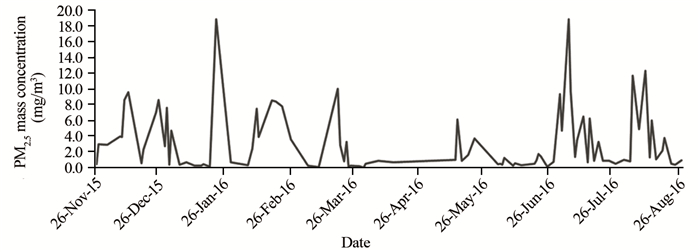
2.1 实验过程中PM2.5质量浓度
实验利用全身暴露系统进行Wistar大鼠PM2.5染毒实验,9月的实验,染毒仓内PM2.5浓度波动较大,但均高于250 μg/m3,见图 2。
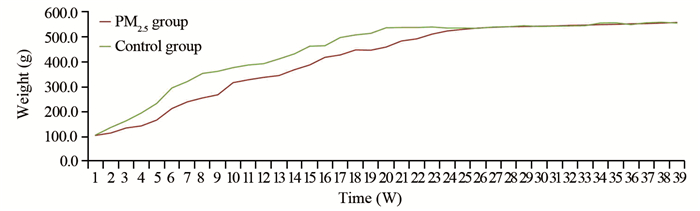
2.2 实验过程中Wistar大鼠体质量变化
整个实验阶段,实验组与对照组Wistar大鼠体质量差异无统计学意义,随着实验时间的延长体重呈现稳定增高,见图 3。
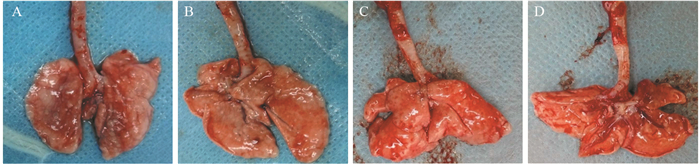
2.3 Wistar大鼠肺组织大体观察
实验组正面观,以支气管向外周辐射状颜色发暗,偏黑,多处可见白色斑点和泡状凸起,边缘不规则白色隆起,反面观,有异常白色区,见图 4A~B;对照组正反面观,均呈现均匀粉红色,表面光滑,无明显异常,见图 4C~D。
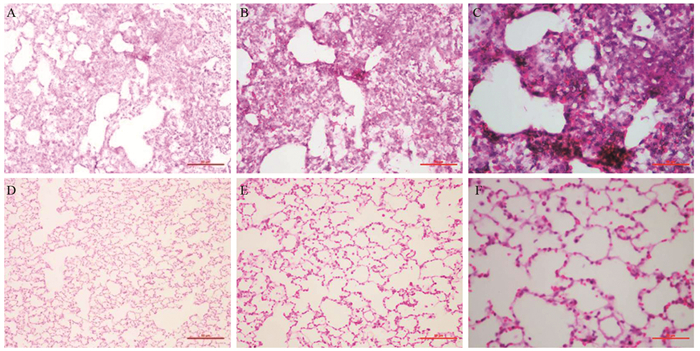
2.4 肺组织HE染色观察
实验组,肺组织纤维化,肺实变严重,肺泡充血,见大量炎性增生,肺组织中可见大量颗粒性沉着及吞噬了颗粒性物质的巨噬细胞,支气管中的纤毛柱状细胞破坏、管壁纤维化增厚,见图 5A~C。对照组,肺泡完整,肺泡壁正常,未见纤维化、肺实变及肺泡内充血,未见异型增生细胞,见图 5D~F。
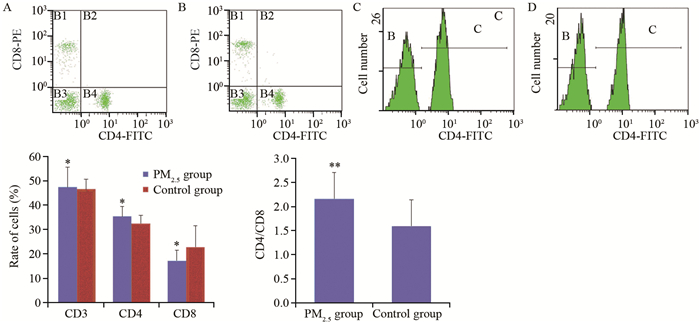
2.5 Wistar大鼠静脉血CD3、CD4、CD8表达水平
实验组与对照组相比,静脉血中CD3及CD4阳性细胞增高而CD8阳性细胞降低,但差异均无统计学意义(P值分别为0.792、0.103、0.087);实验组CD4/CD8比值显著高于对照组CD4/CD8比值(P=0.031),见图 6。
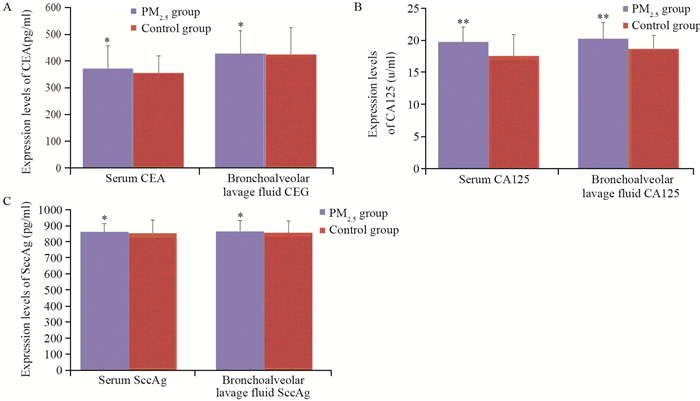
2.6 ELISA实验检测Wistar大鼠血清及肺灌洗液中CEA、CA125及SccAg表达水平
实验组大鼠静脉血及肺灌洗液中CEA及SccAg表达水平高于对照组中的表达,但差异无统计学意义(P值分别为0.495、0.750、0.930、0.667);实验组大鼠静脉血及肺灌洗液中CA125表达水平显著高于对照组中的表达(P值分别为0.023及0.043),见图 7。
2.7 流式细胞术检测Wistar大鼠肺组织细胞周期
实验组与对照组相比,肺组织细胞周期G0/G1期降低而S、G2/M期及增殖指数增高,但差异无统计学意义(P值分别为0.143、0.286、0.779及0.145),见图 8。
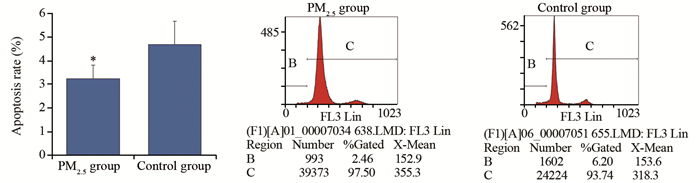
2.8 流式细胞术检测Wistar大鼠肺组织细胞凋亡
结果显示,实验组肺组织细胞凋亡率显著低于对照组细胞凋亡率(P=0.002),见图 9。
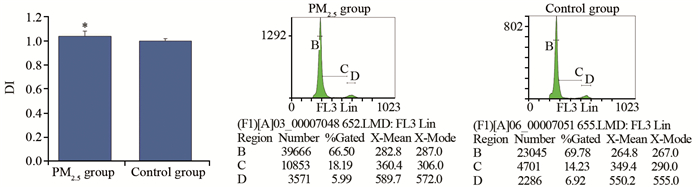
2.9 流式细胞术检测肺组织细胞DNA含量
结果显示,实验组肺组织细胞DI值显著高于对照组细胞DI值(P=0.018),提示实验组肺组织细胞DNA含量显著高于对照组(P=0.018),见图 10。
3 讨论
近年来随着我国工农业、交通运输业等大力发展以及煤炭石油等能源的大规模开发利用,造成环境污染问题日益严峻。PM2.5由于其粒径小,相对表面积大,易富集多环芳烃等有机物、各种重金属等无机物及病原微生物等,并可以随着人的呼吸进入体内导致心血管和呼吸等系统疾病[6-8]。肺癌因其患病率持续增高且病因复杂,和空气质量的变化密切相关而受到重视。PM2.5的污染所带来的环境健康效应问题愈来愈严重。虽然PM2.5与肺癌的关系在流行病学调查中显示有一定的关联,也有一些动物实验研究了PM2.5与肺部病变的研究[9-13],但这些动物实验的PM2.5染尘,多采用PM2.5肺部滴注进行染尘,动物自然呼吸空气进行PM2.5染毒实验少见报道。本研究利用全身暴露染毒系统,实时收集PM2.5进行Wistar大鼠染毒实验,试图寻找PM2.5引起肺癌的动物模型,为PM2.5与肺癌关系研究提供动物实验基础。
经过9月的染毒实验,Wistar大鼠体质量与对照组相比,并无显著变化,行动和饮食并没有受到染毒影响。考虑可能是染毒时间太短或染毒的PM2.5浓度低从而导致的对Wistar大鼠影响不显著。实验过程中观察到染毒至近8周时,Wistar大鼠出现异常呼吸音,此症状持续近3周左右,此后呼吸音逐渐正常,症状消失,观察PM2.5质量浓度曲线图对应的时间显示,出现异常呼吸音的时间正好对应了此时段PM2.5浓度较高,随后PM2.5浓度逐渐降低,同时也出现了大鼠异常呼吸音逐渐消失的现象。此现象反映了PM2.5质量浓度与致肺部病变有直接的关系。
历时9月的PM2.5染毒实验,实验组Wistar大鼠肺组织中出现不同程度的结节,经病理学检测呈现广泛的肺实变,炎性增生,肺泡内充血,大量颗粒性物质在肺组织内沉着,支气管壁纤维化增厚。而对照组大鼠肺组织,肺泡完整,肺泡壁正常,未见纤维化、肺实变及肺泡内充血,未见异型增生细胞。HE染色结果显示实验组肺组织呈现了广泛炎性增生,并未出现不典型增生,出现此结果的原因考虑是由于染毒过程中PM2.5采集是采用实时采集方式,PM2.5的收集受到了外界环境空气质量影响很大,而且PM2.5采集器随着采集时间的延长也会出现偶尔的堵塞现象导致了PM2.5浓度受到一定影响,达不到一定的PM2.5高浓度及浓度的稳定性。考虑到此原因,在以后的实验中会寻找一种能够稳定提供高浓度PM2.5浓度的实验装置。形态学上没有找到肺癌组织形态,实验中进一步进行了与癌变有关因子的检测。
流式细胞术检测了大鼠T细胞免疫功能,结果显示,实验组与对照组相比,静脉血中CD3、CD4、CD8阳性细胞无显著性差异,但实验组CD4/CD8比值显著高于正常对照组。提示了实验组大鼠T细胞的免疫功能高于对照组,此结果与大鼠肺组织的炎性反应有关,也可能与肺早期癌变过程中刺激免疫系统从而引起的免疫功能增强。这需要在后期的实验中进一步验证。
CEA、CA125及SccAg是肿瘤早期诊断常用指标,实验中使用ELISA方法检测了大鼠静脉血及肺灌洗液中CEA、CA125及SccAg表达水平,显示实验组大鼠静脉血及肺灌洗液中CEA及SccAg高于对照组但无统计学意义,而实验组大鼠静脉血及肺灌洗液中CA125表达水平显著高于对照组。同时检测了肺组织细胞周期、凋亡及DNA含量,结果显示,实验组大鼠肺组织细胞增殖高于对照组,但无统计学意义,实验组大鼠肺组织细胞凋亡率显著低于对照组,而细胞DNA含量显著高于对照组,这些结果提示实验组肺组织有癌变的趋势,持续高浓度的染毒可能会导致肺组织早期癌变,但这种假设需要进一步的实验研究进行证实。
以上结果显示,长期接触PM2.5会造成肺组织出现不同程度结节,呈现出广泛的炎性反应增生、肺实变及肺泡充血等变化,提示结节组织有向早期癌发生的趋势,但PM2.5是否能引起肺癌变需要进一步的实验研究。
-
-
[1] 曾其莉, 岳苗苗, 谢曙光, 等.华中某市居民住宅室内外PM2.5与PM10日变化规律及防护建议[J].公共卫生与预防医学, 2015, 26(2):40-2. http://www.cnki.com.cn/Article/CJFDTOTAL-FBYF201502012.htm Zeng QL, Yue MM, Xie SG, et al. Daily change patterns of indoor and outdoor PM2.5 and PM10 concentration in Central China city residences and protection suggestions[J]. Gong Gong Wei Sheng Yu Yu Fang Yi Xue, 2015, 26(2):40-2. http://www.cnki.com.cn/Article/CJFDTOTAL-FBYF201502012.htm
[2] Puett RC, Hart JE, Yanosky JD, et al. Particulate matter air pollution exposure, distance to road, and incident lung cancer in the nurses' health study cohort[J]. Environ Health Perspect, 2014, 122(9):926-32. https://ehp.niehs.nih.gov/1307490/
[3] Atkinson RW, Carey IM, Kent AJ, et al. Long-term exposure to outdoor air pollution and incidence of cardiovascular diseases[J]. Epidemiology, 2013, 24(1):44-53. doi: 10.1097/EDE.0b013e318276ccb8
[4] 李玉洁, 陈颖, 王娅杰, 等. PM2.5暴露诱发动脉粥样硬化斑块失稳定发病机制及应对策略思考[J].中国中药杂志, 2014, 39(15):2978-82. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201415038.htm Li YJ, Chen Y, Wang YJ, et al. Pathogenesis of plaque destabilization induced by PM2.5 exposure and coping strategies[J]. Zhongguo Zhong Yao Za Zhi, 2014, 39(15):2978-82. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201415038.htm
[5] 陶永进, 曾娅莉, 邓建军, 等. PM2.5沙尘矿物的6中主要成分致A549细胞遗传毒性研究[J].工业卫生与职业病, 2016, 42(5):321-5. http://www.cnki.com.cn/Article/CJFDTOTAL-GYWZ201605001.htm Tao YJ, Zeng YL, Deng JJ, et al. Study on genotoxicity of six main kinds of PM2.5 mineral particles in A549 cell[J]. Gong Ye Wei Sheng Yu Zhi Ye Bing, 2016, 42(5):321-5. http://www.cnki.com.cn/Article/CJFDTOTAL-GYWZ201605001.htm
[6] Mahalingaiah S, Hart JE, Laden F, et al. Air pollution and risk of uterine leiomyomata[J]. Epidemiology, 2014, 25(5):682-8. doi: 10.1097/EDE.0000000000000126
[7] Mahalingaiah S, Hart JE, Laden F, et al. Air pollution exposures during adulthood and risk of endometriosis in the Nurses' Health Study Ⅱ[J]. Environ Health Perspect, 2014, 122(1):58-64. https://ehp.niehs.nih.gov/1306627/
[8] Hart JE, Källberg H, Laden F, et al. Ambient air pollution exposures and risk of rheumatoid arthritis[J]. Arthritis Care Res (Hoboken), 2013, 65(7):1190-6. doi: 10.1002/acr.21975
[9] 刘莎莎, 敖登其木格, 王红丽, 等. PM2.5通过活化NF-κB途径诱导支气管上皮细胞中血管内皮生长因子的表达[J].军事医学, 2015, 39(5):325-8. http://www.cnki.com.cn/Article/CJFDTOTAL-JSYX201505003.htm Liu SS, Aodengqimuge, Wang HL, et al. PM2.5 induces VEGF expression via activation of NF-κB pathway in bronchial epithelial cells[J]. Jun Shi Yi Xue, 2015, 39(5):325-8. http://www.cnki.com.cn/Article/CJFDTOTAL-JSYX201505003.htm
[10] 肖纯凌, 李舒音, 尚德志, 等. PM2.5大气污染物致大鼠呼吸系统病理学变化[J].中国公共卫生, 2011, 27(12):1579-81. doi: 10.11847/zgggws2011-27-12-33 XIAO Chun-ling, LI Shu-yin, SHANG De-zhi, et al. Pathologic changes in trachea of rats exposed to PM2.5 artificial air pollution[J]. Zhongguo Gong Gong Wei Sheng, 2011, 27(12):1579-81. doi: 10.11847/zgggws2011-27-12-33
[11] 杨凌, 马琼锦, 李莉珊, 等. PM2.5亚慢性染毒对小鼠肺部炎症及Th17/Treg的影响[J].卫生研究, 2014, 43(3):387-92. http://www.cnki.com.cn/Article/CJFDTOTAL-WSYJ201403008.htm Yang L, Ma QG, Li LS, et al. Effects of airborne fine particulate matters on pulmonary inflammation injury and Th17/Treg balance of sub-chronic exposure mice[J]. Wei Sheng Yan Jiu, 2014, 43(3):387-92. http://www.cnki.com.cn/Article/CJFDTOTAL-WSYJ201403008.htm
[12] 邓元荣, 李泳宁, 黄晓敏, 等.大气细颗粒物吸入动物模型建立及适用性评价[J].中国比较医学杂志, 2016, 26(9):42-9. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGDX201609010.htm Deng YR, Li YN, Huang XM, et al. Establishment and evaluation of animal model induced by inhalation injury of airborne fine particulate matter[J]. Zhongguo Bi Jiao Yi Xue Za Zhi, 2016, 26(9):42-9. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGDX201609010.htm
[13] 周莉婷, 杨果, 古桂雄, 等.苏州市独墅湖高教区PM2.5对大鼠呼吸系统急性损伤的研究[J].环境卫生学杂志, 2016, 6(2):97-101. http://www.cnki.com.cn/Article/CJFDTOTAL-GWYX201602002.htm Zhou LT, Yang G, Gu GX, et al. Acute Injury of Respiratory System in Rats Induced by PM2.5 Collected from Dushu Lake Higher Education Town in Suzhou[J]. Huan Jing Wei Sheng Xue Za Zhi, 2016, 6(2):97-101. http://www.cnki.com.cn/Article/CJFDTOTAL-GWYX201602002.htm



 下载:
下载: