Analysis of Association Between Immune Cells and Breast Cancer Based on Two-sample Mendelian Randomization Method
-
摘要:目的
探究731种免疫细胞与乳腺癌的因果关系。
方法使用免疫细胞和乳腺癌的全基因组关联数据(GWAS),通过逆方差加权(IVW)和加权中位数(WM)法进行孟德尔随机化分析(MR),并采用敏感性分析评估异质性及多效性。
结果以IVW作为主要分析方法(P>0.05),通过错误发现率(FDR)法校正P值,在显著性为0.05时,排除反向因果关系,共鉴定出19种免疫细胞表型与乳腺癌可能存在因果关联,有8种免疫表型可能增加乳腺癌发病的风险因素,另外有11种免疫表型可能降低乳腺癌的发病风险。
结论某些免疫细胞表型可能是乳腺癌早期诊断和开发新的免疫疗法的预测标志。
Abstract:ObjectiveTo explore the causal relationship among 731 types of immune cells and breast cancer.
MethodsGenome-wide association data for immune cells and breast cancer were used. Mendelian randomization analysis was performed using the inverse variance weighting (IVW) and weighted median (WM) methods, and sensitivity analysis was conducted to assess heterogeneity and pleiotropy.
ResultsA total of 19 immune cell phenotypes were identified to potentially have a causal association with breast cancer, using IVW as the main analysis method (P>0.05) and correcting P values using the false discovery rate method at a significance level of 0.05, excluding reverse causality. Of these, eight and 11 immune phenotypes may increase and decrease the risk of breast cancer, respectively.
ConclusionThis study explored the causal relationship between immune cells and breast cancer. Results show that certain immune cell phenotypes could serve as predictive markers for the early diagnosis of breast cancer and the development of new immunotherapeutic strategies.
-
Key words:
- Breast cancer /
- Immune cells /
- Mendelian randomization /
- SNP
-
0 引言
乳腺癌由于其高发病率和死亡率而严重威胁女性的生命健康,据统计,乳腺癌发病率仅次于肺癌[1]。大多数早期乳腺癌患者无症状,乳房X线筛查是早期发现乳腺癌的重要手段之一[2]。乳腺癌的风险因素包括晚婚、初次生育和绝经年龄晚等[3]。传统的治疗方法有多种[4],但仍存在易转移、疗效差等缺点,难以改善晚期乳腺癌患者的生存预后。随着研究的进展,TIL细胞、CAR-T细胞、NK细胞、TCR-T细胞以及乳腺癌疫苗等免疫疗法展现出良好的安全性和有效性[5-7],但早期诊断和有效治疗方法的不足仍然是乳腺癌死亡率较高的关键因素[8]。
有研究证明,免疫系统既可以抗肿瘤,也可以促进肿瘤的起始、发生及发展[9-10]。内、外源性炎性反应一直被视为促发癌症的一个关键风险因素,炎性反应可以诱导免疫耐受、免疫逃逸,使免疫系统不能有效地识别和清除癌细胞。肿瘤炎性反应微环境的特征是在支持基质和肿瘤区域中都存在宿主免疫细胞[11],肿瘤浸润免疫细胞可能促进癌症生长和扩散以及与恶性疾病相关的免疫抑制[12]。免疫细胞是精准治疗癌症的重要方法,此外,还可以作为诊断的生物标志物,比如可以通过流式细胞仪检测并分析乳腺癌高危人群的循环免疫细胞,建立特定的免疫表型特征,用于早期乳腺癌预测。
基于遗传变异随机分配的原理,孟德尔随机化(Mendelian randomization, MR)分析方法等同于随机对照试验(randomized controlled trial, RCT)[13],通过遗传变异揭示暴露与结局之间的因果关系,相较传统的观察性研究,MR已成为识别独立于混杂因素并避免反向因果关系的有效工具[14]。目前很少有研究评价免疫细胞与乳腺癌发生之间的因果关系。本研究中,我们的目的是确定免疫细胞和乳腺癌发病率之间是否存在因果关系,了解与乳腺癌发生、发展相关的风险因素,将有助于预防、早期诊断及开发新免疫疗法。
1 资料与方法
1.1 数据来源
乳腺癌的遗传数据来自Michailidou等[15]发表在Nature上的全基因组关联分析(genome wide association study, GWAS)数据,总样本量228 951例,包括122 977例欧洲血统的乳腺癌病例和105 974例对照,共有10 680 257个单核苷酸多样性(single nucleotide polymorphisms, SNPs)。关于免疫细胞GAWS数据,我们使用了来自BCX(blood cell consortium)对血细胞性状的汇总统计数据[16],有563 085例欧洲血统病例,共纳入731种免疫表型,免疫特征包括四种类型:中值荧光强度(median fluorescence intensities, MFI,n=389)、相对细胞(relative cell, RC,n=192)、绝对细胞(absolute cell, AC,n=118)、形态参数(morphological parameters, MP,n=32),其中MFI、AC和RC免疫特征包括髓样细胞、B细胞、成熟期T细胞、单核细胞、淋巴细胞亚群(T细胞、B细胞、自然杀伤细胞)、经典树突状细胞(conventional dendritic cells, CDCs)和调节性T细胞(regulatory cells, Treg),而MP免疫特征包括CDCs和淋巴细胞亚群(TBNK),最初的淋巴细胞亚群GWAS数据来自3 757例欧洲病例[17],约2 200万个SNPs,但与前者并没有重叠的队列,此外,用于全基因组关联分析的汇总数据可在Open GWAS数据库(http://metabo-lomirs.helmholtz-nuienchen.de/gwas/)获取。
1.2 工具变量的筛选
为了确保结果的准确性及真实性,本研究基于孟德尔随机化三大假设(相关性、排他性和独立性假设)来筛选工具变量SNPs。首先,将每个免疫表型的工具变量(instrumental variable, IV)显著性水平设定为5×10−8,但只有少量的SNPs有统计学意义,参考最近的相关研究[18-19]后,我们将显著性水平设定为1×10−5。对每个免疫表型进行连锁不平衡(linkage disequilibrium, LD)分析(r2<0.001,阈值距离
10000 kb)。对于结局工具变量我们将显著性水平设定为1×10−8,LD参数与免疫表型相同。其次,为了避免弱变量工具对结果的影响,本研究只保留F检验值>10的SNPs进行以下分析,并剔除了具有回文结构的SNPs。最后,本研究使用“Mendelian Randomization” R语言包筛选并剔除与乳腺癌相关混杂因素(乳腺癌、吸烟、饮酒、脂肪和家族史等)和与两个及以上免疫细胞显著相关的SNPs。1.3 孟德尔随机化分析
对免疫细胞与乳腺癌的因果关系进行MR分析。所有的分析均在R v.4.3.1软件中使用TwoSampleMR包和MR-PRESSO包进行。采用随机效应模型IVW作为MR分析的主要方法[20-21],加权中位WM作为次要方法辅助分析[22],如果P<0.05,则认为有统计学意义。反向孟德尔随机化分析方法验证暴露与结局是否存在反向的因果关系。
1.4 敏感性分析
Cochran Q检验验证IVW模型的异质性,并应用MR-Egger截距检验估计因果关系潜在的水平多效性及稳健性,如果其截距项显著,则表示存在水平多效性[23]。此外,利用一种更可靠的方法,MR多效性残差和异常值(MR pleiotropy residual sum and outlier test, MR-PRESSO)方法[24],排除可能的水平多效性异常值,这些异常值可能会严重影响估计的结果,剔除异常SNPs后,重新进行MR分析。采用“留一法”逐个剔除SNP后进行MR分析,观察移除其后是否可以导致因果估计偏差。此外,还使用“留一法”进行敏感性分析。免疫细胞与乳腺癌的风险关系以优势比(odds radio, OR)及其95%CI表示,如果P<0.05,则认为可能存在因果关系。
1.5 FDR和统计功效
错误发现率(false discovery rate, FDR)矫正来控制多重比较的影响,如果IVW方法的P值小于FDR临界值0.05,则认为存在显著的因果关系。此外,使用在线网络工具(https://sb452.shinyapps.io/power)计算统计功效,其中统计功效的错误率为0.05,随着功效的增加,第二类错误的概率降低。
2 结果
2.1 工具变量的筛选
根据本研究所采用的工具变量筛选条件,最终选出7~28个SNPs作为各个免疫表型的工具变量进行MR分析。
2.2 孟德尔随机化分析
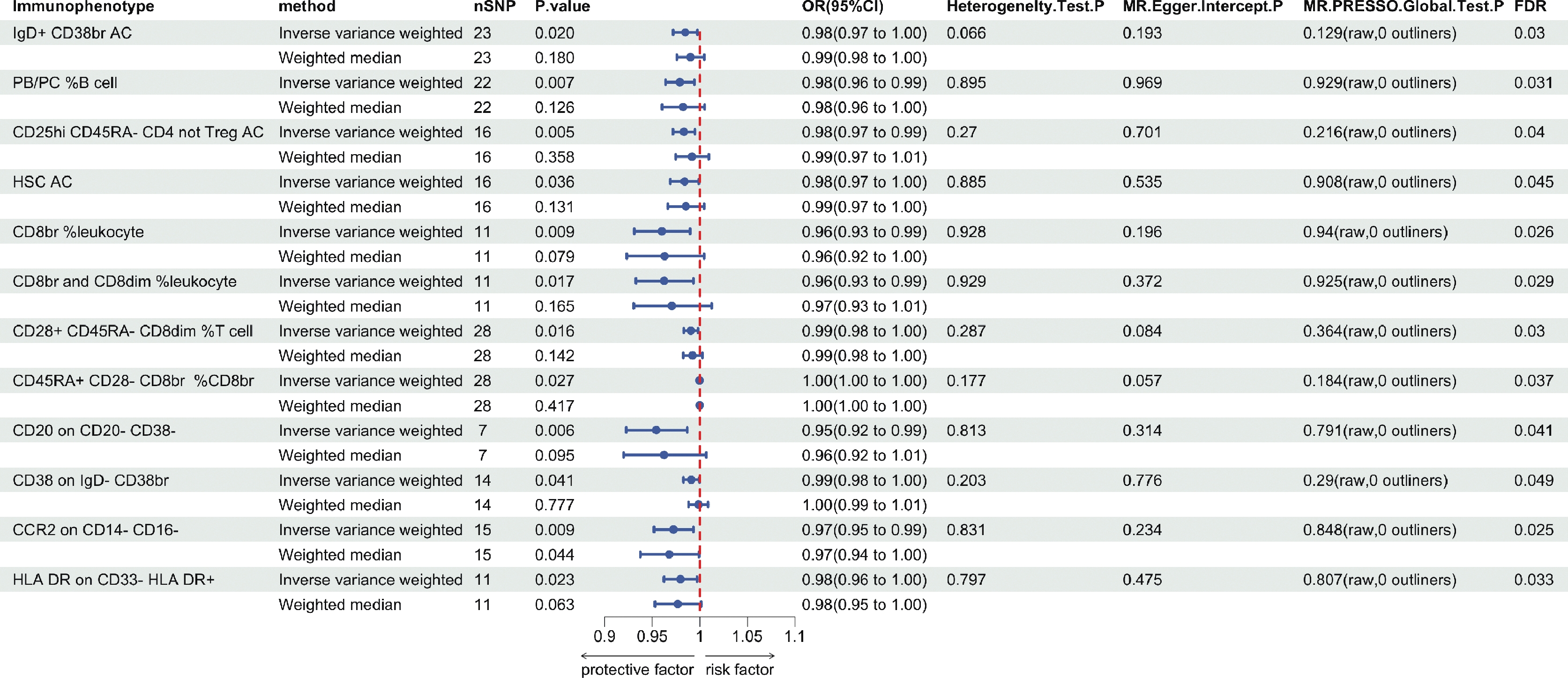
为了探讨免疫表型对乳腺癌的致病作用,采用双样本孟德尔随机化分析,以IVW作为主要分析方法,并通过FDR校正P值,在P为0.05时,在731种免疫表型中共鉴定出了21种,6种在B细胞组;1种在CDCs组;4种在TBNK组;2种在成熟期T细胞组;2种在单核细胞组;3种在髓样细胞组;3种在Treg组。其中有9种免疫表型可能是增加乳腺癌发病的风险因素(图1),另外有12种免疫表型对乳腺癌具有保护作用(图2)。使用WM方法分析表明,较高的乳腺癌风险与IgD- CD38-细胞上的CD20(IVW:OR=1.03,95%CI: 1.01-1.06,P=0.009;WM:OR=1.03,95%CI: 1.00-1.06,P=0.042)、CM CD8br细胞上的HVEM(IVW:OR=1.02,95%CI: 1.01-1.04,P=0.008;WM:OR=1.02,95%CI: 1.01-1.04,P=0.010)和单核样髓源抑制细胞上的CD11b(IVW:OR=1.02,95%CI: 1.00-1.03,P=0.015;WM:OR=1.02,95%CI: 1.00-1.04,P=0.048)计数水平增加之间同样存在显著的因果关联。在乳腺癌保护因素中,CD14- CD16-细胞上的CCR2(IVW:OR=0.97,95%CI: 0.95-0.99,P=0.009;WM:OR=0.97,95%CI: 0.94-1.00,P=0.044)在IVW和WM方法中观察到类似的趋势,其余17种免疫表型尽管在WM方法中P值差异无统计学意义,但与IVW方法分析的结果是同向的,并且统计功效均为100%。
反向孟德尔随机化分析显示,HLA DR+ CD8br细胞上的CD8(IVW:OR=0.90,95%CI: 0.83-0.98,P=0.019)和CD14- CD16-细胞上的CCR2免疫细胞(IVW:OR=0.88,95%CI: 0.82-0.96,P=0.003)与乳腺癌存在反向的因果关联,予以排除,最后筛选出19种免疫表型。综上所述,我们认为8种免疫表型可能为增加乳腺癌发病的风险因素,11种免疫表型可能对乳腺癌具有保护作用。
2.3 敏感性分析
在IVW方法分析的基础上,使用Cochran Q进行异质性检验和MR-Egger回归评估SNPs与结果之间的水平多效性,结果显示19种免疫表型均无异质性和水平多效性(P>0.05)。MR-Egger回归通过MR-Egger截距是否显著提供定向多效性的检验,而MR-PRESSO用于识别和消除水平多效性,因此,我们又进一步采用MR-PRESSO进行基因多效性检验,结果显示未识别到异常SNPs,P>0.05,说明免疫表型和乳腺癌变量不存在水平多效性。
通过绘制散点图和漏斗图证明了相关性的稳健性和无异质性。此外,“留一法”进行的敏感性分析结果表明,剔除某个SNP后结果变化不大。因此,这19种免疫表型与乳腺癌之间可能存在因果关联。
3 讨论
本研究基于公开的遗传数据,通过MR分析,探索了731种免疫细胞与乳腺癌之间的因果关联,发现19种免疫表型对乳腺癌可能有(FDR<0.05)因果影响,并且不存在反向因果关联。
B细胞组中,IgD- CD38-细胞上的CD20已经证实可作为乳腺癌早期诊断的预测标志物,CD20在组织中与乳腺癌亚型之间存在显著相关性[25],它是一种在B细胞而非浆细胞上表达的跨膜蛋白,可调节B细胞的分化和增殖[26],在95%以上的B细胞恶性肿瘤中都有表达[27],本研究表明在CD20- CD38-细胞上的CD20能降低乳腺癌的发病率,但目前的研究对CD20的功能并不完全清楚,具体机制有待进一步探讨。IgD+ CD38dim细胞上的CD38和IgD- CD38br细胞上的CD38对乳腺癌分别有正相关、负相关的因果关联,CD38表达水平与腺苷增加密切相关,而腺苷是实体瘤肿瘤微环境中重要的免疫抑制因子,它是有助于癌症进展的多功能蛋白[28],也有研究证明,高CD38表达和高CD38+浆细胞密度与无病生存率和总生存率的增加相关[29]。
髓样细胞组中有1种免疫表型(CD33br HLA-DR+ CD14-细胞上的CD45)、淋巴细胞亚群组中1种免疫表型(淋巴细胞上的CD45)及单核样髓源抑制细胞上的CD11b可能会导致乳腺癌风险增加。有研究表明,与正常乳腺组织相比,乳腺癌中的白细胞密度以及淋巴细胞和巨噬细胞的特定亚群通常较高,而在乳腺肿瘤组织中CD45表达更显著[30],有研究者观察到CD45抗原与恶性肿瘤早期阶段细胞的分化具有相关性[31]。此外,CD11b能够介导肿瘤细胞与中性粒细胞的结合,它的缺乏能够抑制肿瘤细胞中性粒细胞结合和三阴乳腺癌转移[32]。
Treg可以通过多种途径抑制机体免疫反应,促使肿瘤细胞发生免疫逃逸,Treg已被发现在乳腺癌患者外周血和肿瘤组织中过量增加[33]。本研究Treg组中,未发现能增加乳腺癌风险的免疫细胞,但结果显示有3种免疫表型能降低乳腺癌的风险。
在免疫细胞与乳腺癌有显著因果关系的19种免疫表型中,其中CDCs组中的1种免疫表型(粒细胞上的CD11c)和成熟期T细胞组中的2种免疫表型(CM CD8br细胞上的HVEM和幼稚双阴性(CD4-CD8-)%DN细胞)均显示可能增加乳腺癌的风险。另外,在其他4种类型(B细胞组、单核细胞组、髓样细胞组和淋巴细胞亚群组)的免疫细胞中,免疫表型既有风险因素,也有保护因素,当前的研究尚不能具体解释各免疫表型的细胞对乳腺癌的影响机制。
本研究利用15万人的大型欧洲GWAS队列结果进行了两样本MR分析,排除了人群重叠并保持统计效率和功效为100%。研究基于严格控制水平多效性和混杂因素的多种MR分析方法,以及反向孟德尔随机化分析,排除了反向因果关联。然而,本研究仍存在一定局限性:无法完全评估水平多效性,可能高估遗传和暴露因素之间的关联;无法对乳腺癌人群进行分层分析;统计功效受样本量和两总体差异影响;结论仅适用于欧洲人群,普遍性还需其他人群的研究验证。
本研究评估了免疫细胞对乳腺癌的潜在因果关联,发现了8种免疫表型可能增加乳腺癌风险,同时有11种免疫表型可能具有保护作用。这些表型可能成为乳腺癌早期诊断的生物标志物,并为治疗方法提供新思路,为发病机制提供线索。
致谢:
本研究由新乡市乳腺癌转化与精准治疗重点实验室资助,特此致谢!
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:王远航:数据分析和论文撰写宋之圆:数据收集、整理和筛选及制图路 平:论文修改张 敏:论文构思并设计 -
-
[1] Bray F, Laversanne M, Sung H, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2024, Online Ahead of Print.
[2] Alkabban FM, Ferguson T. Breast Cancer[J]. NCBI Bookshelf, 2022. https://www.ncbi.nlm.nih.gov/books/NBK482286/.
[3] Kashyap D, Pal D, Sharma R, et al. Global Increase in Breast Cancer Incidence: Risk Factors and Preventive Measures[J]. Biomed Res Int, 2022, 2022: 9605439.
[4] Ben-Dror J, Shalamov M, Sonnenblick A. The History of Early Breast Cancer Treatment[J]. Genes (Basel), 2022, 13(6): 960. doi: 10.3390/genes13060960
[5] Zhu Y, Zhu X, Tang C, et al. Progress and challenges of immunotherapy in triple-negative breast cancer[J]. Biochim Biophys Acta Rev Cancer, 2021, 1876(2): 188593. doi: 10.1016/j.bbcan.2021.188593
[6] Zacharakis N, Chinnasamy H, Black M, et al. Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer[J]. Nat Med, 2018, 24(6): 724-730. doi: 10.1038/s41591-018-0040-8
[7] Yang YH, Liu JW, Lu C, et al. CAR-T Cell Therapy for Breast Cancer: From Basic Research to Clinical Application[J]. Int J Biol Sci, 2022, 18(6): 2609-2626. doi: 10.7150/ijbs.70120
[8] Heer E, Harper A, Escandor N, et al. Global burden and trends in premenopausal and postmenopausal breast cancer: a population-based study[J]. Lancet Global Health, 2020, 8(8): e1027-e1037. doi: 10.1016/S2214-109X(20)30215-1
[9] Rosenthal R, Cadieux EL, Salgado R, et al. Neoantigen-directed immune escape in lung cancer evolution[J]. Nature, 2019, 567(7749): 479-485. doi: 10.1038/s41586-019-1032-7
[10] Martins D, Schmitt F. Microenvironment in breast tumorigenesis: Friend or foe?[J]. Histol Histopathol, 2019, 34(1): 13-24.
[11] Bader JE, Voss K, Rathmell JC. Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy[J]. Mol Cell, 2020, 78(6): 1019-1033. doi: 10.1016/j.molcel.2020.05.034
[12] Singh N, Baby D, Rajguru JP, et al. Inflammation and cancer[J]. Ann Afr Med, 2019, 18(3): 121-126. doi: 10.4103/aam.aam_56_18
[13] Sobczyk MK, Zheng J, Smith GD, et al. Systematic comparison of Mendelian randomisation studies and randomised controlled trials using electronic databases[J]. BMJ Open, 2023, 13(9): e072087. doi: 10.1136/bmjopen-2023-072087
[14] Gala H, Tomlinson I. The use of Mendelian randomisation to identify causal cancer risk factors: promise and limitations[J]. J Pathol, 2020, 250(5): 541-554. doi: 10.1002/path.5421
[15] Michailidou K, Lindström S, Dennis J, et al. Association analysis identifies 65 new breast cancer risk loci[J]. Nature, 2017, 551(7678): 92-94. doi: 10.1038/nature24284
[16] Vuckovic D, Bao EL, Akbari P, et al. The Polygenic and Monogenic Basis of Blood Traits and Diseases[J]. Cell, 2020, 182(5): 1214-1231. e11.
[17] Orrù V, Steri M, Sidore C, et al. Complex genetic signatures in immune cells underlie autoimmunity and inform therapy[J]. Nat Genet, 2020, 52(10): 1036-1045. doi: 10.1038/s41588-020-0684-4
[18] Yu XH, Yang YQ, Cao RR, et al. The causal role of gut microbiota in development of osteoarthritis[J]. Osteoarthritis Cartilage, 2021, 29(12): 1741-1750. doi: 10.1016/j.joca.2021.08.003
[19] Wang C, Zhu D, Zhang D, et al. Causal role of immune cells in schizophrenia: Mendelian randomization (MR) study[J]. BMC Psychiatry, 2023, 23(1): 590. doi: 10.1186/s12888-023-05081-4
[20] Chen L, Yang H, Li H, et al. Insights into modifiable risk factors of cholelithiasis: A Mendelian randomization study[J]. Hepatology, 2022, 75(4): 785-796. doi: 10.1002/hep.32183
[21] Jia Y, Hui L, Sun L, et al. Association Between Human Blood Metabolome and the Risk of Psychiatric Disorders[J]. Schizophr Bull, 2023, 49(2): 428-443. doi: 10.1093/schbul/sbac130
[22] Li J, Niu Q, Wu A, et al. Causal relationship between circulating immune cells and the risk of type 2 diabetes: a Mendelian randomization study[J]. Front Endocrinol (Lausanne), 2023, 14: 1210415. doi: 10.3389/fendo.2023.1210415
[23] Xiao G, He Q, Liu L, et al. Causality of genetically determined metabolites on anxiety disorders: a two-sample Mendelian randomization study[J]. J Transl Med, 2022, 20(1): 475. doi: 10.1186/s12967-022-03691-2
[24] Verbanck M, Chen CY, Neale B, et al. Detection of widespread horizontal pleiotropy in causal relationships inferred from Mendelian randomization between complex traits and diseases[J]. Nat Genet, 2018, 50(5): 693-698. doi: 10.1038/s41588-018-0099-7
[25] Hamed MM, Gouida MS, Abd El-Aziz SR, et al. Evaluation PD-L1, CD8 and CD20 as early predictor and tracking markers for breast cancer (BC) in Egypt[J]. Heliyon, 2022, 8(5): e09474. doi: 10.1016/j.heliyon.2022.e09474
[26] Arias-Pulido H, Cimino-Mathews A, Chaher N, et al. The combined presence of CD20+ B cells and PD-L1+ tumor-infiltrating lymphocytes in inflammatory breast cancer is prognostic of improved patient outcome[J]. Breast Cancer Res Treat, 2018, 171(2): 273-282. doi: 10.1007/s10549-018-4834-7
[27] Horna P, Nowakowski G, Endell J, et al. Comparative Assessment of Surface CD19 and CD20 Expression on B-Cell Lymphomas from Clinical Biopsies: Implications for Targeted Therapies[J]. Blood, 2019, 134(Supplement_1): 5345. doi: 10.1182/blood-2019-129600
[28] Li Y, Yang R, Chen L, et al. CD38 as an immunomodulator in cancer[J]. Future Oncol, 2020, 16(34): 2853-2861. doi: 10.2217/fon-2020-0401
[29] Yeong J, Lim JCT, Lee B, et al. High Densities of Tumor-Associated Plasma Cells Predict Improved Prognosis in Triple Negative Breast Cancer[J]. Front Immunol, 2018, 9: 1209. doi: 10.3389/fimmu.2018.01209
[30] Coventry BJ, Weightman MJ, Bradley J, et al. Immune profiling in human breast cancer using high-sensitivity detection and analysis techniques[J]. JRSM Open, 2015, 6(9): 2054270415603909.
[31] Johnson D, Clases D, Fernández-Sánchez ML, et al. Quantitative multiplexed analysis of MMP-11 and CD45 in metastatic breast cancer tissues by immunohistochemistry-assisted LA-ICP-MS[J]. Metallomics, 2022, 14(8): mfac052. doi: 10.1093/mtomcs/mfac052
[32] Li D, Hemati H, Park Y, et al. ICAM-1-suPAR-CD11b Axis Is a Novel Therapeutic Target for Metastatic Triple-Negative Breast Cancer[J]. Cancers (Basel), 2023, 15(10): 2734. doi: 10.3390/cancers15102734
[33] Gobert M, Treilleux I, Bendriss-Vermare N, et al. Regulatory T cells recruited through CCL22/CCR4 are selectively activated in lymphoid infiltrates surrounding primary breast tumors and lead to an adverse clinical outcome[J]. Cancer Res, 2009, 69(5): 2000-2009. doi: 10.1158/0008-5472.CAN-08-2360




 下载:
下载: