-
摘要:目的
基于中药活性分子开发靶向泛素-蛋白酶体系统(UPS)的抗肿瘤小分子。
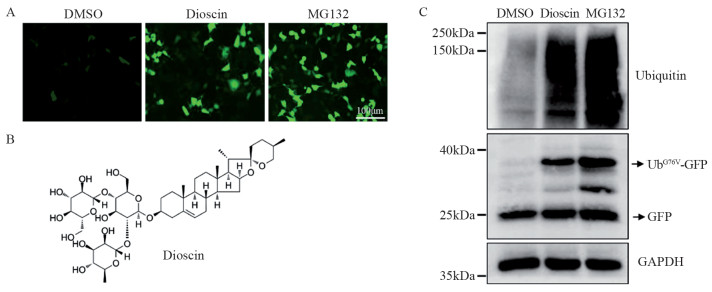
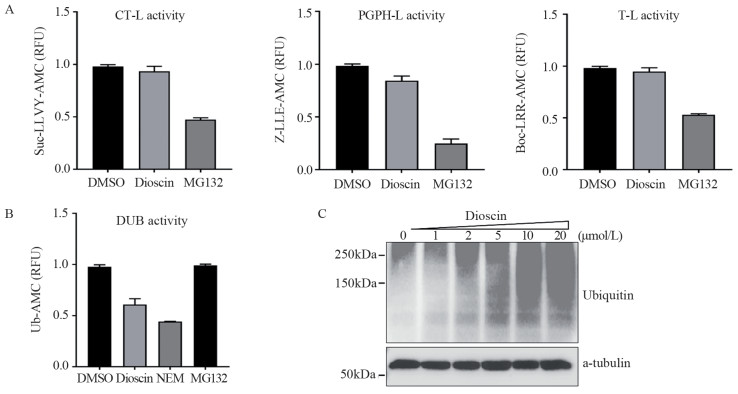
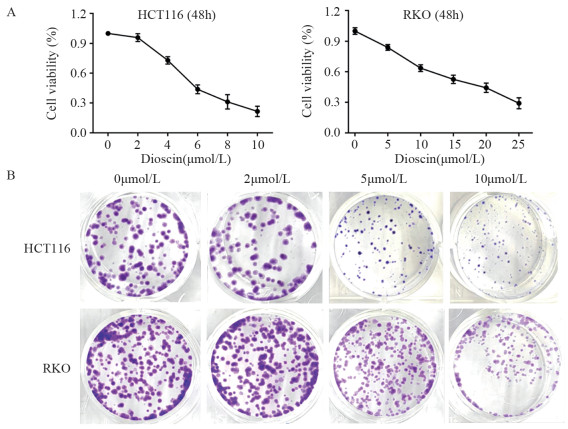
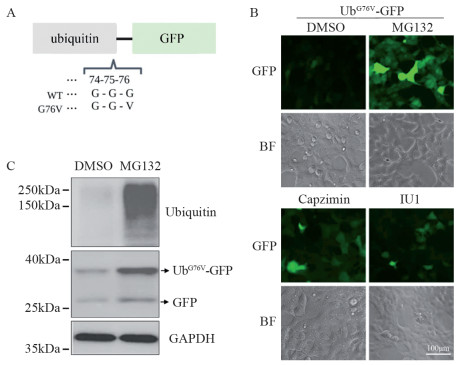
方法建立稳定表达UbG76V-GFP融合蛋白的细胞系来筛选靶向UPS的新型小分子抑制剂。通过Suc-LLVY-AMC、Z-LLE-AMC和Boc-LRR-AMC底物检测薯蓣皂苷对20S蛋白酶体水解酶活性的影响,使用Ub-AMC底物评价其对细胞内去泛素化酶活性的作用。采用Western blot检测薯蓣皂苷对细胞内泛素化水平的影响。CCK-8和克隆形成实验检测薯蓣皂苷对肿瘤细胞增殖的抑制作用。
结果通过UbG76V-GFP报告系统筛选发现薯蓣皂苷是新型的UPS抑制剂,可以抑制细胞内去泛素化酶活性,增强细胞内泛素化水平,抑制肿瘤细胞增殖,减少克隆形成。
结论薯蓣皂苷靶向泛素-蛋白酶体可显著抑制肿瘤细胞增殖。
Abstract:ObjectiveTo explore the antitumor small molecules targeting the ubiquitin–proteasome system (UPS) on the basis of active molecules from traditional Chinese medicine.
MethodsUbG76V-GFP stably expressing cell line was constructed to screen novel small molecule inhibitors targeting UPS. The fluorogenic substrates of Suc-LLVY-AMC, Z-LLE-AMC, and Boc-LRR-AMC were used to assess the effect of dioscin on the 20S proteasome hydrolase activity. The Ub-AMC substrate was used to evaluate the effect of dioscin on the intracellular deubiquitinating enzyme activity. Western blot was used to detect the effect of dioscin on intracellular ubiquitination levels. CCK-8 and colony formation assays were used to detect the inhibitory effect of dioscin on the tumor cell proliferation.
ResultsDioscin is a UPS inhibitor discovered through the UbG76V-GFP reporter system. It enhances intracellular ubiquitination and inhibits tumor cell proliferation and colony formation by targeting deubiquitinating enzymes.
ConclusionDioscin could significantly inhibit tumor cell proliferation by targeting ubiquitin–proteasome.
-
Key words:
- Ubiquitin-proteasome /
- Dioscin /
- Inhibitor /
- Deubiquitinating enzyme /
- Antitumor compound
-
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:李欣茹:实验操作、数据整理及论文撰写王嘉琦:实验操作柯细松:基金支持及论文修改周香莲:实验指导及论文修改
-
-
[1] Nandi D, Tahiliani P, Kumar A, et al. The ubiquitin-proteasome system[J]. J Biosci, 2006, 31(1): 137-155. doi: 10.1007/BF02705243
[2] Swatek KN, Komander D. Ubiquitin modifications[J]. Cell Res, 2016, 26(4): 399-422. doi: 10.1038/cr.2016.39
[3] Komander D, Rape M. The ubiquitin code[J]. Annu Rev Biochem, 2012, 81: 203-229. doi: 10.1146/annurev-biochem-060310-170328
[4] Aliabadi F, Sohrabi B, Mostafavi E, et al. Ubiquitin-proteasome system and the role of its inhibitors in cancer therapy[J]. Open Biol, 2021, 11(4) : 200390. doi: 10.1098/rsob.200390
[5] Khalesi N, Korani S, Korani M, et al. Bortezomib: a proteasome inhibitor for the treatment of autoimmune diseases[J]. Inflammopharmacology, 2021, 29(5): 1291-1306. doi: 10.1007/s10787-021-00863-2
[6] Fricker LD. Proteasome Inhibitor Drugs[J]. Annu Rev Pharmacol Toxicol, 2020, 60: 457-476. doi: 10.1146/annurev-pharmtox-010919-023603
[7] Bandopadhyay S, Anand U, Gadekar VS, et al. Dioscin: A review on pharmacological properties and therapeutic values[J]. Biofactors, 2022, 48(1): 22-55. doi: 10.1002/biof.1815
[8] Li X, Liu S, Qu L, et al. Dioscin and diosgenin: Insights into their potential protective effects in cardiac diseases[J]. J Ethnopharmacol, 2021, 274: 114018. doi: 10.1016/j.jep.2021.114018
[9] Tao X, Yin L, Xu L, et al. Dioscin: A diverse acting natural compound with therapeutic potential in metabolic diseases, cancer, inflammation and infections[J]. Pharmacol Res, 2018, 137: 259-269. doi: 10.1016/j.phrs.2018.09.022
[10] Dantuma NP, Lindsten K, Glas R, et al. Short-lived green fluorescent proteins for quantifying ubiquitin/proteasome-dependent proteolysis in living cells[J]. Nat Biotechnol, 2000, 18(5): 538-543. doi: 10.1038/75406
[11] Gierisch ME, Giovannucci TA, Dantuma NP. Reporter-Based Screens for the Ubiquitin/Proteasome System[J]. Front Chem, 2020, 8(64).
[12] Budenholzer L, Cheng CL, Li Y, et al. Proteasome Structure and Assembly[J]. J Mol Biol, 2017, 429(22): 3500-3524. doi: 10.1016/j.jmb.2017.05.027
[13] Nakamura N. Ubiquitin System[J]. Int J Mol Sci, 2018, 19(4): 1080. doi: 10.3390/ijms19041080
[14] Scott K, Hayden PJ, Will A, et al. Bortezomib for the treatment of multiple myeloma[J]. Cochrane Database Syst Rev, 2016, 4: CD010816.
[15] Yee AJ. The role of carfilzomib in relapsed/refractory multiple myeloma[J]. Ther Adv Hematol, 2021, 12: 1543937372.
[16] Xie J, Wan N, Liang Z, et al. Ixazomib-the first oral proteasome inhibitor[J]. Leuk Lymphoma, 2019, 60(3): 610-618. doi: 10.1080/10428194.2018.1523398
[17] Walhelm T, Gunnarsson I, Heijke R, et al. Clinical Experience of Proteasome Inhibitor Bortezomib Regarding Efficacy and Safety in Severe Systemic Lupus Erythematosus: A Nationwide Study[J]. Front Immunol, 2021, 12: 756941. doi: 10.3389/fimmu.2021.756941
[18] Yao CL, Zhang JQ, Li JY, et al. Traditional Chinese medicine (TCM) as a source of new anticancer drugs[J]. Nat Prod Rep, 2021, 38(9): 1618-1633. doi: 10.1039/D0NP00057D
[19] Yang L, Ren S, Xu F, et al. Recent Advances in the Pharmacological Activities of Dioscin[J]. Biomed Res Int, 2019, 2019: 5763602.
[20] Xi P, Niu Y, Zhang Y, et al. The mechanism of dioscin preventing lung cancer based on network pharmacology and experimental validation[J]. J Ethnopharmacol, 2022, 292: 115138. doi: 10.1016/j.jep.2022.115138
[21] Ding Q, Zhang W, Cheng C, et al. Dioscin inhibits the growth of human osteosarcoma by inducing G2/M-phase arrest, apoptosis, and GSDME-dependent cell death in vitro and in vivo[J]. J Cell Physiol, 2020, 235(3): 2911-2924. doi: 10.1002/jcp.29197
[22] Li X, Liu S, Qu L, et al. Dioscin and diosgenin: Insights into their potential protective effects in cardiac diseases[J]. J Ethnopharmacol, 2021, 274: 114018.



 下载:
下载: