Risk Factors and Prognosis of Patients with Para-Aortic Lymph Node Metastasis of Advanced Esophagogastric Junction Malignancy
-
摘要:目的
通过对比进展期食管胃结合部恶性肿瘤患者一般临床病理特征及区域淋巴结转移状态,探讨患者主动脉旁淋巴结转移阳性的危险因素及其预后。
方法收集224例手术根治性切除食管胃结合部恶性肿瘤患者临床病理资料,对影响第16组淋巴结转移的危险因素进行单因素χ2检验和多因素Logistic回归分析。生存分析采用Kaplan-Meier法,生存率比较采用Log rank检验。
结果(1)单因素分析见Siewert分型、肿瘤大小、病理分期、T分期、N分期与主动脉旁淋巴结转移阳性相关(均P<0.05)。多因素分析发现Siewert分型、肿瘤大小均是其转移阳性的独立危险因素(均P<0.001)。(2)纳入的17组区域淋巴结与主动脉旁淋巴结转移相关的单因素分析中,除No.5、No.6、No.111、No.112组淋巴结与主动脉旁淋巴结转移阳性不相关(均P>0.05),剩余13组区域淋巴结均与其相关。多因素分析发现,No.7、No.11p、No.110组淋巴结均是其转移阳性的独立危险因素(均P<0.05)。进一步分析发现,当至少其中一组区域淋巴结转移时,阳性转移率高达47.4%(3组均阴性时仅4.7%)。(3)主动脉旁淋巴结转移阳性患者术后1年、3年累积生存率分别为76.5%、8.1%,阴性患者分别为98.3%、76.8%。Log rank检验表明两组总生存率存在明显差异(P<0.001)。
结论(1)进展期食管胃结合部恶性肿瘤患者术前检查应明确患者的肿瘤分型及大小,建议SiewertⅡ、Ⅲ型和肿瘤直径>6 cm的患者行主动脉旁淋巴结清扫术。(2)术中行No.7、No.11p、No.110淋巴结冰冻活检病理,发现转移阳性后行主动脉旁淋巴结清扫术,有助于术中对清扫主动脉旁淋巴结的判断。
-
关键词:
- 食管胃结合部恶性肿瘤 /
- 区域淋巴结 /
- 主动脉旁淋巴结 /
- 影响因素 /
- 预后
Abstract:ObjectiveTo determine the risk factors and prognostic survival of patients with para-aortic lymph node metastasis of advanced esophagogastric junction malignancy by comparing their general clinicopathological characteristics and regional lymph node metastasis status with those of patients with negative para-aortic lymph node metastasis.
MethodsThis single-center retrospective case study collected the clinical and pathological data of 224 patients with esophagogastric junction malignant tumors undergoing radical resection. Single factor affecting lymph node metastasis in group 16 was analyzed by chi square test, and multiple factors were examined using logistic regression. Kaplan-Meier method was used for survival analysis, and Log rank test was used for survival rate comparison.
ResultsAmong the 224 patients with advanced esophagogastric junction malignant tumors, (1) Univariate analysis showed that Siewert classification, tumor diameter, pathological stage, T stage, and N stage were associated with positive para-aortic lymph node metastasis (P<0.05). Meanwhile, multivariate logistic analysis showed that Siewert type and tumor diameter were independent risk factors for positive metastasis (P<0.05); (2) Among the 17 groups of regional lymph nodes with para-aortic lymph node metastasis, univariate analysis revealed that No.5, No.6, No.111, and No.112 lymph nodes were not correlated with positive para-aortic lymph node metastasis (P>0.05). The remaining 13 groups of regional lymph nodes were all associated with para-aortic lymph node metastasis. Meanwhile, multivariate logistic analysis revealed that No.7, No.11p, and No.110 lymph nodes were independent risk factors for metastasis (P<0.05). When the regional lymph node metastasis in these three groups was negative, the positive rate of para-aortic lymph node metastasis was only 4.7%. When at least one of these groups had regional lymph node metastasis, the positive metastasis rate was up to 47.4%; (3) The 1- and 3-year cumulative survival rates of the patients with positive para-aortic lymph node metastasis after surgery were 76.5% and 8.1%, respectively, and those in negative patients were 98.3% and 76.8%, respectively. Log rank test showed a significant difference in overall survival rate between the patients with positive and negative para-aortic lymph node metastasis (P<0.001).
Conclusion(1) Preoperative examination of patients with advanced esophagogastric junction malignant tumors should clarify the tumor type and maximum diameter. Patients with Siewert type Ⅱ and Ⅲ and maximum tumor diameter of >6 cm are recommended to undergo para-aortic lymph node dissection. (2) Frozen biopsy of lymph nodes of No.7 and No.11p is performed during the operation, and the para-aortic lymph nodes should be dissected if the metastasis is found to be positive, which is helpful for the clinical surgeon to judge the dissection of the para-aortic lymph nodes.
-
0 引言
随着内窥镜筛查的普及,胃癌的发病率呈现出不断下降趋势,但食管胃结合部恶性肿瘤的发病、死亡率却均呈现逐步上升趋势[1]。中国专家共识(2024年版)将食管胃结合部腺癌(Adenocarcinoma of esophagogastric junction,AEG)定义为:不论肿瘤中心(或主体)处于何种解剖位置,食管-胃解剖交界上下各5 cm区间以内的腺癌,并跨越食管胃结合部(Esophagogastric junction,EGJ)[2]。目前AEG流行使用Siewert分型,分别为SiewertⅠ型、SiewertⅡ型、SiewertⅢ型,其中欧美国家以SiewertⅠ型常见,亚洲国家则以SiewertⅡ型、SiewertⅢ型常见。在我国,胸外科医师主要探讨AEG纵隔区域淋巴结清扫范围,普外科医师主要探讨腹腔区域淋巴结清扫范围。很少有人关注AEG整体清扫范围的大小,尤其是对于主动脉旁淋巴结(Para-aortic lymph node, PALN)清扫的认识更少,因为转移阳性患者相对较少,术中清扫难度大,术后患者恢复慢,对于手术医师有较高的技术要求,国内外指南中并不推荐常规清扫主动脉旁淋巴结。目前关于进展期AEG中是否清扫主动脉旁淋巴结尚存在争议,本研究通过探索AEG主动脉旁淋巴结转移阳性的危险因素、观察患者预后生存情况,使临床医师对AEG这类疾病理解更加深入,制定出更有利于患者的手术方案。(本文后续主动脉旁淋巴结均以第16组淋巴结代指)
1 资料与方法
1.1 研究对象
回顾性收集2018年1月至2023年1月期间在山西省人民医院(山西医科大学第五临床医学院)诊断为食管胃结合部恶性肿瘤患者的临床病理资料。
1.1.1 纳入标准
临床病理资料完整;电子胃镜活检病理诊断为腺癌;首诊患者,治疗开始前未进行过任何治疗;行手术治疗的患者;行规范的淋巴结清扫;手术医师均为高年资主任医师。
1.1.2 排除标准
TNM分期为早期患者(病理分期为Ⅰ期);未行第16组淋巴结清扫术;不符合肿瘤手术整体性切除原则;术中发现其他脏器转移且无法切除的情况;围手术期死亡患者;其他严重疾病影响生存的患者;术后随访未超过3个月;淋巴结清扫数目<16个。
1.2 手术流程
对于SiewertⅠ型患者手术采用经胸入路,行食管次全切除和近端胃切除术;SiewertⅡ型、SiewertⅢ型患者手术优先采用经腹入路,术中视情况选择开胸手术,行近端胃或全胃根治性切除术,清扫D2+No.16组淋巴结。近端胃切除术淋巴结清扫范围包括No.1~No.4、No.7、No.8a、No.9、No.10、No.11p和No.11d;全胃切除术淋巴结清扫范围包括No.1~No.7、No.8a、No.8p、No.9、No.10、No.11p、No.11d和No.12;当肿瘤侵及食管时,清扫范围应包括No.19、No.20和No.110、No.111、No.112。近端胃切除后采用食管残胃吻合方式行消化道重建,全胃切除后消化道重建采用Roux-en-Y吻合方式。根据UICC/AJCC(国际抗癌联盟和美国癌症联合委员会)的TNM分期系统(第8版)记录患者肿瘤、淋巴结转移情况;根据日本《胃癌处理规约》(第14版)及日本食道学会发布的第12版《食管癌处理规约》定义各淋巴结分组编号。
1.3 资料收集
收集AEG患者围手术期资料以及术后1年、3年生存情况,以手术时间为起点,记录发生终点事件(死亡)的时间。随访方式主要为门诊复查、电话、微信等,随访时间截止2024年2月29日。
1.4 统计学方法
用SPSS27.0软件进行数据统计分析,采用描述性统计对一般临床病理资料进行统计;对影响第16组淋巴结转移的危险因素进行单因素χ2检验分析,以P<0.05的结果纳入多因素Logistic回归分析。生存分析采用Kaplan-Meier法,生存率比较采用Log rank检验。所有结果以P<0.05表示差异具有统计学意义。
2 结果
2.1 患者一般临床资料
224例AEG患者中,男190例,女34例,平均年龄64.45(40~89)岁,肿瘤平均最大径为4.64 cm,分化程度以中低分化为主(67.4%),行新辅助化疗的仅16例;Siewert分型中绝大多数患者为Ⅱ、Ⅲ型,Ⅰ型仅8例。病理分期中Ⅳ期52例,其中第16组淋巴结阳性51例,左肝转移1例,见表1。
表 1 患者一般临床病理资料Table 1 General clinicopathological data of patientsVariable n=224(%) Gender Male 190(84.8) Female 34(15.2) Age(years) 64.45(40-89) Siewert type Ⅰ 8(3.6) Ⅱ 151(67.4) Ⅲ 65(29.0) Neoadjuvant chemotherapy Yes 16(7.1) No 208(92.9) Maximum tumor diameter(cm) Mean 4.64(1-13) Degree of differentiation(adenocarcinoma) G1 7(3.1) G2 66(29.5) G3 52(23.2) G4 99(44.2) Pathologic stage Ⅱa 41(18.3) Ⅱb 47(21.0) Ⅲa 44(19.6) Ⅲb 33(14.7) Ⅲc 7(3.1) Ⅳ 52(23.2) T stage T2 18(8.0) T3 115(51.3) T4a 87(38.8) T4b 4(1.8) N stage N0 51(22.8) N1 42(18.8) N2 54(24.1) N3 77(34.4) Surgical modality Proximal gastrectomy 72(32.1) Total gastrectomy 152(67.9) 2.2 患者一般临床病理资料与第16组淋巴结转移相关的单因素分析
将224例AEG患者临床病理资料与第16组淋巴结转移情况行相关的单因素分析,可见第16组淋巴结转移与Siewert分型、肿瘤最大径、病理分期、T分期、N分期比较,差异均有统计学意义(P<0.05)。Siewert分型中Ⅲ型的第16组淋巴结转移阳性率最高为40%,Ⅰ型最低为12.5%。当肿瘤最大直径>6 cm时第16组淋巴结转移阳性率明显升高(47.4%)。51例第16组淋巴结转移阳性AEG患者肿瘤T分期均为3~4期,N分期均为2~3期,见表2。
表 2 一般临床病理资料与第16组淋巴结转移相关的单因素分析Table 2 Univariate analysis of general clinicopathological data related to No.16 lymph node metastasisVariable n (%) No.16 positive
metastasis rate/
% (n)χ2 P Gender 0.598 0.439 Male 190(84.8) 23.7(45) Female 34(15.2) 17.6(6) Age (years) 0.734 0.392 ≥70 64(28.6) 26.6(17) <70 160(71.4) 21.3(34) Siewert type 15.514 <0.001 Ⅰ 8(3.6) 12.5(1) Ⅱ 151(67.4) 15.9(24) Ⅲ 65(29.0) 40.0(26) Neoadjuvant
chemotherapy0.049 0.764 Yes 16(7.1) 25.0(4) No 208(92.9) 22.6(47) Maximum tumor
diameter(cm)15.750 <0.001 >6 38(17.0) 47.4(18) ≤6 186(83.0) 17.7(33) Degree of
differentiation0.794 0.373 G1-2 73(32.6) 19.2(14) G3-4 151(67.4) 24.5(37) Pathologic stage 218.422 <0.001 Ⅱ-Ⅲ 172(76.8) 0.0(0) Ⅳ 52(23.2) 98.1(51) T stage 5.770 0.015 T2 18(8.0) 0.0(0) T3-T4 206(92.0) 24.8(51) N stage 46.880 <0.001 N0-N1 93(41.5) 0.0(0) N2-N3 131(58.5) 38.9(51) 2.3 患者一般临床病理资料与第16组淋巴结转移相关的多因素分析
由于病理分期受T分期、N分期的直接影响,因此将病理分期除外,将上述其他一般临床资料中P<0.05的影响因素纳入Logistic回归模型中进行多因素分析,结果提示Siewert分型、肿瘤最大径均是第16组淋巴结转移阳性患者的高危因素(均P<0.05,OR值分别为3.235、4.173),见表3。
表 3 患者一般临床病理资料与第16组淋巴结转移相关的多因素Logistic分析Table 3 Multivariate Logistic analysis of general clinicopathological data of patients related to No.16 lymph node metastasisVariable Regression coefficient Standard error Wald Degree of freedom P OR (95%CI) Siewert type 1.174 0.320 13.472 1 <0.001 3.235 (1.728-6.055) Maximum tumor diameter 1.429 0.377 14.332 1 <0.001 4.173 (1.992-8.742) 2.4 各区域淋巴结与第16组淋巴结转移相关的单因素分析
将区域淋巴结中无转移的组别剔除,最终纳入的区域淋巴结有17组,将这17组区域淋巴结与第16组淋巴结转移进行相关单因素分析,见表4,结果提示No.1、 No.2、 No.3、 No.4、 No.7、 No.8a、No.8p、 No.9、 No.10、No.11p、 No.11d、 No.12、 No.110与第16组淋巴结转移阳性相关(均P<0.05)。
表 4 各区域淋巴结与第16组淋巴结转移相关的单因素分析Table 4 Univariate analysis of lymph nodes in each region associated with No.16 lymph node metastasisStation Positive rate in
each group
/%(n)No.16 positive
metastasis rate
/%(n)χ2 P No.1 53.1(119) 37.0(44) 29.140 <0.001 No.2 15.6(35) 40.0(14) 7.005 0.008 No.3 63.8(143) 32.9(47) 22.938 <0.001 No.4 20.1(45) 51.1(23) 25.727 <0.001 No.5 1.3(3) 66.7(2) 3.332 0.131 No.6 1.3(3) 66.7(2) 3.332 0.131 No.7 36.2(81) 49.4(40) 51.112 <0.001 No.8a 12.5(28) 67.9(19) 36.998 <0.001 No.8p 4.5(10) 90.0(9) 26.907 <0.001 No.9 9.4(21) 81.0(17) 44.613 <0.001 No.10 6.3(14) 78.6(11) 26.446 <0.001 No.11p 16.5(37) 67.6(25) 50.587 <0.001 No.11d 3.6(8) 62.5(5) 7.448 0.016 No.12 3.1(7) 85.7(6) 24.511 <0.001 No.110 12.9(29) 75.9(22) 53.405 <0.001 No.111 0.4(1) 100(1) 3.407 0.228 No.112 2.2(5) 60.0(3) 4.032 0.079 Notes: No.1: right lymph node of cardia; No.2: left lymph node of cardia; No.3: lymph nodes on the lesser curvature of the stomach; No.4: lymph nodes on the greater curvature of the stomach; No.5: suprapyloric lymph nodes; No.6: subpyloric lymph nodes; No.7: lymph nodes of left gastric artery; No.8a: anterior superior lymph nodes of common hepatic artery; No.8p: posterior lymph nodes of common hepatic artery; No.9: celiac trunk lymph nodes; No.10: splenic hilum lymph nodes; No.11p: proximal splenic artery lymph node; No.11d: distal splenic artery lymph nodes; No.12: lymph nodes within the hepatoduodenal ligament; No.110: periesophageal lymph nodes in the lower thoracic region; No.111: supradiaphragmatic lymph nodes; No.112: posterior mediastinal lymph nodes. 2.5 各区域淋巴结与第16组淋巴结转移相关的多因素分析
将上述与第16组淋巴结转移阳性相关的13个区域淋巴结纳入Logistic回归模型中进行多因素分析,结果提示No.7、No.11p、No.110为第16组淋巴结转移阳性高危因素(均P<0.05,OR值分别为3.029、5.214、11.101),见表5。
表 5 各组淋巴结与第16组淋巴结转移相关的多因素Logistic分析Table 5 Multivariate Logistic analysis of lymph nodes in each group associated with No.16 lymph node metastasisStation Regression coefficient Standard error Wald Degree of freedom P OR (95%CI) No.1 1.264 0.656 3.718 1 0.054 3.541(0.979-12.800) No.2 −0.644 0.733 0.771 1 0.380 0.525(0.125-2.211) No.3 1.064 0.753 1.999 1 0.157 2.899(0.663-12.676) No.4 0.410 0.635 0.418 1 0.518 1.508(0.435-5.229) No.7 1.108 0.563 3.877 1 0.049 3.029(1.005-9.126) No.8a 1.098 0.715 2.358 1 0.125 2.998(0.738-12.175) No.8p 0.745 1.510 0.243 1 0.622 2.106(0.109-40.655) No.9 1.153 0.832 1.919 1 0.166 3.168(0.620-16.191) No.10 1.099 0.996 1.217 1 0.270 3.002(0.426-21.162) No.11p 1.651 0.648 6.496 1 0.011 5.214(1.464-18.563) No.11d 1.648 1.074 2.353 1 0.125 5.195(0.633-42.641) No.12 1.789 1.243 2.356 1 0.131 5.196(0.725-40.256) No.110 2.407 0.646 13.881 1 <0.001 11.101(3.129-39.383) 2.6 No.7、No.11p、No.110淋巴结与第16组淋巴结转移关系
将上述影响第16组淋巴结转移阳性的高危因素进一步研究,显示当三组淋巴结转移均为阴性时,第16组淋巴结转移为阳性的概率仅为4.7%,而当其中至少一组淋巴结转移为阳性时,第16组淋巴结转移为阳性的概率上升至47.4%,见表6。
表 6 No.7、No.11p、No.110与第16组淋巴结转移率的关系Table 6 Relationship between the rate of lymph node metastasis between No.7, No.11p, No.110 and No.16Lymph node metastasis status in No.7, No.11p, No.110 No.16 lymph node metastasis status No.16 positive metastasis rate (%) Metastasis (–) Metastasis(+) All negative results 123 6 4.7 Positive results for at least a regional of lymph nodes 50 45 47.4 2.7 AEG患者第16组淋巴结转移的预后分析
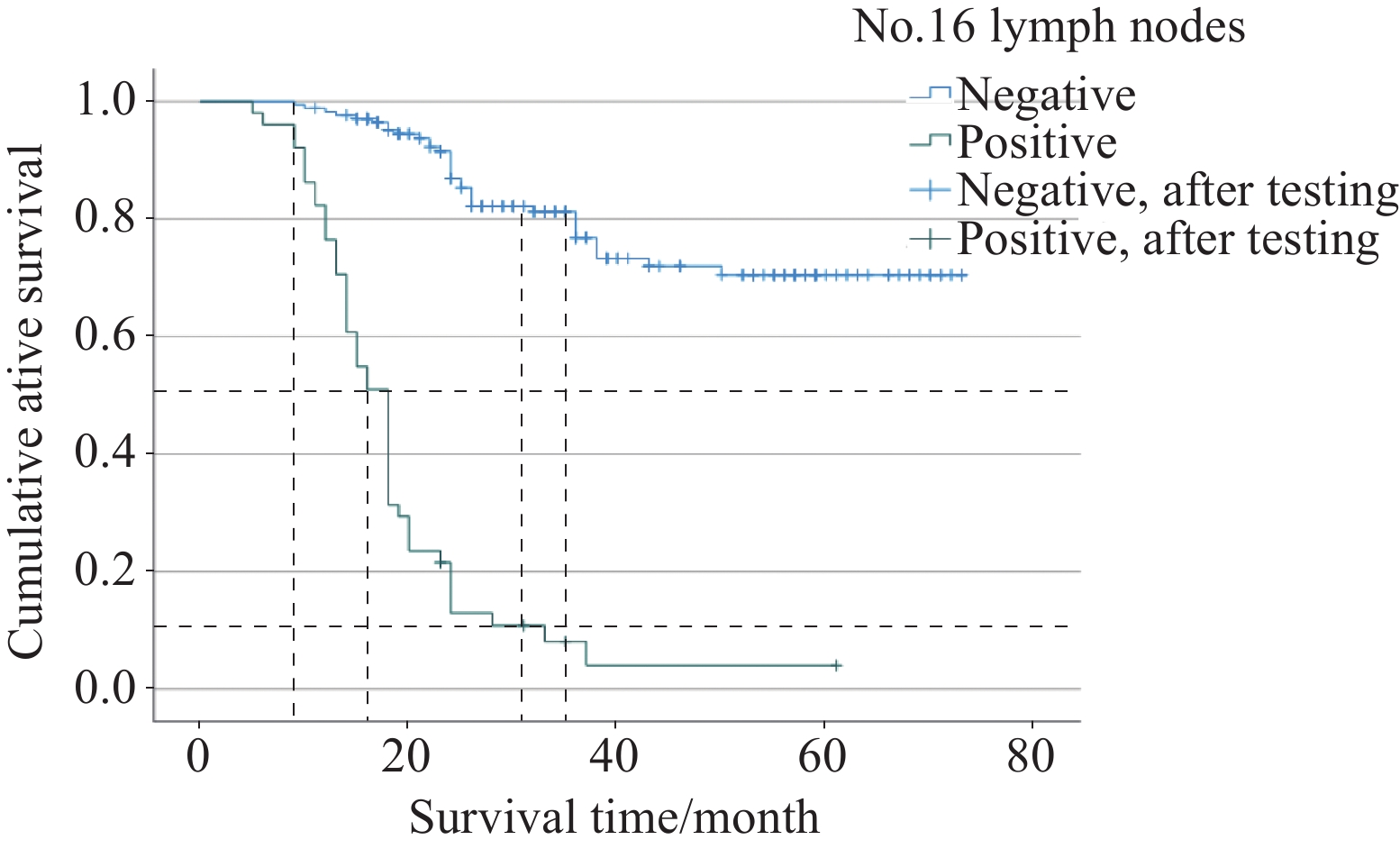
截止随访,51例第16组淋巴结转移阳性AEG患者中死亡47例,仅4例存活;173例第16组淋巴结转移阴性AEG患者中死亡35例,存活138例。使用Kaplan-Meier法绘制生存曲线图见图1。本次研究对象阳性AEG患者平均生存时间为19个月,阴性AEG患者为60个月,见表7。1年累计生存率阳性AEG患者为76.5%,阴性AEG患者为98.3%;3年累计生存率阳性AEG患者仅为8.1%,阴性AEG患者为76.8%。使用Log rank检验比较第16组淋巴结转移阳性与阴性两组患者术后的生存差异,结果显示第16组淋巴结转移阳性AEG患者1年、3年生存率明显低于阴性AEG患者,两组总生存率存在显著差异(P<0.001)。
表 7 第16组淋巴结转移患者生存分析时间的平均值Table 7 Mean value of the survival analysis time of patients with No.16 lymph node metastasisNo.16 lymph node
metastasis statusEstimate Standard
error95%CI Negative 59.780 1.926 56.005-63.555 Positive 18.998 1.644 15.776-22.220 Population 50.000 1.952 46.173-53.826 3 讨论
3.1 AEG患者一般临床病理特征是第16组淋巴结转移的基础
从美国国家癌症中心发布的全球癌症统计报告[3]中可见胃癌(包括AEG)是五大最常见癌症之一,死亡率为7.7%,排在肺癌、结直肠癌、肝癌之后。其中食管胃结合部恶性肿瘤的发病率呈现不断上升的趋势,西方国家中腺癌的上升速度显然已经超过鳞癌,亚洲国家目前发病率虽没有欧美地区高,但整体也呈现上升趋势[4]。Hosokawa等[5]的一项回顾性研究显示AEG患者按照Siewert分型时,Ⅱ、Ⅲ型比Ⅰ型更常见。在本研究中也得出了相同的结果,SiewertⅡ、Ⅲ型AEG患者占收集病例的76.8%。Hasegawa等[6]总结了AEG患者发病的平均年龄约为60岁,不同类型的肿瘤患者均以男性为主,其中SiewertⅢ型似乎比Ⅰ型和Ⅱ型更具有进展性。本研究中224例AEG患者平均年龄为64.45岁,男性占比84.8%,组织学分化程度G3~G4占比67.4%,病理分期为Ⅳ期的AEG患者中SiewertⅢ型占比50%(26/52),可见其进展程度之高。T分期中T3~T4期AEG患者占比92%,N分期中N2~N3期AEG患者占比58.5%,可见AEG患者确诊时大部分处于进展期,这是第16组淋巴结转移阳性的基础。
3.2 患者一般临床病理资料与第16组淋巴结转移特征的关系
患者一般临床病理的特征是导致第16组淋巴结转移阳性的重要影响因素之一,Nomura等[7]进行的著名前瞻性JCOG9501试验表明,N分期和肿瘤直径≥5 cm是第16组淋巴结转移阳性的重要危险因素。Kurokawa等[8]进行的一项全日本前瞻性多中心研究试验,对象为食管胃结合部2.0 cm范围内T2~T4期的腺癌或鳞癌患者,显示肿瘤直径>6 cm时第16组淋巴结转移阳性率为10.1%。意大利学者de Manzoni等[9]的研究表明T分期、肿瘤位置、组织学分级均会增加第16组淋巴结转移阳性的风险。Liang等[10]的研究表明N分期是第16组淋巴结转移阳性的重要和独立危险因素,当N分期由N1逐渐增加到N3b时,第16组淋巴结转移阳性的发生率由16.1%增加到69%,此外肿瘤位置、组织学分级均会增加淋巴结转移阳性的概率。本研究中发现AEG患者的Siewert分型、肿瘤最大径、病理分期、T分期、N分期均与第16组淋巴结转移阳性相关。有趣的是这其中51例第16组淋巴结转移阳性患者T分期均为T3~T4,N分期均为N2~N3,表明AEG患者肿瘤深度达到浆膜下组织、淋巴结转移阳性至少≥3枚时才会出现第16组淋巴结转移阳性的概率。Siewert分型、肿瘤最大径是AEG患者第16组淋巴结转移阳性的独立危险因素。SiewertⅢ型AEG患者第16组淋巴结转移阳性率明显高于另外两种分型,根据肿瘤解剖位置来看Ⅲ型AEG更偏向胃远端侧,肿瘤浸润扩散时优先胃端受侵,距离主动脉更近,因此SiewertⅢ型AEG患者第16组淋巴结转移阳性率高于另外两种分型。当肿瘤最大径>6 cm时AEG患者第16组淋巴结转移阳性率显著高于<6 cm的患者,因肿瘤直径越大发生转移扩散的概率越大,从而第16组淋巴结转移阳性概率的风险增加。因此建议对SiewertⅢ型、肿瘤最大径>6 cm、T3~T4期、N2~3期的晚期AEG患者行第16组淋巴结清扫术,尤其是16a2、16b1这两个亚型淋巴结的清扫。而对于SiewertⅠ、Ⅱ型、肿瘤最大径<6 cm、T2、N0~1的中期AEG患者,手术医师根据术中情况酌情行第16组淋巴结清扫。目前这类患者第16组淋巴结清扫与否存在争议,无权威的循证医学证据,因此我们认为国际性、多中心、前瞻性试验是有必要的。
3.3 各区域淋巴结清扫
AEG患者术中淋巴结清扫是预后生存重要的影响因素,多个研究结果表明清扫No.1、No.2、No.3、No.7淋巴结获益最大,国际上以日本学者的研究为主要代表,其中Fujitani等[11]进行的一项多中心研究结果显示晚期SiewertⅡ型AEG患者淋巴结转移>10%的有No.1、No.2、No.3、No.7、No.11淋巴结,以淋巴结清扫估计效益指数(Index of estimated benefit from lymph node dissection,IEBLD)为衡量标准,其中No.1、No.3、No.11淋巴结清扫获益较高,No.2、No.7淋巴结清扫次之。Goto等[12]的一项研究纳入132例行根治性切除术AEG患者,明确淋巴结清扫的最佳范围,结果表明SiewertⅡ、Ⅲ型AEG患者清扫范围不同,其中SiewertⅡ型转移率>10%的有No.1、No.2、No.3、No.7、No.12淋巴结,SiewertⅢ型转移率>10%的有No.1、No.2、No.3、No.4、No.7、No.9、No.11p淋巴结。在清扫效益方面,No.1、No.3、No.7淋巴结均获益较高,但SiewertⅢ型中清扫No.2、No.10淋巴结获益也较高。之后Yoshikawa等[13]研究显示淋巴结转移率>10%的有No.1、No.2、No.3、No.7、No.9、No.11p、No.16a2、No.16b1、No.110淋巴结,No.5、No.6、No.12淋巴结转移率最低,为0.8%~1.7%。在淋巴结清扫获益方面,No.1、No.2、No.3、No.7、No.110淋巴结清扫均有较高获益。近些年我国学者也进行了这方面的大量研究,其中Wang等[14]分析了1 008例接受经腹全胃切除术的Ⅱ/Ⅲ型AEG患者,表明SiewertⅡ、Ⅲ型AEG患者中No.2、No.3、No.7淋巴结清扫均获益,IEBLD均>10%,No.9淋巴结IEBLD均为5%~10%之间,不同的是SiewertⅡ型AEG患者No.1淋巴结IEBLD>10%而Ⅲ型却<10%。Cai等[15]回顾性分析了395例晚期SiewertⅡ、Ⅲ型AEG患者的临床病理数据,结果提示No.1、No.2、No.3、No.7、No.9、No.11p淋巴结在两种分型中清扫获益最高,No.4、No.8a、No.10淋巴结在SiewertⅢ型中清扫获益远高于SiewertⅡ型AEG患者,且得出No.10淋巴结清扫可提高SiewertⅢ型AEG患者生存率。今年发表的由Chen等[16]纳入12项研究、涉及3 513例AEG患者的Meta分析结果表明,No.1、No.2、No.3、No.7、No.8a、No.9、No.11p淋巴结在AEG患者SiewertⅡ、Ⅲ型中需要手术常规清扫,SiewertⅡ型中尤其对No.110淋巴结的清扫可以提高患者的存活率。虽然上述学者报告的结果存在差异,但手术中关于No.1、No.2、No.3、No.7淋巴结清扫是各专家学者一致的观点,证明AEG患者行D2根治性手术的合理性。在本研究中,No.1、No.2、No.3、No.4、No.7、No.8a、No.11p、No.110淋巴结转移阳性率均>10%,No.5、No.6淋巴结转移率均较小,与之前研究结果相似,再一次证明了进展期AEG患者行D2根治术的重要性,尤其需要手术医师重点清扫贲门周围、胃上区及胰腺上区的淋巴结,使患者得到最佳的外科手术治疗。
3.4 各区域淋巴结与第16组淋巴结转移的关系
主动脉旁淋巴结在解剖学上被定义为主动脉裂孔和主动脉分叉之间的区域淋巴结。根据淋巴结分组编号可见主动脉旁淋巴结被分为4个亚组,分别为16a1(主动脉裂孔周围淋巴结)、16a2(腹腔干动脉上缘至左肾静脉下缘之间的主动脉周围淋巴结)、16b1(左肾静脉下缘至肠系膜下动脉上缘之间的主动脉周围淋巴结)和16b2(肠系膜下动脉上缘至主动脉分叉之间的主动脉周围淋巴结),进展期AEG最常见转移的是16a2、16b1。根据解剖学常规淋巴液回流规律来看,虽然在食管与胃连接处,胃的淋巴管与食管下段的淋巴管网相通,在胃的远端与十二指肠、胰腺的淋巴管网相通,但大体上淋巴液由胃淋巴管网流向胃周淋巴结(第一站),到达腹腔动脉淋巴结(第二站),之后到达主动脉旁淋巴结(第三站)。因此,主动脉旁淋巴结通常被认为是胃淋巴结引流的最终区域淋巴结,理论上当对它进行术中清扫时,可以有效避免淋巴结全身转移的风险。Nomura等[7]认为转移至主动脉旁淋巴结可能存在以下几个引流途径:(1)贲门左淋巴结(No.2);(2)脾动脉旁淋巴结(No.11p);(3)腹腔干淋巴结(No.9);(4)肠系膜上动脉淋巴结(No.14a);(5)胰头后淋巴结(No.13);(6)肝总动脉后淋巴结(No.8p),但是目前为止最常进入主动脉旁淋巴结的途径仍没有定论。因此,许多淋巴结转移与主动脉旁淋巴结转移阳性相关。例如No.1、No.2、No.3、No.4d、No.4sb、No.5、No.6、No.7、No.8a、No.8p、No.9、No.11 p、No.12、No.14淋巴结转移可能与其阳性相关,其中No.1、No.3、No.7、No.9淋巴结转移的比值明显高于其他淋巴结转移[17]。此外,No.7、No.9淋巴结是最常见的主动脉旁淋巴结转移阳性的途径,转移很可能是从胃左动脉淋巴结到达腹腔干动脉淋巴结。No.7、No.9淋巴结转移阳性已被确定为主动脉旁淋巴结转移阳性发生率高的指标。然而No.8淋巴结也被经常认为与主动脉旁淋巴结转移阳性相关。本研究共纳入17组区域淋巴结,通过单因素分析显示除外No.5、No.6、No.111、No.112淋巴结,其余区域淋巴结均与第16组淋巴结转移阳性相关,这与Junfeng Zhou等[17]研究结论相同。将相关区域淋巴结进一步行多因素分析后表明No.7、No.11p、No.110淋巴结阳性是第16组淋巴结转移阳性的高危因素,其中No.7、No.11p淋巴结途径与上述大量研究结论一致。不一致的是No.110淋巴结,在本研究中转移阳性率为12.9%(29/224),考虑引起第16组淋巴结转移阳性的可能原因为:(1)本研究AEG患者多数病理分期偏晚,肿瘤直径较大、分化程度低、T分期、N分期晚,淋巴结转移既通过胃与食管周围淋巴管网向上转移,又通过腹腔区域淋巴结转移到主动脉旁;(2)通过主动脉裂孔淋巴网扩散种植;(3)游离癌细胞直接跳跃转移,因第16组淋巴结位于后腹膜、位置深、范围广,一旦淋巴结转移阳性时很容易造成扩散。进一步我们将No.7、No.11p、No.110淋巴结看成一个整体,重新分为两组:分别是三组淋巴结均未转移、至少一组淋巴结转移阳性(表6),当存在至少一组区域淋巴结阳性时,第16组淋巴结转移为阳性的概率明显高于阴性组。这给我们提供了清扫第16组淋巴结的一种方法,行术中淋巴结病理冰冻活检,当确定No.7、No.11p、No.110淋巴结中存在转移阳性时,尤其是No.7、No.11p淋巴结转移阳性,再行第16组淋巴结清扫术,有助于临床手术医师行个体化手术治疗方案。暂时没有高级别的循证医学证据证实其他区域淋巴结与第16组淋巴结转移阳性的明确关系,或者它们之间是否存在确切的淋巴引流通道[18],需要进行多中心、前瞻性临床试验来确定相关因素的可靠性,以获得准确的临床干预措施。
3.5 清扫主动脉旁淋巴结患者的生存分析
当第16组淋巴结转移阳性时,根据日本《胃癌处理规约》(第14版)中将其划归为远处转移(M1),预后差。Sasako等[19]进行的一项前瞻性随机对照试验,比较D2淋巴结清扫与D2+主动脉旁淋巴结清扫(Para-aortic lymph node dissection,PAND)在胃切除手术患者中的疗效,结果显示术后5年总生存率间比较两者差异无统计学意义,反而行PAND术后相关并发症概率增加(28.1% vs. 20.9%,P=0.07),但其主要并发症(吻合口瘘、胰瘘、腹腔脓肿、肺炎)差异无统计学意义,第16组淋巴结转移阳性率为8.5%,清扫效益很低,因此不建议行预防性PAND术。这一结果存在一些局限性:研究对象为胃癌而不是AEG;T分期中T4患者13人(n=523),占比仅2.5%,我国绝大多数AEG患者发现时基本处于T3~T4期,早期较少[20],所以不能简单地适用于AEG患者。在临床实践中,常常观察到AEG患者在该区域淋巴结存在转移,可能是由于肿瘤解剖位置上更靠近主动脉区域,尤其Siewert Ⅲ型AEG患者。随后Yabusaki等[21]的一项回顾性研究表明AEG患者5年总生存率为47.2%,其中第16组淋巴结转移阳性率为20.8%,且行PAND术有效。Hasegawa等[22]的一项前瞻性试验结果显示第16组淋巴结转移阳性率为10.9%,进一步根据分型分析发现Siewert Ⅱ型AEG中转移率与IEBLD分别为5.4%和0%,Siewert Ⅲ型分别为22.2%和5.6%,未单独进行预后分析。而Yoshikawa等[13]进行的一项包含431例食管胃交界处恶性肿瘤(381例腺癌,50例鳞癌)患者的研究结果表明AEG患者5年总生存率为60.4%,其中第16组淋巴结转移阳性AEG患者5年总生存率为16.7%。国内学者也对第16组淋巴结转移阳性AEG患者进行了研究,其中Zhang等[23]研究显示第16组淋巴结转移阳性患者5年总生存率为15.6%,平均生存时间为32个月,中位生存期为18个月。近期Chen等[16]的研究显示第16组淋巴结转移(No.16a2、No.16b1)和No.110淋巴结的转移阳性率超过10%,明确转移阳性时生存时间均未超过5年。本研究中,第16组淋巴结转移阳性率为22.8%(51/224),第16组淋巴结转移阳性AEG患者平均生存时间为19个月,1年、3年累计生存率为76.5%、8.1%,尤其是3年累计生存率明显低于转移阴性患者的生存率,两者统计学差异显著(P<0.001)。
3.6 本研究局限性
本研究有几个局限性:(1)这是单中心进行的回顾性病例研究,并且均由普外科医师进行手术,样本中SiewertⅠ型患者仅8例(3.6%);(2)手术医师对于术中淋巴结清扫范围存在认识上的差异,并非所有患者都行各区域淋巴结清扫术;(3)未收集患者食管侵犯长度,不能明确No.110淋巴结转移的相关因素;(4)主动脉旁淋巴结各亚组阳性样本数量小,未进行亚组对比分析;(5)病理医师对于术后病理报告中部分区域淋巴结分组描述不规范,数据可能存在偏差;(6)研究人群只是山西省部分区域,不确定数据与其他研究中心是否存在偏差;(7)未评估术后化疗对患者预后的影响。今后的研究还需要进一步突破以上局限。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:牛 权:数据收集、整理、统计分析,文章撰写毕小刚:文章审阅及修改 -
表 1 患者一般临床病理资料
Table 1 General clinicopathological data of patients
Variable n=224(%) Gender Male 190(84.8) Female 34(15.2) Age(years) 64.45(40-89) Siewert type Ⅰ 8(3.6) Ⅱ 151(67.4) Ⅲ 65(29.0) Neoadjuvant chemotherapy Yes 16(7.1) No 208(92.9) Maximum tumor diameter(cm) Mean 4.64(1-13) Degree of differentiation(adenocarcinoma) G1 7(3.1) G2 66(29.5) G3 52(23.2) G4 99(44.2) Pathologic stage Ⅱa 41(18.3) Ⅱb 47(21.0) Ⅲa 44(19.6) Ⅲb 33(14.7) Ⅲc 7(3.1) Ⅳ 52(23.2) T stage T2 18(8.0) T3 115(51.3) T4a 87(38.8) T4b 4(1.8) N stage N0 51(22.8) N1 42(18.8) N2 54(24.1) N3 77(34.4) Surgical modality Proximal gastrectomy 72(32.1) Total gastrectomy 152(67.9) 表 2 一般临床病理资料与第16组淋巴结转移相关的单因素分析
Table 2 Univariate analysis of general clinicopathological data related to No.16 lymph node metastasis
Variable n (%) No.16 positive
metastasis rate/
% (n)χ2 P Gender 0.598 0.439 Male 190(84.8) 23.7(45) Female 34(15.2) 17.6(6) Age (years) 0.734 0.392 ≥70 64(28.6) 26.6(17) <70 160(71.4) 21.3(34) Siewert type 15.514 <0.001 Ⅰ 8(3.6) 12.5(1) Ⅱ 151(67.4) 15.9(24) Ⅲ 65(29.0) 40.0(26) Neoadjuvant
chemotherapy0.049 0.764 Yes 16(7.1) 25.0(4) No 208(92.9) 22.6(47) Maximum tumor
diameter(cm)15.750 <0.001 >6 38(17.0) 47.4(18) ≤6 186(83.0) 17.7(33) Degree of
differentiation0.794 0.373 G1-2 73(32.6) 19.2(14) G3-4 151(67.4) 24.5(37) Pathologic stage 218.422 <0.001 Ⅱ-Ⅲ 172(76.8) 0.0(0) Ⅳ 52(23.2) 98.1(51) T stage 5.770 0.015 T2 18(8.0) 0.0(0) T3-T4 206(92.0) 24.8(51) N stage 46.880 <0.001 N0-N1 93(41.5) 0.0(0) N2-N3 131(58.5) 38.9(51) 表 3 患者一般临床病理资料与第16组淋巴结转移相关的多因素Logistic分析
Table 3 Multivariate Logistic analysis of general clinicopathological data of patients related to No.16 lymph node metastasis
Variable Regression coefficient Standard error Wald Degree of freedom P OR (95%CI) Siewert type 1.174 0.320 13.472 1 <0.001 3.235 (1.728-6.055) Maximum tumor diameter 1.429 0.377 14.332 1 <0.001 4.173 (1.992-8.742) 表 4 各区域淋巴结与第16组淋巴结转移相关的单因素分析
Table 4 Univariate analysis of lymph nodes in each region associated with No.16 lymph node metastasis
Station Positive rate in
each group
/%(n)No.16 positive
metastasis rate
/%(n)χ2 P No.1 53.1(119) 37.0(44) 29.140 <0.001 No.2 15.6(35) 40.0(14) 7.005 0.008 No.3 63.8(143) 32.9(47) 22.938 <0.001 No.4 20.1(45) 51.1(23) 25.727 <0.001 No.5 1.3(3) 66.7(2) 3.332 0.131 No.6 1.3(3) 66.7(2) 3.332 0.131 No.7 36.2(81) 49.4(40) 51.112 <0.001 No.8a 12.5(28) 67.9(19) 36.998 <0.001 No.8p 4.5(10) 90.0(9) 26.907 <0.001 No.9 9.4(21) 81.0(17) 44.613 <0.001 No.10 6.3(14) 78.6(11) 26.446 <0.001 No.11p 16.5(37) 67.6(25) 50.587 <0.001 No.11d 3.6(8) 62.5(5) 7.448 0.016 No.12 3.1(7) 85.7(6) 24.511 <0.001 No.110 12.9(29) 75.9(22) 53.405 <0.001 No.111 0.4(1) 100(1) 3.407 0.228 No.112 2.2(5) 60.0(3) 4.032 0.079 Notes: No.1: right lymph node of cardia; No.2: left lymph node of cardia; No.3: lymph nodes on the lesser curvature of the stomach; No.4: lymph nodes on the greater curvature of the stomach; No.5: suprapyloric lymph nodes; No.6: subpyloric lymph nodes; No.7: lymph nodes of left gastric artery; No.8a: anterior superior lymph nodes of common hepatic artery; No.8p: posterior lymph nodes of common hepatic artery; No.9: celiac trunk lymph nodes; No.10: splenic hilum lymph nodes; No.11p: proximal splenic artery lymph node; No.11d: distal splenic artery lymph nodes; No.12: lymph nodes within the hepatoduodenal ligament; No.110: periesophageal lymph nodes in the lower thoracic region; No.111: supradiaphragmatic lymph nodes; No.112: posterior mediastinal lymph nodes. 表 5 各组淋巴结与第16组淋巴结转移相关的多因素Logistic分析
Table 5 Multivariate Logistic analysis of lymph nodes in each group associated with No.16 lymph node metastasis
Station Regression coefficient Standard error Wald Degree of freedom P OR (95%CI) No.1 1.264 0.656 3.718 1 0.054 3.541(0.979-12.800) No.2 −0.644 0.733 0.771 1 0.380 0.525(0.125-2.211) No.3 1.064 0.753 1.999 1 0.157 2.899(0.663-12.676) No.4 0.410 0.635 0.418 1 0.518 1.508(0.435-5.229) No.7 1.108 0.563 3.877 1 0.049 3.029(1.005-9.126) No.8a 1.098 0.715 2.358 1 0.125 2.998(0.738-12.175) No.8p 0.745 1.510 0.243 1 0.622 2.106(0.109-40.655) No.9 1.153 0.832 1.919 1 0.166 3.168(0.620-16.191) No.10 1.099 0.996 1.217 1 0.270 3.002(0.426-21.162) No.11p 1.651 0.648 6.496 1 0.011 5.214(1.464-18.563) No.11d 1.648 1.074 2.353 1 0.125 5.195(0.633-42.641) No.12 1.789 1.243 2.356 1 0.131 5.196(0.725-40.256) No.110 2.407 0.646 13.881 1 <0.001 11.101(3.129-39.383) 表 6 No.7、No.11p、No.110与第16组淋巴结转移率的关系
Table 6 Relationship between the rate of lymph node metastasis between No.7, No.11p, No.110 and No.16
Lymph node metastasis status in No.7, No.11p, No.110 No.16 lymph node metastasis status No.16 positive metastasis rate (%) Metastasis (–) Metastasis(+) All negative results 123 6 4.7 Positive results for at least a regional of lymph nodes 50 45 47.4 表 7 第16组淋巴结转移患者生存分析时间的平均值
Table 7 Mean value of the survival analysis time of patients with No.16 lymph node metastasis
No.16 lymph node
metastasis statusEstimate Standard
error95%CI Negative 59.780 1.926 56.005-63.555 Positive 18.998 1.644 15.776-22.220 Population 50.000 1.952 46.173-53.826 -
[1] Rodriguez GM, DePuy D, Aljehani M, et al. Trends in epidemiology of esophageal cancer in the US, 1975-2018[J]. JAMA Netw Open, 2023, 6(8): e2329497. doi: 10.1001/jamanetworkopen.2023.29497
[2] 中国医师协会内镜医师分会腹腔镜外科专业组, 国际食管疾病学会中国分会, 中国食管胃结合部腺癌研究协作组, 等. 食管胃结合部腺癌外科治疗中国专家共识(2024年版)[J]. 中华胃肠外科杂志, 2024, 27(2): 109-126. [Laparoscopic Surgery Group of the Endoscopist Branch in the Chinese Medical Doctor Association (CMDA), Chinese Society for Diseases of the Esophagus (CSDE), China Esophageal Gastric Junction Adenocarcinoma Research Collaboration Group, et al. Chinese expert consensus on the surgical treatment for adenocarcinoma of esophagogastric junction (Edition 2024)[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2024, 27(2): 109-126.] doi: 10.3760/cma.j.cn441530-20231212-00213 Laparoscopic Surgery Group of the Endoscopist Branch in the Chinese Medical Doctor Association (CMDA), Chinese Society for Diseases of the Esophagus (CSDE), China Esophageal Gastric Junction Adenocarcinoma Research Collaboration Group, et al. Chinese expert consensus on the surgical treatment for adenocarcinoma of esophagogastric junction (Edition 2024)[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2024, 27(2): 109-126. doi: 10.3760/cma.j.cn441530-20231212-00213
[3] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[4] Manabe N, Matsueda K, Haruma K. Epidemiological Review of Gastroesophageal Junction Adenocarcinoma in Asian Countries[J]. Digestion, 2022, 103(1): 29-36. doi: 10.1159/000519602
[5] Hosokawa Y, Kinoshita T, Konishi M, et al. Clinicopathological features and prognostic factors of adenocarcinoma of the esophagogastric junction according to Siewert classification: experiences at a single institution in Japan[J]. Ann Surg Oncol, 2012, 19(2): 677-683. doi: 10.1245/s10434-011-1983-x
[6] Hasegawa S, Yoshikawa T. Adenocarcinoma of the esophagogastric junction: incidence, characteristics, and treatment strategies[J]. Gastric Cancer, 2010, 13(2): 63-73. doi: 10.1007/s10120-010-0555-2
[7] Nomura E, Sasako M, Yamamoto S, et al. Gastric Cancer Surgical Study Group of the Japan Clinical Oncology Group. Risk factors for para-aortic lymph node metastasis of gastric cancer from a randomized controlled trial of JCOG9501[J]. Jpn J Clin Oncol, 2007, 37(6): 429-433. doi: 10.1093/jjco/hym067
[8] Kurokawa Y, Takeuchi H, Doki Y, et al. Mapping of Lymph Node Metastasis From Esophagogastric Junction Tumors: A Prospective Nationwide Multicenter Study[J]. Ann Surg, 2021, 274(1): 120-127. doi: 10.1097/SLA.0000000000003499
[9] de Manzoni G, Di Leo A, Roviello F, et al. Tumor site and perigastric nodal status are the most important predictors of para-aortic nodal involvement in advanced gastric cancer[J]. Ann Surg Oncol, 2011, 18(8): 2273-2280. doi: 10.1245/s10434-010-1547-5
[10] Liang H, Deng J. Evaluation of rational extent lymphadenectomy for local advanced gastric cancer[J]. Chin J Cancer Res, 2016, 28(4): 397-403. doi: 10.21147/j.issn.1000-9604.2016.04.02
[11] Fujitani K, Miyashiro I, Mikata S, et al. Pattern of abdominal nodal spread and optimal abdominal lymphadenectomy for advanced Siewert type Ⅱ adenocarcinoma of the cardia: results of a multicenter study[J]. Gastric Cancer, 2013, 16(3): 301-308. doi: 10.1007/s10120-012-0183-0
[12] Goto H, Tokunaga M, Miki Y, et al. The optimal extent of lymph node dissection for adenocarcinoma of the esophagogastric junction differs between Siewert type Ⅱ and Siewert type Ⅲ patients[J]. Gastric Cancer, 2014, 18(2): 375-381.
[13] Yoshikawa T, Takeuchi H, Hasegawa S, et al. Theoretical therapeutic impact of lymph node dissection on adenocarcinoma and squamous cell carcinoma of the esophagogastric junction[J]. Gastric Cancer, 2016, 19(1): 143-149. doi: 10.1007/s10120-014-0439-y
[14] Wang JB, Lin MQ, Li P, et al. The prognostic relevance of parapyloric lymph node metastasis in Siewert type Ⅱ/Ⅲ adenocarcinoma of the esophagogastric junction[J]. Eur J Surg Oncol, 2017, 43(12): 2333-2340. doi: 10.1016/j.ejso.2017.08.017
[15] Cai MZ, Lv CB, Cai LS, et al. Priority of lymph node dissection for advanced esophagogastric junction adenocarcinoma with the tumor center located below the esophagogastric junction[J]. Medicine (Baltimore), 2019, 98(51): e18451. doi: 10.1097/MD.0000000000018451
[16] Chen XD, Chen QC, Xu R, et al. Therapeutic value of lymph node dissection for Siewert type Ⅱ and Ⅲ adenocarcinoma: meta-analysis[J]. BJS Open, 2024, 8(1): zrad138. doi: 10.1093/bjsopen/zrad138
[17] Junfeng Z, Yingxue H, Peiwu Y. Systematic review of risk factors for metastasis to para-aortic lymph nodes in gastric cancer[J]. Surg Oncol, 2013, 22(4): 210-216. doi: 10.1016/j.suronc.2013.10.003
[18] Dong YP, Deng JY. Advances in para-aortic nodal dissection in gastric cancer surgery: A review of research progress over the last decade[J]. World J Clin Cases, 2020, 8(13): 2703-2716. doi: 10.12998/wjcc.v8.i13.2703
[19] Sasako M, Sano T, Yamamoto S, et al. D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer[J]. N Engl J Med, 2008, 359(5): 453-462. doi: 10.1056/NEJMoa0707035
[20] Liu K, Yang K, Zhang W, et al. Changes of Esophagogastric Junctional Adenocarcinoma and Gastroesophageal Reflux Disease Among Surgical Patients During 1988-2012: A Single-institution, High-volume Experience in China[J]. Ann Surg, 2016, 263(1): 88-95. doi: 10.1097/SLA.0000000000001148
[21] Yabusaki H, Nashimoto A, Matsuki A, et al. Comparison of the surgical treatment strategies for Siewert type Ⅱ squamous cell carcinoma in the same area as esophagogastric junction carcinoma: data from a single Japanese high-volume cancer center[J]. Surg Today, 2014, 44(8): 1522-1528. doi: 10.1007/s00595-013-0773-4
[22] Hasegawa S, Yoshikawa T, Rino Y, et al. Priority of lymph node dissection for Siewert type Ⅱ/Ⅲ adenocarcinoma of the esophagogastric junction[J]. Ann Surg Oncol, 2013, 20(13): 4252-4259. doi: 10.1245/s10434-013-3036-0
[23] Zhang C, He Y, Schwarz RE, et al. Evaluation of para-aortic nodal dissection for locoregionally advanced gastric cancer with 1-3 involved para-aortic nodes[J]. Chin Med J (Engl), 2014, 127(3): 435-441. doi: 10.3760/cma.j.issn.0366-6999.20130664



 下载:
下载: