Inhibitory Effect of UHRF1 on Invasion and Migration of Colorectal Cancer Cells via WNT/MMP9 Signaling Pathway
-
摘要:目的
探索UHRF1基因与结直肠癌(CRC)患者临床病理特性的关系,慢病毒转染过表达和敲减UHRF1对CRC细胞增殖、侵袭及迁移的影响及可能的信号通路。
方法免疫组织化学和RT-PCR法检测112例CRC癌组织与癌旁组织UHRF1的表达。构建慢病毒转染过表达和敲减UHRF1载体,分别转染SW480和HCT116细胞株,RT-PCR和Western blot检测转染前后及IWP-2(WNT拮抗剂)和HLY78(WNT活化剂)干预前后的UHRF1、WNT信号通路关键分子和MMP9的表达。EDU检测细胞增殖能力;Transwell实验检测细胞迁移和侵袭能力。
结果(1)TCGA数据库和临床数据中,癌组织中UHRF1 mRNA和蛋白表达均高于正常组织。UHRF1表达量与TNM分期、N和M分期密切相关。TCGA中UHRF1低表达患者有更长的5年OS和疾病相关存活时间(DSS),UHRF1预测1、3和5年OS的ROC曲线下面积(AUC)分别为0.634、0.652和0.771;在临床数据中3年OS也有相同生存获益,UHRF1高表达是CRC不良预后因素。(2)过表达UHRF1后,SW480中WNT3a、GSK3β和MMP9分子表达明显升高,p-β-catenin表达下降(P < 0.05);敲减UHRF1后,HCT116细胞中WNT3a、GSK3β、MMP9表达下降,而p-β-catenin表达升高(P < 0.05);分别用IWP-2和HLY78进行“拯救”实验,能够获得一致结果。(3)过表达组细胞增殖、迁移和侵袭能力明显高于对照组;IWP-2处理后,细胞增殖、迁移及侵袭能力则受到抑制。敲减实验呈现与过表达实验相反的结果。
结论UHRF1在CRC发生发展中可能具有重要作用,UHRF1高表达可能是CRC不良预后因素,UHRF1可能通过WNT/MMP9信号通路来影响CRC的增殖、迁移和侵袭。
-
关键词:
- 结直肠癌 /
- UHRF1 /
- WNT/MMP9信号通路 /
- 增殖 /
- 侵袭
Abstract:ObjectiveTo explore the relationship of UHRF1 with the clinicopathological characteristics of colorectal cancer (CRC) patients, as well as the effects of lentivirus transfection overexpression and knockdown of UHRF1 on the proliferation, invasion, and migration of CRC cells and the possible signaling pathways.
MethodsThe expression of UHRF1 mRNA and protein in CRC tissues and adjacent tissues was detected by immunohistochemical staining and RT-PCR. The effects of the constructed UHRF1 overexpression- and knockdown-group cells on the expression of UHRF1, related molecules in the WNT signaling pathway, and MMPR9 were examined by Western blot and RT-PCR. EDU and Transwell assays were used to detect changes in the proliferation, migration, and invasion of CRC cells.
Results(1) In the TCGA database and clinical data, the mRNA and protein expression levels of UHRF1 in CRC cancer tissues were significantly higher than those in adjacent normal tissues. UHRF1 expression was closely correlated with TNM stage, N stage, and M stage. Patients with low UHRF1 expression in TCGA had better 5-year OS and disease-specific survival. The area under the ROC curve of UHRF1 for predicting 1-, 3-, and 5-year OS were 0.634, 0.652, and 0.771, respectively. The 3-year OS in the clinical data also showed the same survival benefit. UHRF1 overexpression was a poor prognostic factor for CRC patients. (2) After UHRF1 overexpression, the expression of WNT3a, GSK3β, and MMP9 in SW480 cells significantly increased, whereas the expression of p-β-catenin decreased (P < 0.05). After UHRF1 knockdown, the expression of WNT3a, GSK3β, and MMP9 in HCT116 cells decreased, whereas the expression of p-β-catenin increased (P < 0.05). The "rescue" experiment with IWP-2 and HLY78 can produce consistent results. (3) Compared with the control group, the cell proliferation, migration, and invasion abilities of the UHRF1 overexpression group were enhanced. After IWP-2 treatment, the cell proliferation, migration, and invasion abilities were inhibited. Knockdown experiment exhibited the reverse results to overexpression experiment.
ConclusionUHRF1 may play an important role in the occurrence and development of CRC. UHRF1 overexpression may be a poor prognostic factor for CRC patients. UHRF1 may affect the proliferation, migration, and invasion of CRC cells through the WNT/MMP9 signaling pathway.
-
Key words:
- Colorectal cancer /
- UHRF1 /
- WNT/MMP9 signaling pathway /
- Proliferation /
- Invasion
-
0 引言
结直肠癌是最常见恶性肿瘤之一,发病率仍然高居全球第三,死亡率居全球第二[1-3]。转移是CRC患者疗效不佳和高死亡率发生的重要因素[4-5]。CRC发生发展过程中需要多种不同的表观遗传学机制驱动[6]。类泛素样含PHD和环指域蛋白(ubiquitin-like PHD and ring finger domains, UHRF)1是一个多功能结构域蛋白,能够识别和修饰不同的染色质,从而发挥不同的生物学功能,特别在表观遗传学修饰方面[7]。UHRF1通过运用其特殊的结构域来参与表观遗传标记的传递[8-9]。UHRF1是一种已知的、负责维持细胞表观遗传的蛋白[10-11],被认为与细胞的快速增长和DNA修复密切相关[12-13]。CRC中存在UHRF1过表达现象[14],并与转移和临床分期紧密相关。UHRF1将可能成为一种独立的生物标志物运用于肿瘤检测、进展和防治监测[15]。
课题组前期研究发现UHRF1能够被多个miRNA结合而沉默[16-17],有望成为潜在的干预靶点,但具体的下游作用信号传递机制目前暂不明确。本研究旨在探究UHRF1对CRC生物学特性的影响及其可能的相关通路,进一步探讨其与CRC的关系及相关作用机制,为CRC诊断和防治提供新的思路。
1 材料与方法
1.1 组织和细胞来源
从癌症基因组图谱(https://portal.gdc.cancer.gov/)下载并获得结肠腺癌(COAD)、直肠腺癌(READ)和正常结直肠组织的RNA测序数据(HTSeq-Counts和HTSeq-FPKM)。在排除总生存期(OS)值缺失或OS时间短(< 30天)的患者后,最终纳入了502例具有完整相关临床信息的患者。同时利用该机构收集的(2018年5月—2019年5月)新鲜保存于-80℃的术前未进行放化疗的CRC组织及匹配的超过5 cm范围的正常肠黏膜组织,共112例。该研究通过福建医科大学附属第一医院伦理委员会批准(批号:闽医大附一伦理医研[2019]021号)。
CRC细胞株SW480、HT29、HCT116、LOVO由福建医科大学药学院惠赠。
1.2 主要试剂与仪器
UHRF1抗体(美国Sigma公司),WNT3a、GSK3β、p-β-catenin和MMP9抗体(美国Abcam公司);慢病毒包装载体、UHRF1过表达载体和UHRF1shRNA(上海吉凯生物公司),RPMI 1640培养基(美国Gibco公司),SYBR Green Real-time PCR(日本Takara公司),GAPDH抗体(美国CST公司),PVDF膜(中国Biosharp公司),Transwell小室(美国Thermo Fisher公司)。PCR引物由上海生工生物科技有限公司合成。
倒置荧光显微镜(日本奥林巴斯),Stratagene Mx3000P PCR仪(美国Agilent公司),凝胶成像及分析系统(美国Bio-Rad公司),酶联免疫监测仪(美国Thermo Fisher公司)。
1.3 实验方法
1.3.1 免疫组织化学
冷冻保存的组织取小块石蜡包埋固定,4 μm厚切片,抗UHRF1抗体以1:200的工作浓度检测组织中UHRF1蛋白的表达。磷酸盐缓冲液冲洗后,加入适量稀释的辣根过氧化物酶标记山羊抗小鼠抗体(工作浓度1:1 000),37℃孵育10~30 min,用磷酸盐缓冲液冲洗。用苏木精对比染色5 min,中性树胶风干。荧光显微镜下观察。
1.3.2 慢病毒转染
构建UHRF1过表达慢病毒和UHRF1敲低(sh-UHRF1)慢病毒载体。SW480细胞用UHRF1过表达慢病毒感染,HCT116细胞用sh-UHRF1慢病毒感染。选择合适的MOI值加入病毒,同时加入共感染剂Polybrene。12 h后更换正常培养基。感染72 h后,在荧光显微镜下观察荧光表达。最后用嘌呤霉素进行细胞抗性筛选,只留下慢病毒感染的细胞,获得稳定表达的细胞系。
1.3.3 Real-time PCR实验
根据试剂盒说明,使用TRIzol试剂从新鲜临床标本组织或者培养的细胞中提取总RNA。反转录试剂盒用于RNA反转录得到cDNA。使用7500 real-time PCR系统进行RT-PCR分析。相对表达式F(倍数变化)= 2-∆∆Ct进行分析和比较。引物设计如下:UHRF1(上游引物:5’-ATGACTCTACCCACGGCAAG-3’;下游引物:5’-CTGGAAGATGGTGATGGGTT-3’);GAPDH(上游引物:5’-CCCTTCATTGACCTCAACTACATG-3’;下游引物:5’-TGGGATTTCCATTGATGACAAGC-3 ’。
1.3.4 蛋白质印迹实验
应用细胞裂解液充分裂解并收集总蛋白。制备10%SDS-PAGE凝胶并将60微克/孔蛋白质加入梳状孔中。电泳转染后,将PVDF膜封闭2 h。然后将PVDF膜与抗UHRF1、抗GAPDH、抗WNT3a、抗GSK3β、抗p-β-连环蛋白和抗MMP9在4℃下孵育过夜。用TBST洗涤膜后,将其与辣根过氧化物酶偶联的山羊抗兔IgG(1: 5 000)孵育2 h。再次洗膜并浸入适量的ECL试剂以测试凝胶成像系统中的结果。
1.3.5 肿瘤细胞生物学特性检测
EdU增殖实验:将各组细胞按1.5×105个/孔接种于24孔板中。加入制备好的试剂EdU并继续孵育细胞2 h。用聚甲醇固定并渗透液体后,加入Click反应溶液。使用Hoechst 33342进行核染色。在荧光显微镜下观察到所有细胞核都被染成蓝色。
Transwell迁移实验:实验前12 h,将细胞更换为无血清培养基进行预处理。取300 μl细胞悬液加入Transwell小室上层,即每孔6×104个细胞,加入700 μl含20%胎牛血清的培养基井板。在5%CO2和37℃下孵育48 h。用棉签轻轻擦拭室上部的细胞,用PBS清洗,用4%多聚甲醛固定20 min,结晶紫染色液染色30 min。然后在显微镜下观察并拍照。
Transwell侵袭实验:提前将Matrigel胶添加到Transwell小室底部,使其凝胶化。与迁移实验一样,Transwell小室上层加入300 μl细胞悬液,每孔接种9×104个细胞,下孔板加入700 μl含20%胎牛血清的培养基,培养48 h,处理方法同迁移实验。荧光显微镜下观察并拍照。
1.4 统计学方法
采用SPSS22.0软件分析,计数资料的比较采用卡方检验;计量资料用(x±s)表示,各计量资料之间组间两两比较时先进行多样本方差齐性检验;若方差齐,则采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果
2.1 UHRF1在TCGA数据库中的表达及作用
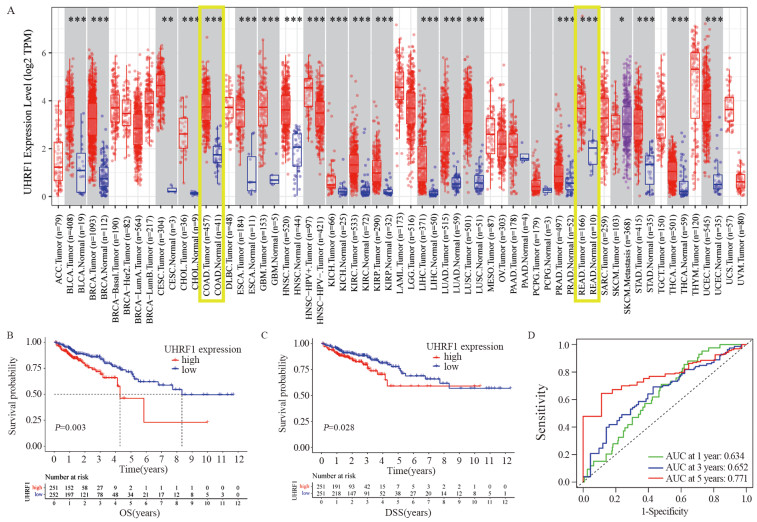
在包括结肠癌和直肠癌在内的绝大部分癌组织的UHRF1 mRNA表达量明显高于对应正常组织,UHRF1在恶性肿瘤的发生发展中可能具有重要的作用(P < 0.001),见图 1A。UHRF1低表达组总生存期(OS)和疾病相关存活时间(DSS)均明显优于高表达组(P < 0.05),UHRF1高表达量是CRC患者不良预后因素,见图 1B~C。利用ROC曲线评价UHRF1表达量预测CRC患者生存时间,1、3和5年OS的AUC分别为0.634、0.652和0.771,见图 1D,具有良好的生存预后预测作用。
![]() 图 1 在TCGA数据中UHRF1的表达及与预后的关系Figure 1 Expression of UHRF1 and its relationship with prognosis in TCGA dataA: Differences in UHRF1 expression between cancer tissues and normal tissues of 33 malignant tumors in the TCGA database.*: P < 0.05; **: P < 0.01; ***: P < 0.001; B: Differences in the 5-year OS of CRC patients in high-/low-UHRF1-expression groups; C: Differences in 5-year DSS of CRC patients in high-/low-UHRF1-expression groups; D: The area under the ROC curve (AUC) was used to evaluate the expression of UHRF1 and thus predict the 1-, 3-, and 5-year OS of CRC patients.
图 1 在TCGA数据中UHRF1的表达及与预后的关系Figure 1 Expression of UHRF1 and its relationship with prognosis in TCGA dataA: Differences in UHRF1 expression between cancer tissues and normal tissues of 33 malignant tumors in the TCGA database.*: P < 0.05; **: P < 0.01; ***: P < 0.001; B: Differences in the 5-year OS of CRC patients in high-/low-UHRF1-expression groups; C: Differences in 5-year DSS of CRC patients in high-/low-UHRF1-expression groups; D: The area under the ROC curve (AUC) was used to evaluate the expression of UHRF1 and thus predict the 1-, 3-, and 5-year OS of CRC patients.2.2 UHRF1在CRC临床样本中的表达
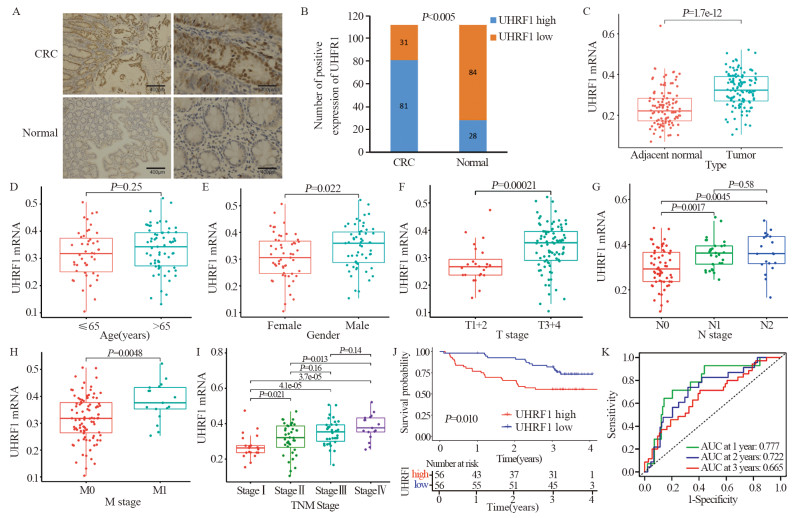
免疫组织化学检测结果显示:UHRF1在CRC癌组织中阳性表达率为72.32%(81/112),在癌旁正常组织中阳性表达率为25.0%(28/112, P < 0.05),见图 2A~B,表 1。RT-PCR结果示UHRF1 mRNA在癌组织中明显高于癌旁组织(P < 0.001),见图 2C。
![]() 图 2 UHRF1在临床样本组织中的表达及其作用Figure 2 Expression of UHRF1 in tissues and its role in the clinical CRC cohortA: Representative immunohistochemical staining for UHRF1 expression; B: UHRF1 expression in colorectal cancer tissues and adjacent tissues; C: Differences in UHRF1 mRNA expression levels between cancer tissues and adjacent normal tissues determined by RT-PCR; D: Differences in UHRF1 expression among distinct age groups; E: Differences in UHRF1 expression among distinct gender groups; F: Differences in UHRF1 expression among distinct T groups; G: Differences in UHRF1 expression among distinct N groups; H: Differences in UHRF1 expression among distinct M groups; I: Differences in UHRF1 expression among distinct tumor TNM staging groups; J: Differences in 3-year OS of CRC patients among high/low UHRF1 expression groups; K: AUC was used to evaluate UHRF1 expression to predict 1-, 2-, and 3-year OS in the clinical CRC cohort.表 1 UHRF1表达与CRC患者临床病理特征的关系Table 1 Relationships between UHRF1 expression and clinicopathological characteristics in CRC patients
图 2 UHRF1在临床样本组织中的表达及其作用Figure 2 Expression of UHRF1 in tissues and its role in the clinical CRC cohortA: Representative immunohistochemical staining for UHRF1 expression; B: UHRF1 expression in colorectal cancer tissues and adjacent tissues; C: Differences in UHRF1 mRNA expression levels between cancer tissues and adjacent normal tissues determined by RT-PCR; D: Differences in UHRF1 expression among distinct age groups; E: Differences in UHRF1 expression among distinct gender groups; F: Differences in UHRF1 expression among distinct T groups; G: Differences in UHRF1 expression among distinct N groups; H: Differences in UHRF1 expression among distinct M groups; I: Differences in UHRF1 expression among distinct tumor TNM staging groups; J: Differences in 3-year OS of CRC patients among high/low UHRF1 expression groups; K: AUC was used to evaluate UHRF1 expression to predict 1-, 2-, and 3-year OS in the clinical CRC cohort.表 1 UHRF1表达与CRC患者临床病理特征的关系Table 1 Relationships between UHRF1 expression and clinicopathological characteristics in CRC patients
UHRF1 mRNA表达量男性高于女性(图 2E);T3+4组高于T1+2组(图 2F);N+组高于N0组(图 2G);M1组高于M0组(图 2H);且随着TNM分期升高,表达量也随着升高(图 2I),但与年龄无关(P > 0.05)见图 2D。UHRF1蛋白表达量与肿瘤浸润深度、淋巴结转移、远处转移和TNM分期有关(P < 0.05),与患者性别、年龄、肿瘤位置和肿瘤直径无关(P > 0.05),见表 1;均提示UHRF1高表达与不良的临床病理特征密切相关。
UHRF1低表达患者的3年OS明显优于高表达患者(P < 0.05),见图 2J。1、2和3年OS的AUC分别为0.777、0.722和0.665,见图 2K,再次验证UHRF1具有良好的预后预测作用。
2.3 CRC细胞株筛选和慢病毒转染结果
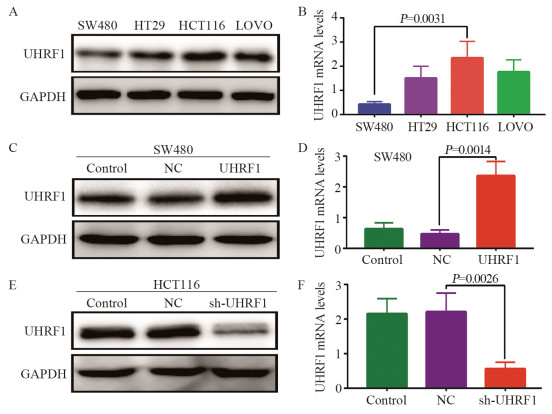
检测4株细胞株UHRF1 mRNA和蛋白的表达,UHRF1 mRNA和蛋白表达从高到低分别是HCT116、LOVO、HT29、SW480细胞,见图 3A~B。因此选用SW480细胞作为过表达转染载体,HCT116细胞作为敲减转染载体。
![]() 图 3 UHRF1 mRNA和蛋白在不同细胞中的表达Figure 3 UHRF1 mRNA and protein expression in different cellsA: UHRF1 protein expression in four CRC cell lines; B: UHRF1 mRNA expression in four CRC cells; C: The protein expression of UHRF1 in SW480 cells after lentivirus transfection; D: Expression of UHRF1 mRNA in SW480 cells after lentivirus transfection; E: UHRF1 protein expression in HCT116 cells after lentivirus transfection; F: UHRF1 mRNA expression in HCT116 cells after lentivirus transfection.
图 3 UHRF1 mRNA和蛋白在不同细胞中的表达Figure 3 UHRF1 mRNA and protein expression in different cellsA: UHRF1 protein expression in four CRC cell lines; B: UHRF1 mRNA expression in four CRC cells; C: The protein expression of UHRF1 in SW480 cells after lentivirus transfection; D: Expression of UHRF1 mRNA in SW480 cells after lentivirus transfection; E: UHRF1 protein expression in HCT116 cells after lentivirus transfection; F: UHRF1 mRNA expression in HCT116 cells after lentivirus transfection.转染后,SW480细胞中UHRF1 mRNA和蛋白表达量明显高于NC组和Control组(P < 0.01),证实过表达组细胞株构建成功,见图 3C~D。
敲减后,HCT116细胞sh-UHRF1敲减组的UHRF1 mRNA和蛋白的表达量较NC组和Control组明显降低(P < 0.01),表明敲减组细胞株构建成功,见图 3E~F。
2.4 CRC细胞中UHRF1的表达与WNT/MMP9信号通路的关系
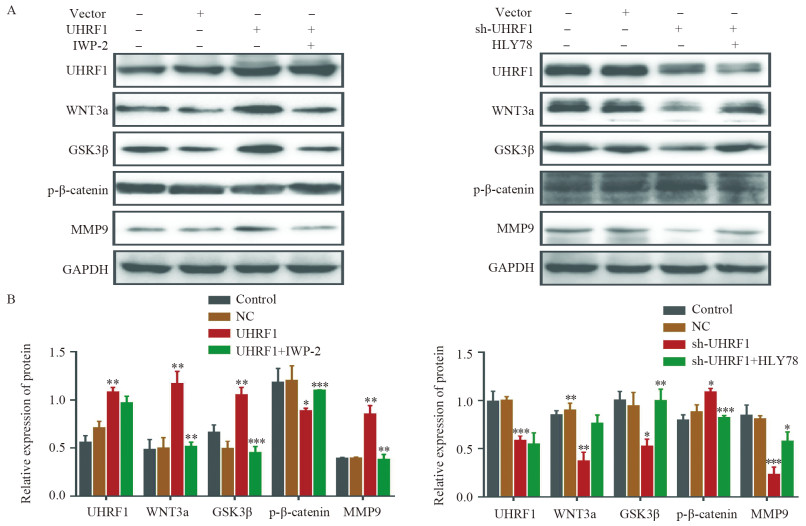
转染过表达后,Western blot结果显示,随着UHRF1表达量的增加,WNT信号通路中关键蛋白WNT3a和GSK3β的表达量增加,而p-β-catenin的表达量显著降低,MMP9表达量增加。在此基础上,加入了IWP-2(WNT拮抗剂),发现原来WNT信号通路中表达增加的相关蛋白均降低,见图 4。
![]() 图 4 CRC细胞中UHRF1调控WNT信号通路相关蛋白的表达Figure 4 UHRF1 regulated the expression of WNT signaling pathway-related proteins in CRC cellsA: The upregulation or downregulation of UHRF1 affected the WNT signaling pathway and ultimately induced changes in the expression of the matrix metalloproteinase MMP9; B: Expression levels of WNT signaling pathway-related proteins and MMP9 in each group.*: P < 0.05, **: P < 0.01, ***: P < 0.001.
图 4 CRC细胞中UHRF1调控WNT信号通路相关蛋白的表达Figure 4 UHRF1 regulated the expression of WNT signaling pathway-related proteins in CRC cellsA: The upregulation or downregulation of UHRF1 affected the WNT signaling pathway and ultimately induced changes in the expression of the matrix metalloproteinase MMP9; B: Expression levels of WNT signaling pathway-related proteins and MMP9 in each group.*: P < 0.05, **: P < 0.01, ***: P < 0.001.sh-UHRF1敲低后,UHRF1表达明显降低,WNT3a和GSK3β的表达降低,MMP9表达量下降;使用HLY78(WNT激活剂)后,相关蛋白的表达趋于恢复,见图 4。因此,在结直肠癌中UHRF1可能通过调节WNT信号通路影响基质金属蛋白酶MMP9的表达。
2.5 UHRF1对CRC细胞增殖、迁移和侵袭能力的影响
EdU结果显示:过表达组增殖细胞数较NC组和Control组明显增多,使用抑制剂后UHRF1+IWP-2组较过表达组显著降低(P < 0.05),见图 5A;而在sh-UHRF1组中,随着UHRF1表达的降低,细胞增殖数目也随之减少(P < 0.05),加入WNT活化剂后细胞增殖率明显上升(P < 0.05),见图 5B。
![]() 图 5 UHRF1通过WNT信号通路影响结直肠癌细胞增殖Figure 5 UHRF1 affected the proliferation of colorectal cancer cells through WNT signaling pathwayA: The pathway inhibitor IWP-2 could reverse the changes in SW480 cell proliferation induced by UHRF1 overexpression; B: The application of the WNT pathway activator HLY78 could increase the decline in HCT116 cell proliferation after silencing UHRF1.
图 5 UHRF1通过WNT信号通路影响结直肠癌细胞增殖Figure 5 UHRF1 affected the proliferation of colorectal cancer cells through WNT signaling pathwayA: The pathway inhibitor IWP-2 could reverse the changes in SW480 cell proliferation induced by UHRF1 overexpression; B: The application of the WNT pathway activator HLY78 could increase the decline in HCT116 cell proliferation after silencing UHRF1.Transwell迁移实验结果显示:过表达组细胞数明显较NC组和Control组多(P < 0.05),并且过表达组通过IWP-2处理后细胞数明显低于未经拮抗剂处理组(P < 0.05),见图 6A。敲减组迁移数明显低于NC组和Control组(P < 0.01),而sh-UHRF1+HLY78组明显高于敲减组(P < 0.05),见图 6B。
![]() 图 6 UHRF1通过WNT信号通路影响结直肠癌细胞的迁移和侵袭Figure 6 UHRF1 affected migration and invasion of colorectal cancer cells through WNT signaling pathwayA: Migration of UHRF1-overexpressing cell lines; B: Migration of UHRF1-silenced cell lines; C: Invasion of UHRF1-overexpressing cell lines; D: Invasion of UHRF1-knockdown cell lines.
图 6 UHRF1通过WNT信号通路影响结直肠癌细胞的迁移和侵袭Figure 6 UHRF1 affected migration and invasion of colorectal cancer cells through WNT signaling pathwayA: Migration of UHRF1-overexpressing cell lines; B: Migration of UHRF1-silenced cell lines; C: Invasion of UHRF1-overexpressing cell lines; D: Invasion of UHRF1-knockdown cell lines.Transwell侵袭实验结果示:过表达组细胞数明显多于NC组和Control组(P < 0.01),且明显高于UHRF1+IWP-2组(P < 0.01),见图 6C。敲减组细胞数明显低于NC组和Control组,sh-UHRF1+HLY78组细胞数高于敲减组(P < 0.05),见图 6D。
3 讨论
UHRF1基因编码蛋白是一个多功能结构域蛋白,包含UBL、PHD和TTD结构域、RING finger功能域和SET-环指状结构域,能够识别和修饰不同的染色质,在细胞增殖、DNA损伤与修复、周期调控和细胞损伤放射敏感性等方面发挥重要作用[18]。UHRF1是一个重要的表观遗传调控因子,是整合表观遗传信息的关键蛋白质,通过其特殊域参与表观遗传过程,进一步调节肿瘤的生物学特性[19]。
研究表明,UHRF1在包括CRC在内的多种恶性肿瘤的发生发展中发挥重要作用[20-22],虽然具体的调控机制尚未完全阐明。UHRF1在结直肠癌中表达上调,并与结直肠癌的进展有关[23],CRC细胞中DNA甲基化的维持高度依赖于UHRF1,因此UHRF1耗竭迅速诱导DNA去甲基化作用[24]。本研究揭示了UHRF1在具有淋巴结转移、远处转移和高TNM分期不良预后因素的CRC患者中明显高表达,可能是影响CRC患者预后的一个因素,3年随访结果显示UHRF1高表达提示不良的预后,且具有较为稳定可靠的预后预测能力,更加可靠的证据需要等待5年随访结果进一步评估预后情况。UHRF1蛋白还与细胞增殖和分化能力密切相关,增殖能力越强和分化程度越低的细胞中UHRF1表达越高。本研究还发现UHRF1的过表达可增强CRC的增殖、迁移和侵袭能力。UHRF1基因沉默后,CRC细胞的这些生物学特性受到抑制,这与UHRF1的促进增殖作用密切相关,这与课题组前期研究结果相一致[16-17],同时在体内外也验证了UHRF1在CRC中的重要作用。亦有研究发现SHMT2敲低可通过降低UHRF1的表达进而抑制CRC的增殖并诱导细胞周期阻滞,表明UHRF1可能与CRC细胞周期有关[25],但UHRF1影响侵袭、迁移能力的具体机制还需要进一步探索。
WNT信号通路是细胞生长发育过程中传递生物信息的重要通路,是一个复杂的蛋白质网络。WNT信号通路参与调节肿瘤微环境的形成。通过级联信号传递,可导致EMT、肿瘤细胞转移和肿瘤干细胞特性增强[26]。同时,无论是乳腺癌、肺癌、肝癌,甚至CRC[27],这些肿瘤的发生均被认为与WNT信号通路有关[28-30]。因此,UHRF1作为整合遗传信息的重要分子,也可引起异常细胞增殖和肿瘤形成,UHRF1和WNT信号通路之间是否存在相关性目前尚不清楚。本研究验证了UHRF1可以通过WNT信号通路调节CRC细胞中基质金属蛋白酶MMP9的表达,从而影响CRC迁移和侵袭的生物学特性,进一步揭示了UHRF1发挥作用的内在机制。UHRF1也可能通过其他作用机制发挥作用,有研究发现UHRF1可能介导的泛素化和DNA甲基转移酶1(DNMT1)的降解,导致启动子CpG岛的去甲基化和STAT1的过表达,进而促进CRC的生长[31]。
综上所述,本研究探索了UHRF1如何介导其在CRC中的促癌作用。但目前的研究仅基于细胞水平的实验研究,即体外水平。同时,我们也在思考这个系统中是否有其他分子参与,UHRF1是否是这个调控的起点,是否还有其他的信号通路,这有待未来进一步的研究和发现。本研究发现UHRF1基因可通过调控WNT信号通路影响CRC增殖、迁移和侵袭,希望为结直肠癌的分子靶向治疗提供新的可能。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:陈志华:研究设计和实验实施、文章撰写郑艳:研究设计和实验实施林素勇:数据分析陈绍勤:文章审阅 -
表 1 UHRF1表达与CRC患者临床病理特征的关系
Table 1 Relationships between UHRF1 expression and clinicopathological characteristics in CRC patients

-
[1] Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. doi: 10.3322/caac.21763
[2] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[3] Munro MJ, Wickremesekera SK, Peng L, et al. Cancer stem cells in colorectal cancer: a review[J]. J Clin Pathol, 2018, 71(2): 110-116. doi: 10.1136/jclinpath-2017-204739
[4] Katoh M, Katoh M. WNT signaling and cancer stemness[J]. Essays Biochem, 2022, 66(4): 319-331. doi: 10.1042/EBC20220016
[5] Birrer DL, Tschuor C, Reiner C, et al. Multimodal treatment strategies for colorectal liver metastases[J]. Swiss Med Wkly, 2021, 151: w20390. doi: 10.4414/smw.2021.20390
[6] Chen S, Chen Z, Lin S, et al. KISS1 methylation and expression as predictors of disease progression in colorectal cancer patients[J]. World J Gastroenterol, 2014, 20(29): 10071-10081. doi: 10.3748/wjg.v20.i29.10071
[7] Hopfner R, Mousli M, Jeltsch JM, et al. ICBP90, a novel human CCAAT binding protein, involved in the regulation of topoisomerase Ⅱalpha expression[J]. Cancer Res, 2000, 60(1): 121-128.
[8] Bronner C, Krifa M, Mousli M. Increasing role of UHRF1 in the reading and inheritance of the epigenetic code as well as in tumorogenesis[J]. Biochem Pharmacol, 2013, 86(12): 1643-1649. doi: 10.1016/j.bcp.2013.10.002
[9] Bronner C, Alhosin M, Hamiche A, et al. Coordinated Dialogue between UHRF1 and DNMT1 to Ensure Faithful Inheritance of Methylated DNA Patterns[J]. Genes (Basel), 2019, 10(1): 65. doi: 10.3390/genes10010065
[10] Hu Q, Qin Y, Ji S, et al. UHRF1 promotes aerobic glycolysis and proliferation via suppression of SIRT4 in pancreatic cancer[J]. Cancer Lett, 2019, 452: 226-236. doi: 10.1016/j.canlet.2019.03.024
[11] Xu X, Ding G, Liu C, et al. Nuclear UHRF1 is a gate-keeper of cellular AMPK activity and function[J]. Cell Res, 2022, 32(1): 54-71. doi: 10.1038/s41422-021-00565-y
[12] Pacaud R, Brocard E, Lalier L, et al. The DNMT1/PCNA/UHRF1 disruption induces tumorigenesis characterized by similar genetic and epigenetic signatures[J]. Sci Rep, 2014, 4: 4230. doi: 10.1038/srep04230
[13] Wang H, Cao D, Wu F. Long noncoding RNA UPAT promoted cell proliferation via increasing UHRF1 expression in non-small cell lung cancer[J]. Oncol Lett, 2018, 16(2): 1491-1498.
[14] Wang F, Yang YZ, Shi CZ, et al. UHRF1 promotes cell growth and metastasis through repression of p16(ink(4)a) in colorectal cancer[J]. Ann Surg Oncol, 2012, 19(8): 2753-2762. doi: 10.1245/s10434-011-2194-1
[15] Kong X, Chen J, Xie W, et al. Defining UHRF1 Domains that Support Maintenance of Human Colon Cancer DNA Methylation and Oncogenic Properties[J]. Cancer Cell, 2019, 35(4): 633-648. e7. doi: 10.1016/j.ccell.2019.03.003
[16] Lin Y, Chen Z, Lin S, et al. MiR-202 inhibits the proliferation and invasion of colorectal cancer by targeting UHRF1[J]. Acta Biochim Biophys Sin (Shanghai), 2019, 51(6): 598-606.
[17] Lin Y, Chen Z, Zheng Y, et al. MiR-506 Targets UHRF1 to Inhibit Colorectal Cancer Proliferation and Invasion via the KISS1/PI3K/NF-κB Signaling Axis[J]. Front Cell Dev Biol, 2019, 7: 266. doi: 10.3389/fcell.2019.00266
[18] Mancini M, Magnani E, Macchi F, et al. The multi-functionality of UHRF1: epigenome maintenance and preservation of genome integrity[J]. Nucleic Acids Res, 2021, 49(11): 6053-6068. doi: 10.1093/nar/gkab293
[19] Ren Y. Regulatory mechanism and biological function of UHRF1-DNMT1-mediated DNA methylation[J]. Funct Integr Genomics, 2022, 22(6): 1113-1126. doi: 10.1007/s10142-022-00918-9
[20] Kim JK, Kan G, Mao Y, et al. UHRF1 downmodulation enhances antitumor effects of histone deacetylase inhibitors in retinoblastoma by augmenting oxidative stress-mediated apoptosis[J]. Mol Oncol, 2019, 14(2): 329-346.
[21] Jiao D, Huan Y, Zheng J, et al. UHRF1 promotes renal cell carcinoma progression through epigenetic regulation of TXNIP[J]. Oncogene, 2019, 38(28): 5686-5699. doi: 10.1038/s41388-019-0822-6
[22] Lu NH, Wei CY, Qi FZ, et al. Hsa-let-7b suppresses cell proliferation by targeting UHRF1 in melanoma[J]. Cancer Invest, 2020, 38(1): 52-60. doi: 10.1080/07357907.2019.1709482
[23] Wang F, Yang Y, Shi C, et al. UHRF1 promotes cell growth and metastasis through repression of p16(ink4a) in colorectal cancer[J]. Ann Surg Oncol, 2012, 19(8): 2753-2762. doi: 10.1245/s10434-011-2194-1
[24] Niinuma T, Kitajima H, Kai M, et al. UHRF1 depletion and HDAC inhibition reactivate epigenetically silenced genes in colorectal cancer cells[J]. Clin Epigenetics, 2019, 11(1): 70. doi: 10.1186/s13148-019-0668-3
[25] Cui X, Cui Y, Du T, et al. SHMT2 Drives the Progression of Colorectal Cancer by Regulating UHRF1 Expression[J]. Can J Gastroenterol Hepatol, 2022, 2022: 3758697.
[26] Patel S, Alam A, Pant R, et al. Wnt Signaling and Its Significance Within the Tumor Microenvironment: Novel Therapeutic Insights[J]. Front Immunol, 2019, 10: 2872.
[27] Zhao H, Ming T, Tang S, et al. Wnt signaling in colorectal cancer: pathogenic role and therapeutic target[J]. Mol Cancer, 2022, 21(1): 144.
[28] Parsons MJ, Tammela T, Dow LE. WNT as a Driver and Dependency in Cancer[J]. Cancer Discov, 2021, 11(10): 2413-2429.
[29] Yu F, Yu C, Li F, et al. Wnt/β-catenin signaling in cancers and targeted therapies[J]. Signal Transduct Target Ther, 2021, 6(1): 307.
[30] Zhou Y, Xu J, Luo H, et al. Wnt signaling pathway in cancer immunotherapy[J]. Cancer Lett, 2022, 525: 84-96.
[31] Han J, Chen X, Xu J, et al. Simultaneous silencing Aurora-A and UHRF1 inhibits colorectal cancer cell growth through regulating expression of DNMT1 and STAT1[J]. Int J Med Sci, 2021, 18(15): 3437-3451.
-
期刊类型引用(1)
1. 孙晓慧,李颖,李凯丽,郭舟群. 宫颈癌组织DCLK1、UHRF1 mRNA表达及临床特征与放疗敏感性的关系. 实用癌症杂志. 2025(05): 697-700 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: