Predictive Factors and Prognostic Value of Pathologic Complete Response of Internal Mammary Lymph Nodes in Breast Cancer After Neoadjuvant Chemotherapy
-
摘要:目的
探讨乳腺癌新辅助化疗后内乳区淋巴结病理完全缓解(ipCR)的预测因素及其对预后的影响。
方法对70例伴内乳区淋巴结转移的原发乳腺癌并接受新辅助化疗患者病例资料进行回顾性分析,根据术后病理分为ipCR组和non-ipCR组。对乳腺癌新辅助化疗后同侧ipCR的预测因素,χ2检验、Fisher及Logistic回归分别进行单因素和多因素分析,Kaplan-Meier曲线和Cox回归进行预后分析。
结果70例患者中31例获得ipCR(44.3%)。单因素分析显示,腋窝pCR、激素受体表达水平、HER2状态与ipCR有关(P < 0.05)。多因素分析显示,年龄、腋窝pCR、HER2状态是ipCR的独立预测因子。ipCR组平均DFS达96.0个月(95%CI: 49.5~84.7),明显优于non-ipCR组为67.1个月(95%CI: 81.7~110.3, P < 0.05)。ipCR组复发转移风险较non-ipCR组降低87%(HR=0.13, 95%CI: 0.04~0.44, P < 0.01)。ipCR、Ki67表达水平、乳房pCR是影响患者预后的独立因素。
结论新辅助化疗后是否获得ipCR与临床病理因素存在相关性。ipCR可用于预测内乳区淋巴结转移患者的预后。
Abstract:ObjectiveTo explore the prognostic factors of the pathological complete response of internal mammary lymph node (ipCR) after neoadjuvant chemotherapy and its effect on breast cancer prognosis.
MethodsWe retrospectively analyzed the clinical data of 70 patients with primary breast cancer with internal mammary lymph node metastasis who received neoadjuvant chemotherapy. Patients were divided into the ipCR group and non-ipCR group based on their postoperative pathology. χ2 test, Fisher, and Logistic regression were used for univariate and multivariate analysis. Meanwhile, the Kaplan-Meier curve and Cox regression were used for prognostic analysis.
ResultsOf 70 patients, 31 obtained ipCR (44.3%). Univariate analysis showed that the expression levels of apCR, HR, and HER2 status were related to ipCR (P < 0.05). Multivariate analysis showed that age, apCR, and HER2 status were independent predictors of ipCR (P < 0.05). The average DFS of ipCR group was better than non-ipCR group (96.0 vs. 67.1 months, P < 0.05). The risk of recurrence and metastasis was 87% lower in the ipCR group than in the non-ipCR group (HR=0.13, 95%CI: 0.04-0.44, P < 0.01). ipCR, Ki67 expression level, and breast pCR (bpCR) were independent factors affecting patients' prognosis.
ConclusionThere is a correlation between clinico pathological factors and ipCR after neoadjuvant chemotherapy. ipCR can be used to predict the prognosis of patients with internal mammary lymph node metastasis.
-
0 引言
内乳区淋巴结是乳腺癌淋巴引流的第一站,类似于腋窝淋巴系统[1]。虽然内乳区淋巴结转移率低于腋窝淋巴结,但内乳区淋巴结仍是乳腺癌第二大常见的淋巴结转移部位[2]。内乳区淋巴结转移的患者总体预后较差[3],对其优化治疗的需求日益增加。活检或切除内乳区淋巴结的适应证由于预后没有改善和出血并发症而存在争议。对于内乳区淋巴结转移乳腺癌,提倡采用结合乳腺手术、内乳区淋巴结放射治疗和全身治疗的多模式治疗[4]。新辅助化疗是局部晚期以及某些Ⅱ~Ⅲ期人类表皮生长因子受体2(HER2)阳性和三阴性乳腺癌患者的标准首选治疗方法[5]。病理完全缓解(pCR)是一个独立的预后因素,与新辅助化疗后的乳腺癌固有亚型无关[6]。Mougalian等的研究证明新辅助化疗后腋窝pCR(axillary pCR, apCR)的患者比腋窝残留疾病的患者具有更好的长期临床结果[7]。然而,目前报道新辅助化疗后内乳区淋巴结pCR(internal mammary lymph nodes pathological complete response, ipCR)的预测因素和预后价值的研究较少。本文旨在研究ipCR的影响因素及其与病理证实的内乳区淋巴结转移患者预后的关系。
1 资料与方法
1.1 资料
收集2009年10月1日—2020年8月31日在河北医科大学第四医院乳腺中心接受新辅助化疗伴内乳区淋巴结转移的患者病例资料共70例。根据患者术后内乳区病理情况分为ipCR组(31例)和non-ipCR组(39例)。病例纳入标准:(1)经病理组织学确诊的乳腺癌患者;(2)经病理组织学证实同侧内乳区淋巴结转移;(3)新辅助化疗后行内乳区淋巴结摘除或改良扩大根治术;(4)临床病理学及随访资料完整;(5)新辅助化疗化疗≥2周期。排除标准:(1)双侧乳腺癌;(2)伴远处转移;(3)其他恶性肿瘤病史。本研究经河北医科大学第四医院医学伦理委员会批准(2020KY129),所有患者行相关治疗前均签署知情同意书。
1.2 治疗
所有患者均接受了3~8个周期新辅助化疗,ipCR组与non-ipCR组使用含紫衫杉类方案比例分别为100%、92.3%,使用含蒽环类方案分别为83.9%、92.3%。之后所有患者行内乳区淋巴结摘除或改良扩大根治术。术后所有患者接受放射治疗,激素受体阳性患者进行辅助内分泌治疗。因经济及个人意愿原因,仅33.3%(7/21)的HER2阳性患者使用靶向治疗。
1.3 随访
无病生存时间(DFS)定义为从手术时间至患者肿瘤出现复发、死亡或随访终点的时间。总生存时间(OS)定义为从手术时间至患者死亡或随访终点的时间。电话随访持续到2021年8月17日,中位随访时间36.5个月,失访率为2.9%。
1.4 结果判定
(1)ER、PR及HR[8]:ER、PR阳性定义为细胞核阳性细胞≥1%,HR阳性定义为ER和(或)PR阳性;(2)HER2[8]:阳性定义为免疫组织化学检测3+或FISH检测基因扩增为阳性;(3)Ki67[9]:高表达定义为阳性细胞占全部肿瘤细胞的平均比≥14%,低表达为 < 14%;(4)pCR[10]:bpCR定义为乳腺肿瘤原发灶无任何癌残留或残留原位癌,apCR定义为腋窝清扫术后病理检查淋巴结无癌转移,ipCR定义为改良扩大根治术后或内乳区淋巴结摘除术后病理检查淋巴结无癌转移。
1.5 统计学方法
采用SPSS25.0软件进行统计学分析。分类变量单因素分析采用χ2检验,P < 0.10的因素进一步进行多因素Logistic回归分析,P < 0.05的判定为独立相关因素。Kaplan-Meier法绘制生存曲线分析ipCR组和non-ipCR组患者的OS和DFS。Cox回归进行多因素生存分析,P < 0.05的判定为独立预后因素。iPCR影响因素的Logistic回归变量赋值见表 1。
表 1 ipCR影响因素的Logistic回归分析变量赋值表Table 1 Logistic regression analysis variable assignment table of ipCR influencing factors
2 结果
2.1 临床特征
入组70例女性患者,中位年龄46.5岁,其中9例 < 35岁(12.9%)。46例(65.7%)未绝经。cT1有6例(8.6%),cT2有44例(62.8%),cT3有10例(14.3%)、cT4有10例(14.3%)。新辅助化疗后14例(20.0%)获得bpCR、23例(32.9%)获得apCR、31例(44.3%)获得ipCR。26例(37.1%)出现复发或转移、21例(30.0%)复发转移后死亡,没有非癌症相关死亡。
2.2 影响ipCR的单因素和多因素分析
单因素分析显示,ipCR与apCR、激素受体表达水平和HER2状态有关,见表 2。多因素分析结果显示,年龄(OR=8.00, 95%CI: 1.07~59.39)、apCR(OR=5.57, 95%CI: 1.28~24.36)和HER2状态(OR=4.87, 95%CI: 1.17~20.27)是ipCR的独立相关因素,见表 3。年龄 < 35岁、获得apCR、HER2阳性的患者更容易获得ipCR。
表 2 70例乳腺癌患者临床病理特征与ipCR的相关性分析Table 2 Correlation analysis of clinicopathological features and ipCR of 70 breast cancer patients 表 3 70例乳腺癌患者ipCR的独立相关因素Table 3 Independent correlation factors of ipCR of 70 breast cancer patients
表 3 70例乳腺癌患者ipCR的独立相关因素Table 3 Independent correlation factors of ipCR of 70 breast cancer patients
2.3 预后分析
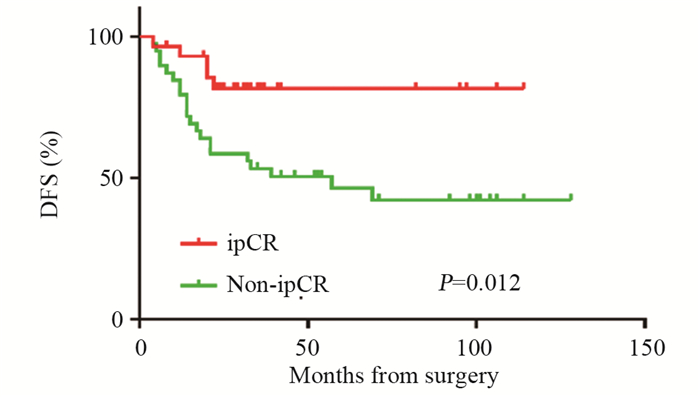
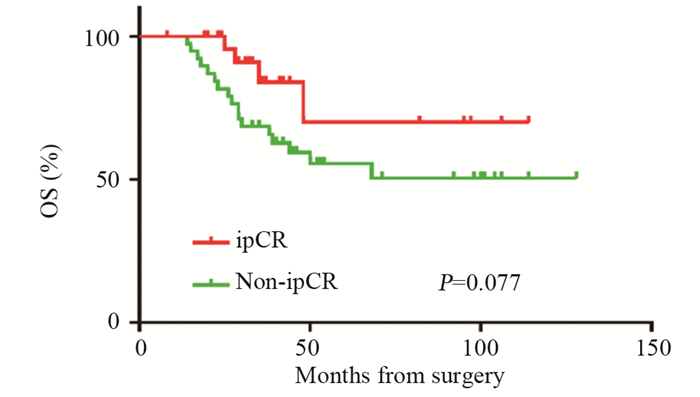
ipCR组平均DFS达96.0个月(95%CI: 49.5~84.7),明显优于non-ipCR组67.1个月(95%CI: 81.7~110.3),见图 1。两组OS差异无统计学意义,见图 2。
单因素预后分析显示Ki67、ipCR、apCR与患者预后显著相关(P < 0.05),见表 4。对单因素分析有意义的因素及临床考虑有影响的因素进一步多因素分析,结果显示ipCR、Ki67表达水平和bpCR是影响患者DFS的独立因素,见表 4~5。
表 4 70例乳腺癌患者单因素Cox回归分析Table 4 Univariate Cox regression analysis of 70 breast cancer patients 表 5 70例乳腺癌患者多因素Cox回归分析Table 5 Multivariate Cox regression analysis of 70 breast cancer patients
表 5 70例乳腺癌患者多因素Cox回归分析Table 5 Multivariate Cox regression analysis of 70 breast cancer patients
3 讨论
乳腺淋巴引流途径主要分为腋窝和内乳两条途径,同侧腋窝淋巴结引流乳腺75%淋巴液,而剩余25%淋巴液由内乳区淋巴结引流。尽管内乳区淋巴结被定义为与腋窝淋巴结相似的区域性淋巴结,但先前的研究表明,内乳区淋巴结转移的乳腺癌预后比腋窝淋巴结转移的乳腺癌更差[11-12]。临床研究强调内乳区淋巴结转移是独立于腋窝淋巴结状态的不良预后指标[13]。然而,内乳区淋巴结的局部治疗仍存在争议。将扩大改良根治术与改良根治术进行比较的随机试验并未显示内乳区淋巴结切除术对患者的生存率有显著益处。但由于早期试验大部分未经辅助系统治疗,仍存在一定不足。丹麦和不列颠哥伦比亚随机试验和EBCTCG荟萃分析的最新结果表明局部区域控制对生存的重要性[3]。随着全身治疗的普遍应用,内乳区淋巴结局部区域处理是否能转化为生存获益还有待思考。目前推荐采用局部控制联合全身治疗,但新辅助化疗后影响ipCR的相关因素及ipCR与预后的关系目前尚不清楚,因此有必要对其进行研究。
新辅助治疗是局部晚期乳腺癌的标准疗法。使用新辅助化疗治疗乳腺癌患者减少了部分乳房切除术和腋窝清扫的需要,降低了手术率,也不会增加局部-区域复发的风险[14]。关于新辅助化疗后内乳区淋巴结pCR的研究报道很少。本研究发现新辅助化疗后ipCR的发生率为44.3%,明显高于bpCR和apCR,提示内乳区淋巴结转移更容易通过新辅助化疗清除,另本研究显示 < 35岁、获得apCR的患者更容易获得ipCR。内乳区淋巴结切除术目前临床上仍存在争议,因此若能通过年龄、apCR预测ipCR,新辅助化疗后针对内乳区淋巴结手术的必要性也值得商榷。
pCR已作为新辅助治疗有效的病理性证据,是评价新辅助治疗疗效的关键指标。新辅助后pCR已成为一个强有力的预后因素[10]。内乳区淋巴结转移与腋窝淋巴结转移具有相似的预后重要性。而传统淋巴结pCR的定义评估了乳房及腋窝的病理状态,却忽略了内乳区淋巴结的病理状态[15]。本研究结果显示ipCR的患者预后更佳,Kaplan-Meier生存分析表明ipCR患者的DFS显著优于non-ipCR组(P < 0.05),提示ipCR是影响内乳区淋巴结转移患者预后的重要因素。多因素Cox回归分析显示,ipCR患者复发相对风险降低了88%,证实ipCR是DFS的独立影响因素。因此,我们可以说ipCR,类似于bpCR和apCR,可以较好地区分预后良好和不良的患者。提示我们可通过综合评估腋窝淋巴结和内乳区淋巴结状态,完善淋巴结pCR的定义,来指导治疗及分析预后。
本研究存在一些优势和不足:不足在于样本量较小,随访时间较短,一些样本未达到观察终点,且是回顾性研究,不如前瞻性研究更有说服力;优势在于本研究是首次评估乳腺癌ipCR影响因素及预后的研究,且对淋巴结进行了病理水平上的评估。本研究提示年龄、apCR、HER2状态是ipCR的独立相关因素,ipCR是患者DFS的独立预测因素。
Competing interests: The authors declare that they have no conflict of interests.作者贡献:张玮芳:病例资料收集、数据整理及分析、论文撰写及修改刘金钊:临床资料数据整理分析张香梅、张硕、马祥敏:收集临床病例资料刘运江:指导课题设计、审核数据、指导论文撰写与修改 -
表 1 ipCR影响因素的Logistic回归分析变量赋值表
Table 1 Logistic regression analysis variable assignment table of ipCR influencing factors

表 2 70例乳腺癌患者临床病理特征与ipCR的相关性分析
Table 2 Correlation analysis of clinicopathological features and ipCR of 70 breast cancer patients

表 3 70例乳腺癌患者ipCR的独立相关因素
Table 3 Independent correlation factors of ipCR of 70 breast cancer patients

表 4 70例乳腺癌患者单因素Cox回归分析
Table 4 Univariate Cox regression analysis of 70 breast cancer patients

表 5 70例乳腺癌患者多因素Cox回归分析
Table 5 Multivariate Cox regression analysis of 70 breast cancer patients

-
[1] Plichta JK. Breast cancer prognostic staging and internal mammary lymph node metastases: a brief overview[J]. Chin Clin Oncol, 2019, 8(S1): S11. doi: 10.21037/cco.2019.01.09
[2] Zhang X, Jaffer S, Bleiweiss IJ, et al. The clinical significance of internal mammary lymph node (IMLN) biopsy during autologous reconstruction in breast cancer patients[J]. Breast Cancer Res Treat, 2015, 153(3): 565-572. doi: 10.1007/s10549-015-3569-y
[3] Chen RC, Lin NU, Golshan M, et al. Internal mammary nodes in breast cancer: diagnosis and implications for patient management-a systematic review[J]. J Clin Oncol, 2008, 26(30): 4981-4989. doi: 10.1200/JCO.2008.17.4862
[4] Kim H, Kim SS, Lee IJ, et al. Outcome of radiotherapy for clinically overt metastasis to the internal mammary lymph node in patients receiving neoadjuvant chemotherapy and breast cancer surgery[J]. Breast, 2021, 55: 112-118. doi: 10.1016/j.breast.2020.12.011
[5] 中国抗癌协会乳腺癌专业委员会. 中国晚期乳腺癌临床诊疗专家共识(2018版)[J]. 中华肿瘤杂志, 2018, 40(9): 703-713. doi: 10.3760/cma.j.issn.0253-3766.2018.09.013 Chinese Anti-Cancer Association, Committee of Breast Cancer Society. Chinese expert consensus on the clinical diagnosis and treatment of advanced breast carcinoma(2018)[J]. Zhonghua Zhong Liu Za Zhi, 2018, 40(9): 703-713. doi: 10.3760/cma.j.issn.0253-3766.2018.09.013
[6] Bonnefoi H, Litière S, Piccart M, et al. Pathological complete response after neoadjuvant chemotherapy is an independent predictive factor irrespective of simplified breast cancer intrinsic subtypes: a landmark and two-step approach analyses from the EORTC 10994/BIG 1-00 phase Ⅲ trial[J]. Ann Oncol, 2014, 25(6): 1128-1136. doi: 10.1093/annonc/mdu118
[7] Mougalian SS, Hernandez M, Lei X, et al. Ten-Year Outcomes of Patients With Breast Cancer With Cytologically Confirmed Axillary Lymph Node Metastases and Pathologic Complete Response After Primary Systemic Chemotherapy[J]. JAMA Oncol, 2016, 2(4): 508-516. doi: 10.1001/jamaoncol.2015.4935
[8] Chen Y, Liu X, Yu K, et al. Impact of hormone receptor, HER2, and Ki-67 status conversions on survival after neoadjuvant chemotherapy in breast cancer patients: a retrospective study[J]. Ann Transl Med, 2022, 10(2): 93. doi: 10.21037/atm-21-6924
[9] Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747. doi: 10.1093/annonc/mdr304
[10] Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis[J]. Lancet, 2014, 384(9938): 164-172. doi: 10.1016/S0140-6736(13)62422-8
[11] Madsen EV, Aalders KC, van der Heiden-van der Loo M, et al. Prognostic Significance of Tumor-Positive Internal Mammary Sentinel Lymph Nodes in Breast Cancer: A Multicenter Cohort Study[J]. Ann Surg Oncol, 2015, 22(13): 4254-4262. doi: 10.1245/s10434-015-4535-y
[12] Noguchi M, Ohta N, Koyasaki N, et al. Reappraisal of internal mammary node metastases as a prognostic factor in patients with breast cancer[J]. Cancer, 1991, 68(9): 1918-1925. doi: 10.1002/1097-0142(19911101)68:9<1918::AID-CNCR2820680913>3.0.CO;2-L
[13] Karanetz I, Jin M, Nguyen K, et al. Evaluation of internal mammary lymph node biopsy during microsurgical breast reconstruction: An analysis of 230 consecutive patients[J]. Breast J, 2021, 27(1): 7-12. doi: 10.1111/tbj.14105
[14] King TA, Morrow M. Surgical issues in patients with breast cancer receiving neoadjuvant chemotherapy[J]. Nat Rev Clin Oncol, 2015, 12(6): 335-343. doi: 10.1038/nrclinonc.2015.63
[15] Bi Z, Chen P, Liu J, et al. Internal Mammary Sentinel Lymph Node Biopsy after Neoadjuvant Chemotherapy in Breast Cancer[J]. J Breast Cancer, 2018, 21(4): 442-446. doi: 10.4048/jbc.2018.21.e49
-
期刊类型引用(18)
1. 付艳杰,郭文静,段鹏月,刘星辰. CAR-T细胞免疫疗法对复发/难治性弥漫大B细胞淋巴瘤患者LDH、ALC、CD4+/CD8+、Ki67表达的影响. 实用癌症杂志. 2024(01): 78-82 .  百度学术
百度学术
2. 张盛琪,蒋佩珍,高琰,刘青果,张朝畅,唐旭东. 较高危骨髓增生异常综合征伴原始细胞增多患者的中医证候特征及早期死亡危险因素研究. 北京中医药大学学报. 2024(03): 429-439 .  百度学术
百度学术
3. 孙邡,桑艳. 腹膜后肾肿瘤切除术治疗儿童双侧肾母细胞瘤疗效及对围手术期指标和术后并发症的影响. 临床和实验医学杂志. 2024(08): 853-857 .  百度学术
百度学术
4. 杨婷婷,黄一丹,杨蓉蓉,杨莹,张敬. 2型糖尿病合并慢性牙周炎患者血清LRG1、LDH与牙周指标和牙周病变程度的关系. 实用医学杂志. 2024(16): 2250-2255 .  百度学术
百度学术
5. 王英英,关珊珊,全建峰,任革,贾永军,韩冬. 小细胞肺癌患者血清LDH和proGRP与血浆D-D水平评估化疗疗效及预后的效能. 中国临床研究. 2023(03): 398-403 .  百度学术
百度学术
6. 罗旭,王千千,党会芬,王玉凤,田迎霞. 血清乳酸脱氢酶与转移性胃癌姑息性化疗患者生存期的关系. 兰州大学学报(医学版). 2023(03): 39-45 .  百度学术
百度学术
7. 闫隔,赵娜,张营. 胃肠胰神经内分泌肿瘤中GSK-3β、LDHA表达及其与临床病理特征的关系. 河南医学研究. 2023(09): 1616-1619 .  百度学术
百度学术
8. 王思宇,李佳蔚,李程豪,李玲,郭晴阳,邱璐,周世琴,刘永琦. 乳酸脱氢酶A在消化系统肿瘤中的作用及相关药物研究进展. 中国临床药理学与治疗学. 2023(04): 445-454 .  百度学术
百度学术
9. 宫业宏,白宏宇,陈天龙,方文星. 术前乳酸脱氢酶/白蛋白比值对肝细胞癌患者预后推断的价值分析. 医学理论与实践. 2023(13): 2175-2177 .  百度学术
百度学术
10. 廖奕娇,程馨缘,易铁钢. 蒿甲醚通过调节氧化应激改善阿霉素诱导小鼠心肌损伤的作用研究. 中药新药与临床药理. 2022(03): 319-324 .  百度学术
百度学术
11. 张硕,钟政昌,宋鑫龙,徐本韩,张玉红. LDH抑制剂筛选方法的优化及西藏药材中的应用. 食品工业. 2022(03): 155-159 .  百度学术
百度学术
12. 周永婕,王正峰,严俊,王海平,徐雯,周文策. 术前乳酸脱氢酶/白蛋白比值联合AFP评估肝细胞癌患者预后的价值. 肿瘤防治研究. 2022(04): 347-351 .  本站查看
本站查看
13. 庄思远,周旭,刘箬瑶,刘春明,李赛男,张语迟. 茯神中乳酸脱氢酶抑制剂的提取筛选与质谱分析. 食品工业. 2022(04): 16-22 .  百度学术
百度学术
14. 崔杨,曲璇. 乳酸在肿瘤中的作用及乳酸脱氢酶作为治疗靶点的研究进展. 肿瘤预防与治疗. 2022(06): 572-578 .  百度学术
百度学术
15. 丁晨. C反应蛋白、乳酸脱氢酶和β_2-微球蛋白检测对急性白血病患者治疗预后评估中的价值. 系统医学. 2022(20): 17-20+25 .  百度学术
百度学术
16. 胡忠利,杨艳丽,潘少君. 急性白血病中超敏C反应蛋白及乳酸脱氢酶的表达特点及临床意义. 现代医药卫生. 2021(14): 2337-2339 .  百度学术
百度学术
17. 倪玉芳,张树军,方天星,万军,陈洁,曾凡才. 黄胸鼠Ldha基因的克隆、原核表达及酶学性质研究. 四川动物. 2021(06): 601-610 .  百度学术
百度学术
18. 杨夏影,马银娟,师丽丽,吉小凡,潘耀柱. 多发性骨髓瘤有氧糖酵解的研究进展. 医学研究杂志. 2021(11): 12-15 .  百度学术
百度学术
其他类型引用(19)



 下载:
下载: