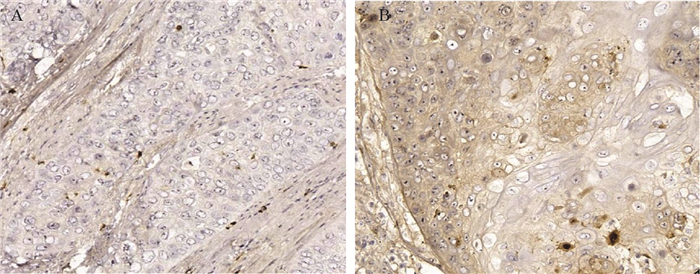
Expression of FGL1, Distribution of Tumor-Infiltrating Lymphocytes, and Their Clinical Significance in Esophageal Squamous-Cell Carcinoma
-
摘要:目的
探讨食管鳞状细胞癌(ESCC)组织中纤维蛋白原样蛋白1(FGL1)的表达、肿瘤浸润淋巴细胞(TILs)的分布及其与预后的关系。
方法回顾性分析120例ESCC患者临床资料,采用免疫组织化学法检测FGL1的表达,HE镜下评估肿瘤内浸润淋巴细胞(iTILs)和肿瘤间质浸润淋巴细胞(sTILs)的分布情况。生存分析评估患者的预后情况。
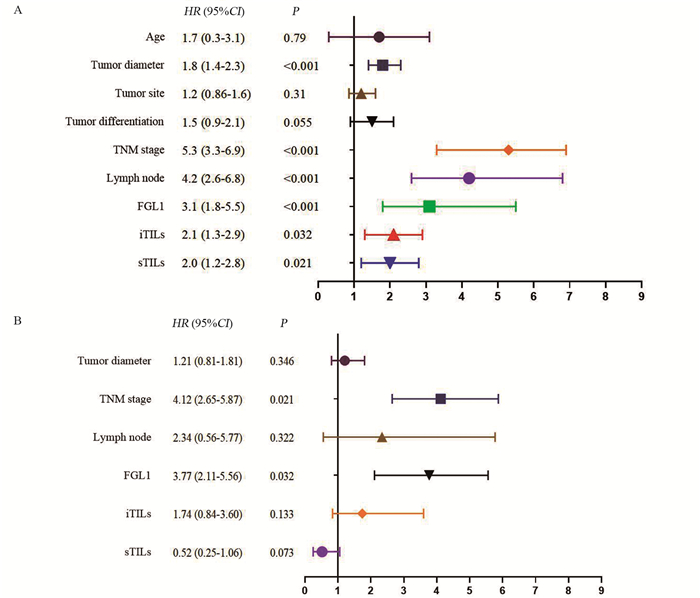
结果FGL1在ESCC组织中的阳性率为18.3%(22/120),其表达与TNM分期、淋巴结转移和TILs有关;ESCC组织中低度iTILs(iTILs≤10%)73例(60.8%),高度iTILs(iTILs > 10%)47例(39.2%);低度sTILs(sTILs≤10%)82例(68.3%),高度sTILs(sTILs > 10%)38例(31.7%)。iTILs分布与FGL1的表达、肿瘤分化程度和TNM分期有关,sTILs分布与FGL1的表达、肿瘤部位和TNM分期有关。Kaplan-Meier生存分析结果显示肿瘤直径、TNM分期、淋巴结转移、FGL1的表达、TILs的分布与患者预后有关(P < 0.05),多因素Cox回归结果显示,FGL1的表达、TILs的分布和TNM分期是患者预后的影响因素。
结论FGL1的表达与ESCC的不良预后相关,可能成为ESCC的预后生物标志物。FGL1联合TILs可作为预测ESCC预后的生物标志物。
Abstract:ObjectiveTo explore the expression of fibrinogen-like protein 1 (FGL1), the distribution of tumor-infiltrating lymphocytes (TILs), and their relationship with the prognosis of esophageal squamous-cell carcinoma (ESCC) patients.
MethodsWe analyzed retrospectively the clinical data of 120 ESCC patients. The expression of FGL1 was detected through immunohistochemistry. The distributions of intratumoral TILs (iTILs) and stromal TILs (sTILs) were evaluated under a microscope. Survival analysis was used to evaluate the patient outcomes.
ResultsThe positive rate of FGL1 in ESCC was 18.3% (22/120), and it was connected to the TNM stage, lymph node status, and TILs. A total of 73 cases (60.8%) showed low levels of iTILs (iTILs≤10%), and 47 cases (39.2%) exhibited high iTIL levels (iTILs > 10%). Similarly, 82 cases (68.3%) presented low levels of sTILs (sTILs≤10%), and 38 cases (31.7%) manifested high sTIL levels (sTILs > 10%). The distribution of iTILs was associated with FGL1, tumor differentiation, and TNM stage, whereas the distribution of sTILs was associated with FGL1, tumor location, and TNM stage. The Kaplan–Meier survival analysis showed that tumor diameter, TNM stage, lymph node status, FGL1, and TILs were associated with the prognosis of patients with ESCC (P < 0.05). Multivariate Cox regression revealed that FGL1, TILs and TNM stage were the influencing factors of prognosis.
ConclusionFGL1 expression is associated with the poor prognosis and may be a prognostic biomarker of ESCC. FGL1 combined with TILs can be used as a biomarker to predict ESCC.
-
Key words:
- Esophageal squamous cell carcinoma /
- Immunohistochemistry /
- FGL1 /
- TILs /
- Prognosis
-
0 引言
阿卡替尼是全球首个第二代布鲁顿酪氨酸激酶(Bruton’s tyrosine kinase, BTK)抑制剂。BCR通路是调控B细胞生存、增殖分化、黏附和迁移的关键信号通路,该通路的异常活化与B细胞恶性肿瘤的出现密切相关。BTK是BCR通路的关键激酶,临床试验显示BTK抑制剂对多种B细胞淋巴瘤疗效显著[1-2]。阿卡替尼于2017年10月31日在美国上市,被批准用于治疗复发性或难治性套细胞淋巴瘤和慢性淋巴细胞白血病或小细胞淋巴瘤,属于激酶抑制剂类药物,自身及其活性代谢产物均可与BTK活性位点中的半胱氨酸残基形成共价键,抑制BTK酶活性,从而抑制恶性B细胞的增殖和存活[3]。研究显示[4],相比第一代BTK抑制剂伊布替尼,阿卡替尼具有更高的选择性,脱靶效应更小,能够特异性地阻断BTK相关信号通路,无进展生存期方面不劣于伊布替尼,不良反应事件发生率更低。
虽然早期经验表明,阿卡替尼比伊布替尼耐受性更好[5],但由于上市时间较短,其安全性的研究大多源自临床试验数据,数据来源在多种限制条件下获取,研究数据不足,缺乏更广泛的上市后的药品不良事件(adversed drug events, ADEs)系统性研究;并且心血管和血液系统毒性是BTK抑制剂共有的不良反应[6],但阿卡替尼的药品说明书上记载的相关不良反应与伊布替尼相比不够全面,需要进行补充。因此本研究通过对美国FDA不良事件报告系统(FDA Adverse Events Reporting System, FAERS)中关于阿卡替尼上市以来不良反应信号进行挖掘分析,以便及时发现潜在的药物不良反应(adverse drug reaction, ADR),规避临床用药安全风险。
1 资料与方法
1.1 资料来源
对FAERS数据库中2017年第四季度至2021年第三季度共16个季度的美国信息交换标准代码(American Standard Code for Information Interchange, ASCII)原始数据进行提取,数据内容包括DEMO(患者的人口学信息)、DRUG(药品)、REAC(不良反应事件)、OUTC(事件结果)、RPSR(事件报告源)、THER(药物治疗始止日期)、INDI(原发疾病信息)。将数据导入MySQL软件进行分析,使用DEMO数据表进行去重,然后通过文档共有的primaryID字段建立映射关系,搜索阿卡替尼通用名“Acalabrutinib”和商品名“Calquence”获得首要怀疑不良事件及相关数据纳入分析。
1.2 方法
比例失衡法是目前最广泛使用的ADR信号检测方法[7],原理是通过四格表法比较目标药物(阿卡替尼)ADE的出现频率与背景频率之比以此来分析目标药物与ADE的相关程度,当目标药物ADE出现频率高于整个数据库背景频率设定的阈值,称之为失衡,提示产生了信号,信号值越强则认为目标药物与可疑ADE之间相关性越大。为了确保本次研究测得的信号更具有准确性,采用比例失衡法中的报告比值比法(reporting odds ratio, ROR)和比例报告比值法(proportional reporting ratio, PRR)同时检测,ROR法阈值为a(目标事件ADE)≥3且95%CI下限 > 1。
计算公式:ROR=(a/c)/(b/d); ROR 95%CI=

PRR=[a/(a+b)]/[c/(c+d)]; PRR 95%CI=
 表 1 比例失衡法的四格表Table 1 Fourfold table of disproportionality methods
表 1 比例失衡法的四格表Table 1 Fourfold table of disproportionality methods
1.3 统计学方法
使用Microsoft Excel软件筛选a≥3的ADE,排除无法判断的ADE信号(药品的质量问题、超说明书使用,先天性家族遗传性疾病,与原发疾病相关等问题),获得目标药物ADE,记录报告频次获得a值,搜索数据库其他药物的ADE,获得c值,随后分别计算获得b与d值,代入计算公式得出各个目标ADE的ROR值、PRR值及其95%CI下限,通过阈值排除无效信号,获得最终信号。最后采用《ICH国际医学用语词典》(medical dictionary for regularly activities, MedDRA)首选语(preferred terms, PT)编码,将最终挖掘的信号进行系统器官分类(system organ class, SOC)整理。
2 结果
2.1 阿卡替尼不良反应事件报告的基本特征
从2017年第四季度至2021年第三季度,数据库中共提取到ADE背景信号22 224 937例次,目标药物阿卡替尼首要怀疑不良反应事件3 155例次,共1 247例患者。上报的病例中,1 143例具有明确性别,104例未知性别;上报人职业为医疗卫生人员的有587例,消费者有470例,未知职业190例;上报例次较多的国家为美国和加拿大,其他国家报告例数较少,上报前5名的国家见表 2;上报的ADE事件中患者的原发疾病为套细胞淋巴瘤299例、慢性淋巴细胞白血病559例,占比68.75%,见表 2。从阿卡替尼不良反应事件各季度分布情况图可以看出,FAERS收到阿卡替尼自上市后至今首要不良事件数量呈上升趋势,见图 1。由此可以看出,该药的安全性仍需要引起重视,要加强用药监测。
表 2 阿卡替尼相关不良事件报告基本信息Table 2 Basic information about acalabrutinib-related adverse event reports
2.2 阿卡替尼不良反应事件的系统器官分类及信号检测
将最终筛选出的阿卡替尼73个ADE映射至相应的SOC,共涉及15个系统器官分类,各类损伤、中毒及手术并发症和血管疾病各有1个,肌肉骨骼及结缔组织疾病ADE有2个,皮肤及皮下组织类疾病、呼吸系统、胸及纵隔疾病、心脏疾病、肾脏及泌尿系统疾病和良恶性及性质不明肿瘤的ADE各4个,胃肠系统疾病、全身性疾病及给药部位各种反应、代谢及营养类疾病、神经系统疾病的ADE各5个,试剂检查ADE有8个,感染及侵染类疾病的ADE有9个,血液和淋巴系统疾病的ADE有12个。报告数较多的SOC为血液和淋巴系统、试剂检查和感染及侵染类疾病,见表 3。
表 3 各系统器官分类项(SOC)下阿卡替尼不良反应事件信号检测Table 3 Signal detection of adverse events of acalabrutinib under each system organ classification (SOC)
使用ROR、PPR法计算得出的73个阿卡替尼ADE信号值见表 4,排序前10的警戒信号为会阴蜂窝组织炎、软组织炎性反应、菌血症、淋巴球增多、淋巴结疼痛、肿瘤溶解综合征、自身免疫性溶血性贫血、肺泡出血、窦性头痛、血尿酸升高。将检测得出的73个信号与药品说明书进行对比,共有37个在阿卡替尼药品说明书中提及。
表 4 阿卡替尼不良反应事件信号强度Table 4 The signal intensity of adverse events of acalabrutinib
2.3 阿卡替尼ADE性别差异
由于女性有生育方面的需要,临床试验的受试者常规情况下男性都多于女性,并且男女性体质之间(激素水平、药物代谢酶等)也有差异[8],理论上不良反应在性别方面可能存在差异,而在FAERS数据库中,Yu等[9]通过对其常见的668种药物进行检测发现近50%的药物具有性别差异,Chen等[10]利用FAERS对阿利西尤单抗进行警戒信号挖掘后也发现14个ADE存在性别差异。因此,我们对阿卡替尼的ADE进行性别方面的进一步研究发现,使用DEMO数据表排除未上报性别的ADE后,使用ROR法分别对阿卡替尼的73个ADE进行男性及女性的相关信号计算,若男性有产生信号(a≥3且ROR 95%CI下限 > 1)而女性未产生信号或者男性信号值比女性信号值> 1.5则称之为男性高危信号,反之则成为女性高危信号[10]。从表 5可以看出,男性高危信号远多于女性,男性患者服用阿卡替尼应注意出血、心脏、泌尿系统、高血压等方面的不良反应,女性患者服用阿卡替尼应注意肝功能、皮肤炎性反应等方面的不良反应,而血液毒性和感染是使用此药物时都应该引起重视的不良反应。
表 5 性别差异的高危信号Table 5 High-risk signals of gender differences
3 讨论
本研究共检测出73个ADE,说明书中提到的不良反应如感染、出血、心房纤颤、挫伤、高血压、血液毒性、皮肤癌及其他第二原发肿瘤、实验室检查异常指标等,在本研究中都有信号响应,检出基本涵盖了说明书中提及的不良反应,证明了本研究结果的可靠性。
血液毒性是BTK抑制剂最常见的不良反应,可能与BTK抑制剂本身能抑制BTK酶活性有关。BTK属于Tec酪氨酸激酶家族,存在于除T细胞和NK细胞外的几乎所有造血细胞中,与BCR信号转导通路密切相关,而BCR通路功能正常是B细胞成熟发育的必要条件。同时研究显示,BTK抑制剂除了对BTK有较高的激酶抑制活性,对于其他激酶如EGFR、ITK、JAK3、HER2、BLK、BMX、SRC等也具有抑制作用[11-12]。其中ITK(IL2诱导性T细胞激酶)同样属于Tec家族非受体酪氨酸激酶的一员,调节常规T细胞和非常规NKT细胞的发育、分化和功能,也参与了对骨髓、肥大细胞和B细胞的生长分化和活化,与血小板功能密切相关[13]。而在此次研究中除了说明书提及的贫血、粒细胞缺乏症、血小板减少等ADE,还挖掘出了自身免疫性溶血性贫血、骨髓衰竭、淋巴结疼痛、骨髓增生异常综合征、里希特氏综合征、脾肿大这六个未收录的血液和淋巴系统疾病,在临床研究中,由于样本量和随访时间受限容易忽视迟发或罕见ADE,通过此次对FAERS数据库挖掘弥补了安全性的不足。以往的研究显示第一代BTK抑制剂伊布替尼可选择性抑制血小板的信号转导,影响血小板的黏附功能[14],出血的不良反应发生率高,而阿卡替尼与伊布替尼作用相似,在几个大型临床研究[15-16]中都有关于出血方面的报道,其余的几个已上市BTK抑制剂说明书上也都有提及,由此可见,出血是此类药物共有的ADR,服用时应密切监测患者的出血体征。
除了BCR信号转导通路,BTK还参与了B细胞中的许多其他信号转导途径(包括Toll样受体(TLR)和趋化因子和Fc受体信号转导)[17]。其中Fc受体是免疫球蛋白Fc段的特异性受体,γ链是Fc受体的一个组成亚单位,FcγR存在于周围神经系统和中枢神经系统的各种细胞上,可通过影响相关的致病性免疫球蛋白吞噬和清除机制进而影响神经系统疾病的易感性[18],因此服用阿卡替尼后可能出现神经系统疾病的不良反应。而此次ADR挖掘出的各个炎性反应感染也应高度警惕,其机制可能是:(1)TLR通路作为病原体检测的主要监控系统,可识别多种病原体广泛表达的碳水化合物、脂类、肽和核酸结构,是宿主防御外界病原体进攻的重要屏障[19];(2)研究显示BTK抑制剂也会抑制在淋巴细胞和骨髓中表达与机体免疫调节有关的JAK3;(3)B细胞作为机体的一种免疫细胞,能够介导体液免疫,识别呈递抗原后分化为浆细胞来保护人体免于病原体的入侵。并且此次还挖掘出说明书未提及的皮肤性炎性反应,在女性群体中可能更容易发生,因此女性人群服用时需要更加注意[20]。
许多肿瘤药物ADR都有涉及胃肠系统疾病、全身性疾病及给药部位的各种反应,这可能与大部分肿瘤患者需要长期进行大强度的治疗,从而导致身体虚弱乏力,免疫力低下和胃肠道功能紊乱有关,并且阿卡替尼是口服给药,对胃肠道黏膜也有一定的刺激作用,在与减少胃酸分泌药和CYP3A诱导剂和抑制剂联用时需注意调整剂量。阿卡替尼的适应证为慢性淋巴细胞白血病和套细胞淋巴瘤,发病的中位年龄在60岁左右,老年患者比例较高,可能与本次新挖掘出的肾脏及泌尿系统疾病的不良反应发生相关。由上述可知,阿卡替尼对EGFR具有抑制作用,EGFR参与刺激表皮生长、加快伤口愈合等多项皮肤生理学反应,抑制其活性可能会引起多种皮肤系统的不良反应[21],并且Pileri等[22]研究显示伊布替尼可导致皮肤反应和脆甲症,阿卡替尼导致的第二原发肿瘤发生率最高的是皮肤癌,说明阿卡替尼与皮肤及皮下组织类不良反应的出现有一定的关联,使用时应有所警惕。
心血管不良反应是BTK抑制剂上市以前最受关注的不良反应。BTK和TEC均已在心脏组织中发现,研究显示伊布替尼可脱靶作用于SRC,可导致心房颤动、高血压、室性心律失常等心血管并发症[23],ASCEND[15]和ELEVATE-TN[16]这两项大型研究也报道了阿卡替尼会导致心房颤动和高血压,Grewal等[24]利用FAERS数据库对慢性淋巴细胞白血病中的新型药物进行药物警戒的分析,发现包括阿卡替尼在内的新型药物在治疗慢性淋巴细胞白血病时具有心血管不良事件(心房颤动、心衰、心律失常、高血压等)发生风险,由此验证了本次研究挖掘出5个心血管方面的ADE,除了房颤和高血压,还有说明书未录入的心动过速、急性心肌梗死、心跳不规律都值得注意,需加强对心血管方面的监测,有体征时及时进行相应的检查。
FAERS系统作为药品不良反应的大样本数据库,是评价药品上市后安全性的最经济、最有效的监测工具。但该系统属于自发呈报系统,不良反应事件上报受到多种因素的影响,具有一定的局限性。首先是数据的规范性,数据上报者来源多样,就本研究而论,非专业人士上报率接近一半,可能存在重报漏报或掺杂患者的主观感受;其次是数据人种大部分源于欧美,亚洲人群较少,药物在不同种族间可能存在差异;最后是患者的合并用药情况无法探究。同时在方法上,研究采用比例失衡法中的ROR与PRR法,属于频数分析方法,具有简单易懂、敏感度高,一致性好等优势,能够减少对照组选择误差,估计相对危险性,但在特定条件下容易出现假阳性,并且计算所得的ADE信号只表示统计学上的相关性,不能明确生物学上的因果关系[25],二者需要进一步评估。
综上所述,本研究基于FAERS数据库,使用比例失衡法挖掘阿卡替尼上市以来16个季度的ADE数据,补充了药品说明书中未提及的相关系统的不良反应,为该药的药物警戒工作提供了客观参考资料,以降低临床用药风险。
Competing interests: The authors declare that they have no competing interests.作者贡献:刘尧:实验设计、实施;数据分析;论文撰写及修改孙雪梅:临床数据收集、统计学分析刘静:临床数据筛选刘炜:实验设计、临床数据筛选吕菲:免疫组织化学切片染色刘月平:课题设计、数据审核及指导论文撰写 -
表 1 120例食管鳞状细胞癌中FGL1的表达及与临床病理学特征的关系
Table 1 Relationship between FGL1 expression and clinicopathological features in 120 cases of ESCC

表 2 120例食管鳞状细胞癌中TILs状态与临床病理学特征的关系
Table 2 Relationship between TIL status and clinicopathological features in 120 cases of ESCC

-
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567. doi: 10.1016/S2214-109X(18)30127-X
[3] Qian W, Zhao M, Wang R, et al. Fibrinogen-like protein 1 (FGL1): the next immune checkpoint target[J]. J Hematol Oncol, 2021, 14(1): 147. doi: 10.1186/s13045-021-01161-8
[4] Wang J, Sanmamed MF, Datar I, et al. Fibrinogen-like Protein 1 is a Major Immune Inhibitory Ligand of LAG-3[J]. Cell, 2019, 176(1-2): 334-347. doi: 10.1016/j.cell.2018.11.010
[5] Okadome K, Baba Y, Yagi T, et al. Prognostic Nutritional Index, Tumor-infiltrating Lymphocytes, and Prognosis in Patients with Esophageal Cancer[J]. Ann Surg, 2020, 271(4): 693-700. doi: 10.1097/SLA.0000000000002985
[6] Lv Z, Cui B, Huang X, et al. FGL1 as a Novel Mediator and Biomarker of Malignant Progression in Clear Cell Renal Cell Carcinoma[J]. Front Oncol, 2021, 11: 756843. doi: 10.3389/fonc.2021.756843
[7] Hoeppner J, Plum PS, Buhr H, et al. Surgical treatment of esophageal cancer-Indicators for quality in diagnostics and treatment[J]. Chirurg, 2021, 92(4): 350-360. doi: 10.1007/s00104-020-01267-8
[8] Huang TT, Li SH, Chen YH, et al. Definitive chemoradiotherapy for clinical T4b esophageal cancer - Treatment outcomes, failure patterns, and prognostic factors[J]. Radiother Oncol, 2021, 157: 56-62. doi: 10.1016/j.radonc.2021.01.007
[9] Li CY, Cao CZ, Xu WX, et al. Recombinant human hepassocin stimulates proliferation of hepatocytes in vivo and improves survival in rats with fulminant hepatic failure[J]. Gut, 2010, 59(6): 817-826. doi: 10.1136/gut.2008.171124
[10] Demchev V, Malana G, Vangala D, et al. Targeted deletion of fibrinogen like protein 1 reveals a novel role in energy substrate utilization[J]. PLoS One, 2013, 8(3): e58084. doi: 10.1371/journal.pone.0058084
[11] Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nat Med, 1999, 5(12): 1365-1369. doi: 10.1038/70932
[12] Son Y, Shin NR, Kim SH, et al. Fibrinogen-Like Protein 1 Modulates Sorafenib Resistance in Human Hepatocellular Carcinoma Cells[J]. Int J Mol Sci, 2021, 22(10): 5330. doi: 10.3390/ijms22105330
[13] Yu J, Li J, Shen J, et al. The role of Fibrinogen-like proteins in Cancer[J]. Int J Biol Sci, 2021, 17(4): 1079-1087. doi: 10.7150/ijbs.56748
[14] Liu XH, Qi LW, Alolga RN, et al. Implication of the hepatokine, fibrinogen-like protein 1 in liver diseases, metabolic disorders and cancer: The need to harness its full potential[J]. Int J Biol Sci, 2022, 18(1): 292-300. doi: 10.7150/ijbs.66834
[15] Badalamenti G, Fanale D, Incorvaia L, et al. Role of tumor-infiltrating lymphocytes in patients with solid tumors: Can a drop dig a stone?[J] Cell Immunol, 2019, 343: 103753. doi: 10.1016/j.cellimm.2018.01.013
[16] Zhao Z, Ding H, Lin ZB, et al. Relationship between Tertiary Lymphoid Structure and the Prognosis and Clinicopathologic Characteristics in Solid Tumors[J]. Int J Med Sci, 2021, 18(11): 2327-2338. doi: 10.7150/ijms.56347
-
期刊类型引用(2)
1. 熊瑞,雷静,张世鹏,张宏,仝永涛,来小丹. 基于美国FAERS数据库的阿可替尼ADE信号挖掘与分析. 中国药房. 2024(05): 595-600 .  百度学术
百度学术
2. 吕艳华,梁傲雪,李琦. 基于真实世界数据的阿米替林不良事件信号挖掘. 山西医科大学学报. 2024(06): 798-803 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: