Research Progress on Regulation of Tumor-Associated Macrophages Polarization by Intratumoral Microorganisms in Pancreatic Cancer
-
摘要:
近年来研究发现胰腺癌中存在特定的微生物,越来越多的证据显示微生物组的改变与胰腺癌肿瘤免疫功能之间存在关联,肿瘤微环境(TME)中的不同刺激促使肿瘤相关巨噬细胞(TAM)向免疫激活的M1表型或免疫抑制的M2表型极化,TME中的微生物通过影响巨噬细胞的表型和功能促进或抑制肿瘤生长、转移和耐药等过程。本文对胰腺癌TME中的几种厌氧菌调控TAM极化的作用机制进行了综述,就细菌菌体成分和代谢产物对TAM极化的影响进行了讨论,以期从微生物的视角为胰腺癌的诊断及治疗提供新的靶点。
Abstract:Recent studies have revealed the presence of specific microorganisms in pancreatic cancer. Accumulating evidence suggests a correlation between changes in the microbiome and tumor immune function in pancreatic cancer. Various stimuli within the tumor microenvironment (TME) prompt the polarization of tumor-associated macrophages (TAMs) toward the immune-activating M1 phenotype or immunosuppressive M2 phenotype. Microorganisms in the TME can facilitate or inhibit tumor growth, metastasis, drug resistance, and other processes by influencing the phenotypes and functions of macrophages. This article reviews the mechanisms by which anaerobic bacteria regulate TAM polarization in the TME of pancreatic cancer. Additionally, it discusses the effects of bacterial components and metabolites on TAM polarization, aiming to provide new targets for the diagnosis and treatment of pancreatic cancer from a microbial perspective.
-
0 引言
胰腺癌是恶性程度极高的实体肿瘤之一,2022年癌症统计报告显示全球共有51.1万例胰腺癌患者,而死亡患者高达46.7万例,是癌症相关死亡的第六大原因[1]。缺氧是胰腺癌的主要恶性特征,通过适应性调节与代谢促进肿瘤发生发展,增强了肿瘤微环境(Tumor microenvironment, TME)中厌氧菌的生长与繁殖[2]。胰腺癌TME中的微生物组成对肿瘤相关巨噬细胞(Tumor-associated macrophage, TAM)的极化状态有显著影响,厌氧菌的定植使肿瘤浸润性T细胞减少并上调M2型巨噬细胞的表达,从而抑制抗肿瘤免疫反应[3]。相反,清除这些微生物有助于改变免疫抑制微环境,从而增强免疫系统对肿瘤细胞的杀伤能力[4]。此外,瘤内微生物可通过产生特定的代谢物影响化疗药物的代谢和吸收,如吲哚类化合物可增强小鼠对化疗药物的反应[5]、铁载体有助于改善胰腺癌对于免疫检查点抑制剂(Immune checkpoint inhibitor, ICI)的反应性[6]。这些发现强调了在胰腺癌中针对微生物组和巨噬细胞极化状态的潜在治疗策略的重要性。TAM主要分为促炎性反应及抑制肿瘤的M1表型和抑制炎性反应及促肿瘤的M2表型。越来越多的研究发现肿瘤TME中的微生物与TAM极化的关系[7],微生物自身及其代谢产物通过IFN-γ、促肿瘤信号TLR4受体、芳基烃受体(Aryl hydrocarbon receptor, Ahr)、肿瘤坏死因子超家族成员9(Tumor necrosis factor superfamily member 9, TNFSF9)调节并介导了TAM的极化[8-9],影响了胰腺癌的发生发展、治疗及预后。本文对瘤内微生物群及其衍生代谢物通过介导TAM向不同表型的极化在胰腺癌发生发展中的作用进行了综述,为胰腺癌的微生物研究提供了新的方向。
1 TAM对胰腺癌的影响
血液循环中的单核细胞和巨噬细胞被肿瘤细胞产生的趋化因子招募并在相应的受体引导下向胰腺肿瘤组织浸润,如CCL2/CCR2轴[10],在TME中接受不同刺激分化为两种表型的TAM,进一步释放各种细胞因子和信号,在胰腺癌血管生成、侵袭与转移、免疫逃逸、化疗耐药等过程中发挥作用。
M1型巨噬细胞通常表现出增强免疫及抗肿瘤活性,分泌白细胞介素12和肿瘤坏死因子α等促炎介质激活肿瘤浸润T细胞,促进胰腺癌的抗肿瘤免疫[11],还可高表达细胞毒素活性氧和诱导型一氧化氮合酶参与宿主的先天性免疫,对胰腺癌细胞产生细胞毒性作用,并可损伤血管内皮抑制肿瘤血管生成和营养供应[12-13]。最新研究表明胰腺癌细胞的脂质代谢可被M1巨噬细胞中的IRF7/RPS18信号通路抑制,IRF7与M1巨噬细胞正相关并下调了RPS18的转录,使其通过外泌体转移到癌细胞的数量减少,抑制胰腺癌增殖、侵袭与转移,并促进癌细胞凋亡[14]。
胰腺癌TAM的M2极化与患者的预后不良相关[15],TAM摄取葡萄糖的过程伴随对溶酶体组织蛋白酶B的O-连接糖基化修饰,这一机制可使TAM获得免疫抑制表型并促进胰腺癌的化疗抵抗[16]。M2型巨噬细胞和调节性T细胞、髓源性抑制细胞共同参与免疫抑制微环境的形成[17],还通过TGF-β信号通路激活肌成纤维细胞使其释放大量胶原蛋白重塑细胞外基质形成缺氧微环境[18],分泌血管内皮生长因子刺激肿瘤组织内新生血管的形成[13],从而创造利于肿瘤生长的条件。M2分泌基质金属蛋白酶与组织蛋白酶协同修饰和降解细胞外基质又可促进肿瘤细胞的转移[19]。还有研究表明M2型巨噬细胞激活了肿瘤坏死因子样弱凋亡诱导因子TWEAK上游的TRAF6/NF-κB信号并与TWEAK的表达正相关,巨噬细胞被胰腺癌肿瘤细胞招募并可能向M2型极化,反向促进癌细胞非自主分泌TWEAK,诱导患者肌肉萎缩以及形成恶病质[10]。
2 微生物自身调控胰腺癌TAM极化的作用机制
2.1 具核梭杆菌
具核梭杆菌是革兰氏阴性厌氧菌,通常在口腔、胃肠道、泌尿道等部位中存在,其中以口腔中多见[20],在许多常见肿瘤中具核梭杆菌的存在导致了不良的预后。在胰腺癌患者中发现8.8%的肿瘤组织[21]和18.84%胰腺囊液标本存在具核梭杆菌感染[22],还有研究发现与正常胰腺对照组相比,胰腺癌患者十二指肠液中的具核梭杆菌富集程度更高[23],这些结果表明具核梭杆菌感染可能是胰腺癌患者预后不佳的独立危险因素。但也有部分研究在胰腺癌患者的肿瘤样本中并未检测到具核梭杆菌感染,或者发现其细菌丰度仅仅处于相对较低的水平[24-25]。
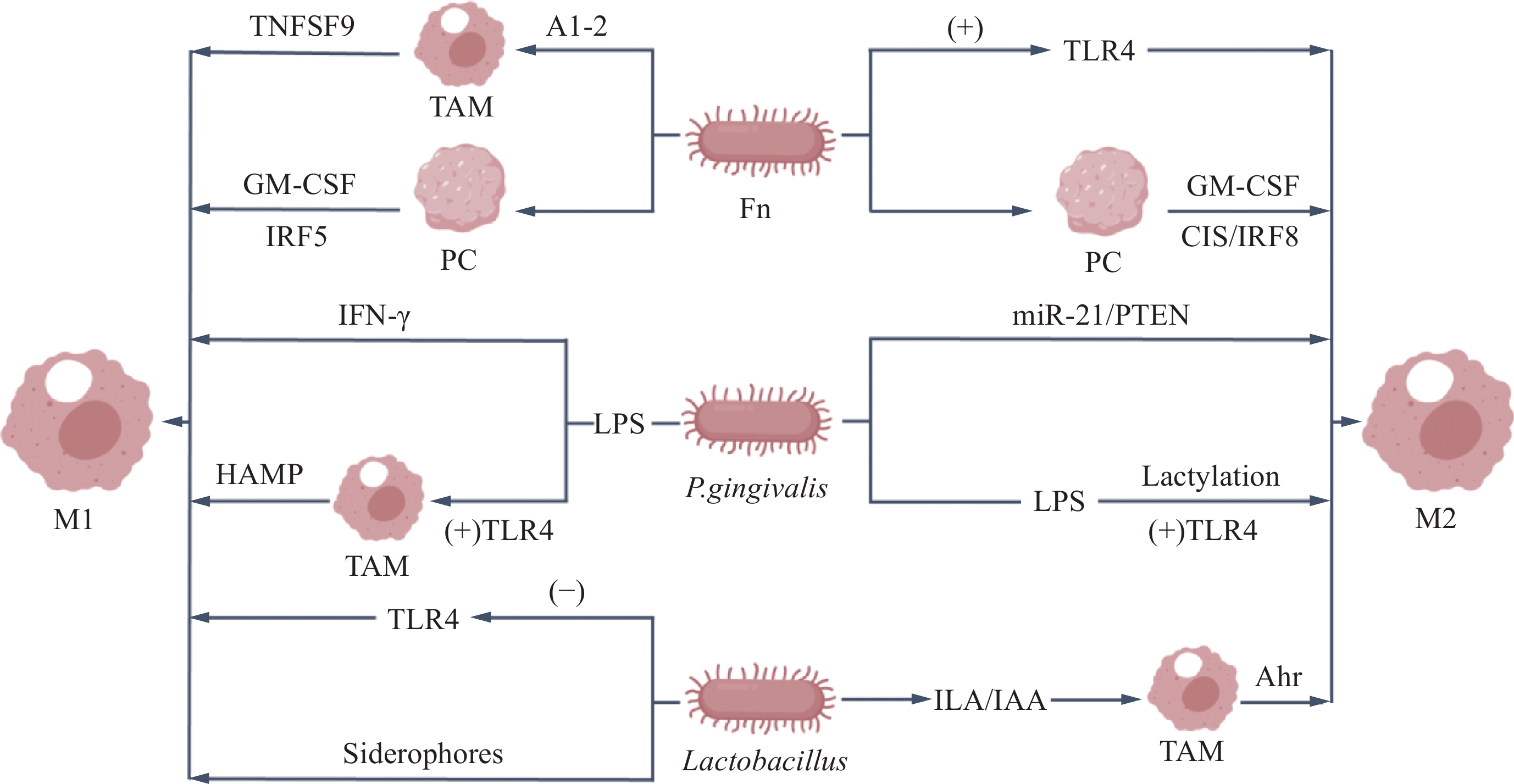
具核梭杆菌既可以通过激活TLR4受体诱导巨噬细胞向M2表型极化[26],又可以生成AI-2促使巨噬细胞分泌炎症介质TNFSF9并调节巨噬细胞向M1型极化[27],TNFSF9在胰腺癌中高表达与肿瘤进展密切相关,这与具核梭杆菌感染的胰腺癌患者预后不佳一致,说明具核梭杆菌更可能通过介导TNFSF9抑制肿瘤浸润CD8+ T细胞的免疫作用从而促进胰腺癌的进展[28]。此外,具核梭杆菌感染能够刺激胰腺癌细胞以及毗邻的正常胰腺上皮细胞分泌一系列细胞因子[20],其中粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony-stimulating factor, GM-CSF)对巨噬细胞的极化具有双重作用。GM-CSF/CSF2可以通过JAK2-STAT5/ERK/PKB/NF-κB/IRF5信号通路诱导TAM的M1极化状态[29],又能使单核细胞分化为具有相反功能的M2型巨噬细胞[30]。值得注意的是,无论是否受到具核梭杆菌的直接感染,经GM-CSF调节的癌细胞均展示出更为显著的增殖活性、侵袭能力和转移潜能,见图1。
这些研究结果表明,具核梭杆菌感染与胰腺癌致病与预后之间的关系可能并非绝对,因此在未来的研究中首先需要明确具核梭杆菌对胰腺癌患者预后的影响,其次应该更加深入地讨论具核梭杆菌如何精准调控肿瘤微环境中基质细胞的功能与分布,从而为开发基于靶向具核梭杆菌及其衍生的细胞因子网络的胰腺癌新型治疗策略提供理论依据。
2.2 牙龈卟啉单胞菌
口腔菌群与消化道肿瘤之间的关系也是近年来研究的热点之一[31],大量细菌经由唾液进入胃肠道,并可能通过血液循环系统传播至全身。牙龈卟啉单胞菌是一种在口腔中定植的革兰氏阴性厌氧菌,它感染宿主后刺激胃肠道上皮细胞和结缔组织使其通透性增加,进入血液后进一步繁殖和释放内毒素导致机体炎性反应和菌血症[32],这种致病机制与其自身结构和代谢产物密切相关,如菌毛、细菌脂多糖(Lipopolysaccharide, LPS)、外膜囊泡和牙龈蛋白酶[7]等。
牙龈卟啉单胞菌感染激活TGF-β信号通路促进胰腺上皮内瘤变的发生发展[33],还通过影响TLR介导胰腺癌小鼠的肿瘤进展[34],有证据表明牙龈卟啉单胞菌在胰腺癌中的促瘤作用是炎性微环境介导的[35],免疫抑制性TME也在胰腺癌的转移和免疫逃逸中发挥作用。研究发现,牙龈卟啉单胞菌通过miR-21/PTEN轴介导抑癌基因PTEN的表达下调[36],使胰腺癌处于M2型巨噬细胞参与构成的免疫抑制微环境[17],从而在抑制胰腺癌抗肿瘤免疫和促进癌细胞转移的过程中发挥重要作用。
此外,牙龈卟啉单胞菌的LPS通过IFN-γ诱导巨噬细胞M1极化,释放出TNF-α、IL-6、HLA-DR、CCL2等细胞因子导致典型的炎性反应[8]。被LPS激活的巨噬细胞向M1极化的过程中会发生代谢重编程[7],通过糖酵解代谢产生乳酸堆积,不仅作为代谢副产物,还通过促进组蛋白乳酸化修饰间接诱导M2巨噬细胞的极化从而调节免疫应答[37-38]。Huang等[8]研究发现在单核细胞系中通过敲低TET1和抑制其下游信号靶点NF-κB的表达可显著抑制牙龈卟啉单胞菌经LPS/IFN-γ诱导的M1巨噬细胞极化。继续探讨TET1/NF-κB信号通路和乳酸化修饰在巨噬细胞极化过程中的调控作用并在牙龈卟啉单胞菌感染的胰腺癌动物模型中进行验证具有重要意义。见图1。
2.3 乳酸杆菌
乳酸杆菌是一类革兰氏阳性厌氧菌或兼性厌氧菌,在肠道微生物群落中占据重要地位。目前研究表明乳酸杆菌对肿瘤的作用可能是双向的。有研究通过检测162例手术切除的胰腺癌患者肿瘤组织的细菌确定了乳酸杆菌定植与患者的预后不良相关[3]。该研究发现乳酸杆菌的瘤内感染导致CD4、CD8和 CD45RO的肿瘤浸润T细胞数量明显减少,免疫抑制性M2型巨噬细胞的丰度增加,胰腺癌患者生存率明显下降,这一结果与之前的研究保持一致[39],表明乳酸杆菌可能促进M2型TAM表达和抑制胰腺癌的抗肿瘤免疫。
但还有许多研究支持乳酸杆菌在抗消化道肿瘤方面具有积极效果。乳酸杆菌可以调节肿瘤微环境中的血管内皮生长因子等表达[40],抑制血管生成,从而限制肿瘤的生长和转移。同时乳酸杆菌还可以促使巨噬细胞向M1型极化和调节肠道微生物稳态,增强其抗肿瘤活性[41]。联合使用干酪乳杆菌与罗伊氏乳杆菌具有益生菌特性,联合使用后可通过抑制TLR4控制胰腺癌小鼠癌组织的生长并诱导M1型巨噬细胞极化[41],从而改善了荷瘤小鼠的预后。此外,该研究还发现益生菌疗法使胰腺癌小鼠粪便中的拟普雷沃氏菌属丰度降低,基于小鼠预后的改善,研究者倾向于认为益生菌导致的这种微生物改变有助于抑制胰腺癌的发展,换言之拟普雷沃氏菌属促进了肿瘤的进展,在结直肠癌患者口腔微生物组中也发现了这种菌群特征[42]。目前关于拟普雷沃氏菌属的研究较少,需要更多的研究深入了解其潜在机制。
3 微生物不同组分调控胰腺癌TAM极化的作用机制
3.1 菌体成分
瘤内微生物自身调节代谢或信号通路可直接影响巨噬细胞极化,其组成成分或分泌物也可通过改变TME从而发挥类似的作用。M1/M2极化在很大程度上依赖于TME中的铁代谢[43],LPS作为革兰氏阴性菌细胞壁外膜的关键成分,能够激活TLR4上调巨噬细胞内源性HAMP的表达[6],HAMP与TME中的铁转运蛋白结合后致使其发生内化及降解促进M1巨噬细胞极化。细菌的鞭毛蛋白帮助细菌运动的同时还具有一定的免疫调节作用,胰岛常驻巨噬细胞表达的TLR5可以介导鞭毛蛋白的促炎性反应[44],促进IL-6、TNF-α等炎性因子产生,进而启动机体的免疫防御机制,这些细菌包括乳酸杆菌、梭状芽孢杆菌和罗斯布氏菌等[45]。细菌的不同组成成分在胰腺癌中的具体作用还没有得到很好的描述,未来应该有更多的研究集中于瘤内微生物的各类结构与致病机制的相关性,以期找到有助于胰腺癌临床诊断及治疗的共同点和潜在生物标志物。
3.2 代谢产物
巨噬细胞还可以接受细菌代谢产物的调节。三甲胺n-氧化物(Trimethylamine n-oxide, TMAO)是肠道微生物裂解食物中的胆碱产生三甲胺,三甲胺进入血液循环后再经肝脏氧化生成的一种免疫相关代谢物。研究发现TMAO激活了M1型TAM,在肿瘤免疫治疗中有助于增强抗肿瘤免疫反应[46]。此外,TMAO还通过IFN依赖途径诱导了效应T细胞的抗肿瘤作用,饮食补充或经腹腔静脉注射TMAO可逆转胰腺癌小鼠的M2表型并达到同样的肿瘤抑制效应[47]。TMAO还可以改善免疫检查点阻断即抗PD-1/抗TIM3的效果,延长胰腺癌小鼠的生存期。深入探究TMAO与其他免疫调节因子或信号通路在胰腺癌TME中的协同或拮抗作用机制有助于开发新型的联合治疗方案。
Zhang等[48]研究表明乳酸杆菌代谢色氨酸生成的吲哚类化合物,如吲哚-3-乙酸(Indole-3-acetic, IAA)和吲哚-3-乳酸(3-indolylacetic acid, ILA),通过激活巨噬细胞中的Ahr使其极化为M2表型,促进肿瘤生长,药物抑制Ahr后增强了肿瘤患者TME的炎性反应并改善了患者对治疗的反应。双歧杆菌属也是ILA的来源之一[49],微生物组学分析显示该菌属在胰腺癌短期生存患者中富集,见图1。值得注意的是,最新的研究发现植物乳杆菌L168代谢产生的ILA通过增强肿瘤浸润CD8+ T细胞的抗肿瘤免疫和调节肠道菌群失调改善了结直肠癌患者预后[48]。结果提示ILA在不同肿瘤中可能具有截然不同的作用机制。明确乳杆菌及其吲哚类代谢物与TME中不同因素的相互作用将有助于开辟肿瘤精准治疗的新方向。
4 微生物治疗在胰腺癌中的作用
4.1 益生菌疗法
双歧杆菌和乳酸杆菌同属于益生菌,两者联合运用可减轻胰腺癌小鼠的病情[3],在维持肠道微生物平衡和增强肠道屏障功能方面起到关键作用。乳酸杆菌代谢色氨酸产生吲哚类代谢物,通过激活巨噬细胞的Ahr受体抑制胰腺癌免疫微环境形成和促进肿瘤生长[9],去除饮食中色氨酸的摄入和肠道菌群的缺失又可明显抑制巨噬细胞的Ahr活性,补充吲哚可逆转这一反应。Chaib等[6]研究表明源自益生菌菌株干酪乳杆菌的铁载体使胰腺癌的TAM向M1型极化,并增加CD8+ T细胞浸润,使小鼠的肿瘤负荷显著下降。尽管尚无直接应用于临床的益生菌,但上述研究足以说明益生菌疗法对胰腺癌治疗具有理论意义。
4.2 粪菌移植
粪菌移植(Fecal microbiota transplantation, FMT)作为一种新兴的胰腺癌治疗手段,在调节肠道微生物群和改善宿主免疫反应方面已显示出潜力[50-51]。Tintelnot等[5]表明FMT能够显著增加受体小鼠肠道中微生物衍生物IAA的浓度,中性粒细胞来源的髓过氧化物酶(Myeloperoxidase, MPO)能增强小鼠对化疗药物的反应。这表明FMT可增强胰腺癌传统化疗的效果,但FMT在胰腺癌治疗中的作用机制以及如何优化方案以实现最佳疗效仍需要深入研究。
5 小结与展望
近年来,胰腺癌与肿瘤微生物组的关系已成为研究焦点,瘤内微生物的定植与清除实现了对胰腺癌TME免疫系统的重编程,TAM受TME中各种复杂成分的影响后可在M1和M2表型之间相互转化,然而关于微生物及其代谢产物影响TAM极化的具体分子机制及潜在靶点仍有待进一步阐明。相较于侵入性的血液和组织病理活检,微生物检测因采集唾液或粪便样本的无创性,用于肿瘤筛查更易于被患者接受。此外,通过调整饮食结构或补充益生菌作为肿瘤预防的新途径,不仅为临床医师制定个性化治疗方案提供了支持,而且对优化预后及提升患者生存质量具有重要意义。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:鄢雅纤:文献检索、论文撰写与修改王 玮:论文选题及框架构思 -
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263. doi: 10.3322/caac.21834
[2] Gnanasekaran J, Binder Gallimidi A, Saba E, et al. Intracellular Porphyromonasgingivalis Promotes the Tumorigenic Behavior of Pancreatic Carcinoma Cells[J]. Cancers (Basel), 2020, 12(8): 2331. doi: 10.3390/cancers12082331
[3] Abe S, Masuda A, Matsumoto T, et al. Impact of intratumoral microbiome on tumor immunity and prognosis in human pancreatic ductal adenocarcinoma[J]. J Gastroenterol, 2024, 59(3): 250-262. doi: 10.1007/s00535-023-02069-5
[4] Gautam SK, Batra SK, Jain M. Molecular and metabolic regulation of immunosuppression in metastatic pancreatic ductal adenocarcinoma[J]. Mol Cancer, 2023, 22(1): 118. doi: 10.1186/s12943-023-01813-y
[5] Tintelnot J, Xu Y, Lesker TR, et al. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer[J]. Nature, 2023, 615(7950): 168-174. doi: 10.1038/s41586-023-05728-y
[6] Chaib M, Hafeez BB, Mandil H, et al. Reprogramming of pancreatic adenocarcinoma immunosurveillance by a microbial probiotic siderophore[J]. Commun Biol, 2022, 5(1): 1181. doi: 10.1038/s42003-022-04102-4
[7] Lin J, Huang D, Xu H, et al. Macrophages: A communication network linking Porphyromonas gingivalis infection and associated systemic diseases[J]. Front Immunol, 2022, 13: 952040. doi: 10.3389/fimmu.2022.952040
[8] Huang Y, Tian C, Li Q, et al. TET1 Knockdown Inhibits Porphyromonas gingivalis LPS/IFN-γ-Induced M1 Macrophage Polarization through the NF-κB Pathway in THP-1 Cells[J]. Int J Mol Sci, 2019, 20(8): 2023. doi: 10.3390/ijms20082023
[9] Hezaveh K, Shinde RS, Klötgen A, et al. Tryptophan-derived microbial metabolites activate the aryl hydrocarbon receptor in tumor-associated macrophages to suppress anti-tumor immunity[J]. Immunity, 2022, 55(2): 324-340. e8.
[10] Liu M, Ren Y, Zhou Z, et al. The crosstalk between macrophages and cancer cells potentiates pancreatic cancer cachexia[J]. Cancer Cell, 2024, 42(5): 885-903. e4.
[11] Zhu Y, Knolhoff BL, Meyer MA, et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models[J]. Cancer Res, 2014, 74(18): 5057-5069. doi: 10.1158/0008-5472.CAN-13-3723
[12] Liang G, Wang H, Shi H, et al. Porphyromonas gingivalis Promotes the Proliferation and Migration of Esophageal Squamous Cell Carcinoma through the miR-194/GRHL3/PTEN/Akt Axis[J]. ACS Infect Dis, 2020, 6(5): 871-881. doi: 10.1021/acsinfecdis.0c00007
[13] Yang J, Li Y, Sun Z, et al. Macrophages in pancreatic cancer: An immunometabolic perspective[J]. Cancer Lett, 2021, 498: 188-200. doi: 10.1016/j.canlet.2020.10.029
[14] Zhan T, Zou Y, Han Z, et al. Single-cell sequencing combined with spatial transcriptomics reveals that the IRF7 gene in M1 macrophages inhibits the occurrence of pancreatic cancer by regulating lipid metabolism-related mechanisms[J]. Clin Transl Med, 2024, 14(8): e1799. doi: 10.1002/ctm2.1799
[15] Kurahara H, Shinchi H, Mataki Y, et al. Significance of M2-Polarized Tumor-Associated Macrophage in Pancreatic Cancer[J]. J Surg Res, 2011, 167(2): e211-e219. doi: 10.1016/j.jss.2009.05.026
[16] Shi Q, Shen Q, Liu Y, et al. Increased glucose metabolism in TAMs fuels O-GlcNAcylation of lysosomal Cathepsin B to promote cancer metastasis and chemoresistance[J]. Cancer Cell, 2022, 40(10): 1207-1222. e10.
[17] Vidotto T, Melo CM, Castelli E, et al. Emerging role of PTEN loss in evasion of the immune response to tumours[J]. Br J Cancer, 2020, 122(12): 1732-1743. doi: 10.1038/s41416-020-0834-6
[18] Zhang JY, Zhu WW, Wang MY, et al. Cancer-associated fibroblasts promote oral squamous cell carcinoma progression through LOX-mediated matrix stiffness[J]. J Transl Med, 2021, 19(1): 513. doi: 10.1186/s12967-021-03181-x
[19] Kim ML, Sung KR, Kwon J, et al. Statins Suppress TGF-β2-Mediated MMP-2 and MMP-9 Expression and Activation Through RhoA/ROCK Inhibition in Astrocytes of the Human Optic Nerve Head[J]. Invest Ophthalmol Vis Sci, 2020, 61(5): 29. doi: 10.1167/iovs.61.5.29
[20] Udayasuryan B, Ahmad RN, Nguyen TTD, et al. Fusobacterium nucleatum induces proliferation and migration in pancreatic cancer cells through host autocrine and paracrine signaling[J]. Sci Signal, 2022, 15(756): eabn4948. doi: 10.1126/scisignal.abn4948
[21] Mitsuhashi K, Nosho K, Sukawa Y, et al. Association of Fusobacterium species in pancreatic cancer tissues with molecular features and prognosis[J]. Oncotarget, 2015, 6(9): 7209-7220. doi: 10.18632/oncotarget.3109
[22] Li S, Fuhler GM, Bn N, et al. Pancreatic cyst fluid harbors a unique microbiome[J]. Microbiome, 2017, 5(1): 147. doi: 10.1186/s40168-017-0363-6
[23] Kohi S, Macgregor-Das A, Dbouk M, et al. Alterations in the Duodenal Fluid Microbiome of Patients With Pancreatic Cancer[J]. Clin Gastroenterol Hepatol, 2022, 20(2): e196-e227. doi: 10.1016/j.cgh.2020.11.006
[24] Guo W, Zhang Y, Guo S, et al. Tumor microbiome contributes to an aggressive phenotype in the basal-like subtype of pancreatic cancer[J]. Commun Biol, 2021, 4(1): 1019. doi: 10.1038/s42003-021-02557-5
[25] Riquelme E, Zhang Y, Zhang L, et al. Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes[J]. Cell, 2019, 178(4): 795-806. e12.
[26] Chen T, Li Q, Wu J, et al. Fusobacterium nucleatum promotes M2 polarization of macrophages in the microenvironment of colorectal tumours via a TLR4-dependent mechanism[J]. Cancer Immunol Immunother, 2018, 67(10): 1635-1646. doi: 10.1007/s00262-018-2233-x
[27] Wu J, Li K, Peng W, et al. Autoinducer-2 of Fusobacterium nucleatum promotes macrophage M1 polarization via TNFSF9/IL-1β signaling[J]. Int Immunopharmacol, 2019, 74: 105724. doi: 10.1016/j.intimp.2019.105724
[28] Wu J, Wang Y, Jiang Z. Immune induction identified by TMT proteomics analysis in Fusobacterium nucleatum autoinducer-2 treated macrophages[J]. Expert Rev Proteomics, 2020, 17(2): 175-185. doi: 10.1080/14789450.2020.1738223
[29] Lacey DC, Achuthan A, Fleetwood AJ, et al. Defining GM-CSF- and macrophage-CSF-dependent macrophage responses by in vitro models[J]. J Immunol, 2012, 188(11): 5752-5765. doi: 10.4049/jimmunol.1103426
[30] Zhang S, Rautela J, Bediaga NG, et al. CIS controls the functional polarization of GM-CSF-derived macrophages[J]. Cell Mol Immunol, 2023, 20(1): 65-79.
[31] 龚忠诚, 买热拍提•买明, 李晨曦, 等. 牙龈卟啉单胞菌与常见消化系统恶性肿瘤相关性的研究现状[J]. 新疆医科大学学报, 2023, 46(5): 596-600. [Gong ZC, Mairepaiti•MM, Li CX, et al. Research progress on the relationship between Porphyromonas gingivalis and the malignancy of the digestive system[J]. Xinjiang Yi Ke Da Xue Xue Bao, 2023, 46(5): 596-600.] doi: 10.3969/j.issn.1009-5551.2023.05.004 Gong ZC, Mairepaiti•MM, Li CX, et al. Research progress on the relationship between Porphyromonas gingivalis and the malignancy of the digestive system[J]. Xinjiang Yi Ke Da Xue Xue Bao, 2023, 46(5): 596-600. doi: 10.3969/j.issn.1009-5551.2023.05.004
[32] Koliarakis I, Messaritakis I, Nikolouzakis TK, et al. Oral Bacteria and Intestinal Dysbiosis in Colorectal Cancer[J]. Int J Mol Sci, 2019, 20(17): 4146. doi: 10.3390/ijms20174146
[33] Chen SM, Hsu LJ, Lee HL, et al. Lactobacillus Attenuate the Progression of Pancreatic Cancer Promoted by Porphyromonas Gingivalis in K-rasG12D Transgenic Mice[J]. Cancers (Basel), 2020, 12(12): 3522. doi: 10.3390/cancers12123522
[34] Li P, Shu Y, Gu Y. The potential role of bacteria in pancreatic cancer: a systematic review[J]. Carcinogenesis, 2020, 41(4): 397-404. doi: 10.1093/carcin/bgaa013
[35] Tan Q, Ma X, Yang B, et al. Periodontitis pathogen Porphyromonas gingivalis promotes pancreatic tumorigenesis via neutrophil elastase from tumor-associated neutrophils[J]. Gut Microbes, 2022, 14(1): 2073785. doi: 10.1080/19490976.2022.2073785
[36] Li R, Hu Y, Hou S. An Exploration of Oral-Gut Pathogens Mediating Immune Escape of Pancreatic Cancer via miR-21/PTEN Axis[J]. Front Microbiol, 2022, 13: 928846. doi: 10.3389/fmicb.2022.928846
[37] Zhang D, Tang Z, Huang H, et al. Metabolic regulation of gene expression by histone lactylation[J]. Nature, 2019, 574(7779): 575-580. doi: 10.1038/s41586-019-1678-1
[38] Diskin C, Ryan TAJ, O’Neill LAJ. Modification of Proteins by Metabolites in Immunity[J]. Immunity, 2021, 54(1): 19-31. doi: 10.1016/j.immuni.2020.09.014
[39] Tanaka T, Masuda A, Inoue J, et al. Integrated analysis of tertiary lymphoid structures in relation to tumor-infiltrating lymphocytes and patient survival in pancreatic ductal adenocarcinoma[J]. J Gastroenterol, 2023, 58(3): 277-291. doi: 10.1007/s00535-022-01939-8
[40] Yin Z, Wang Y, Feng X, et al. Lactobacillus rhamnosus GG and Bifidobacterium animalis subsp. lactis BB-12 promote infected wound healing via regulation of the wound microenvironment[J]. Microb Biotechnol, 2024, 17(10): e70031. doi: 10.1111/1751-7915.70031
[41] Zhu Z, Yi B, Tang Z, et al. Lactobacillus casei combined with Lactobacillus reuteri alleviate pancreatic cancer by inhibiting TLR4 to promote macrophage M1 polarization and regulate gut microbial homeostasis[J]. BMC Cancer, 2023, 23(1): 1044. doi: 10.1186/s12885-023-11557-z
[42] Conde-Pérez K, Aja-Macaya P, Buetas E, et al. The multispecies microbial cluster of Fusobacterium, Parvimonas, Bacteroides and Faecalibacterium as a precision biomarker for colorectal cancer diagnosis[J]. Mol Oncol, 2024, 18(5): 1093-1122. doi: 10.1002/1878-0261.13604
[43] Dong D, Zhang G, Yang J, et al. The role of iron metabolism in cancer therapy focusing on tumor-associated macrophages[J]. J Cell Physiol, 2019, 234(6): 8028-8039. doi: 10.1002/jcp.27569
[44] Scheithauer TPM, Herrema H, Yu H, et al. Gut-derived bacterial flagellin induces beta-cell inflammation and dysfunction[J]. Gut Microbes, 2022, 14(1): 2111951. doi: 10.1080/19490976.2022.2111951
[45] O’ Donnell MM, Harris HMB, Lynch DB, et al. Lactobacillus ruminis strains cluster according to their mammalian gut source[J]. BMC Microbiol, 2015, 15: 80. doi: 10.1186/s12866-015-0403-y
[46] Zhao X, Di Q, Liu H, et al. MEF2C promotes M1 macrophage polarization and Th1 responses[J]. Cell Mol Immunol, 2022, 19(4): 540-553. doi: 10.1038/s41423-022-00841-w
[47] Mirji G, Worth A, Bhat SA, et al. The microbiome-derived metabolite TMAO drives immune activation and boosts responses to immune checkpoint blockade in pancreatic cancer[J]. Sci Immunol, 2022, 7(75): eabn0704. doi: 10.1126/sciimmunol.abn0704
[48] Zhang Q, Zhao Q, Li T, et al. Lactobacillus plantarum-derived indole-3-lactic acid ameliorates colorectal tumorigenesis via epigenetic regulation of CD8+ T cell immunity[J]. Cell Metab, 2023, 35(6): 943-960. e9.
[49] Russell WR, Duncan SH, Scobbie L, et al. Major phenylpropanoid-derived metabolites in the human gut can arise from microbial fermentation of protein[J]. Mol Nutr Food Res, 2013, 57(3): 523-535. doi: 10.1002/mnfr.201200594
[50] Liu LW, Xie Y, Li GQ, et al. Gut microbiota-derived nicotinamide mononucleotide alleviates acute pancreatitis by activating pancreatic SIRT3 signalling[J]. Br J Pharmacol, 2023, 180(5): 647-666. doi: 10.1111/bph.15980
[51] Liu L, Zhang T, Sui Y, et al. Gut microbiota affects pancreatic fibrotic progression through immune modulation in chronic pancreatitis[J]. Microb Pathog, 2023, 177: 106035. doi: 10.1016/j.micpath.2023.106035



 下载:
下载:

