Effect and Mechanism of TFAM on Chemotherapy Resistance in Ovarian Cancer Cells Through Metabolic Reprogramming Regulation
-
摘要:目的
研究线粒体转录因子A(TFAM)在铂耐药卵巢癌细胞中的作用及其对代谢重编程和铂类药物敏感性的影响。
方法分析铂耐药卵巢癌细胞的线粒体功能和代谢特征。通过构建TFAM过表达细胞,探讨其对细胞铂敏感性、线粒体功能及有氧糖酵解的影响,同时检测糖酵解酶和耐药蛋白的表达。
结果铂耐药卵巢癌细胞表现出显著的线粒体功能障碍(细胞耗氧率减少)及有氧糖酵解增强(胞外酸化率、葡萄糖摄取和乳酸生成增加)。TFAM在铂耐药细胞中低表达,过表达TFAM显著提高了细胞对铂类药物的敏感性(P<0.01),恢复线粒体功能并抑制有氧糖酵解活性。糖酵解相关酶和耐药蛋白表达均显著下调(P<0.05)。
结论TFAM低表达与铂耐药卵巢癌细胞中的线粒体氧化磷酸化抑制及有氧糖酵解增强相关。过表达TFAM能恢复细胞对氧化磷酸化的依赖性并提高其对铂类药物的敏感性,提示其可能是逆转铂耐药的潜在治疗靶点。
Abstract:ObjectiveTo investigate the role of mitochondrial transcription factor A (TFAM) in platinum-resistant ovarian cancer cells and its effects on metabolic reprogramming and sensitivity to platinum-based drugs
MethodsThe mitochondrial function and metabolic characteristics of platinum-resistant ovarian cancer cells were analyzed. A TFAM-overexpressing cell model was established to assess its effects on platinum sensitivity, mitochondrial function, and aerobic glycolysis; and glycolytic enzyme and drug-resistant protein expression were analyzed.
ResultsPlatinum-resistant ovarian cancer cells exhibited considerable mitochondrial dysfunction (reduced oxygen consumption rate) and enhanced aerobic glycolysis (increased extracellular acidification rate, glucose uptake, and lactate production). TFAM was downregulated in resistant cells. Meanwhile, TFAM overexpression significantly enhanced platinum sensitivity (P<0.01), restored mitochondrial function, and inhibited aerobic glycolysis. The expression levels of glycolytic enzymes and drug-resistant proteins were also downregulated (P<0.05).
ConclusionTFAM downregulation is associated with suppressed oxidative phosphorylation and enhanced aerobic glycolysis in platinum-resistant ovarian cancer cells. TFAM overexpression can restore cellular dependence on oxidative phosphorylation and increase platinum sensitivity, suggesting that TFAM is a potential therapeutic target for reversing platinum resistance.
-
0 引言
卵巢癌因缺乏早期症状和有效的筛查手段,大多数患者在确诊时已处于晚期,五年生存率仅为30%~50%[1-2]。尽管手术联合铂类化疗是卵巢癌的主要治疗手段,但高复发率和铂耐药性的出现限制了其疗效[3-4]。
代谢重编程,尤其是糖酵解在耐药中发挥关键作用。肿瘤细胞常表现出“Warburg效应”[5-6]。此外,部分耐药细胞氧化磷酸化增强,提示糖酵解与线粒体功能可能协同促进耐药[7-8]。
线粒体DNA的转录与复制由线粒体转录因子A(Mitochondrial transcription factor A, TFAM)调控。TFAM在维持线粒体DNA稳定性及肿瘤代谢重编程中起重要作用。研究表明,TFAM在乳腺癌和非小细胞肺癌中与肿瘤增殖、侵袭及转移密切相关[9-13],并可能通过维持氧化磷酸化活性,增强耐药性肿瘤的抗氧化应激能力[14]。但TFAM在卵巢癌中的具体机制尚不明确。
糖酵解与线粒体功能可能通过代谢信号通路协同调节耐药[15-16]。基于此,本研究旨在探讨TFAM在卵巢癌代谢重编程、糖酵解调控及铂耐药中的作用,以期为耐药性卵巢癌的治疗提供新思路。
1 材料与方法
1.1 实验材料
1.1.1 细胞株
人卵巢癌细胞株SKOV3和A2780、人卵巢癌顺铂耐药细胞株SKOV3/DDP和A2780/DDP由中国医学科学院馈赠,SKOV3/DDP和A2780/DDP耐药细胞的耐药指数分别为5.30和5.20。
1.1.2 主要试剂
RPMI 1640培养基、Opti-MEM培养基、胰酶、PBS缓冲液、青链霉素混合液、胎牛血清(Gibco公司,美国);顺铂(齐鲁制药有限公司,中国);2-脱氧-D-葡萄糖(2-Deoxy-D-glucose, 2-DG)和DMSO溶液(Sigma Chemical公司,美国);RT SuperMix反转录试剂盒、ChamQ SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司,中国);CCK-8试剂(上海碧云天生物科技公司,中国);TRIzol试剂和RIPA裂解液(Thermo Fisher公司,美国);结晶紫染液、BCA蛋白浓度测定试剂盒、蛋白酶抑制剂、磷酸酶抑制剂、蛋白修饰酶抑制剂(上海碧云天生物科技公司,中国);兔抗人单克隆抗体MPD-1、兔抗人单克隆抗体MPR-1(CST公司,美国);兔抗人单克隆抗体TFAM、兔抗人单克隆抗体HK2、兔抗人单克隆抗体IDH2、鼠抗人单克隆抗体β-Tubulin、HRP标记的羊抗兔单克隆二抗、HRP标记的羊抗鼠单克隆二抗(上海碧云天生物科技公司,中国);ECL化学发光液(南京诺唯赞生物科技有限公司,中国);细胞耗氧率(Oxygen consumption rate, OCR)及细胞外酸化速率(Extracellular acidification rate, ECAR)能量代谢试剂盒(Seahorse公司,美国);Lipo8000™转染试剂(上海碧云天生物科技公司,中国);过表达TFAM慢病毒委托上海吉凯生物有限公司合成;葡萄糖比色测定试剂盒和乳酸测定试剂盒(Abcam公司,美国);其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养及分组
SKOV3/DDP和A2780/DDP细胞用含有1 μmol/L顺铂(DDP)和10%胎牛血清(FBS)的RPMI 1640培养基,于37℃、5% CO2条件下培养。SKOV3和A2780细胞在不含DDP的RPMI 1640培养基中,添加10%胎牛血清,37℃、5%CO2条件下培养。细胞每2~3天传代一次,并在对数生长期收集用于后续实验。
1.2.2 慢病毒转染实验
将细胞以适宜密度接种于6孔板中,待细胞贴壁并恢复正常形态后,使用滴度为1.0×108 TU/ml的慢病毒rLv-hTFAM进行转染。转染72 h后,更换为正常培养基,并加入终浓度为10 μg/ml(经梯度实验优化)的嘌呤霉素进行筛选,每2~3天更换含10 μg/ml嘌呤霉素的新鲜培养基,直至对照组细胞完全死亡。随后,扩增存活的转染细胞并继续培养。
1.2.3 反转录实时荧光定量PCR技术
使用TRIzol试剂提取细胞总RNA,测定RNA浓度后,按照10 µl体系(2 µl 5×Supermix、500 ng RNA以及适量无酶水)进行反转录合成cDNA,程序如下:37℃ 15 min;85℃ 5 s。然后进行RT-qPCR反应,5 μl SYBR Green Mix、0.2 µl正向引物、0.2 µl反向引物、3.6 μl无酶水以及1 μl cDNA。RT-qPCR扩增程序:50℃ 2 min;95℃ 10 min;95℃ 15 s;60℃ 1 min;95℃ 15 s;60℃ 15 s;95℃ 15 s,共循环40次。平行样本的Ct值取均值,采用2−ΔΔCt的方法分析数据,引物序列如下:TFAM的正向引物:5’-TCCAAGAAGCTAAGGGTGAT-3’,反向引物:5’-CCTAACTGGTTTCCTGTGCC-3’;pan-β-Tubulin的正向引物:5’-CTGGACCGCATCTCTGTGTACTAC-3’,反向引物:5’-GACCTGAGCGAACAGAGTCCAT-3’。
1.2.4 免疫印迹实验
收集细胞样品,加入含有1×蛋白酶抑制剂、磷酸酶抑制剂、蛋白修饰酶抑制剂的RIPA裂解液,冰上充分裂解0.5 h以提取总蛋白。使用BCA试剂盒测定样品蛋白总量后,加入蛋白上样缓冲液,混匀并在95℃煮沸10 min使蛋白变性。将蛋白样品进行SDS-PAGE电泳分离,并转印至PVDF膜上。转膜后,用TBS-T洗膜,5%脱脂牛奶室温封闭1 h。随后,加入一抗,置于4℃摇床孵育过夜。次日,用TBS-T洗膜后,分别加入HRP标记的羊抗兔二抗(1∶10 000稀释)和HRP标记的羊抗鼠二抗(1∶10 000稀释),室温孵育2 h。最后,加入超敏型ECL发光液,通过Bio-Rad化学发光成像仪进行显影和观察,使用Image J软件分析结果。
1.2.5 CCK-8实验
将转染过表达TFAM慢病毒的SKOV3/DDP和A2780/DDP细胞以及对照组细胞进行消化处理后,以5×103个/孔的密度用新鲜培养基重悬,接种于96孔板中,每组设置6个复孔。为防止蒸发,在96孔板的边缘孔各加入100 μl含有20 μg/ml顺铂的PBS缓冲液。随后将96孔板置于37℃、5%CO2培养箱中培养1~3天。培养结束后,弃去培养基,加入含有10 μl CCK-8试剂的100 μl新鲜培养基,避光孵育1.5 h。使用酶标仪在450 nm波长处检测吸光度。
1.2.6 平板克隆形成实验
将处理后的细胞以500个/孔的密度接种于12孔板中,培养7~10天。弃上清液,用PBS洗涤细胞,4%多聚甲醛固定,结晶紫染色。染色后洗净细胞,拍照记录克隆形成情况。
1.2.7 乳酸生产和葡萄糖利用实验
将SKOV3/DDP和A2780/DDP细胞(1×106个)进行TFAM过表达慢病毒转染。转染后,细胞在完全培养基中孵育24 h,然后更换为Opti-MEM培养基(含1% FBS和20 mmol/L草氨酸钠),继续孵育72 h。每天收集培养上清液,使用葡萄糖比色测定试剂盒检测培养基中的葡萄糖浓度,计算葡萄糖消耗量并标准化至细胞数量。同时,使用乳酸测定试剂盒检测乳酸生成量。
1.2.8 细胞外酸化速率的检测
将转染过表达TFAM慢病毒的SKOV3/DDP和A2780/DDP细胞以5×104个/孔的密度接种于24孔板中。待细胞贴壁后,分别加入糖酵解压力试剂盒中的药物诱导剂(葡萄糖10 mmol/L、寡霉素1 μmol/L、2-脱氧葡萄糖50 mmol/L)。使用细胞代谢分析仪检测各组细胞的ECAR,并计算糖酵解能力值和糖酵解保留值。每组设3个复孔,实验重复3次。
1.2.9 细胞耗氧率的检测
实验前一天,将8×103个细胞接种至培养板并置于培养箱中培养。向水化板中加入200 μl无菌水,将检测板放入水化板并置于无CO2的37℃培养箱中过夜;另取50 ml校准液于50 ml离心管中,同样放入无CO2的37℃培养箱。次日,弃去检测板中无菌水,加入预先准备的200 μl校准液,继续置于无CO2的37℃培养箱中。配置检测培养液(含终浓度1 mmol/L丙酮酸、2 mmol/L谷氨酸、25 mmol/L葡萄糖),调pH至7.4并过滤除菌,预热至37℃。弃去原培养基,用200 μl检测培养液洗涤细胞两次,加入180 μl检测培养液,37℃平衡1 h。加入对应药物后,使用Seahorse细胞能量代谢仪进行OCR检测。每组设3个复孔,实验重复3次。
1.3 统计学方法
使用SPSS21.0和GraphPad Prism 7.0软件对数据进行统计分析和作图。两组间差异比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 铂耐药卵巢癌细胞中线粒体稳定性和功能受损
与对照组相比,铂耐药卵巢癌细胞SKOV3/DDP(P=0.01)和A2780/DDP(P=0.002)的基础呼吸、ATP产量以及最大呼吸水平均显著降低,表明铂耐药细胞的线粒体呼吸能力减弱、氧化磷酸化水平下降,见图1。
![]() 图 1 Seahorse实验检测铂耐药卵巢癌细胞及其对照组细胞中耗氧率(OCR)的变化Figure 1 Changes in oxygen consumption rate (OCR) in platinum-resistant ovarian cancer cells and control cells measured by Seahorse assay*: P<0.05, **: P<0.01, compared with the control (SKOV3 or A2780) group. Rote: rotenone; AA: antimycin A; FCCP: carbonyl cyanide-p-(trifluoromethoxy) phenylhydrazone.
图 1 Seahorse实验检测铂耐药卵巢癌细胞及其对照组细胞中耗氧率(OCR)的变化Figure 1 Changes in oxygen consumption rate (OCR) in platinum-resistant ovarian cancer cells and control cells measured by Seahorse assay*: P<0.05, **: P<0.01, compared with the control (SKOV3 or A2780) group. Rote: rotenone; AA: antimycin A; FCCP: carbonyl cyanide-p-(trifluoromethoxy) phenylhydrazone.2.2 铂耐药卵巢癌细胞株中有氧糖酵解增强
与对照组相比,SKOV3/DDP(P=0.000 2)和A2780/DDP(P=0.000 3)的ECAR显著升高,表明其有氧糖酵解活性显著增强。此外,测定培养基中葡萄糖的浓度及乳酸产量发现,与对照组相比,SKOV3/DDP(P=0.000 2)和A2780/DDP(P=0.000 09)的葡萄糖摄取量显著增加,同时,乳酸生成量也显著增加(SKOV3/DDP P=0.000 1, A2780/DDP P=0.000 07),见图2。
2.3 TFAM在卵巢癌铂耐药细胞中低表达
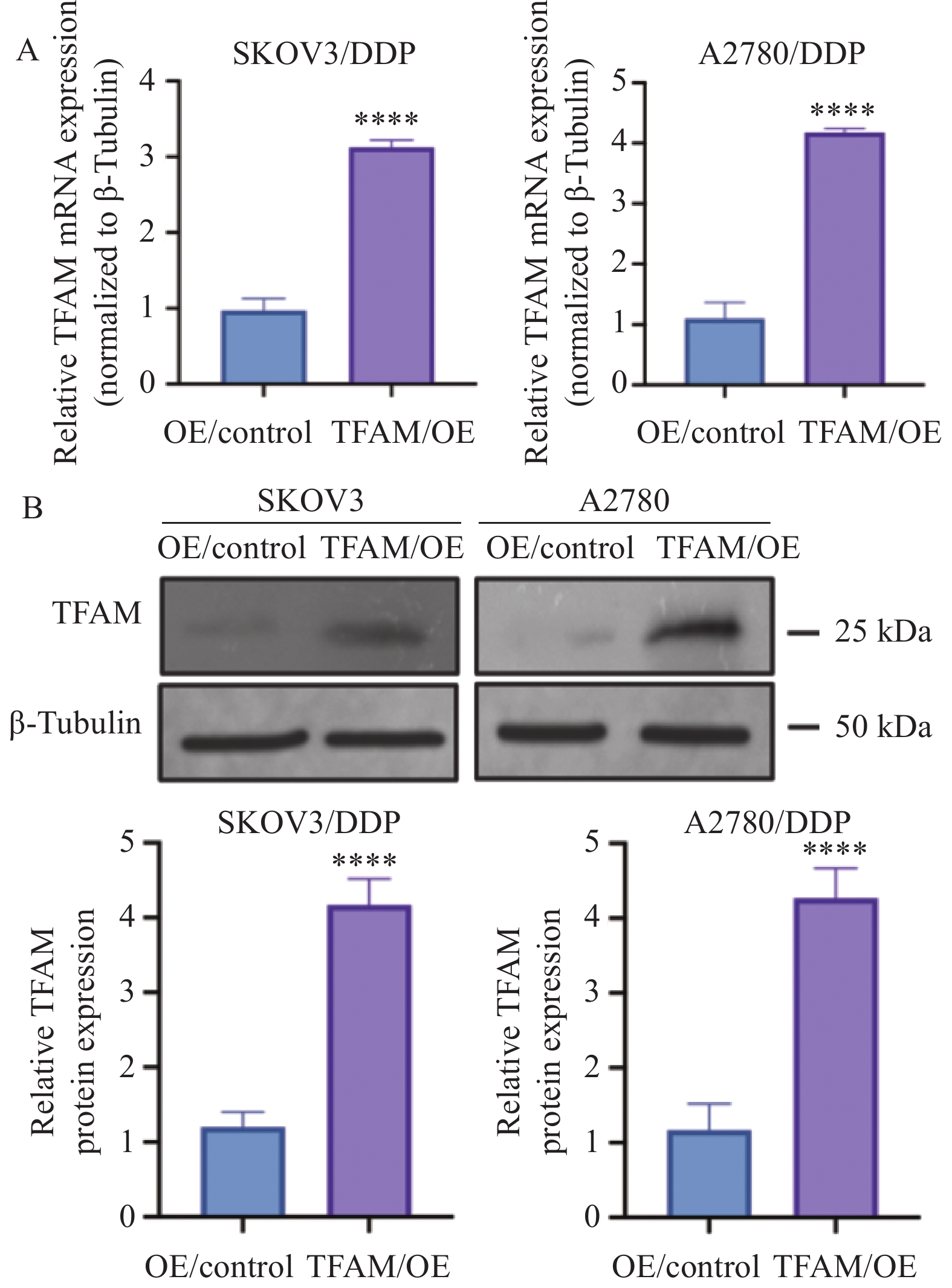
RT-qPCR结果显示,TFAM mRNA在铂耐药卵巢癌细胞SKOV3/DDP和A2780/DDP中的表达明显低于SKOV3(P=0.000 03)和A2780(P=0.000 05)细胞,见图3A。在Western blot检测中观察到相同的结果,顺铂耐药卵巢癌细胞中TFAM蛋白的表达明显低于对照组(SKOV3/DDP P=0.000 04, A2780/DDP P=0.000 05),见图3B。
2.4 构建TFAM高表达的铂耐药卵巢癌细胞株
为进一步研究TFAM对卵巢癌铂耐药的影响,我们通过慢病毒转染技术构建了TFAM稳定过表达的铂耐药卵巢癌细胞株SKOV3/DDP和A2780/DDP,并通过嘌呤霉素筛选得到TFAM稳定过表达的SKOV3/DDP和A2780/DDP细胞。RT-qPCR验证表明过表达组TFAM mRNA表达水平显著高于对照组(P=0.000 07,P=0.000 06),见图4A。Western blot观察到相同现象(P=0.000 02,P=0.000 03),见图4B。
2.5 过表达TFAM增加卵巢癌细胞的铂敏感性
为探讨TFAM高表达对铂耐药卵巢癌细胞顺铂敏感性的影响,采用20 μg/ml顺铂处理各组细胞24、48和72 h,并通过CCK-8实验评估细胞增殖情况。结果显示,过表达TFAM后,与对照组相比,顺铂处理48 h和72 h时SKOV3/DDP细胞增殖显著受抑(48 h P=0.000 03, 72 h P=0.000 01)。在A2780/DDP细胞中亦观察到相同趋势,即A2780/DDP-TFAM/OE组在48 h和72 h的细胞增殖较对照组显著下降,差异具有统计学意义(48 h P=0.000 07, 72 h P=0.000 04),见图5A。
顺铂处理48 h后,SKOV3/DDP-TFAM/OE(P=0.000 01)和A2780/DDP-TFAM/OE(P=0.000 02)细胞的克隆形成能力较对照组显著降低,克隆数明显减少,见图5B。
2.6 过表达TFAM恢复铂耐药卵巢癌细胞的线粒体功能并抑制有氧糖酵解
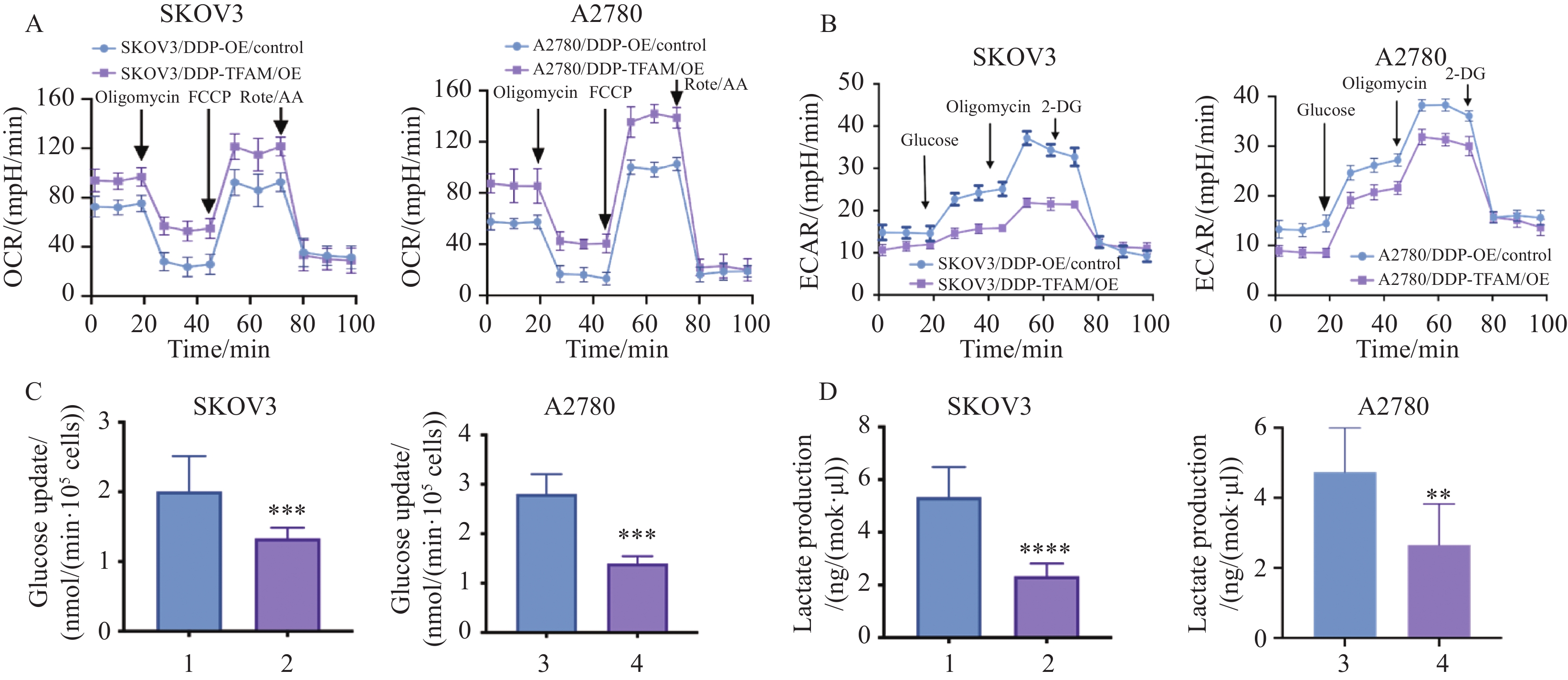
OCR检测结果显示,与对照组相比,TFAM过表达的铂耐药卵巢癌细胞SKOV3/DDP-TFAM/OE(P=0.003)和A2780/DDP-TFAM/OE(P=0.00 02)的基础呼吸、ATP生成量和最大呼吸能力均显著提升,表明其线粒体呼吸功能及氧化磷酸化水平增强,见图6A。进一步的ECAR检测结果表明,TFAM过表达后,SKOV3/DDP(P=0.000 05)和A2780/DDP(P=0.00 08)细胞的有氧糖酵解活性显著减弱,见图6B。此外,通过检测培养基中葡萄糖浓度和乳酸生成量发现,TFAM高表达的铂耐药卵巢癌细胞SKOV3/DDP-TFAM/OE(P=0.00 09)和A2780/DDP-TFAM/OE(P=0.00 07)的葡萄糖摄取量显著降低,且乳酸生成量也显著减少(SKOV3/DDP TFAM/OE P=0.000 05,A2780/DDP TFAM/OE P=0.003),见图6C~D。
![]() 图 6 过表达TFAM基因后对铂耐药卵巢癌细胞氧化磷酸化(A)和糖酵解(B~D)的影响Figure 6 Effects of TFAM gene overexpression on oxidative phosphorylation (A) and glycolysis (B-D) in platinum-resistant ovarian cancer cells**: P<0.01,***: P<0.001,****: P<0.0001, compared with the OE/control group. 1: SKOV3/DDP-OE/control; 2: SKOV3/DDP-TFAM/OE; 3: A2780/DDP-OE/control; 4: A2780/DDP-TFAM/OE.
图 6 过表达TFAM基因后对铂耐药卵巢癌细胞氧化磷酸化(A)和糖酵解(B~D)的影响Figure 6 Effects of TFAM gene overexpression on oxidative phosphorylation (A) and glycolysis (B-D) in platinum-resistant ovarian cancer cells**: P<0.01,***: P<0.001,****: P<0.0001, compared with the OE/control group. 1: SKOV3/DDP-OE/control; 2: SKOV3/DDP-TFAM/OE; 3: A2780/DDP-OE/control; 4: A2780/DDP-TFAM/OE.2.7 糖酵解抑制剂联合TFAM过表达进一步增加卵巢癌细胞的铂敏感性
在SKOV3/DDP细胞中,CCK-8实验结果显示,糖酵解抑制剂2-DG处理显著增强了过表达TFAM的细胞对顺铂的敏感性,尤其在处理48和72 h后,顺铂对细胞的抑制效果显著增强,与对照组相比差异具有统计学意义(48 h P=0.000 07, 72 h P=0.000 04)。在A2780/DDP细胞中也观察到类似的现象。2-DG处理后,顺铂在48和72 h对A2780/DDP-TFAM/OE组细胞的抑制作用显著增强,与对照组相比差异有统计学意义(48 h P=0.000 08, 72 h P=0.000 03),见图7。
![]() 图 7 糖酵解抑制剂2-DG处理对TFAM过表达卵巢癌细胞顺铂敏感性的影响Figure 7 Effect of glycolysis inhibitor 2-DG treatment on cisplatin sensitivity in TFAM-overexpressing ovarian cancer cells****: P<0.000 1, compared with the TFAM/OE group. A: in SKOV3/DDP cells, treatment with 2-DG (5 mmol/L) significantly enhanced cisplatin sensitivity in TFAM-overexpressing cells, particularly at 48 h and 72 h, compared with the control group (48 h, P=0.000 07; 72 h, P=0.000 04); B: a similar trend was observed in A2780/DDP cells, where 2-DG treatment significantly improved cisplatin sensitivity in TFAM-overexpressing cells, particularly at 48 h and 72 h, compared with the control group (48 h, P=0.000 08; 72 h, P=0.000 03).
图 7 糖酵解抑制剂2-DG处理对TFAM过表达卵巢癌细胞顺铂敏感性的影响Figure 7 Effect of glycolysis inhibitor 2-DG treatment on cisplatin sensitivity in TFAM-overexpressing ovarian cancer cells****: P<0.000 1, compared with the TFAM/OE group. A: in SKOV3/DDP cells, treatment with 2-DG (5 mmol/L) significantly enhanced cisplatin sensitivity in TFAM-overexpressing cells, particularly at 48 h and 72 h, compared with the control group (48 h, P=0.000 07; 72 h, P=0.000 04); B: a similar trend was observed in A2780/DDP cells, where 2-DG treatment significantly improved cisplatin sensitivity in TFAM-overexpressing cells, particularly at 48 h and 72 h, compared with the control group (48 h, P=0.000 08; 72 h, P=0.000 03).2.8 TFAM基因过表达对铂耐药卵巢癌细胞糖酵解相关蛋白表达的影响
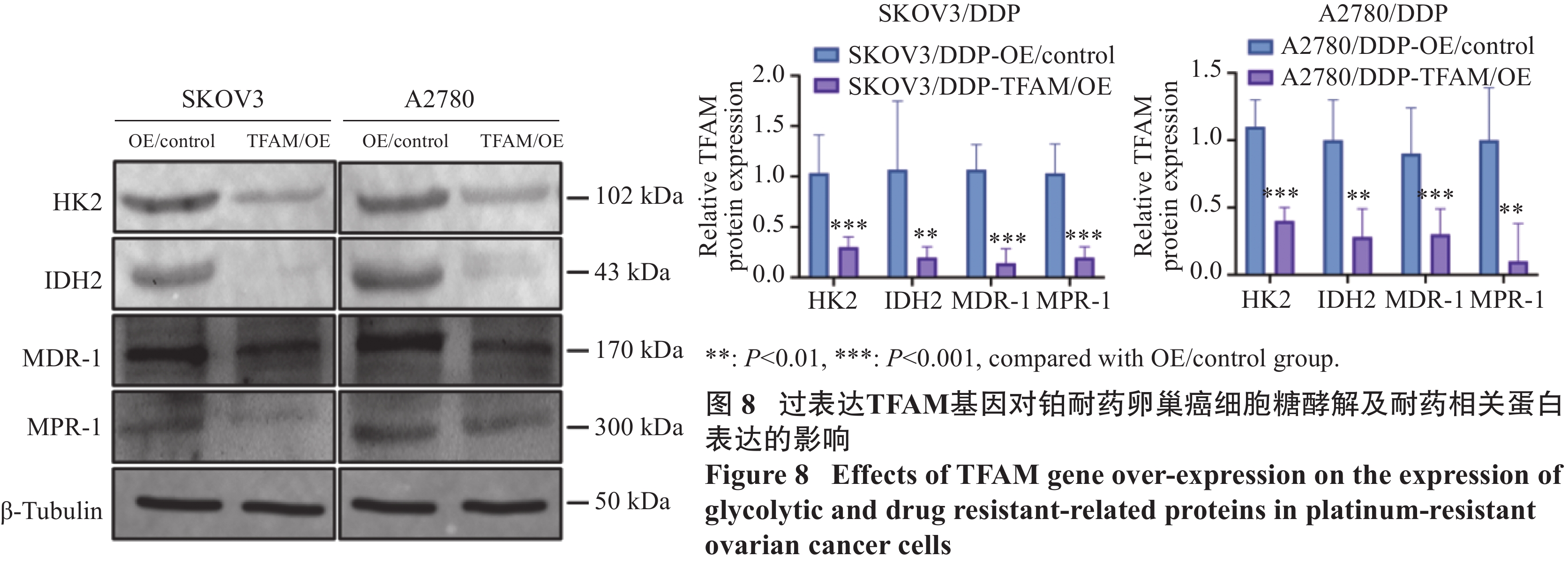
Western blot检测结果显示,在顺铂耐药卵巢癌细胞中,上调TFAM表达后,SKOV3/DDP-TFAM/OE和A2780/DDP-TFAM/OE细胞中HK2(P=0.000 5,P=0.000 8)、IDH2(P=0.006,P=0.009)、MDR-1(P=0.000 9,P=0.000 4)和 MRP-1(P=0.000 3,P=0.006)蛋白的表达水平显著降低,见图8。
3 讨论
卵巢癌是女性生殖系统常见的恶性肿瘤之一,因其早期症状隐匿且筛查率低,多数患者在确诊时病情已进展至晚期,导致预后较差。尽管手术、化疗、靶向和免疫等多种治疗手段已被广泛应用,但患者5年总体生存率仍不足50%[1]。铂类药物治疗是卵巢癌治疗的标准方案,能够有效诱导癌细胞凋亡并抑制肿瘤进展。然而,尽管通常初始治疗能取得较好的临床疗效,但许多患者最终仍因肿瘤细胞获得耐药性而复发,显著制约了治疗效果并影响预后[4]。因此,探索克服肿瘤耐药的新策略对于提高卵巢癌患者的生存率具有重要意义。
研究表明,肿瘤细胞在化疗药物影响下会通过代谢重编程来适应恶劣的生存环境,从而降低对药物的敏感性。这种代谢重编程的核心特征之一是能量代谢模式的改变,即从依赖氧化磷酸化(OXPHOS)转向有氧糖酵解(Warburg效应),即使在氧气充足的条件下,癌细胞仍优先利用糖酵解产生ATP。这种适应性转变不仅加快了能量供应,还帮助降低氧化应激水平,减少活性氧(ROS)的积累,从而增强细胞的耐药性[17-18]。此外,有氧糖酵解还能通过调控乳酸积累、重塑肿瘤微环境以及激活多种信号通路,进一步促进耐药表型的形成。这种代谢重编程在多种恶性肿瘤中均被发现,尤其是在铂耐药卵巢癌细胞中表现得尤为显著[19]。因此,深入研究其分子机制并探索针对代谢重编程的干预策略,对于克服耐药性、提高铂类药物疗效具有重要的临床价值。
本研究发现,铂耐药卵巢癌细胞的氧化磷酸化水平显著降低,促使细胞通过有氧糖酵解维持生存,减少对线粒体的依赖,减轻线粒体功能障碍带来的负面影响,并通过糖酵解生成ATP以应对药物应激。这种代谢重编程被认为是肿瘤耐药的重要标志[20-22]。本研究中,铂耐药卵巢癌细胞的耗氧率显著降低,而胞外酸化率、葡萄糖摄取量和乳酸生成量明显升高,这进一步证明了其代谢方式从氧化磷酸化向有氧糖酵解转变的趋势。
已有研究报道TFAM在线粒体氧化磷酸化和肿瘤代谢调控中的重要作用,并指出线粒体功能障碍与化疗耐药的相关性[23-24]。本研究首次发现了铂耐药卵巢癌细胞中TFAM低表达驱动糖酵解代谢重编程的现象,为深入理解TFAM在铂耐药中的作用提供了新的视角。尤其是TFAM在低表达条件下如何通过促进有氧糖酵解来支持肿瘤细胞存活,凸显了代谢适应性在耐药机制中的重要性。为进一步探究TFAM在铂耐药中的作用,本研究通过过表达TFAM评估了其对线粒体功能、糖酵解和药物敏感性的影响。结果显示,TFAM过表达显著提高了铂耐药卵巢癌细胞对铂类药物的敏感性,提示TFAM可能通过恢复细胞对线粒体氧化磷酸化的依赖,抑制有氧糖酵解,从而逆转耐药表型。这种代谢转变使细胞重新依赖线粒体产生ATP,而非仅依赖糖酵解,从而增强了其对铂类药物的敏感性。
进一步研究发现,糖酵解抑制剂2-DG与TFAM过表达的联合应用显著增强了铂耐药卵巢癌细胞对顺铂的敏感性,这一现象在SKOV3/DDP和A2780/DDP细胞中均得到了验证。尤其在处理48和72 h后,顺铂对细胞的抑制效果显著增强。这些结果提示,在TFAM过表达的条件下,糖酵解抑制剂2-DG通过改善代谢重编程进一步提高了铂耐药细胞对顺铂的敏感性,表明TFAM可以通过调节代谢重编程在铂类耐药中发挥关键作用。
从机制层面来看,TFAM过表达改善了线粒体功能,促进了氧化磷酸化,抑制了有氧糖酵解,减少了葡萄糖摄取和乳酸生成,从而帮助细胞恢复其对铂类药物的敏感性。研究还表明,TFAM通过调控糖酵解酶和耐药相关蛋白来实现其作用。TFAM上调后,糖酵解和耐药相关蛋白的水平下降,提示其可能直接或间接影响这些蛋白的表达,进一步说明TFAM通过调节代谢在分子层面上逆转耐药的潜在机制。
在卵巢癌中,TFAM的高表达已被证实能够促进肿瘤细胞增殖,而抑制其表达则可以减少细胞增殖[25-26]。本研究发现,铂耐药的卵巢癌细胞中TFAM表达显著降低,而过表达TFAM能够部分逆转耐药性,表明其在细胞增殖和耐药性调控中具有双重作用。在正常生理条件下,TFAM支持线粒体功能和氧化磷酸化,促进细胞增殖;而在化疗压力下,TFAM的低表达可能帮助细胞通过增强有氧糖酵解来逃避药物毒性,从而维持生存。TFAM过表达则可恢复细胞对氧化磷酸化的依赖,抑制有氧糖酵解,进而克服耐药性。值得注意的是,有研究表明顺铂能通过诱导细胞应激显著提高敏感卵巢癌细胞中TFAM的表达,增强线粒体功能和ATP生成,以应对药物引起的能量消耗和氧化应激[27]。然而,本研究发现耐药细胞中TFAM表达降低,提示耐药细胞可能通过下调TFAM来减轻化疗引起的能量消耗与氧化应激,减少损伤并维持生存。这种代谢适应虽然有助于短期生存,但可能削弱线粒体功能,影响细胞的长期生存能力。
综上,本研究确立了TFAM在铂耐药卵巢癌细胞代谢重编程中的关键作用。通过增强线粒体功能并抑制糖酵解,TFAM的表达上调能够恢复细胞对铂类化疗药物的敏感性。这些发现不仅强调了线粒体调控在化疗耐药中的重要性,还指出TFAM是一个潜在的治疗靶点,为克服耐药性卵巢癌提供了新的研究方向。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:范玲玲:研究设计、实验实施、统计学分析及论文撰写热孜婉古丽·吾布力:数据汇总卢玲岚:数据收集及分析韩莉莉:研究指导、论文审校 -
-
[1] Konstantinopoulos PA, Matulonis UA. Clinical and translational advances in ovarian cancer therapy[J]. Nat Cancer, 2023, 4(9): 1239-1257. doi: 10.1038/s43018-023-00617-9
[2] Cho KR, Shih IeM. Ovarian cancer[J]. Annu Rev Pathol, 2009, 4: 287-313. doi: 10.1146/annurev.pathol.4.110807.092246
[3] Liu C, Li J, Xu F, et al. PARP1-DOT1L transcription axis drives acquired resistance to PARP inhibitor in ovarian cancer[J]. Mol Cancer, 2024, 23(1): 111. doi: 10.1186/s12943-024-02025-8
[4] Wang L, Wang X, Zhu X, et al. Drug resistance in ovarian cancer: from mechanism to clinical trial[J]. Mol Cancer, 2024, 23(1): 66. doi: 10.1186/s12943-024-01967-3
[5] Halma MTJ, Tuszynski JA, Marik PE. Cancer Metabolism as a Therapeutic Target and Review of Interventions[J]. Nutrients, 2023, 15(19): 4245. doi: 10.3390/nu15194245
[6] Ge T, Gu X, Jia R, et al. Crosstalk between metabolic reprogramming and epigenetics in cancer: updates on mechanisms and therapeutic opportunities[J]. Cancer Commun (Lond), 2022, 42(11): 1049-1082. doi: 10.1002/cac2.12374
[7] Porporato PE, Filigheddu N, Pedro JMB, et al. Mitochondrial metabolism and cancer[J]. Cell Res, 2018, 28(3): 265-280. doi: 10.1038/cr.2017.155
[8] Yang Y, Karakhanova S, Hartwig W, et al. Mitochondria and Mitochondrial ROS in Cancer: Novel Targets for Anticancer Therapy[J]. J Cell Physiol, 2016, 231(12): 2570-2581. doi: 10.1002/jcp.25349
[9] Lei T, Rui Y, Xiaoshuang Z, et al. Mitochondria transcription and cancer[J]. Cell Death Discov, 2024, 10(1): 168. doi: 10.1038/s41420-024-01926-3
[10] Jia Z, Wang F, Li G, et al. Zinc finger protein 468 up-regulation of TFAM contributes to the malignant growth and cisplatin resistance of breast cancer cells[J]. Cell Div, 2024, 19(1): 8. doi: 10.1186/s13008-024-00113-1
[11] Xie D, Wu X, Lan L, et al. Downregulation of TFAM inhibits the tumorigenesis of non-small cell lung cancer by activating ROS-mediated JNK/p38MAPK signaling and reducing cellular bioenergetics[J]. Oncotarget, 2016, 7(10): 11609-11624. doi: 10.18632/oncotarget.7018
[12] Lu T, Zhang Z, Bi Z, et al. TFAM deficiency in dendritic cells leads to mitochondrial dysfunction and enhanced antitumor immunity through cGAS-STING pathway[J]. J Immunother Cancer, 2023, 11(3): e005430. doi: 10.1136/jitc-2022-005430
[13] Huang Q, Wu D, Zhao J, et al. TFAM loss induces nuclear actin assembly upon mDia2 malonylation to promote liver cancer metastasis[J]. EMBO J, 2022, 41(11): e110324. doi: 10.15252/embj.2021110324
[14] Wang W, Jiang CF, Yin HS, et al. Targeting mitochondrial transcription factor A sensitizes pancreatic cancer cell to gemcitabine[J]. Hepatobiliary Pancreat Dis Int, 2023, 22(5): 519-527. doi: 10.1016/j.hbpd.2023.03.006
[15] Caruso G, Laera R, Ferrarotto R, et al. Mitochondrial Dysfunction: Effects and Therapeutic Implications in Cerebral Gliomas[J]. Medicina (Kaunas), 2024, 60(11): 1888. doi: 10.3390/medicina60111888
[16] Roszkowska M. Multilevel Mechanisms of Cancer Drug Resistance[J]. Int J Mol Sci, 2024, 25(22): 12402. doi: 10.3390/ijms252212402
[17] Qin R, Fan X, Huang Y, et al. Role of glucose metabolic reprogramming in colorectal cancer progression and drug resistance[J]. Transl Oncol, 2024, 50: 102156. doi: 10.1016/j.tranon.2024.102156
[18] Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324(5930): 1029-1033. doi: 10.1126/science.1160809
[19] Martinez-Outschoorn UE, Lin Z, Ko YH, et al. Understanding the metabolic basis of drug resistance: therapeutic induction of the Warburg effect kills cancer cells[J]. Cell Cycle, 2011, 10(15): 2521-2528. doi: 10.4161/cc.10.15.16584
[20] Cui X, Xu J, Jia X. Targeting mitochondria: a novel approach for treating platinum-resistant ovarian cancer[J]. J Transl Med, 2024, 22(1): 968. doi: 10.1186/s12967-024-05770-y
[21] Shen L, Xia M, Zhang Y, et al. Mitochondrial integration and ovarian cancer chemotherapy resistance[J]. Exp Cell Res, 2021, 401(2): 112549. doi: 10.1016/j.yexcr.2021.112549
[22] Emmings E, Mullany S, Chang Z, et al. Targeting Mitochondria for Treatment of Chemoresistant Ovarian Cancer[J]. Int J Mol Sci, 2019, 20(1): 229. doi: 10.3390/ijms20010229
[23] Bruno G, Pietrafesa M, Crispo F, et al. TRAP1 modulates mitochondrial biogenesis via PGC-1alpha/TFAM signalling pathway in colorectal cancer cells[J]. J Mol Med (Berl), 2024, 102(10): 1285-1296. doi: 10.1007/s00109-024-02479-9
[24] Hsieh YT, Tu HF, Yang MH, et al. Mitochondrial genome and its regulator TFAM modulates head and neck tumourigenesis through intracellular metabolic reprogramming and activation of oncogenic effectors[J]. Cell Death Dis, 2021, 12(11): 961. doi: 10.1038/s41419-021-04255-w
[25] Koc ZC, Sollars VE, Bou Zgheib N, et al. Evaluation of mitochondrial biogenesis and ROS generation in high-grade serous ovarian cancer[J]. Front Oncol, 2023, 13: 1129352. doi: 10.3389/fonc.2023.1129352
[26] Baczewska M, Supruniuk E, Bojczuk K, et al. Energy Substrate Transporters in High-Grade Ovarian Cancer: Gene Expression and Clinical Implications[J]. Int J Mol Sci, 2022, 23(16): 8968. doi: 10.3390/ijms23168968
[27] Gabrielson M, Björklund M, Carlson J, et al. Expression of mitochondrial regulators PGC1alpha and TFAM as putative markers of subtype and chemoresistance in epithelial ovarian carcinoma[J]. PLoS One, 2014, 9(9): e107109. doi: 10.1371/journal.pone.0107109
-
期刊类型引用(6)
1. 殷生楠,高一,戴怀洋,王刚,殷勇. 黄芪皂苷Ⅱ成分对三阴性乳腺癌细胞增殖及侵袭转移的抑制作用研究. 泰州职业技术学院学报. 2025(01): 63-66+96 .  百度学术
百度学术
2. 邱文秀,王苗锋. 乳腺癌特异基因1在三阴性乳腺癌中的表达与免疫治疗疗效及预后分析. 中国优生与遗传杂志. 2024(01): 86-91 .  百度学术
百度学术
3. 谭艳芳,张艳冰,万红霞,肖薇,赵友兰. 黄芪总皂苷调控LKB1/AMPK信号通路对人乳腺癌细胞增殖、凋亡、周期的影响及机制. 中国老年学杂志. 2023(02): 388-391 .  百度学术
百度学术
4. 王月鹏. 肿瘤特异性CD8~+ T细胞在三阴性乳腺癌免疫治疗中的价值研究. 中国实用医药. 2022(01): 99-101 .  百度学术
百度学术
5. 胡士杰. 三阴性乳腺癌治疗研究进展. 中国城乡企业卫生. 2022(11): 39-41 .  百度学术
百度学术
6. 张阿润,刘传波,赵鹏飞,王玥慧,孙晓静. 肠道菌群与肺癌关系的研究进展. 癌症进展. 2021(19): 1950-1953+2027 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: