Effects of UBE2T on Proliferation, Apoptosis, and Epithelial-Mesenchymal Transition of Breast Cancer Cells
-
摘要:目的
探究泛素结合酶E2T(UBE2T)在乳腺癌中的表达和对预后的影响及其可能的作用机制。
方法采用肿瘤基因组图谱(TCGA)数据库分析UBE2T在乳腺癌组织中的表达情况,Kaplan-Meier生存曲线分析UBE2T高低表达对无病生存期(DFS)和总生存期(OS)的影响。实时定量PCR和Western blot验证UBE2T敲降和过表达效率,分析其对肿瘤细胞生物学行为的影响,Western blot研究UBE2T对细胞上皮-间质转化(EMT)的作用。构建异种移植瘤模型,验证敲降UBE2T对乳腺癌细胞在体内生长的影响。
结果UBE2T在乳腺癌组织和癌旁组织的表达量差异具有统计学意义(P<0.001),在远处转移或分期较晚的乳腺癌患者中表达量较高(均P<0.05),且UBE2T高表达组的DFS和OS降低(均P<0.05)。UBE2T在MCF-7、MDA-MB-231细胞中高表达,在MDA-MB-361细胞中低表达(均P<0.01)。敲降UBE2T后肿瘤细胞增殖能力显著下降,而上调UBE2T表达后细胞增殖能力增强(均P<0.05);沉默组MCF-7、MDA-MB-231细胞凋亡率均较shNC组显著升高,过表达组MAD-MB-361细胞凋亡率下降(均P<0.001);敲降组细胞迁移率较shNC组降低,而过表达组细胞迁移率显著增加(均P<0.01)。此外,敲降组细胞迁移数和侵袭数均低于shNC组,过表达组细胞迁移数和侵袭数均高于对照组(均P<0.01)。下调UBE2T可以降低N-cadherin、Snail和Vimentin的表达(均P<0.05),升高E-cadherin的表达,而上调UBE2T表达则相反(均P<0.01);但TIMER数据库分析结果提示,UBE2T表达与E-cadherin(P<0.001)、N-cadherin(P=0.013)、Snail(P<0.001)正相关,与Vimentin负相关(P<0.001)。体内实验表明下调UBE2T可以减缓移植瘤的生长速度。
结论UBE2T在乳腺癌组织中高表达并影响患者预后,UBE2T可以促进乳腺癌细胞的增殖,并抑制凋亡,同时通过改变EMT相关蛋白的表达,增强肿瘤细胞迁移和侵袭的能力。
Abstract:ObjectiveTo investigate the expression of ubiquitin binding enzyme E2T (UBE2T) in breast cancer (BRCA) and its role and mechanism in the prognosis of BRCA patients.
MethodsThe Tumor Genome Atlas (TCGA) database was used to analyze UBE2T expression in BRCA tissues, and the effects of UBE2T expression on disease-free survival (DFS) and overall survival (OS) were analyzed by Kaplan-Meier (KM) survival curve. In vitro, real-time quantitative PCR and Western blot were used to confirm the knock-down and overexpression efficiency, to analyze its effect on tumor cell biological behavior. The effect of UBE2T on cell epithelial–mesenchymal transition (EMT) was studied by Western blot. A xenograft tumor model was established to verify the effect of UBE2T knockdown on the growth of BRCA cells in vivo.
ResultsThe UBE2T expression levels in BRCA and adjacent tissues were statistically different (P<0.001), and the expression was increased in tissues with distant metastasis or late stage (all P<0.05). The DFS and OS were decreased in the UBE2T high-level group (both P<0.05). UBE2T was highly expressed in MCF-7 and MDA-MB-231 cells and lowly expressed in MDA-MB-361 cells (all P<0.01). After UBE2T was silenced by shRNA, the proliferation ability of tumor cells significantly decreased, whereas it increased after UBE2T up-expression (all P<0.05). The apoptotic rates of MCF-7 and MDA-MB-231 cells in the silent groups were significantly higher than those in the shNC groups, while the apoptotic rates of MAD-MB-361 cells in the overexpression group decreased (all P<0.001). The mobility in the knockdown groups were lower than in the shNC groups, while the mobility in the overexpression group significantly increased (both P<0.01). The migration and invasion cells in the shUBE2T groups were lower than those in the shNC groups, and the migration and invasion cells in the UBE2T group were higher than those in the vector group (all P<0.01). Downregulation of UBE2T decreased the expression levels of N-cadherin, Snail, and Vimentin (all P<0.05) and increased that of E-cadherin; however, the result of UBE2T upregulation was opposite (all P<0.01). TIMER results showed that UBE2T was positively correlated with E-cadherin (P<0.001), N-cadherin (P=0.013), and Snail (P<0.001) and negatively correlated with Vimentin (P<0.001). In vivo experiments showed that downregulation of UBE2T slowed down the growth of transplanted tumors.
ConclusionUBE2T is highly expressed in BRCA tissues and may affect the prognosis. UBE2T can promote the proliferation of BRCA cells, inhibit apoptosis, and increase the migration and invasion abilities by changing the expression levels of EMT-related proteins.
-
Key words:
- Breast cancer /
- UBE2T /
- Prognosis /
- Proliferation /
- Migration /
- Invasion /
- EMT
-
0 引言
根据癌症数据统计报告,乳腺癌是全球女性发病率最高的恶性肿瘤,占全球癌症新发病例的11.6%[1]。随着诊疗水平的提高以及生活方式和女性生育规律的改变,乳腺癌发病率呈现逐年递增趋势。有研究表明Ⅰ~Ⅳ期乳腺癌患者的5年生存率分别为98%、92%、76%、31%,尽管早期乳腺癌预后较好,但对于存在腋窝淋巴结转移和远处转移的乳腺癌患者,其5年生存率明显下降[2]。泛素结合酶E2T(Ubiquitin-conjugating enzyme E2T, UBE2T)是E2家族中的一员,最早发现于对范可尼贫血的研究中[3]。UBE2T常参与DNA修复,调节血管生成和细胞周期等多种重要生理活动[4]。研究显示,UBE2T在鼻咽癌、结直肠癌、肝癌、胃癌等多种肿瘤组织中的表达水平明显高于癌旁组织,且高表达水平与不良预后密切相关,提示UBE2T可能具有促进恶性肿瘤增殖、侵袭和转移的能力[5-6],但关于UBE2T在乳腺癌组织中的表达及作用尚不明确。本研究结合肿瘤基因组图谱(TCGA)等公共数据库,通过细胞学实验和动物实验研究UBE2T对乳腺癌细胞增殖、迁移、侵袭和凋亡能力的影响及其可能的作用机制,为寻找乳腺癌临床诊疗靶点提供理论依据。
1 材料与方法
1.1 主要材料与仪器
人正常乳腺上皮细胞MCF-10A、人 Luminal A型乳腺癌细胞MCF-7、人HER-2阳性型乳腺癌细胞MDA-MB-361以及人三阴性乳腺癌细胞MDA-MB-231均购自(武汉)普诺赛生命科技有限公司;细胞DMEM培养基、胎牛血清、胰蛋白消化酶、TRIzol及反转录试剂均购自(北京)赛默飞世尔生物化学制品有限公司;UBE2T抗体、GAPDH抗体、Vimentin抗体和Snail抗体均购自美国Affinity Bioscience公司;E-cadherin抗体、N-cadherin抗体购自英国Abcam公司;引物购自北京梓熙生物科技有限公司;转染试剂和shRNA购自北京擎科生物科技有限公司,细胞计数(Cell counting kit-8,CCK-8)试剂盒和Transwell试剂盒购自美国CoStar公司。
550全自动型酶标仪和SDS-PAGE电泳系统购自美国BIO-RAD公司;BG-subMIDI电泳仪购自北京百晶生物技术有限公司;GelDoc-It310凝胶成像系统购自德国Analytik Jena公司;ChemiDoc MP化学发光成像系统购自上海勤翔科学仪器有限公司。
1.2 实验方法
1.2.1 数据库检索
选择TCGA数据库进行检索和分析(https://portal.gdc.cancer.gov/)。癌症部位选择“breast”,并对疾病类型限制为“ductal and lobular neoplasms”。本次检索共收集1 231例,其中乳腺癌患者1 118例,乳腺正常组织113例。
1.2.2 细胞培养和实时定量PCR(RT-qPCR)检测
使用加入10%胎牛血清、100 IU/ml青霉素和100 μg/ml链霉素的DMEM培养基培养细胞。所有细胞均置于37 ℃和5%CO2恒温培养箱。采用TRIzol法提取样本的总RNA,核酸浓度测定仪测定RNA浓度和纯度,使用反转录试剂盒superscript Ⅲ合成cDNA,按照TOYOBO SYBR Green Realtime PCR Master Mix使用说明书进行RT-qPCR测定,并采用2−△△Ct计算TRA2B相对表达量。UBE2T引物序列为:正向5′-CATCCCAGGCAGCTCTTAGT-3′,反向5′-GTGTTGGCTCCACCTAATATTTCT-3′;本次测定以GAPDH为内参,内参引物序列为:正向5′-AACTTTGGCATTGTGGAAGGGCTC-3′,反向5′-TGGAAGAGTGGGAGTTGCTGTTGA-3′。
1.2.3 细胞转染
按照shRNA慢病毒颗粒转染试剂说明书,在MCF-7、MDA-MB-231细胞培养基中分别加入5×104 IFU的shNC、shUBE2T#1、shUBE2T#2、shUBE2T#3、shUBE2T#4。置于37℃培养箱中孵育8 h,更换为正常DMEM培养基继续培养48 h。MDA-MB-361细胞使用pcDNA3.1-UBE2T或pcDNA3.1(Vector)转染。通过RT-qPCR和Western blot检测转染效果。shRNA序列见表1。
表 1 shRNA 序列Table 1 shRNA sequenceshRNA Forward (5′→3′) Reverse (5′→3′) shNC CCGGGGTTCTCCGAACGTGTCACGTCTCGAG
ACGTGACACGTTCGGAGAACCTTTTTGCAAAAAGGTTCTCCGAACGTGTCACGTCTC
GAGACGTGACACGTTCGGAGAACCCCGGshUBE2T#1 CCGGGCCAACACACCTTATGAGAAACTCGA
GTTTCTCATAAGGTGTGTTGGCTTTTTTAAAAAAGCCAACACACCTTATGAGAAACT
CGAGTTTCTCATAAGGTGTGTTGGCCCGGshUBE2T#2 CCGGGAACCTCCTCAGATCCGATTTCTCGAG
AAATCGGATCTGAGGAGGTTCTTTTTTAAAAAAGAACCTCCTCAGATCCGATTTCTC
GAGAAATCGGATCTGAGGAGGTTCCCGGshUBE2T#3 CCGGTGAGGAAGAGATGCTTGATAACTCGA
GTTATCAAGCATCTCTTCCTCATTTTTTAAAAAATGAGGAAGAGATGCTTGATAACT
CGAGTTATCAAGCATCTCTTCCTCACCGGshUBE2T#4 CCGGGTCCTGGTTCATCTTAGTTAACTCGAG
TTAACTAAGATGAACCAGGACTTTTTTAAAAAAGTCCTGGTTCATCTTAGTTAACTC
GAGTTAACTAAGATGAACCAGGACCCGG1.2.4 CCK-8法
采用CCK-8法测定转染后的细胞活性。将处于对数生长期的细胞接种于96孔培养板中,每孔加入100 µl细胞悬液,共设置3个复孔。培养12 h使细胞贴壁后每孔加入10 µl CCK-8试剂,继续培养48 h。最后在酶标仪上测量波长为450 nm处的吸光度(OD)值。
1.2.5 Transwell实验
在迁移实验中,于Transwell下室加入600 µl含10%胎牛血清的完全培养基,上室加入细胞悬液100 μl。置于培养箱培养24 h后取出小室,使用甲醛固定30 min,0.1%结晶紫染色20 min,PBS缓冲液清洗3次并用棉签轻擦小室上侧,于显微镜下拍照并随机选取3个视野进行细胞计数。在侵袭实验中,将Matrigengel和无血清培养基以1:8的比例稀释,吸取60 µl稀释后的基质胶垂直加入Transwell上室中。24孔细胞板置于培养箱3 h后形成Matrigengel聚合薄膜,按相同步骤将细胞种植于小室上层,其余步骤同迁移实验。
1.2.6 划痕实验
将转染后的细胞接种于6孔板上,待细胞密度达90%以上时,用10 µl枪头垂直于孔板和标记线划痕,PBS冲洗细胞2次后于显微镜下拍照。将细胞置于37 ℃、5%CO2培养箱中培养,每隔12 h拍照记录。
1.2.7 流式细胞术
使用不含EDTA的胰酶消化细胞。取100 µl的细胞悬液加入5 ml流式管中,加入5 µl Annexin V/FITC混匀后于室温避光孵育5 min。加入10 µl 20 μg/ml的碘化丙锭溶液(PI),并加400 µl PBS,采用流式细胞术观察细胞凋亡情况。
1.2.8 Western blot
采用RIPA裂解液提取细胞总蛋白,将其加热变性后进行SDS-PAGE凝胶电泳。电泳结束后,将凝胶上分离到的蛋白条带通过转移电泳方式转印至PVDF膜。室温封闭1 h后,分别孵育对应样品一抗,4℃反应过夜。洗膜后,使用二抗工作液孵育1 h。使用ECL试剂盒检测蛋白条带,最后放入化学发光成像系统成像。
1.2.9 体内成瘤实验
选取体重约20 g、6周龄Balb/c裸鼠[斯贝福生物技术有限公司,生产许可证号:SCXK(京)2019-0010],在康泰医学检验服务河北有限公司动物房中适应性饲养1周[实验单位使用许可证编号:SYXK(冀)2021-006]。将裸鼠分为shNC组和shUBE2T组,每组裸鼠6只。使用100 µl细胞悬液接种于裸鼠右前腋下位置,每2天测量瘤径、动物体重,于第25天麻醉裸鼠并去除瘤体,称重并测量肿瘤体积(肿瘤体积= 0.5×长径×短径2)。固定后进行HE染色,免疫组织化学检测瘤体中UBE2T、E-cadherin、Ki-67和p53表达情况。动物实验严格按照实验动物护理和使用指南进行。本研究获伦理学批准(伦理批号:2022093010101)。
1.3 统计学方法
采用Graphpad Prism 8.0、R语言和SPSS 22.0进行数据分析并绘图。正态分布的计量资料用${{\bar x}} \pm {{s}} $表示。差异比较采用独立样本t检验或单因素方差分析(ANOVA)比较差异。当计量资料不符合正态分布时采用Mann-Whitney U检验进行分析。采用Kaplan-Meier生存曲线分析UBE2T表达与乳腺癌患者生存期的相关性,并通过Log-rank进行差异性检验比较预后差异。P<0.05为差异具有统计学意义。
2 结果
2.1 UBE2T在乳腺癌组织中的表达情况
基于TCGA-BRCA数据集,对不同临床特征的乳腺癌组织中UBE2T表达量进行分析。Mann-Whitney结果显示,与正常组织相比,乳腺癌组织中的UBE2T表达显著上调(P<0.001)。当存在远处转移时,UBE2T表达量同样显著升高(P=0.026);相比于Ⅰ期患者,Ⅱ~Ⅳ期患者的UBE2T表达量均升高(均P<0.05);此外,不同分子分型的乳腺癌患者中,UBE2T表达量同样存在显著差异,见图1。
2.2 UBE2T表达量与乳腺癌患者预后相关
以UBE2T在样本中的中位表达量为分界(UBE2T=
41.2756 ),将其分为低表达组和高表达组。结果表明,无论是无病生存期(Disease-free survival,DFS)(P=0.026)还是总生存期(Overall survival,OS)(P=0.029),UBE2T高表达组患者的预后均明显低于低表达组,见图2。2.3 UBE2T在细胞中的表达情况
Western blot结果显示,相比于人正常乳腺上皮细胞MCF-10A、MCF-7和MDA-MB-231细胞系中UBE2T的表达均显著增加(均P<0.01);而MDA-MB-361细胞系中UBE2T的表达减少(P=
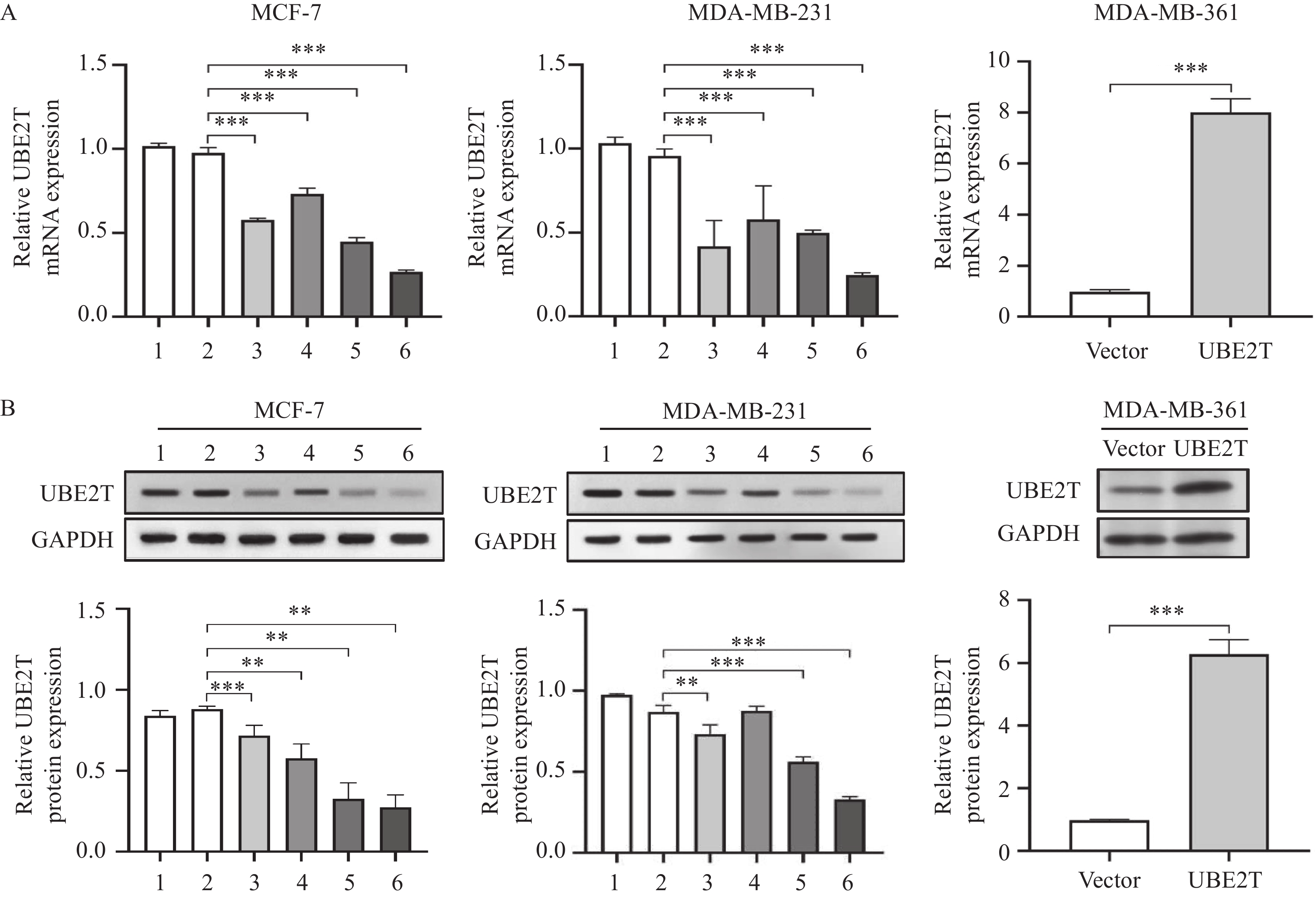
0.0051 ),见图3。选择MCF-7、MDA-MB-231和MDA-MB-361细胞系进行后续实验。2.4 UBE2T敲减和过表达模型构建
使用shNC、shUBE2T#1、shUBE2T#2、shUBE2T#3、shUBE2T#4分别转染MCF-7和MDA-MB-231细胞,使用pcDNA3.1-UBE2T和pcDNA3.1转染MDA-MB-361细胞系。RT-qPCR和Western blot结果显示,MCF-7和MDA-MB-231细胞中UBE2T的mRNA和蛋白质水平显著下调,而MDA-MB-361细胞中UBE2T水平显著上调,见图4。我们选择其中敲降效率最优的shRNA进行后续实验,即MCF-7和MDA-MB-231细胞均选择shUBE2T#4。
2.5 UBE2T对乳腺癌细胞增殖和凋亡能力的影响
CCK-8实验结果表明,相比于shNC组,敲降UBE2T后MCF-7、MDA-MB-231细胞活性均明显下降;而上调UBE2T后细胞活性则增加(均P<0.05),见图5A。流式细胞术结果显示,shUBE2T组MCF-7、MDA-MB-231细胞凋亡率分别为(14.79±0.57)%、(11.18±0.48)%,均较shNC组显著升高;UBE2T组细胞凋亡率为(4.05±0.33)%,较Vector组下降(均P<0.001),见图5B。
2.6 UBE2T对乳腺癌细胞迁移和侵袭的影响
划痕实验结果显示,shUBE2T组MCF-7细胞迁移率为(37.40±1.22)%,较shNC组显著降低(P<0.01);UBE2T组MDA-MB-361细胞迁移率为51.36±0.75)%,较Vector组显著增加(P<0.001)。而shUBE2T组MDA-MB-231细胞迁移率为(44.61±0.94)%,相比于shNC组细胞迁移率(48.60±3.16)%,差异无统计学意义(P=0.104),见图6A。Transwell结果表明,shUBE2T组MCF-7、MDA-MB-231细胞迁移数分别为(322.00±14.18)、(288.70±9.71)个,细胞侵袭数分别为(254.70±14.50)、(237.00±11.53)个,均低于shNC组(均P<0.01);UBE2T组MDA-MB-361细胞迁移数为(382.00±12.00)个,细胞侵袭数为(377.00±18.33)个,均高于Vector组(均P<0.01),见图6B。
2.7 UBE2T对乳腺癌细胞上皮-间质转化(EMT)的影响
结果表明,与阴性对照组相比,MCF-7和MDA-MB-231细胞的shUBE2T组E-cadherin蛋白表达量均升高(均P<0.01);而N-cadherin、Snail和Vimentin蛋白表达量有所下降(均P<0.05);而MDA-MB-361的结果则相反(均P<0.01),见图7A~C。此外,采用TIMER在线数据库分析EMT相关基因与UBE2T的相关性。结果显示,UBE2T与E-cadherin(P<0.001)、N-cadherin(P=0.013)、Snail(P<0.001)呈正相关,而与Vimentin呈负相关(P<0.001),见图7D。
![]() 图 7 UBE2T对乳腺癌细胞EMT相关蛋白的影响Figure 7 Effects of UBE2T on EMT-related proteins of breast cancer cells*: P<0.05, **: P<0.01, ***: P<0.001. Western blot verification of the effect of downregulated UBE2T on EMT-related proteins in MCF-7 cells (A), MDA-MB-231 cells (B) and MDA-MB-361 cells (C); D: correlation between UBE2T and EMT-related proteins. CDH1: E-cadherin; CDH2: N-cadherin.
图 7 UBE2T对乳腺癌细胞EMT相关蛋白的影响Figure 7 Effects of UBE2T on EMT-related proteins of breast cancer cells*: P<0.05, **: P<0.01, ***: P<0.001. Western blot verification of the effect of downregulated UBE2T on EMT-related proteins in MCF-7 cells (A), MDA-MB-231 cells (B) and MDA-MB-361 cells (C); D: correlation between UBE2T and EMT-related proteins. CDH1: E-cadherin; CDH2: N-cadherin.2.8 敲降UBE2T对乳腺癌细胞体内肿瘤生长的影响
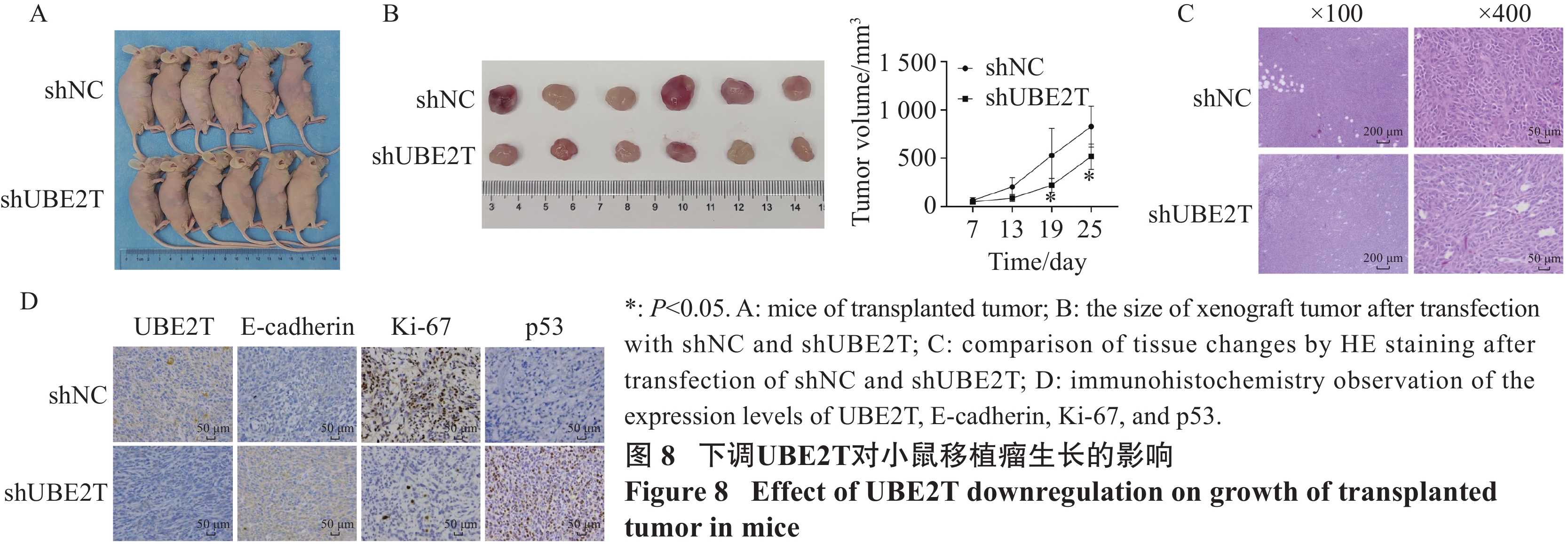
将转染shNC和shUBE2T的MCF-7细胞分别注射于裸鼠皮下建立异种移植瘤。动物实验结果表明,相比于shNC组,shUBE2T组肿瘤的体积更小,生长速度更缓慢,见图8A~B。
对裸鼠肿瘤组织进行HE染色,可以观察到shNC组瘤细胞形状不规则,排列紊乱;细胞核出现明显的核固缩,细胞质染色变深,有大量淋巴细胞浸润和丰富血管形成。shUBE2T组瘤细胞形状不规则,排列相对紊乱;细胞核出现核固缩,细胞质染色相对较浅,有淋巴细胞浸润和少量血管出现,整体病变较shNC组轻,见图8C。
同时,免疫组织化学染色结果显示下调UBE2T降低了移植瘤组织中Ki-67的表达,升高了E-cadherin和p53的表达,见图8D。
3 讨论
目前乳腺癌的病因尚不明确,高危因素包括初潮年龄、遗传因素、生育模式、吸烟史、饮酒史等。早期乳腺癌5年生存率可达95%以上,但存在腋窝淋巴结转移和远处转移的乳腺癌患者5年生存率并不乐观。目前针对乳腺癌患者的治疗方式包括外科手术、放疗、化疗、靶向治疗及免疫治疗等[7]。虽然这些治疗方法都取得了一定的疗效,但对于晚期患者,目前仍缺乏有效的治疗靶点和措施。
人类大约有35个泛素E2家族成员,全部成员共享一个核心泛素结合域(UBC)[8]。泛素结合酶UBE2T由一个核心泛素结合域折叠区域和一个C末端延伸组成[9],参与调节多种重要细胞过程。UBE2T可通过泛素化改变多种蛋白质的位置、功能和活性,参与多种信号通路和生物过程,其中包括DNA损伤修复、细胞周期以及恶性肿瘤相关过程[10]。目前,已有研究证明UBE2T在多种恶性肿瘤中均上调。Hu等发现,UBE2T可以通过激活AKT/GSK3β/β-catenin通路促进鼻咽癌细胞的生长[11];Luo等研究表明,UBE2T激活EMT过程,从而促进胃癌细胞的浸润和转移[12];此外,Liu等研究发现,UBE2T高表达的患者具有较高的病理学分级、TNM分期以及较差的无病生存率和总生存率,且UBE2T可通过泛素化抑癌基因p53,从而加速p53蛋白降解,促进肝癌细胞的进展;而miR-543可靶向UBE2T的启动子区域,负性调节其表达,并通过调节cyclinB1和CDK1的表达诱导肝癌细胞G2/M期阻滞,因此miR-543/UBE2T/p53轴有望成为新治疗靶点[13]。
本研究基于生物信息学分析,探讨了UBE2T在乳腺癌组织中的异常表达。结果显示,UBE2T在乳腺癌组织中的表达显著高于正常组织,且存在远处转移或临床分期较晚的患者,UBE2T同样明显上调。该结果与Wen等的研究结论类似。其发现UBE2T在前列腺癌组织中高表达,特别是在远处转移的组织中上调明显[14];而针对不同分子分型的患者,我们发现相比于Luminal A型,Luminal B型、HER-2阳性型以及三阴性乳腺癌中UBE2T表达量相对较高。此外,生存分析结果表明,UBE2T低表达组的DFS和OS均明显优于高表达组,整体与Cao等在UBE2T泛癌分析中的结果相类似[15]。
细胞异常增殖和凋亡途径紊乱与肿瘤的发生发展密切相关。UBE2T与具有高度分化和更新能力的假复层柱状上皮基底细胞呈阳性免疫反应,同时在增殖活跃的组织中也表现出较高活性,如胸腺和睾丸。以上均提示UBE2T与细胞增殖行为密切相关[16-17]。研究发现,UBE2T通过调节乳腺癌细胞系MCF-7中PI3K/AKT信号通路促进细胞增殖、侵袭和糖酵解[18];E2F5促进UBE2T转录,而UBE2T过表达则可以逆转E2F5缺失对胃癌细胞增殖和侵袭的影响,Li等初步证实了E2F5通过上调UBE2T转录,进而促进胃癌的恶性进展[19]。本研究对MCF-7、MDA-MB-231和MDA-MB-361三种乳腺癌细胞系进行研究,发现沉默UBE2T均可不同程度地降低肿瘤细胞的增殖活性,增加细胞凋亡;而过表达UBE2T则具有相反作用,进一步证实了UBE2T在肿瘤生长中的正向作用。
肿瘤细胞的迁移和侵袭是影响乳腺癌疾病进展以及患者预后的关键因素[20]。我们采用shRNA转染的方式下调三种乳腺癌细胞系中UBE2T的表达水平,划痕实验结果发现下调UBE2T可以降低MCF-7细胞的迁移能力,而Transwell结果表明沉默UBE2T可显著减低MCF-7和MDA-MB-231细胞的迁移和侵袭能力。EMT是肿瘤细胞由上皮细胞向间质细胞转化的过程,可增强细胞的运动性、侵袭以及逃避免疫细胞的能力,在肿瘤细胞的迁移和侵袭中发挥重要作用[21]。通常该过程伴随着上皮细胞表面标志物E-cadherin表达降低和间质细胞表面标志物N-cadherin、Snail和Vimentin的表达升高[22-23]。本研究发现,下调UBE2T表达可增加乳腺癌细胞中E-cadherin蛋白表达量,降低N-cadherin、Snail和Vimentin蛋白表达量,而上调UBE2T则相反。Huang等同样发现下调UBE2T可以不同程度降低卵巢癌细胞中N-cadherin、MMP2以及Slug蛋白的表达,增加E-cadherin的表达,并选择性降解Snail和Slug蛋白,通过自噬负性调节EMT过程,最终抑制AKT/mTOR通路从而降低肿瘤细胞的增殖和侵袭能力,改善患者预后[24]。因此,结合以上研究结果,我们推测UBE2T通过调控EMT相关蛋白表达,促进乳腺癌细胞迁移和侵袭,最终影响患者预后。
本研究中TIMER在线数据库分析结果提示,UBE2T与E-cadherin、N-cadherin、Snail正相关,而与Vimentin负相关,与上述实验结果存在差异。2019年美国约翰斯·霍普金斯大学研究者揭示了E-cadherin的复杂功能。研究发现缺乏E-cadherin表达的乳腺癌细胞虽然迁移能力更强,但会同时激活TGF-β通路,增加细胞内活性氧水平,促进癌细胞中凋亡基因的表达[25]。此外,还有研究发现E-cadherin过表达在炎性乳腺癌中发挥重要作用,其可将细胞连接到真皮淋巴管内转移的瘤栓中,增加肿瘤细胞的侵袭性[26]。结合上述研究,我们认为E-cadherin、Vimentin研究结果的不一致暗示着二者在肿瘤细胞中的复杂功能,因此E-cadherin和Vimentin在乳腺癌中的作用仍需进一步验证。
综上所述,UBE2T可以抑制乳腺癌细胞凋亡,增加细胞活性,并通过影响肿瘤细胞EMT的相关蛋白表达,进而促进肿瘤细胞的迁移和侵袭。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:刘思琪:研究设计及实施、数据收集与处理、论文撰写孙 欣:数据处理、图表绘制、论文审阅及修改刘 娜:数据处理、论文修改林方才:研究设计、论文审阅及修改 -
表 1 shRNA 序列
Table 1 shRNA sequence
shRNA Forward (5′→3′) Reverse (5′→3′) shNC CCGGGGTTCTCCGAACGTGTCACGTCTCGAG
ACGTGACACGTTCGGAGAACCTTTTTGCAAAAAGGTTCTCCGAACGTGTCACGTCTC
GAGACGTGACACGTTCGGAGAACCCCGGshUBE2T#1 CCGGGCCAACACACCTTATGAGAAACTCGA
GTTTCTCATAAGGTGTGTTGGCTTTTTTAAAAAAGCCAACACACCTTATGAGAAACT
CGAGTTTCTCATAAGGTGTGTTGGCCCGGshUBE2T#2 CCGGGAACCTCCTCAGATCCGATTTCTCGAG
AAATCGGATCTGAGGAGGTTCTTTTTTAAAAAAGAACCTCCTCAGATCCGATTTCTC
GAGAAATCGGATCTGAGGAGGTTCCCGGshUBE2T#3 CCGGTGAGGAAGAGATGCTTGATAACTCGA
GTTATCAAGCATCTCTTCCTCATTTTTTAAAAAATGAGGAAGAGATGCTTGATAACT
CGAGTTATCAAGCATCTCTTCCTCACCGGshUBE2T#4 CCGGGTCCTGGTTCATCTTAGTTAACTCGAG
TTAACTAAGATGAACCAGGACTTTTTTAAAAAAGTCCTGGTTCATCTTAGTTAACTC
GAGTTAACTAAGATGAACCAGGACCCGG -
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263. doi: 10.3322/caac.21834
[2] Wang X, Liu S, Xue Y. Clinicopathological features and prognosis of male breast cancer[J]. J Int Med Res, 2021, 49(10): 3000605211049977.
[3] Kelsall IR, Langenick J, Mackay C, et al. The Fanconi anaemia components UBE2T and FANCM are functionally linked to nucleotide excision repair[J]. PLoS One, 2012, 7(5): e36970. doi: 10.1371/journal.pone.0036970
[4] Matthew JC, Graeme JT, Julia C, et al. Small-Molecule Inhibition of UBE2T/FANCL-Mediated Ubiquitylation in the Fanconi Anemia Pathway[J]. ACS Chem Biol, 2019, 14(10): 2148-2154.
[5] Zhu ZR, Cao CH, Zhang DY, et al. UBE2T-mediated Akt ubiquitination and Akt/β-catenin activation promotes hepatocellular carcinoma development by increasing pyrimidine metabolism[J]. Cell Death Dis, 2022, 13(2): 154. doi: 10.1038/s41419-022-04596-0
[6] Wu MQ, Li XL, Huang WW, et al. Ubiquitin-conjugating enzyme E2T(UBE2T) promotes colorectal cancer progression by facilitating ubiquitination and degradation of p53[J]. Clin Res Hepatol Gastroenterol, 2020, 45(2): 101493.
[7] Rossi L, Mazzara C, Pagani O. Diagnosis and Treatment of Breast Cancer in Young Women[J]. Curr Treat Options Oncol, 2019, 20(12): 86. doi: 10.1007/s11864-019-0685-7
[8] Du XD, Song HY, Shen HY, et al. The Molecular Basis of Ubiquitin-Conjugating Enzymes (E2s) as a Potential Target for Cancer Therapy[J]. Int J Mol Sci, 2021, 22(7): 3440. doi: 10.3390/ijms22073440
[9] Arno FA, Viduth C, Helen W. Mechanism and disease association of E2-conjugating enzymes: lessons from UBE2T and UBE2L3[J]. Biochem J, 2016, 473(20): 3401-3419. doi: 10.1042/BCJ20160028
[10] Zhang Y, Zhou X, Huang P. Fanconi anemia and ubiquitination[J]. J Genet Genomics, 2007, 34(7): 573-580. doi: 10.1016/S1673-8527(07)60065-4
[11] Hu W, Xiao LS, Cao CH, et al. UBE2T promotes nasopharyngeal carcinoma cell proliferation, invasion, and metastasis by activating the AKT/GSK3β/β-catenin pathway[J]. Oncotarget, 2016, 7(12): 15161-15172. doi: 10.18632/oncotarget.7805
[12] Luo C, Yao Y, Yu Z, et al. UBE2T knockdown inhibits gastric cancer progression[J]. Oncotarget, 2017, 8(20): 32639-32654. doi: 10.18632/oncotarget.15947
[13] Liu LL, Zhu JM, Yu XN, et al. UBE2T promotes proliferation via G2/M checkpoint in hepatocellular carcinoma[J]. Cancer Manag Res, 2019, 11: 8359-8370. doi: 10.2147/CMAR.S202631
[14] Wen MX, Kwon YW, Wang YS, et al. Elevated expression of UBE2T exhibits oncogenic properties in human prostate cancer[J]. Oncotarget, 2015, 6(28): 25226-25239. doi: 10.18632/oncotarget.4712
[15] Cao K, Ling XD, Jiang XY, et al. Pan-cancer analysis of UBE2T with a focus on prognostic and immunological roles in lung adenocarcinoma[J]. Respir Res, 2022, 23(1): 306. doi: 10.1186/s12931-022-02226-z
[16] Hao J, Xu A, Xie X, et al. Elevated expression of UBE2T in lung cancer tumors and cell lines[J]. Tumour Biol, 2008, 29(3): 195-203. doi: 10.1159/000148187
[17] 杨豪帅, 赖慧娜, 饶怡茹, 等. 基于生物信息学途径评估UBE2家族及UBE2T基因在肺腺癌中的表达及临床意义[J]. 中山大学学报(医学科学版), 2020, 41(3): 445-451. [Yang HS, Lai HN, Rao YR, et al. Expressions and Clinical Implication of UBE2 Family and UBE2T Gene in Lung Adenocarcinoma Based on Bioinformatics[J]. Zhongshan Da Xue Xue Bao (Yi Xue Ke Xue Ban), 2020, 41(3): 445-451.] Yang HS, Lai HN, Rao YR, et al. Expressions and Clinical Implication of UBE2 Family and UBE2T Gene in Lung Adenocarcinoma Based on Bioinformatics[J]. Zhongshan Da Xue Xue Bao (Yi Xue Ke Xue Ban), 2020, 41(3): 445-451.
[18] Qiao L, Dong C, Ma BL. UBE2T promotes proliferation, invasion and glycolysis of breast cancer cells by regualting the PI3K/AKT signaling pathway[J]. J Recept Signal Transduct Res, 2021, 42(2): 151-159.
[19] Li LN, Liu J, Huang W. E2F5 promotes proliferation and invasion of gastric cancer through directly upregulating UBE2T transcription[J]. Dig Liver Dis, 2021, 54(7): 937-945.
[20] Fanfone D, Wu Z, Mammi J, et al. Confined migration promotes cancer metastasis through resistance to anoikis and increased invasiveness[J]. Elife, 2022, 11: e73150. doi: 10.7554/eLife.73150
[21] Mittal V. Epithelial Mesenchymal Transition in Tumor Metastasis[J]. Annu Rev Pathol, 2018, 13: 395-412. doi: 10.1146/annurev-pathol-020117-043854
[22] Pastushenko I, Blanpain C. EMT Transition States during Tumor Progression and Metastasis[J]. Trends Cell Biol, 2019, 29(3): 212-226. doi: 10.1016/j.tcb.2018.12.001
[23] Lim B, Woodward WA, Wang X, et al. Inflammatory breast cancer biology: the tumour microenvironment is key[J]. Nat Rev Cancer, 2018, 18(8): 485-499. doi: 10.1038/s41568-018-0010-y
[24] Huang W, Huang HY, Xiao YZ, et al. UBE2T is upregulated, predicts poor prognosis, and promotes cell proliferation and invasion by promoting epithelial-mesenchymal transition via inhibiting autophagy in an AKT/mTOR dependent manner in ovarian cancer[J]. Cell Cycle, 2022, 21(8): 780-791. doi: 10.1080/15384101.2022.2031426
[25] Padmanaban V, Krol I, Suhail Y, et al. E-cadherin is required for metastasis in multiple models of breast cancer[J]. Nature, 2019, 573(7774): 439-444. doi: 10.1038/s41586-019-1526-3
[26] Dong HM, Liu G, Hou YF, et al. Dominant-negative E-cadherin inhibits the invasiveness of inflammatory breast cancer cells in vitro[J]. J Cancer Res Clin Oncol, 2007, 133(2): 83-92.



 下载:
下载: