Diosgenin Induces Apoptosis of MCF-7 Cells by Regulating DAXX Subcellular Localization and Activating JNK/p38 Signaling Pathway
-
摘要:目的
探讨薯蓣皂苷元对乳腺癌细胞增殖和凋亡的影响及潜在的分子机制。
方法以低、中、高剂量的薯蓣皂苷元作用于乳腺癌MCF-7细胞,MMT法检测细胞增殖力;流式细胞术检测细胞凋亡;核—浆蛋白分离法检测死亡结构域相关蛋白(DAXX)亚细胞定位;qRT-PCR和Western blot检测DAXX和c-Jun N末端激酶通路(JNK)相关蛋白表达水平。
结果薯蓣皂苷元可以显著抑制MCF-7细胞增殖、促进其凋亡,且呈现出一定的剂量依赖性;薯蓣皂苷元能够促进DAXX由细胞核进入细胞质,并且剂量依赖性地上调细胞表面死亡受体(Fas)表达,提高JNK和丝裂原活化蛋白激酶(p38)的磷酸化水平,激活JNK/p38信号通路。
结论薯蓣皂苷元抑制乳腺癌MCF-7细胞增殖并促进其凋亡,其作用机制可能与调节DAXX亚细胞定位、激活JNK/p38信号通路有关。
-
关键词:
- 乳腺癌 /
- 薯蓣皂苷元 /
- DAXX /
- JNK/p38信号通路
Abstract:ObjectiveTo investigate the effect of diosgenin on the proliferation and apoptosis of breast cancer cells and its potential molecular mechanism.
MethodsThe breast cancer cell line MCF-7 was treated with low, medium, and high doses of diosgenin, and cell proliferation was detected through the MMT method. Flow cytometry was used to detect cell apoptosis. Nuclear-cytoplasmic-protein separation method was applied to detect the subcellular localization of death associated protein (DAXX). qRT-PCR and Western blot were used to detect the expressions of DAXX and c-Jun N-terminal kinase pathway (JNK)-related proteins.
ResultsDiosgenin considerably inhibited the proliferation of MCF-7 cells and promoted cell apoptosis in a concentration-dependent manner. Diosgenin can promote the movement of DAXX from nucleus into the cytoplasm. Diosgenin upregulated the expression of cell surface death receptor (Fas), increased the phosphorylation levels of JNK and mitogen activated protein kinase (p38), and activated the JNK/p38 signaling pathway with concentration dependence.
ConclusionDiosgenin inhibits the proliferation and promotes the apoptosis of the breast cancer cell line MCF-7, whose mechanism may be related to the regulation of DAXX subcellular localization and the activation of JNK/p38 signaling pathway.
-
Key words:
- Breast cancer /
- Diosgenin /
- DAXX /
- JNK/p38 signaling pathway
-
0 引言
乳腺癌(Breast cancer, BC)是全球女性最常见的恶性肿瘤,是女性癌症相关性死亡的主要原因[1]。虽然目前乳腺癌的治疗以手术切除、放化疗和靶向治疗为主,但乳腺癌的异质性决定了不同人群对治疗的反应不同。此外,联合治疗的不良反应与治疗后期的获得性耐药,也极大程度影响了乳腺癌的治疗效果[2]。中医药治疗乳腺癌具有不良反应小、患者依从性高等特点,其作用机制涉及多靶点、多信号通路,不仅可以调节机体免疫,还能够抑制肿瘤转移、逆转化疗药物耐药等[3-4]。薯蓣皂苷元(Diosgenin)是来源于薯蓣科、百合科和豆科等植物的类固醇基化合物,广泛存在于山药、穿山龙、黄精及重楼等传统中草药中,是具有抗肿瘤作用的天然产物[5]。研究表明,薯蓣皂苷元可以通过诱导细胞凋亡、对抗瓦氏效应、抑制细胞增殖和迁移等多种途径来发挥抗乳腺癌的作用[6-8]。控制细胞增殖与凋亡的信号通路失调,是肿瘤发生的重要环节。既往研究显示,薯蓣皂苷元促进肿瘤细胞凋亡的作用涉及多个分子和信号通路,如通过抑制AKT信号通路诱导乳腺癌细胞凋亡;通过增加活性氧(Reactive oxygen species, ROS)水平、诱导氧化损伤来促进非小细胞肺癌细胞凋亡;通过抑制PI3K信号通路诱导卵巢癌细胞凋亡等[9-11]。
死亡结构域相关蛋白(Death domain-associated protein, DAXX)是一种广泛表达于人类多种组织的多功能蛋白,其C末端部分可以特异性结合Fas死亡结构域(Fas-associated protein with a novel death domain, FADD),通过激活凋亡信号调节激酶1(Apoptosis signal regulating kinase 1, ASK1)/c-Jun N末端激酶(c-Jun N-terminal kinase, JNK)信号通路发挥促凋亡的作用[12-13]。作为一种核蛋白,DAXX不仅可以定位于细胞核质、核仁,还可以移位至胞质和早幼粒细胞白血病蛋白核小体等亚细胞区室,参与细胞增殖、周期调控、凋亡及转录调控等重要过程。既往研究认为,DAXX需要移位至细胞质中才能与ASK1结合,继而激活JNK通路诱导细胞凋亡[14]。本课题组前期研究发现薯蓣皂苷元并未显著改变DAXX蛋白表达,而本研究旨在探索薯蓣皂苷元是否通过改变DAXX亚细胞定位,激活JNK通路,继而诱导MCF-7细胞凋亡,为薯蓣皂苷元治疗乳腺癌提供新的理论依据。
1 材料与方法
1.1 细胞系与药物
人乳腺癌细胞系(MCF-7)购自武汉普诺赛有限公司;薯蓣皂苷元药物粉末购于美国Target Mol公司。将0.1 g薯蓣皂苷元溶于10 ml DMSO中,制备成10 mg/ml的溶液储存。在后续实验中分别稀释成不同浓度溶液(15、30、50 μg/ml)备用。
1.2 主要试剂
Annexin V-FITC/PI细胞凋亡试剂盒购自上海碧云天生物技术有限公司;HiScript®ⅡQRT SuperMix for qPCR试剂盒购自南京诺唯赞生物科技股份有限公司;细胞核—浆分离试剂盒及ECL化学发光试剂盒均购自美国Thermo ScientificTM公司;DAXX抗体(AF3318)购自美国赛默飞世尔科技有限公司,ASK1抗体(28201-1-AP)、Fas抗体(13098-1-AP)、丝裂原活化蛋白激酶p38(p38 mitogen-activated protein kinase, p38)抗体(14064-1-AP)、辣根过氧化物酶标记的山羊抗鼠(SA00001-1)及山羊抗兔(SA00001-2)抗体均购自武汉三鹰生物技术有限公司。p-ASK1抗体(AF3477)、p-p38抗体(AF4001)、p-JNK抗体(AF3318)及JNK抗体(AF6319)均购自江苏亲科生物技术有限公司。
1.3 实验方法
1.3.1 细胞培养
将人乳腺癌细胞系(MCF-7)置于含10%胎牛血清、100 μg/ml链霉素和100 μg/ml青霉素的DMEM培养基中。在恒温培养箱中培养(5%CO2、37℃),当细胞融合率达到90%时进行传代,取对数生长期细胞用于后续实验。
1.3.2 MTT法检测细胞增殖能力
将所有细胞分为对照组、低剂量组(15 μg/ml)、中剂量组(30 μg/ml)和高剂量组(50 μg/ml),分别在薯蓣皂苷元作用于细胞24、48、72 h时,将细胞消化悬浮后以5×103/孔接种于96孔板,每组设3个复孔。每孔加入5 mg/ml的MTT溶液50 μl孵育5 h,吸弃上清液,加入150 μl DMSO溶解结晶,酶标仪检测570 nm处各孔的吸光值(OD)。
1.3.3 流式细胞术检测细胞凋亡
分别将不同浓度薯蓣皂苷元(15、30、50 μg/ml)作用48 h的细胞以5×103/孔接种于6孔板中,待细胞融合度达到70%~80%,PBS洗涤细胞,0.25%无EDTA的胰酶消化细胞,终止消化后1 000 r/min离心5 min,弃上清液,重悬细胞并计数。取5×104重悬细胞,离心后弃上清液,加入200 μl Annexin V/PI结合液,室温避光孵育10 min,500 r/min离心5 min,弃上清液后再次加入190 μl Annexin V/PI结合液重悬细胞,加入10 μl碘化丙啶染色液,最后上机检测。
1.3.4 细胞核—浆蛋白分离实验
收集中剂量薯蓣皂苷元(30 μg/ml)作用48 h的细胞,冰PBS洗涤2次。按照试剂盒说明书,将细胞重悬于500 μl冰冷的细胞分级缓冲液中,孵育10 min,离心样品5 min(4℃和1 000 r/min),上清液即为细胞质蛋白。使用细胞破碎缓冲液重悬沉淀,即得到细胞核蛋白,实验重复3次。
1.3.5 qRT-PCR检测DAXX和JNK通路相关基因mRNA水平
收集薯蓣皂苷元作用48 h后的细胞,按照试剂盒说明书提取RNA,核酸蛋白定量仪检测RNA浓度。将RNA反转录成cDNA,根据HiScript®ⅡQRT SuperMix for qPCR试剂盒说明书扩增。qPCR反应体系20 μl:SYBR GREEN 10 μl,上游引物(稀释浓度10 μmol/L)0.4 μl,下游引物(稀释浓度10 μmol/L)0.4 μl,cDNA 2 μl,ddH2O 7.2 μl。反应条件:预变性95℃ 30 s;循环反应95℃ 10 s,60℃ 30 s,循环40次。以GAPDH为内参基因,以2−△△Ct法计算结果,实验重复3次。引物序列见表1。
表 1 引物序列Table 1 Primer sequenceGenes Forward primer (5’-3’) Reverse primer (5’-3’) DAXX GAGGCACGGTTGAAGCGTAAGC GCCGCTCATGCGCCTGTTAACC Fas ATGGCTTAGAAGTGGAAAT CTTGGTGTTGCTGGTGAGT ASK1 TCTACTGTGATACTAACTCGGACTC CAAGAGGTAAGCAGATGGGTC JNK AGAAGCAAGCGTGACAACAAT TTCAAGAATGGCATCATAAGC p38 GAACAAGACAATCTGGGAGGTG TTCGCATGAATGATGGACTGAAA GAPDH GTCATCCCAGAGCTGAACGG TACTTGGCAGGTTTCTCCAGG 1.3.6 Western blot检测DAXX和JNK通路相关蛋白的表达
收集薯蓣皂苷元作用48 h后的细胞,加入裂解液提取总蛋白,BCA法检测蛋白浓度,蛋白样品经SDS-PAGE电泳分离后转移至PVDF膜,室温5%脱脂牛奶封闭2 h,加入一抗后4℃孵育过夜。次日室温下TBST缓冲液清洗,加入二抗,室温孵育2 h后TBST缓冲液再清洗。最后加入ECL显影液后固定PVDF膜,进入暗室压片,Image J软件计算灰度值,用于后续分析。
1.4 统计学方法
应用SPSS 23.0软件进行统计学分析,结果以均值±标准差($ \bar x \pm s $)表示。两组数据间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 薯蓣皂苷元对MCF-7细胞增殖力的抑制作用
MTT检测结果显示,薯蓣皂苷元可以显著抑制MCF-7细胞增殖力(P<0.01),并且从加药后48 h起,抑制作用随着药物浓度增高而增强,呈现剂量依赖性,见图1。
2.2 薯蓣皂苷元促进MCF-7细胞凋亡
流式细胞术检测结果显示,与对照组相比,中剂量组(P<0.05)和高剂量组(P<0.01)细胞凋亡率显著增高,且高剂量组细胞凋亡率显著高于低剂量组(P<0.05)。说明薯蓣皂苷元可以促进MCF-7细胞凋亡,见图2。
2.3 薯蓣皂苷元对MCF-7细胞DAXX表达的影响
qRT-PCR检测结果显示,与对照组相比,薯蓣皂苷元中、高剂量组DAXX的mRNA水平显著增加(P<0.01),低剂量组DAXX的mRNA水平无显著影响(P>0.05)。Western blot结果显示,薯蓣皂苷元对各组DAXX的蛋白表达水平均无显著影响(P>0.05),见图3。
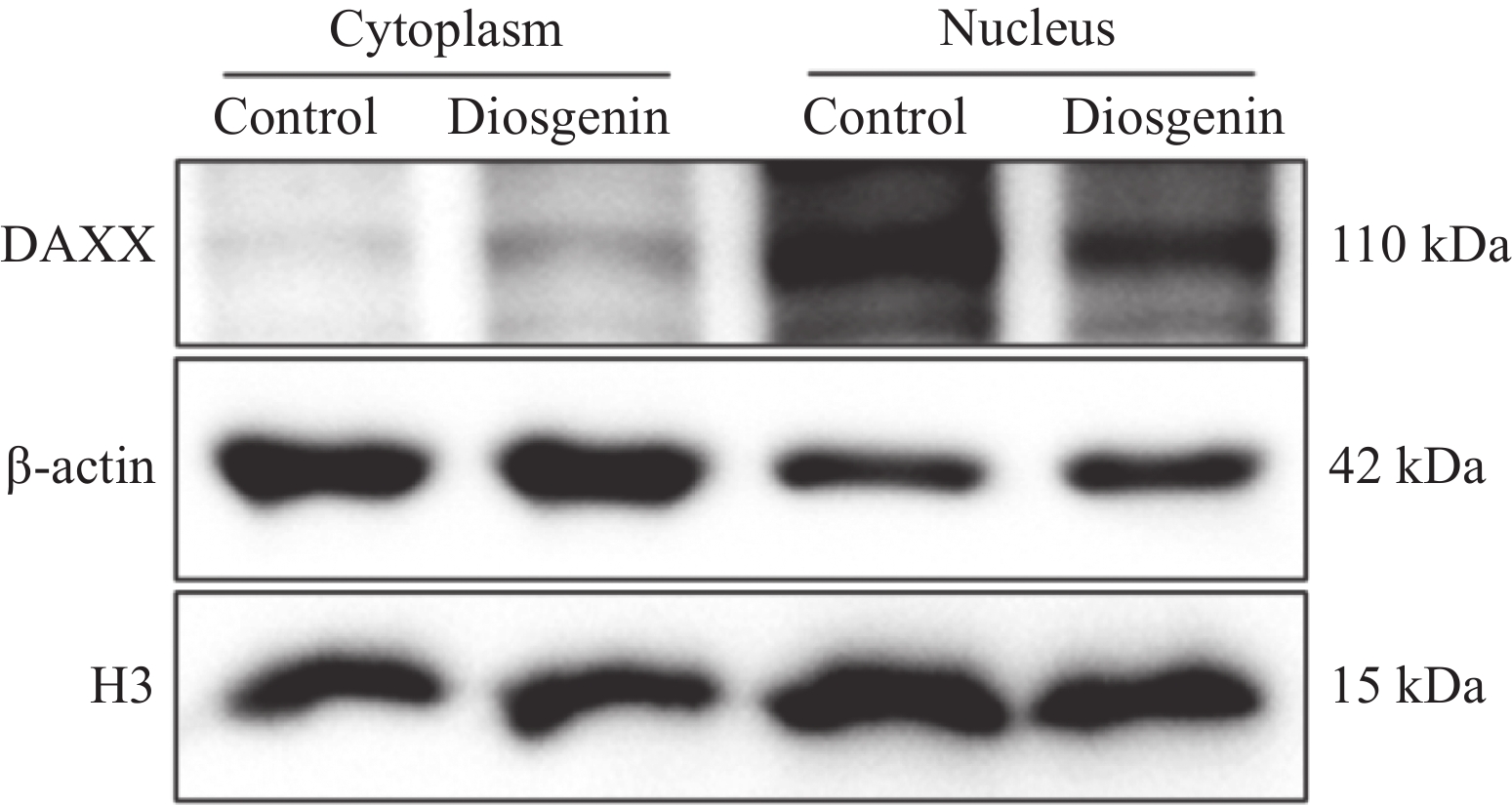
2.4 薯蓣皂苷元对MCF-7细胞中DAXX亚细胞定位的影响
为了明确薯蓣皂苷元是否能够影响DAXX在MCF-7细胞中的亚细胞定位,我们采用核-浆蛋白分离实验观察薯蓣皂苷元作用前后,MCF-7细胞质与细胞核中DAXX表达水平的变化。结果显示,薯蓣皂苷元(30 μg/ml)作用于MCF-7细胞48 h后,细胞质中的DAXX表达水平显著上升,而细胞核中的DAXX表达水平显著下降。说明薯蓣皂苷元可以促进DAXX从MCF-7细胞核进入细胞质,见图4。
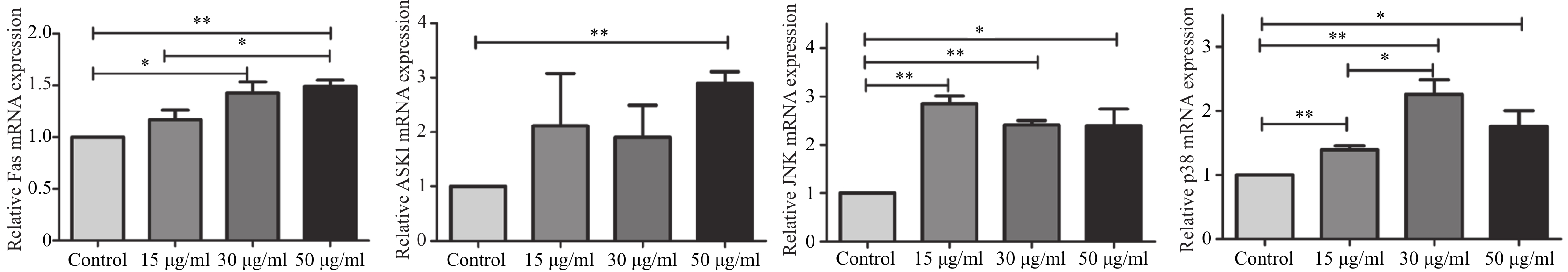
2.5 薯蓣皂苷元对JNK信号通路的影响
qRT-PCR检测结果显示,与对照组相比,薯蓣皂苷元高剂量组Fas和ASK1的mRNA水平显著升高(P<0.01);薯蓣皂苷元低、中剂量组JNK和p38的mRNA水平显著升高(P<0.01);中剂量组的Fas、高剂量组JNK和p38的mRNA水平也明显升高(P<0.05)。其中,薯蓣皂苷元高剂量组Fas的mRNA水平显著高于低剂量组(P<0.05),薯蓣皂苷元中剂量组p38的mRNA水平显著高于低剂量组(P<0.05),见图5。
Western blot结果显示,与对照组相比,薯蓣皂苷元中、高剂量组Fas、p-JNK以及p-p38的蛋白表达水平显著上调(P<0.05);而薯蓣皂苷元低、中剂量组ASK1的蛋白表达水平显著低于对照组(P<0.01),薯蓣皂苷元中、高剂量组p-ASK1的蛋白表达水平显著低于对照组(P<0.05,P<0.01);薯蓣皂苷元各剂量组JNK和p38的蛋白表达水平与对照组相比差异均无统计学意义(P>0.05)。其中,薯蓣皂苷元中剂量组Fas的蛋白表达水平显著高于低剂量组(P<0.05),薯蓣皂苷元高剂量组p-ASK1的蛋白表达水平显著低于低剂量组(P<0.05),薯蓣皂苷元中、高剂量组p-p38的蛋白表达水平均显著高于低剂量组(P<0.05),见图6。
3 讨论
近年来,尽管区别于传统放化疗的靶向药物和抗体药物偶联物等在临床上广泛应用,但是不可避免地伴随有不良反应较多、治疗花费较高、患者长期依从性较差等特点。中医药作为祖国文化瑰宝,在治疗恶性肿瘤中具有独特的优势,经常与西医治疗相结合,起到增效减毒的作用。薯蓣皂苷元已被证实对于胃癌、乳腺癌和肺癌等多种恶性肿瘤具有抑制作用,其具体机制涉及靶向溶质载体家族1成员5(Solute carrier family 1member 5, SLC1A5)抑制雷帕霉素复合物1机制靶点信号通路(Mechanistic target of rapamycin complex 1, mTORC1),减缓肿瘤细胞生长,对抗瓦氏效应,增加细胞内活性氧含量、诱导细胞死亡等[15-17]。调节肿瘤细胞增殖与凋亡相关信号通路是抗癌药物的重要作用机制。
本研究证实,不同剂量的薯蓣皂苷元作用于MCF-7细胞,均可以显著抑制其细胞增殖、促进细胞凋亡。然而薯蓣皂苷元对DAXX的蛋白表达并无显著影响,说明薯蓣皂苷元并非直接通过调节DAXX表达水平来激活下游凋亡相关通路。DAXX是一种主要定位在细胞核的多功能蛋白质,既往研究发现DAXX可以在某些药物作用或者细胞应激条件下移位至细胞质,进而激活JNK信号通路,促进细胞凋亡[18]。本研究通过核-浆蛋白分离实验观察到薯蓣皂苷元可以促进DAXX从MCF-7细胞核进入细胞质。既往研究表明,沙棘提取物与二甲双胍合成的新型植物纳米药物可以通过上调B淋巴细胞瘤2相关X蛋白(B-cell lymphoma-2-associated X protein, Bax)表达、激活细胞表面死亡受体(Fas cell surface death receptor, Fas)信号通路,诱导下游DAXX和FADD表达,进一步激活半胱氨酸蛋白酶3(caspase-3),促进三阴性乳腺癌细胞凋亡[19]。
JNK信号通路是丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)通路的重要分支,可以调控细胞的生长、分化、存活和凋亡等重要生命过程。p38属于MAPK家族成员,需要通过磷酸化激活,进而参与细胞增殖、凋亡和转录调控等。研究表明,白毛杨提取物能够通过促进MCF-7细胞内ROS生成,促进JNK和p38的磷酸化,诱导MCF-7细胞凋亡[20]。圣草次苷也可以通过氧化应激介导的JNK/p38信号通路激活,促进诱导MCF-7细胞凋亡[21]。此外,研究发现,以siRNA沉默基本螺旋-环-螺旋家族成员E41(Basic helix-loop-helix family member e41,BHLHE41)基因可以诱导JNK磷酸化,激活JNK信号通路,进而抑制MCF-7细胞上皮间质转化和细胞侵袭[22]。本研究中,薯蓣皂苷元可以不同程度地上调MCF-7细胞中Fas、ASK1、JNK、p38的mRNA水平,然而只有Fas、p-JNK以及p-p38的蛋白表达水平显著上调,说明薯蓣皂苷元不仅激活了Fas,还促进JNK和p38磷酸化,激活了JNK通路。
综上,本研究证实了薯蓣皂苷元能够抑制乳腺癌细胞MCF-7细胞增殖并促进其凋亡,阐明了薯蓣皂苷元通过调节DAXX亚细胞定位而激活JNK/p38信号通路的分子机制,为薯蓣皂苷元抗乳腺癌提供了新的理论依据。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:王 佳:实验设计、数据分析、论文撰写高世磊:实验实施、数据收集整理张丽菡、张璐、孙旭、李华华:数据收集整理刘怀民:研究方案指导、论文修改 -
表 1 引物序列
Table 1 Primer sequence
Genes Forward primer (5’-3’) Reverse primer (5’-3’) DAXX GAGGCACGGTTGAAGCGTAAGC GCCGCTCATGCGCCTGTTAACC Fas ATGGCTTAGAAGTGGAAAT CTTGGTGTTGCTGGTGAGT ASK1 TCTACTGTGATACTAACTCGGACTC CAAGAGGTAAGCAGATGGGTC JNK AGAAGCAAGCGTGACAACAAT TTCAAGAATGGCATCATAAGC p38 GAACAAGACAATCTGGGAGGTG TTCGCATGAATGATGGACTGAAA GAPDH GTCATCCCAGAGCTGAACGG TACTTGGCAGGTTTCTCCAGG -
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Kerr AJ, Dodwell D, McGale P, et al. Adjuvant and neoadjuvant breast cancer treatments: A systematic review of their effects on mortality[J]. Cancer Treat Rev, 2022, 105: 102375. doi: 10.1016/j.ctrv.2022.102375
[3] 钟悦, 王志宇, 杨博文, 等. 探讨自噬相关基因介导乳腺癌预后及免疫浸润的潜在机制及干预中药预测[J]. 中草药, 2024, 55(13): 4463-4477. [Zhong Y, Wang ZY, Yang BW, et al. Exploration on potential mechanism of autophagy-related genes mediating prognosis and immune infiltration of breast cancer and prediction of intervention in traditional Chinese medicine[J]. Zhong Cao Yao, 2024, 55(13): 4463-4477.] Zhong Y, Wang ZY, Yang BW, et al. Exploration on potential mechanism of autophagy-related genes mediating prognosis and immune infiltration of breast cancer and prediction of intervention in traditional Chinese medicine[J]. Zhong Cao Yao, 2024, 55(13): 4463-4477.
[4] 张小帅, 杨柳青, 王晓艳, 等. 通关藤注射液逆转乳腺癌多柔比星耐药的作用机制[J]. 中草药, 2024, 55(15): 5112-5124. [Zhang XS, Yang LQ, Wang XY, et al. Mechanism of Tongguanteng Injection on reversing doxorubicin resistance in breast cancer[J]. Zhong Cao Yao, 2024, 55(15): 5112-5124.] Zhang XS, Yang LQ, Wang XY, et al. Mechanism of Tongguanteng Injection on reversing doxorubicin resistance in breast cancer[J]. Zhong Cao Yao, 2024, 55(15): 5112-5124.
[5] 张释晴, 宋雨轩, 张文雪, 等. 抗肿瘤天然产物薯蓣皂苷元的研究进展[J]. 中国中药杂志, 2021, 46(17): 4360-4366. [Zhang SQ, Song YX, Zhang WX, et al. Research on anti-tumor natural product diosgenin[J]. Zhongguo Zhong Yao Za Zhi, 2021, 46(17): 4360-4366.] Zhang SQ, Song YX, Zhang WX, et al. Research on anti-tumor natural product diosgenin[J]. Zhongguo Zhong Yao Za Zhi, 2021, 46(17): 4360-4366.
[6] Teymouri F, Karimi E. Development of chitosan-folate modified PLGA nanoparticles for targeted delivery of diosgenin as an anticancer agent[J]. Discov Oncol, 2024, 15(1): 100. doi: 10.1007/s12672-024-00957-7
[7] Khanal P, Patil VS, Bhandare VV, et al. Systems and in vitro pharmacology profiling of diosgenin against breast cancer[J]. Front Pharmacol, 2023, 4(13): 1052849.
[8] Lü P, Wu F, Li F, et al. Diosgenin inhibits the proliferation and migration of MCF-7 breast cancer cells through the demethylation of miR-145 gene[J]. Panminerva Med, 2023. Online ahead of print.
[9] Dharani S, Kalaiarasi G, Ravi M, et al. Diosgenin derivatives developed from Pd(II) catalysed dehydrogenative coupling exert an effect on breast cancer cells by abrogating their growth and facilitating apoptosis via regulating the AKT1 pathway[J]. Dalton Trans, 2022, 51(17): 6766-6777. doi: 10.1039/D2DT00514J
[10] Wang Q, Zhang L, Xiao Y, et al. Diosgenin promotes cisplatin-induced apoptosis through oxidative DNA damage in A549 non-small cell lung cells[J]. Cell Biol Int, 2022, 46(10): 1571-1576. doi: 10.1002/cbin.11862
[11] Fang F, Zhang X, Fang Y. Diosgenin inhibits proliferation and migration of ovarian cancer cells and induce apoptosis via upregulation of PTEN[J]. Chem Biol Drug Des, 2024, 103(3): e14459. doi: 10.1111/cbdd.14459
[12] Ding S, Wang H, Liao Y, et al. HPV16 E7 protein antagonizes TNF-α-induced apoptosis of cervical cancer cells via Daxx/JNK pathway[J]. Microb Pathog, 2023, 185: 106423. doi: 10.1016/j.micpath.2023.106423
[13] Bogolyubova I, Bogolyubov D. DAXX Is a Crucial Factor for Proper Development of Mammalian Oocytes and Early Embryos[J]. Int J Mol Sci, 2021, 28,22(3): 1313.
[14] Junn E, Taniguchi H, Jeong BS, et al. Interaction of DJ-1 with Daxx inhibits apoptosis signal-regulating kinase 1 activity and cell death[J]. Proc Natl Acad Sci U S A, 2005, 102(27): 9691-9696. doi: 10.1073/pnas.0409635102
[15] Cui N, Ding F. Co-Expression Network Analysis and Molecular Docking Demonstrate That Diosgenin Inhibits Gastric Cancer Progression via SLC1A5/mTORC1 Pathway[J]. Drug Des Devel Ther, 2024, 18: 3157-3173. doi: 10.2147/DDDT.S458613
[16] Khanal P, Patil VS, Bhandare VV, et al. Systems and in vitro pharmacology profiling of diosgenin against breast cancer[J]. Front Pharmacol, 2023, 13: 1052849. doi: 10.3389/fphar.2022.1052849
[17] da Silva MF, de Lima LVA, de Oliveira LM, et al. Regulation of cytokinesis and necroptosis pathways by diosgenin inhibits the proliferation of NCI-H460 lung cancer cells[J]. Life Sci, 2023, 330: 122033. doi: 10.1016/j.lfs.2023.122033
[18] 王佳, 马旭辉, 高世磊, 等. 死亡结构域相关蛋白的核-质定位对乳腺癌MCF-7细胞功能的影响[J]. 医学研究杂志, 2024, 53(8): 79-84. [Wang J, Ma XH, Gao SL, et al. Effect of Subcellular Localization of Death Domain - associated Protein on Cellular Function of MCF-7 Cells[J]. Yi Xue Yan Jiu Za Zhi, 2024, 53(8): 79-84.] Wang J, Ma XH, Gao SL, et al. Effect of Subcellular Localization of Death Domain - associated Protein on Cellular Function of MCF-7 Cells[J]. Yi Xue Yan Jiu Za Zhi, 2024, 53(8): 79-84.
[19] Farheen J, Iqbal MZ, Mushtaq A, et al. Hippophae Rhamnoides-derived Phytomedicine Nano-System Modulates Bax/Fas Pathways to Reduce Proliferation in Triple-Negative Breast Cancer[J]. Adv Healthc Mater, 2024, 12: e2401197.
[20] Ryu M, Sung CK, Im YJ, et al. Activation of JNK and p38 in MCF-7 Cells and the In Vitro Anticancer Activity of Alnus hirsuta Extract[J]. Molecules, 2020, 25(5): 1073. doi: 10.3390/molecules25051073
[21] Yuan C, Chen G, Jing C, et al. A dietary flavonoid suppressed cell proliferation, induced apoptosis through modulation of JAK2/STAT3 and JNK/p38 MAPKs signaling pathway in MCF-7 cells[J]. J Biochem Mol Toxicol, 2022, 36(1): e22943. doi: 10.1002/jbt.22943
[22] Zhang D, Zheng Q, Wang C, et al. BHLHE41 suppresses MCF-7 cell invasion via MAPK/JNK pathway[J]. J Cell Mol Med, 2020, 24(7): 4001-4010. doi: 10.1111/jcmm.15033



 下载:
下载: