SerpinA5 Inhibits Malignant Biological Behavior of Esophageal Squamous Cell Carcinoma by Regulating Fn/Integrin-β1 Signaling Pathway
-
摘要:目的
探讨SerpinA5对食管鳞癌(ESCC)细胞恶性生物学行为的影响及其分子机制。
方法通过TIMER2.0数据库分析SerpinA5基因在不同肿瘤和相邻正常组织之间的表达水平。Western blot检测SerpinA5在ESCC细胞系和食管上皮细胞中的表达情况。利用慢病毒构建SerpinA5过表达KYSE150细胞稳转株,Western blot方法检测过表达效率。采用CCK8、平板克隆实验、流式细胞术、创面愈合实验、Transwell侵袭实验检测过表达SerpinA5对食管鳞癌细胞增殖、凋亡、迁移及侵袭能力的影响。构建过表达SerpinA5的裸鼠皮下移植瘤模型。观察肿瘤生长,测量瘤体的体积和质量。IHC法检测裸鼠皮下移植瘤中细胞增殖水平。采用免疫共沉淀(Co-IP)方法明确SerpinA5与Fn之间的相互作用。Western blot方法检测移植瘤中Fn/Integrin-β1信号通路相关蛋白(Fn、Integrin-β1、FAK和p-FAK)的表达水平变化。
结果SerpinA5在ESCC组织及细胞系中均为低表达水平。在ESCC细胞中过表达SerpinA5后,可显著抑制细胞的增殖、迁移及侵袭,促进其凋亡。SerpinA5过表达组的瘤体体积和质量均小于阴性对照组。IHC结果显示SerpinA5过表达可显著抑制瘤体中ESCC细胞增殖。Co-IP证实SerpinA5与Fn存在相互作用。过表达SerpinA5后裸鼠皮下移植瘤内ESCC细胞中Fn/Integrin-β1信号通路相关蛋白Fn、Integrin-β1、p-FAK表达水平显著降低。
结论Serpin A5可能通过调控Fn/Integrin-β1信号通路抑制食管鳞癌细胞的增殖、迁移、侵袭,并促进其凋亡。
-
关键词:
- 食管鳞状细胞癌 /
- SerpinA5 /
- 恶性生物学行为 /
- Fn/Integrin-β1信号通路
Abstract:ObjectiveTo investigate the effect of SerpinA5 on the malignant biological behavior of esophageal squamous cell carcinoma (ESCC) and its molecular mechanism.
MethodsThe expression levels of the SerpinA5 gene in various tumors and adjacent normal tissues were analyzed by using the TIMER2.0 database. The expression levels of SerpinA5 in the ESCC cell line and esophageal epithelial cells were detected through Western blot analysis. Stably transfected KYSE150 cell line with overexpression of SerpinA5 was constructed through lentiviral transfection, and overexpression efficiency was detected via Western blot analysis. The effects of SerpinA5 overexpression on the proliferation, apoptosis, migration, and invasion of ESCC cells were detected by employing the CCK8, plate cloning, flow cytometry, wound healing, and Transwell invasion assays. The nude mice subcutaneous xenograft model with SerpinA5 overexpression was constructed. Tumor growth was observed, and tumor volume and mass were measured. The cell proliferation level of the subcutaneous xenograft tumors in nude mice was detected via immunohistochemistry (IHC). Coimmunoprecipitation (Co-IP) was employed to determine the interaction between SerpinA5 and Fn. Western blot analysis was applied to detect the expression levels of proteins (Fn, Integrin-β1, FAK, and p-FAK) related to the Fn/Integrin-β1 signaling pathway in transplanted tumors.
ResultsSerpinA5 was expressed at low levels in ESCC tissues and cell lines. In ESCC cells, SerpinA5 overexpression can considerably inhibit cell proliferation, migration, and invasion and promote cell apoptosis. In the subcutaneous xenograft experiment on nude mice, the tumor volume and weight of the SerpinA5 overexpression group were lower than those of the negative control group. IHC results demonstrated that SerpinA5 overexpression significantly inhibited the proliferation of ESCC cells in tumor tissues. Co-IP confirmed the interaction between SerpinA5 and Fn. Western blot analysis results showed that the expression levels of Fn, Integrin-β1, and p-FAK in the Fn/Integrin-β1 signaling pathway of ESCC cells in the subcutaneous xenograft tumors of nude mice significantly decreased after SerpinA5 overexpression.
ConclusionSerpin A5 may inhibit proliferation, migration, and invasion and promote apoptosis of ESCC cells by regulating the Fn/Integrin-β1 signaling pathway.
-
0 引言
食管癌(Esophageal cancer, EC)为消化道常见恶性肿瘤之一。据2022年全球癌症数据统计,食管癌死亡率位居全球恶性肿瘤的第七位[1]。我国仍是全世界食管癌疾病负担最重的国家,在我国其发病率和死亡率分别位于第七位和第五位,病理类型主要为食管鳞状细胞癌(Esophageal squamous cell carcinoma, ESCC)[2-3]。由于食管鳞癌恶性程度高、侵袭性强、患者早期症状不典型、缺乏有效的早期诊断方法,约有4/5的患者确诊时已为中晚期,失去了手术机会,5年生存率仅约30%[4-5]。因此,在分子水平上探究食管鳞癌的潜在发病机制至关重要,对提高食管鳞癌患者的生存有积极意义。
本课题组前期通过蛋白质组学技术研究发现,食管鳞癌患者外周血中丝氨酸蛋白酶抑制剂A5(Serine protease inhibitor, clade A member 5, SerpinA5)在随访期间表达均上调,且与疗效及预后呈显著正相关[6]。SerpinA5属于丝氨酸蛋白酶抑制剂(Serpin)超家族A分支第5号成员,参与蛋白C信号通路,调节血栓形成和凝血功能,并可与多种蛋白酶相互作用,包括凝血因子、纤溶酶、组织激肽释放酶等[7]。SerpinA5是一种分泌型蛋白,除了在凝血过程中起调节作用,还在肿瘤细胞中有抑制转移和血管新生等功能[8-9]。近年来有研究认为,SerpinA5在肿瘤细胞迁移、侵袭和转移等方面发挥重要作用,是一种潜在的抑癌基因[10-11]。目前关于SerpinA5对食管鳞癌细胞恶性生物学行为的影响及机制尚不明确。本研究旨在探讨SerpinA5对食管鳞癌细胞恶性生物学行为的影响及其可能的分子机制。
1 材料与方法
1.1 食管鳞癌细胞及动物来源
人正常食管上皮细胞Het-1A购置武汉普诺赛生命科技有限公司。人ESCC细胞系(TE-1和KYSE150)均购自上海吉凯基因科技有限公司。SPF级BALB/c雄性裸鼠16只,周龄为5~6周,体质量为17~19 g,购自北京斯贝福生物技术有限公司(动物质量合格证号:110324230102157417,实验动物生产许可证号码:SCXK(京)2019-0010)。动物饲养在新疆医科大学动物中心(动物伦审号IACUC-20230523-19),室温(22±2)℃,相对湿度60%~80%,昼夜节律,自由进食、饮水。
1.2 试剂
胎牛血清购自以色列BI公司;RPMI 1640培养基和胰酶购自美国Gibco公司;SerpinA5过表达慢病毒购自上海吉凯基因化学技术有限公司;BCA蛋白分析试剂盒及ECL化学发光液购自美国Thermo Fisher公司;裂解液和蛋白酶抑制剂均购自中国博士德公司;Ⅰ抗Integrin-β1、FAK、p-FAK均购自美国Affinity公司;Ⅰ抗Fn购自武汉三鹰公司;Ⅰ抗SerpinA5、GAPDH以及HRP标记山羊抗兔及山羊抗小鼠Ⅱ抗均购自美国Abcam公司;Ⅰ抗β-actin购自中国义翘神州公司。
1.3 方法
1.3.1 细胞培养、分组及转染
将KYSE150、TE-1及Het-1A细胞使用含10%胎牛血清及1%双抗的RPMI 1640培养基,置于37℃、5%CO2培养箱中培养。取对数生长期KYSE150细胞接种至6孔板中,待细胞密度达60%左右时,对细胞中的SerpinA5进行过表达。感染12 h后更换为含10%胎牛血清和双抗的RPMI 1640培养基,将细胞继续培养至融合度为70%~80%时,收集细胞继续后续实验并利用Western blot检测SerpinA5过表达效率。实验分组为阴性对照组(oe-NC)、SerpinA5基因过表达组(oe-SerpinA5)。
1.3.2 Western blot检测相关蛋白表达
收取各实验组细胞沉淀,用含有蛋白酶抑制剂PMSF的RIPA裂解液提取总蛋白。采用BCA试剂盒蛋白定量,进行SDS-PAGE电泳分离,电转至PVDF膜,5%脱脂牛奶封闭2 h,一抗(体积比:SerpinA5,1:
1000 ;Fn,1:400;Integrin-β1,1:800;FAK,1:1000 ;p-FAK,1:800;β-actin,1:1000 ;GAPDH,1:1000 )4℃孵育过夜。TBST洗膜,加入HRP二抗(1:5000 )室温孵育1 h,TBST洗膜,条带滴加超敏化学发光显色剂曝光显影,Image J软件进行定量分析。1.3.3 免疫共沉淀
提取过表达SerpinA5食管鳞癌细胞蛋白质。FLag抗体(购自美国Abcam公司)及IgG分别与Protein A磁珠孵育,再分别与蛋白样本一起孵育过夜,磁珠经清洗液洗涤5次后,加入2×SDS上样缓冲液,沸水浴5 min后上样进行Western blot检测。输入样品为过表达SerpinA5食管鳞癌细胞经裂解离心上清,加入等体积2×SDS上样缓冲液样品。
1.3.4 CCK8检测细胞增殖
将处于对数生长期的各实验组细胞,经胰酶消化,重悬,并计数细胞。以每毫升3×103个细胞密度将细胞铺至96孔板,每孔加入完全培养基100 μl,每组3~6个复孔,边缘孔每孔加适量PBS防止液体蒸发,置于37°C、5%CO2培养箱中培养。取各组细胞分别在0、24、48和72 h时,吸除待测孔培养基,加入110 μl提前配制好的含有10% CCK8的完全培养基,将96孔板放入细胞培养箱内培养2 h,用酶标仪测量450 nm波长处的吸光度。计算公式:细胞存活率=各组OD值/对照组OD值×100%。数据统计及画图采用GraphPad Prism 9.3。
1.3.5 平板克隆形成实验
将各实验组细胞以500个/孔密度加入细胞培养板中并摇匀。在37℃、5%CO2细胞培养箱中培养10天以上。当培养板中出现肉眼可见的克隆时,终止培养。中途每隔3天换液并观察细胞状态。克隆结束后,每孔加入1 ml 4%多聚甲醛,室温固定30 min,吸弃多聚甲醛,PBS清洗3次,每次3~5 min。每孔加入1 ml结晶紫染色液,室温孵育30 min,流水轻柔缓慢冲洗,随后将细胞培养板倒置,待其干燥后拍照并在显微镜下计数。
1.3.6 流式细胞术检测细胞凋亡
将各实验组细胞用不含EDTA的胰酶进行消化,得到的细胞悬液转移至离心管中,低速离心(800 r/min,5 min),得到的细胞沉淀使用预冷处理的PBS溶液充分洗涤2~3遍,弃去上清液。用1 ml 1×结合缓冲液重悬各组细胞,从每组细胞悬液中取100 μl移至1.5 ml EP管中。向EP管中避光加入染色液,室温条件下避光孵育15 min并不时振动。染色结束后,每管加入400 μl 1×结合缓冲液重悬细胞,筛网过滤一次,转移至流式管中,采用流式细胞仪检测细胞凋亡率。
1.3.7 创面愈合实验
将各实验组细胞密度调整为每毫升3×105个细胞。取1 ml细胞悬液接种于6孔细胞培养板中,使细胞完全贴壁且单层细胞融合度达到70%~80%。将6孔板从培养箱中取出,吸除培养基,用PBS洗涤1~2遍。用200 μl枪头垂直于孔底“十”字形划痕,然后加入PBS缓慢清洗掉脱落的细胞。加入无血清培养基,培养箱中继续培养, 0和24 h用荧光显微镜观察并拍照,计算每组细胞迁移率。
1.3.8 Transwell(含Matrigel基质胶)侵袭实验
每个Transwell小室铺入50 μl Matrigel基质胶过夜。次日将处于对数生长期的各实验组细胞胰酶消化后,使用无血清RPMI 1640培养基重悬细胞,使细胞数为每孔5×104个;上层加入无FBS的培养基,下层加入含有20%FBS的培养基,孵育24 h后,去除上层小室细胞,4%多聚甲醛溶液固定30 min,小室取出倒扣滤纸上,浸泡结晶紫染色液30 min,清洗后用棉签轻轻擦去未转移的细胞,风干。显微镜下拍照,分析数据。
1.3.9 过表达SerpinA5对食管鳞癌细胞在裸鼠体内成瘤的影响
取对数生长期oe-NC和oe-SerpinA5组细胞制成密度为每毫升2×106个的细胞悬液。用1 ml的注射器以每只100 μl细胞悬液+100 μl基质胶接种于裸鼠右侧腋部皮下。自细胞注射开始,每5天使用游标卡尺测量小鼠皮下肿瘤的最大长径(a)和横径(b),根据公式(体积=1/2×a×b2)计算体积,分析实验过程中肿瘤体积的变化,并称量动物体质量。持续30天,实验结束后,麻醉后颈椎脱臼法处死裸鼠,完整剥离肿瘤,称重,测量瘤块直径并拍照。
1.3.10 免疫组织化学法(IHC)检测瘤块组织中Ki-67蛋白表达
组织切片,经脱蜡水化、热抗原修复之后,用3%H2O2阻断内源性过氧化物酶。在切片上滴加5%山羊血清溶液封闭10 min。孵育一抗(Ki-67 1:50),4℃过夜,孵育二抗(1:100),DAB显色,苏木精对比染色,脱水、透明、封片。
1.4 统计学方法
采用SPSS 25.0和Graphpad Prism 9.3软件对实验数据进行分析并绘图。计量资料用均数±标准差($\bar x \pm s $)表示,组间比较前进行正态检验和方差同质性检验,两组间比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 食管鳞癌组织及细胞株中SerpinA5表达量显著低于正常食管上皮细胞
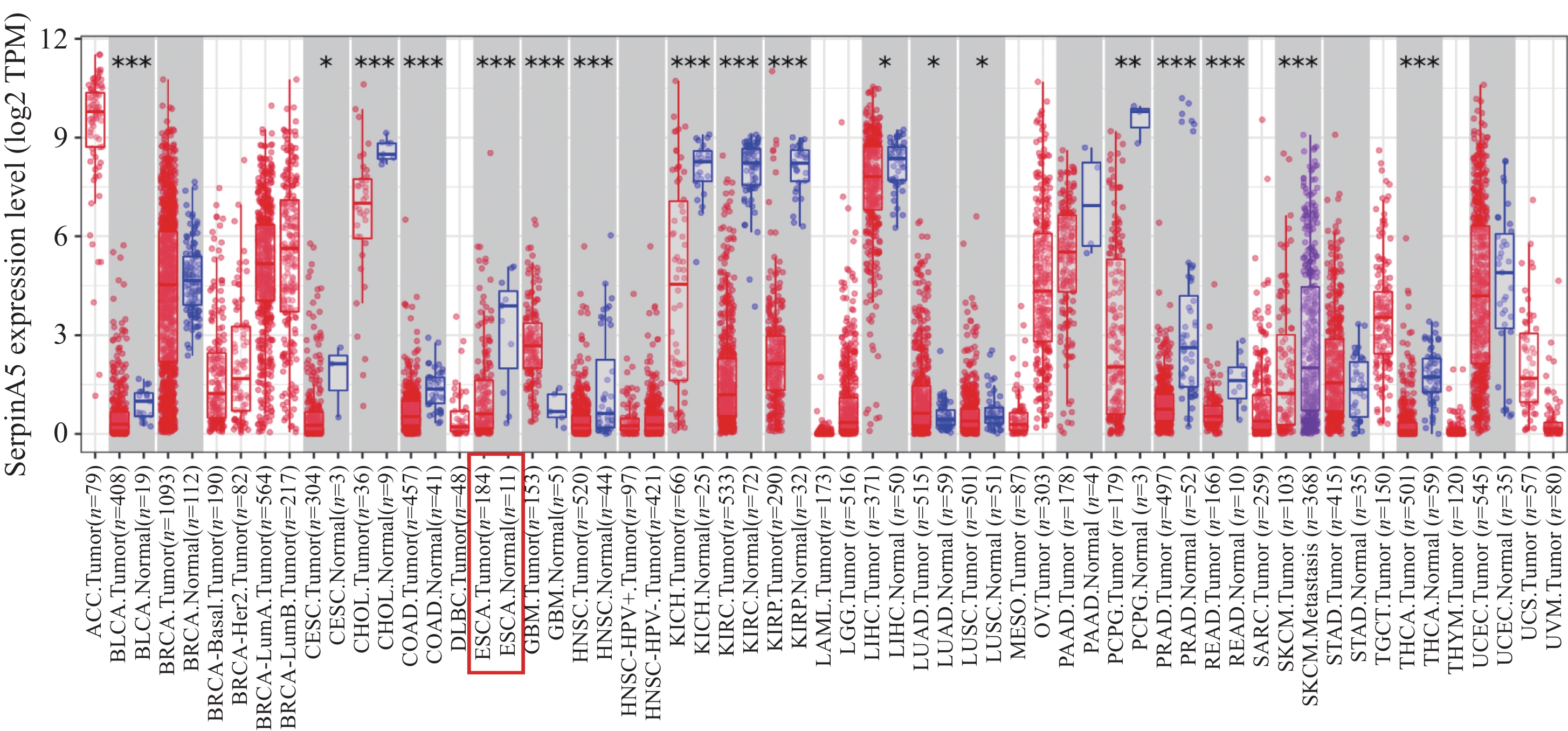
TIMER2.0数据库(http://timer.cistrome.org/)中SerpinA5 mRNA表达的数据分析显示,在食管癌组织中SerpinA5 mRNA的表达水平较相邻正常组织低(P<0.001),见图1。
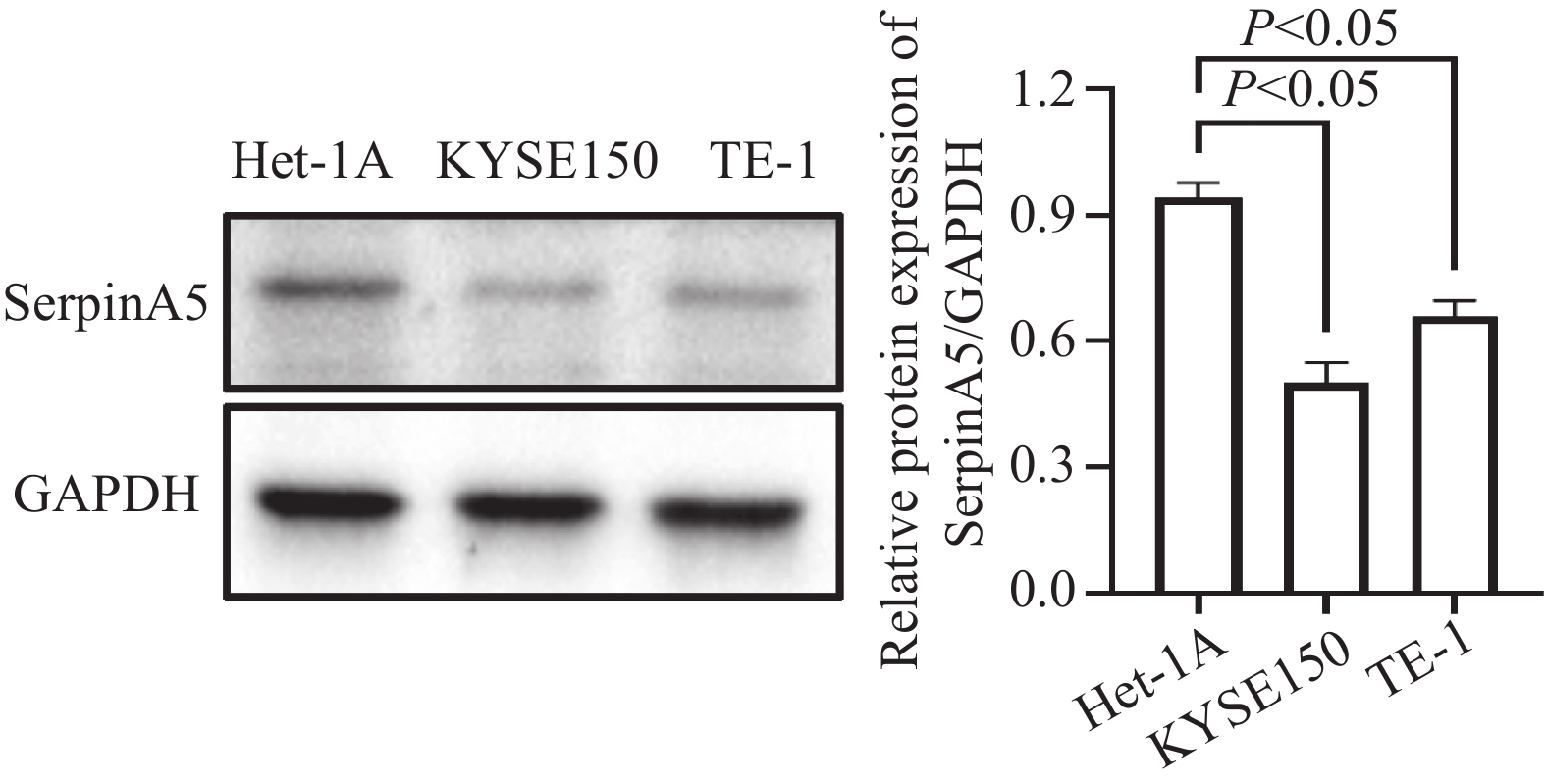
采用Western blot法检测正常食管上皮细胞Het-1A和食管鳞癌细胞系KYSE150、TE-1中SerpinA5蛋白的表达水平,GAPDH作为内参。结果显示,与正常食管上皮细胞Het-1A相比,SerpinA5蛋白在KYSE150和TE-1细胞系中均低表达,见图2。后续实验我们选用表达水平相对最低的KYSE150细胞。
2.2 SerpinA5过表达效率检测
将过表达SerpinA5的慢病毒及对应阴性对照均以MOI=30加入KYSE150细胞中。转染72 h后,采用Western blot对过表达效率进行验证。结果显示,与oe-NC组相比,oe-SerpinA5组中SerpinA5蛋白表达量显著升高(P<
0.0001 ),表明过表达慢病毒转染成功,见图3。2.3 过表达SerpinA5对食管鳞癌细胞增殖、凋亡、迁移、侵袭能力的影响
CCK8检测结果显示,与oe-NC组相比,过表达SerpinA5后细胞的活性显著降低(P<0.05),见图4A。为进一步佐证上述结果,我们利用平板克隆实验检测食管鳞癌细胞中过表达SerpinA5对细胞增殖能力的影响。结果显示,与oe-NC组相比,过表达SerpinA5后细胞克隆数明显减少,见图4B。以上实验表明过表达SerpinA5可显著抑制食管鳞癌细胞的增殖能力。
流式细胞术检测结果显示,与oe-NC组相比,过表达SerpinA5后细胞的凋亡率显著增加(P<0.001),见图4C。表明过表达SerpinA5可显著增强食管鳞癌细胞的凋亡能力。
创面愈合实验检测结果显示,与oe-NC组相比,过表达SerpinA5基因可显著抑制食管鳞癌细胞的迁移能力(P<0.01),见图4D。
Transwell检测结果显示,与oe-NC组相比,过表达SerpinA5后镜下每个视野中穿过小室小孔的细胞数明显减少(P<0.001),见图4E。表明过表达SerpinA5基因后食管鳞癌细胞侵袭能力被显著抑制。
2.4 两组皮下移植瘤的重量和体积比较
为进一步验证过表达SerpinA5在体内对食管鳞癌细胞生长的影响,我们成功构建了裸鼠皮下移植瘤模型。oe-NC和oe-SerpinA5两组各8只裸鼠,接种肿瘤细胞1周后均开始有肉眼可见的移植瘤长出,成瘤率为100%,实验结束前两组裸鼠均无死亡病例,见图5A。移植瘤生长曲线显示,oe-SerpinA5组肿瘤生长速度和体积显著低于oe-NC组(P<0.05),见图5B。剥离移植瘤后称重发现,oe-SerpinA5组瘤重显著低于oe-NC组[(0.22±0.084)vs. (0.75±0.24)g,P<
0.0001 ],见图5C。但两组间裸鼠体质量比较差异无统计学意义,见图5D。综上所述,在不影响裸鼠体质量的前提下,过表达SerpinA5基因在体内具有显著抑制肿瘤生长的作用,进一步从体内实验证实了SerpinA5在食管鳞癌中的抑癌功能。2.5 IHC检测Ki-67在皮下成瘤组织中的表达
结果显示,与oe-NC组相比,oe-SerpinA5组Ki-67蛋白的表达显著下降,提示过表达SerpinA5在体内亦能显著抑制肿瘤的增殖(P<0.01),见图6。
2.6 SerpinA5与Fn相互作用
Co-IP实验结果显示,在过表达SerpinA5食管鳞癌KYSE150细胞系中,SerpinA5与纤连蛋白(Fibronectin, Fn)存在相互作用,见图7。
2.7 过表达SerpinA5对Fn/Integrin-β1信号通路相关蛋白表达的影响
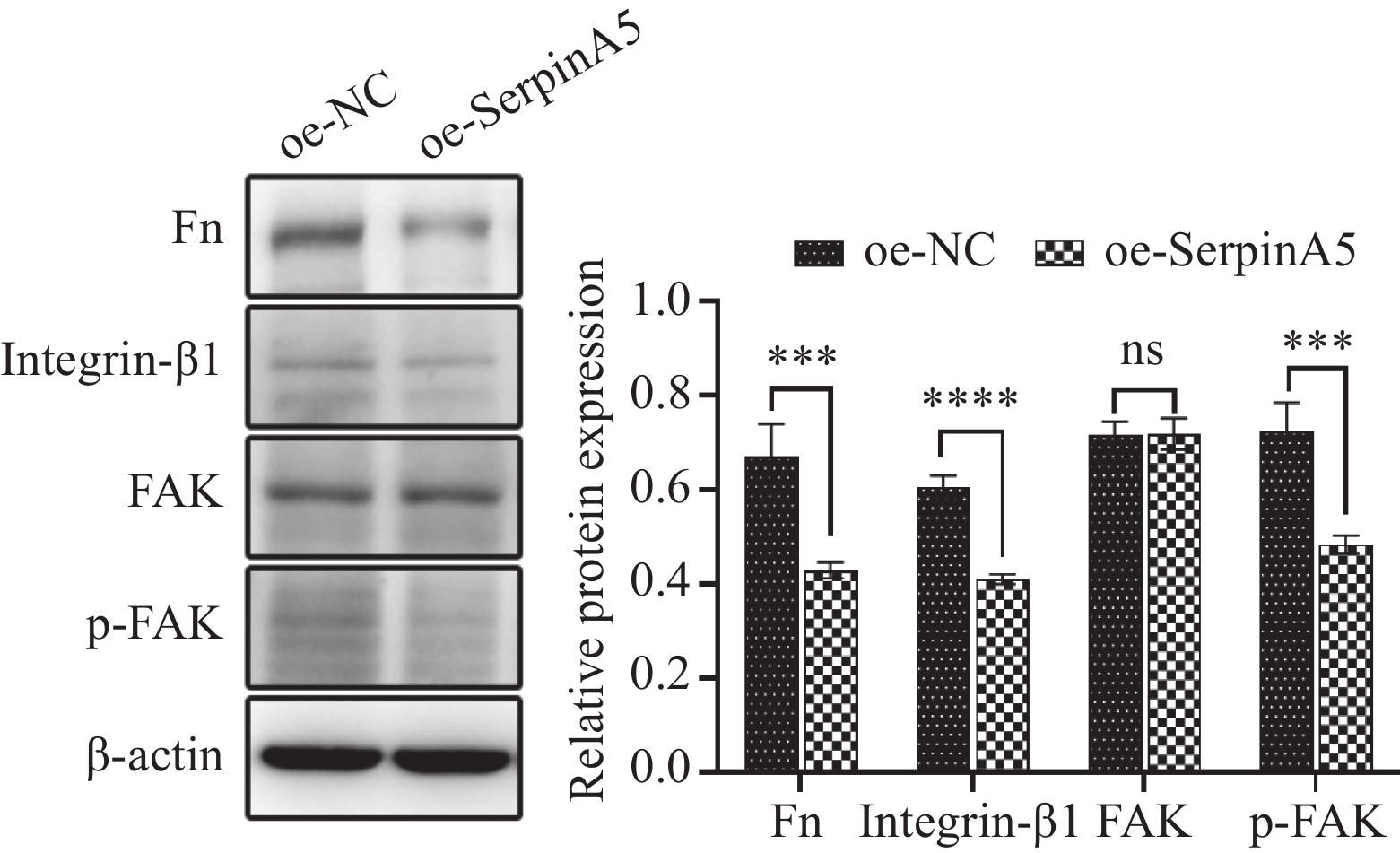
在裸鼠皮下移植瘤组织中,采用Western blot检测过表达SerpinA5基因后Fn/Integrin-β1通路相关蛋白的表达变化。结果显示,过表达SerpinA5基因后Fn(P<0.001)、Integrin-β1(P<
0.0001 )及p-FAK(P<0.001)蛋白表达均较oe-NC组显著降低,FAK蛋白表达较oe-NC组差异无统计学意义(P>0.05),见图8。由此推断,SerpinA5是通过调控Fn/Integrin-β1信号通路抑制食管鳞癌细胞恶性生物学行为。3 讨论
食管鳞癌的发生是多基因参与、多阶段进行的复杂过程[12]。我国食管鳞癌患者目前尚缺乏有效的分子靶标,为此,深入研究与食管鳞癌相关的分子靶标,探索食管鳞癌发生及转移的机制至关重要。
SerpinA5基因又称蛋白C抑制剂(Protein C inhibitor, PCI),是一种由387个氨基酸组成的单链糖蛋白,主要在肝脏合成,但也在肾脏、睾丸、精囊和卵巢等生殖器官产生。Asanuma等[13]研究发现SerpinA5可抑制乳腺癌细胞的侵袭。Bijsmans等[14]发现SerpinA5低表达与交界性肿瘤侵袭性正相关。本研究发现,SerpinA5在食管鳞癌中低表达,过表达SerpinA5后食管鳞癌细胞增殖、迁移、侵袭能力显著受到抑制,并促进其凋亡,表明SerpinA5可能与ESCC的发生发展密切相关,并在发生发展中扮演抑癌因子的角色。这与Asanuma等和Bijsmans等研究结果相一致。然而也有研究提出了不同观点,Palmieri等[15]发现在乳腺癌细胞内源性表达的SerpinA5增强了细胞黏附特性和迁移能力。Fan等[16]发现SerpinA5在胃癌中高表达,且可通过调控PI3K/AKT/mTOR信号通路促进胃癌发生发展。为进一步验证体外细胞实验结果,本研究构建了食管鳞癌裸鼠皮下移植瘤模型,结果发现过表达SerpinA5后食管鳞癌细胞在体内致瘤能力显著降低,这与体外细胞实验结果相一致。此外,有研究证实Ki-67系反映食管鳞癌发生和发展的重要参考指标,Ki-67参与调控细胞增殖活性,且与细胞增殖程度呈正相关[17]。本研究发现过表达SerpinA5可显著降低Ki-67阳性率。通过上述体内外实验证实了过表达SerpinA5可抑制食管鳞癌的发生发展。
有多项研究报道在肝癌、结肠癌、基底细胞癌中纤连蛋白-整合素β1信号通路异常激活促进肿瘤细胞的增殖侵袭和转移[11,18-19]。Fn是一种参与细胞—基质相互作用的糖蛋白,在细胞增殖、扩散、迁移和上皮间充质转化中发挥作用。Integrin-α5β1是Fn的经典受体,结合后引起整合素的接触活化,激活与黏着斑相连的非受体酪氨酸蛋白激酶FAK和Src,引起激活的激酶结构改变、磷酸化以及肿瘤细胞失巢凋亡抵抗,导致肿瘤细胞间黏连和侵袭性增加,进一步促进肿瘤发生发展[20-23]。Jing等[11]研究发现SerpinA5可通过和肿瘤细胞中高丰度的Fn直接结合,过表达SerpinA5基因可干扰Fn经典的受体Integrin-β1及其下游分子的磷酸化水平,进而抑制肝癌细胞转移。目前关于SerpinA5与Fn/Integrin β1信号通路在食管鳞癌中的关系研究尚未见报道。本研究通过Co-IP实验证实食管鳞癌细胞中SerpinA5与Fn存在相互作用,且过表达SerpinA5基因可明显抑制Fn、Integrin-β1及磷酸化FAK蛋白活性,进而抑制食管鳞癌的发生发展。
综上所述,SerpinA5在食管鳞癌中低表达,并可通过调控Fn/Integrin-β1信号通路抑制食管鳞癌细胞的增殖、迁移和侵袭,并促进其凋亡。目前SerpinA5在ESCC中的研究尚少,本研究为完善ESCC的发生发展机制和ESCC的防治提供了新的依据和作用靶点,后续还需要更多的体内外实验对其进行验证。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:魏 瑜:动物实验、数据分析及论文撰写张周华、李志芳:生信分析及细胞实验张 莉:实验设计及论文审校 -
-
[1] Ferlay J, Ervik M, Lam F, et al. Globocan 2022 (version 1.1) [EB/OL]. https://gco.iarc.who.int/today/en/dataviz/bars?mode=cancer&group_populations=1&populations=900&types=1&sort_by=value0&key=total. –[2024-02-08].
[2] Xu QL, Li H, Zhu YJ, et al. The treatments and postoperative complications of esophageal cancer: a review[J]. J Cardiothorac Surg, 2020, 15(1): 163-173. doi: 10.1186/s13019-020-01202-2
[3] 郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231. [Zheng RS, Chen R, Han BF, et al. Cancer incidence and mortality in China, 2022[J]. Zhonghua Zhong Liu Za Zhi, 2024, 46(3): 221-231.] doi: 10.3760/cma.j.cn112152-20240119-00035 Zheng RS, Chen R, Han BF, et al. Cancer incidence and mortality in China, 2022[J]. Zhonghua Zhong Liu Za Zhi, 2024, 46(3): 221-231. doi: 10.3760/cma.j.cn112152-20240119-00035
[4] Thrift AP. The epidemic of oesophageal carcinoma: Where are we now?[J]. Cancer Epidemiol, 2016, 41: 88-95. doi: 10.1016/j.canep.2016.01.013
[5] Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567. doi: 10.1016/S2214-109X(18)30127-X
[6] 陈星. SERPINA5预测食管鳞癌放化疗疗效及预后的价值[D]. 乌鲁木齐:新疆医科大学, 2020. [Chen X. The value of SERPINA5 in predicting the efficacy and prognosis of radiotherapy and chemotherapy in esophageal squamous cell carcinoma[D]. Urumqi: Xinjiang Medical University, 2020.] Chen X. The value of SERPINA5 in predicting the efficacy and prognosis of radiotherapy and chemotherapy in esophageal squamous cell carcinoma[D]. Urumqi: Xinjiang Medical University, 2020.
[7] Yang H, Wahlmüller FC, Sarg B, et al. A+-helix of protein C inhibitor (PCI) is a cell-penetrating peptide that mediates cell membrane permeation of PCI[J]. J Biol Chem, 2015, 290(5): 3081-3091. doi: 10.1074/jbc.M114.581736
[8] Wahlmüller FC, Yang H, Furtmüller M, et al. Regulation of the Extracellular SERPINA5(Protein C Inhibitor) Penetration Through Cellular Membranes[J]. Adv Exp Med Biol, 2017, 966: 93-101.
[9] Wakita T, Hayashi T, Nishioka J, et al. Regulation of carcinoma cell invasion by protein C inhibitor whose expression is decreased in renal cell carcinoma[J]. Int J Cancer, 2004, 108(4): 516-523. doi: 10.1002/ijc.11594
[10] Song Y, Ye L, Tan Y, et al. Therapeutic exosomes loaded with SERPINA5 attenuated endometrial cancer cell migration via the integrin β1/FAK signaling pathway[J]. Cell Oncol (Dordr), 2022, 45(5): 861-872.
[11] Jing Y, Jia D, Wong CM, et al. SERPINA5 inhibits tumor cell migration by modulating the fibronectin-integrin β1 signaling pathway in hepatocellular carcinoma[J]. Mol Oncol, 2014, 8(2): 366-377. doi: 10.1016/j.molonc.2013.12.003
[12] Morgan E, Soerjomataram I, Gavin A T, et al. International trends in oesophageal cancer survival by histological subtype between 1995 and 2014[J]. Gut, 2021, 70(2): 234-242.
[13] Asanuma K, Yoshikawa T, Hayashi T, et al. Protein C inhibitor inhibits breast cancer cell growth, metastasis and angiogenesis independently of its protease inhibitory activity[J]. Int J Cancer, 2007, 121(5): 955-965. doi: 10.1002/ijc.22773
[14] Bijsmans Ingrid TGW, Smits Kim M, de Graeff Pauline, et al. Loss of SerpinA5 protein expression is associated with advanced-stage serous ovarian tumors[J]. Mod Pathol, 2011, 24: 463-470.
[15] Palmieri D, Lee JW, Juliano RL, et al. Plasminogen activator inhibitor-1 and -3 increase cell adhesion and motility of mda-mb-435 breast cancer cells[J]. J Biol Chem, 2002, 277(43): 40950-40957. doi: 10.1074/jbc.M202333200
[16] Fan M, Xiong X, Han L, et al. Serpina5 promotes tumour cell proliferation by modulating the pi3k/akt/mtor signalling pathway in gastric cancer[J]. J Cell Mol Med, 2022, 26(18): 4837-4846. doi: 10.1111/jcmm.17514
[17] Zhang L, Hu S, Korteweg C, et al. Expression of immunoglobulin G in esophageal squamous cell carcinomas and its association with tumor grade and Ki67[J]. Hum Pathol, 2012, 43(3): 423-434. doi: 10.1016/j.humpath.2011.05.020
[18] Ma H, Wang J, Zhao X, et al. Periostin Promotes Colorectal Tumorigenesis through Integrin-FAK-Src Pathway-Mediated YAP/TAZ Activation[J]. Cell Rep, 2020, 30(3): 793-806. e6.
[19] Kuonen F, Surbeck I, Sarin KY, et al. TGFβ, Fibronectin and Integrin α5β1 Promote Invasion in Basal Cell Carcinoma[J]. J Invest Dermatol, 2018, 138(11): 2432-2442. doi: 10.1016/j.jid.2018.04.029
[20] Vega ME, Schwarzbauer JE. Collaboration of Fibronectin Matrix with other Extracellular Signals in Morphogenesis and Differentiation[J]. Curr Opin Cell Biol, 2016, 42: 1-6. doi: 10.1016/j.ceb.2016.03.014
[21] Strohmeyer N, Bharadwaj M, Costell M, et al. Fibronectin-bound α5β1 integrins sense load and signal to reinforce adhesion in less than a second[J]. Nat Mater, 2017, 16(12): 1261-1270.
[22] Li K, Zhao G, Ao J, et al. ZNF32 induces anoikis resistance through maintaining redox homeostasis and activating Src/FAK signaling in hepatocellular carcinoma[J]. Cancer Lett, 2019, 442: 271-278. doi: 10.1016/j.canlet.2018.09.033
[23] Zhao G, Gong L, Su D, et al. Cullin5 deficiency promotes small-cell lung cancer metastasis by stabilizing integrin β1[J]. J Clin Invest, 2019, 129(3): 971-987.



 下载:
下载: