EMP1 Induces Proliferation and Migration of Pancreatic Cancer Cells by Activating PI3K/AKT Signaling Pathway
-
摘要:目的
探讨EMP1在胰腺癌细胞中生物学作用及其促进肿瘤进展的相关分子机制。
方法通过慢病毒转染,获得稳定的EMP1敲低肿瘤细胞系。通过CCK-8、克隆形成实验检测EMP1对肿瘤细胞增殖的影响。通过划痕实验、Transwell实验检测EMP1对肿瘤细胞迁移、侵袭的影响。通过Western blot探究EMP1对下游信号通路的影响。
结果qRT-PCR和Western blot结果显示EMP1在胰腺癌细胞中高表达。CCK-8、克隆形成、划痕和Transwell实验结果表明EMP1在胰腺癌中促进癌细胞增殖、迁移及侵袭。Western blot实验结果发现EMP1可能是通过PI3K/AKT促进肿瘤进展。
结论本研究表明EMP1可能激活PI3K/AKT信号通路促进胰腺癌细胞增殖、迁移与侵袭,从而正向调控肿瘤进展。
Abstract:ObjectiveTo investigate the biological behavior of EMP1 in pancreatic cancer cells and the molecular mechanism of EMP1 in promoting tumor progression.
MethodsA stable EMP1 knockdown cell line was obtained by lentivirus transfection. The effect of EMP1 on the proliferation of cancer cells was determined by CCK-8 and clonal formation assay. The effect of EMP1 on the migration and invasion of cancer cells was detected by scratch test and Transwell test. The influence of EMP1 on downstream signaling pathways was investigated by Western blot.
ResultsThe results of qRT-PCR and Western blot showed that EMP1 was highly expressed in pancreatic cancer cells. The results of CCK-8, colony formation, scratch, and Transwell assays indicated that EMP1 promoted the proliferation, migration, and invasion of pancreatic cancer cells. Western blot results revealed that EMP1 might promote tumor progression through the PI3K/AKT signaling pathway.
ConclusionThis study suggested that EMP1 may activate the PI3K/AKT signaling pathway to promote the proliferation, migration, and invasion of pancreatic cancer cells, thereby positively regulating tumor progression.
-
Key words:
- Pancreatic cancer /
- EMP1 /
- PI3K/AKT
-
0 引言
胰腺癌是一种恶性程度极高的消化道肿瘤,与其发病相关的主要危险因素包括吸烟、酗酒、糖尿病、肥胖、年龄、家族史和遗传因素等[1-2]。据2024年美国癌症统计报告显示,估计2024年全球共有66 440例患者被诊断为胰腺癌,并且2024年可能有51 750人发生胰腺癌相关死亡[3]。由于暂时没有有效的治疗手段,其5年生存率小于9%[4]。目前,根治性手术切除是胰腺癌唯一的治愈方法。然而,大多数胰腺癌患者发现时往往已处于晚期并伴发远处转移,失去手术机会。即使在手术切除后,也会出现复发或者转移,这些均是导致胰腺癌患者死亡率高的原因[5-6]。因此,迫切需要发现新的分子标志物及治疗靶点,以便能够早发现、早诊断、早治疗,从而有效降低患者的死亡率。
上皮膜蛋白1(Epithelial membrane protein 1, EMP1)属于外周髓鞘蛋白22基因家族,也被称为CL-40,肿瘤相关膜蛋白(TMP)。作为一种细胞连接蛋白,在癌细胞增殖、侵袭及转移中有着重要作用,并且EMP1表达情况与肿瘤耐药密切相关[7-12]。因此,探索EMP1基因与胰腺癌之间的关系,或许可以为胰腺癌的治疗提供新思路。PI3K/AKT信号转导通路可以调节细胞增殖、凋亡、存活、新陈代谢和血管生成等[13-14]。在多种癌症中,PI3K/AKT往往被激活,促进肿瘤进展以及抗癌治疗抵抗[15]。在食管癌、胃癌、乳腺癌、肺癌中已有研究显示抑制PI3K/AKT通路可抑制肿瘤进展[16-19]。以上研究提示,靶向该通路可能作为肿瘤进展的潜在治疗方向。
本研究中,我们首先通过生物信息学分析发现EMP1在胰腺癌组织中高表达,并且与患者的诊断、预后密切相关。然后进行细胞实验表明EMP1对胰腺癌细胞恶性生物学行为的影响,并进一步验证了其发挥作用的下游信号通路,希望该研究能为胰腺癌治疗提供新的理论依据。
1 材料与方法
1.1 数据库资料
使用肿瘤基因组图谱(The Cancer Genome Atlas, TCGA)数据库(https://cancergenome.nih.gov)和基因型组织表达(Genotype-Tissue Expression Project, GTEx)数据库(https://www.gtexportal.org/)获取胰腺相关的高通量测序数据,其中包括TCGA数据库中的胰腺癌组织(n=178)、TCGA数据库中的正常胰腺组织(n=4)以及GTEx数据库中的正常胰腺组织(n=167)。根据EMP1表达水平中位数将所有患者分为高表达组(n=89)和低表达组(n=89),利用Kaplan Meier-plotter数据库绘制生存曲线图,利用R包绘制受试者工作特征曲线(Receiver operating characteristic curve, ROC)。通过Kaplan-Meier生存曲线分析EMP1高低表达组之间在生存时间上的差异,具体包括总生存时间(Overall survival, OS)、疾病特定生存时间(Disease-specific survival, DSS)、无进展生存时间(Progression-free survival, PFS)。
1.2 KEGG通路富集分析
通过LinkedOmics数据库的胰腺癌数据集获取与EMP1协同表达的基因,EMP1协同表达基因的筛选标准为:相关系数的绝对值≥0.5和P<0.05。京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)可以系统地分析基因组中涉及的细胞生化途径。使用ClusterProfiler R软件包对EMP1共表达基因进行KEGG富集分析,P<0.05的GO条目和通路差异具有统计学意义。
1.3 细胞培养
人胰腺癌细胞系AsPC-1、BxPC-3、PANC-1、SW1990均购自上海中国科学院细胞库,胰腺正常上皮细胞HPDE购自北京北纳生物。AsPC-1、BxPC-3细胞使用含10%胎牛血清(ABW血清,乌拉圭)及1%青霉素-链霉素溶液(Gibco, Thermo Fisher, 上海)的RPMI1640培养基(Gibco, Thermo Fisher, 上海),PANC-1、SW1990和 HPDE细胞置于DMEM培养基,5%CO2、37℃的恒温培养箱孵育。
1.4 细胞转染
EMP1-RNAi慢病毒(siEMP1)和RNAi阴性对照组慢病毒(Negative control, NC)均由上海吉凯基因公司构建。EMP1 RNAi慢病毒阴性对照组载体序列为TTCTCCGAACGTGTCACGT(滴度:1×108),EMP1-sh1序列为cgCAGTATCACCACGGCTATT(滴度:3×108),EMP1-sh2序列为gtGTCCATCTACACTAGTCAT(滴度:1.5×108),EMP1-sh3序列为cgCTACTGTTATTATGCTATT(滴度:1.5×108)。细胞消化计数后取2×105个细胞接种到六块孔板中置于培养箱过夜,待细胞融合度在30%~40%时进行慢病毒转染。1 ml的完全培养基中,按照MOI=10计算需要加入的病毒量,并加入40 µl病毒转染试剂,混匀后加入六孔板中置于细胞培养箱,24 h后换液,3天后用嘌呤霉素(4 µg/ml)筛选,获得稳定转染的细胞。
1.5 RNA的提取、反转录及qRT-PCR
观察密度>80%且生长状态良好的细胞,使用TRIzol试剂(TakaRa,日本)提取细胞RNA。严格按照试剂说明书(TakaRa, RR047A,日本)进行RNA反转录及qRT-PCR反应。引物由北京擎科生物科技有限公司(西安,中国)合成,引物序列如下:EMP1: 5'-3' CCCTCCTGGTCTTCGTGT(正义), 5'-3' GGAATAGCCGTGGTGATA(反义);GAPDH: 5'-3' AAGGTGAAGGTCGGAGTCAAC(正义),5'-3' GGGGTCATTGATGGCAACAATA(反义)。
1.6 蛋白质印迹法(Western blot)
使用RIPA裂解液(博士德,武汉)提取细胞总蛋白,收集上清液,BCA蛋白测定试剂盒(博士德,武汉)测定蛋白质浓度。每孔加40 µg蛋白进行SDS-PAGE凝胶电泳。5%脱脂奶粉封闭2 h,TBST清洗PVDF膜(Millipore, 美国)按分子量裁剪条带,置于一抗中,4℃下摇床过夜。TBST清洗后,置于二抗中,室温孵育1 h,清洗后,ECL化学发光液曝光仪下使条带可视化。
1.7 CCK-8细胞增殖实验
根据试剂说明书操作,CCK-8用于检测细胞增殖。细胞消化计数后按照100 µl、每孔
1000 (BxPC-3)或2 000(AsPC-1)个细胞接种到96孔板中。3 h后等待细胞贴壁,弃去原培养基,将CCK-8试剂(同仁,日本)与细胞培养基按照1∶10配置,每孔加入100 µl配置液,培养箱孵育2 h后使用酶标仪(synergy H1, Biotek, 美国)测定吸光度值,波长设置为450 nm,分别在24、48和72 h检测数值。1.8 细胞克隆形成实验
使用细胞克隆实验检测细胞增殖情况。细胞消化计数后按照2 000个/孔的密度将细胞接种到六孔板中,培养14天之后,移除培养基,用PBS清洗3次,并将六孔板中的细胞用4%多聚甲醛固定20 min,1%的结晶紫染色3 min后拍照。
1.9 细胞划痕实验
使用细胞划痕实验评估细胞迁移能力。将处于对数生长期的细胞消化后均匀地接种到六孔板中,待细胞在六孔板中融合度达到90%,使用无菌的200 µl枪头在孔中划出干净、笔直的区域,清洗漂浮细胞后加入2 ml不含血清的培养基,分别在0 h、48 h使用倒置荧光显微镜沿着划痕方向观察并拍照。
1.10 Transwell实验
通过Transwell实验评估细胞迁移及侵袭能力。取处于对数生长期的细胞饥饿24 h后消化并计数,取250 µl无血清的细胞悬液接种于上室中,下室中加入700 µl含30%血清的完全培养基,细胞培养箱中孵育48~72 h。按基质胶∶培养基为1∶9的比例稀释基质胶。清洗后使用4%多聚甲醛固定20 min,结晶紫避光染色3 min后倒置显微镜下多视野拍照。
1.11 统计学方法
使用Image J软件对数据进行分析,Graphpad Prism 8绘图可视化。符合正态分布计量资料的以$\bar x \pm s $表示,独立样本及配对数据分别采用两独立样本t检验与配对样本t检验进行组间比较;计数资料以率表示,并以χ2检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 TCGA及GEO数据库中EMP1在胰腺癌中的表达及其与诊断、预后的关系
TCGA数据库的结果表明,EMP1在胰腺癌组织中高表达(图1A)。下载基因芯片GSE15471(13例正常胰腺组织,118例胰腺癌),GSE62165(正常胰腺组织和胰腺癌组织各39例)进一步验证EMP1的表达水平,同样发现EMP1在胰腺癌组织中的水平高于正常组织(图1B、C)。绘制ROC曲线评估EMP1对胰腺癌患者的诊断预测效能,结果显示:曲线下面积为0.967(图1D),表明EMP1在胰腺癌诊断中具有较高的价值。随后绘制了时间依赖的ROC曲线,结果显示,1年、3年、5年AUC值均>0.6(图1E),对于患者的预后评估具有参考价值。
![]() 图 1 TCGA及GEO数据库中EMP1在胰腺癌中表达上调及其与诊断、预后的关系Figure 1 Upregulation of EMP1 in pancreatic cancer and its relationship with diagnosis and prognosis in TCGA and GEO databasesA: The expression of EMP1 in tumor tissues and normal tissues in the TCGA database; B, C: The expression of EMP1 in tumor tissues and normal tissues in two gene chips; D: The ROC curve of EMP1 and pancreatic cancer patients; E: Time-dependent ROC curve; F: OS of patients in the high expression group of EMP1; G: DSS of patients in the high expression group of EMP1; H: PFS of patients in the high expression group of EMP1.
图 1 TCGA及GEO数据库中EMP1在胰腺癌中表达上调及其与诊断、预后的关系Figure 1 Upregulation of EMP1 in pancreatic cancer and its relationship with diagnosis and prognosis in TCGA and GEO databasesA: The expression of EMP1 in tumor tissues and normal tissues in the TCGA database; B, C: The expression of EMP1 in tumor tissues and normal tissues in two gene chips; D: The ROC curve of EMP1 and pancreatic cancer patients; E: Time-dependent ROC curve; F: OS of patients in the high expression group of EMP1; G: DSS of patients in the high expression group of EMP1; H: PFS of patients in the high expression group of EMP1.2.2 Kaplan-Meier法分析EMP1在胰腺癌患者中的生存曲线
生存分析显示EMP1高表达组患者OS(P=0.011)、DSS(P=
0.0019 )和PFS(P=0.0012 )更短(图1)。提示EMP1高表达的患者预后不良。2.3 EMP1在胰腺癌细胞中高表达
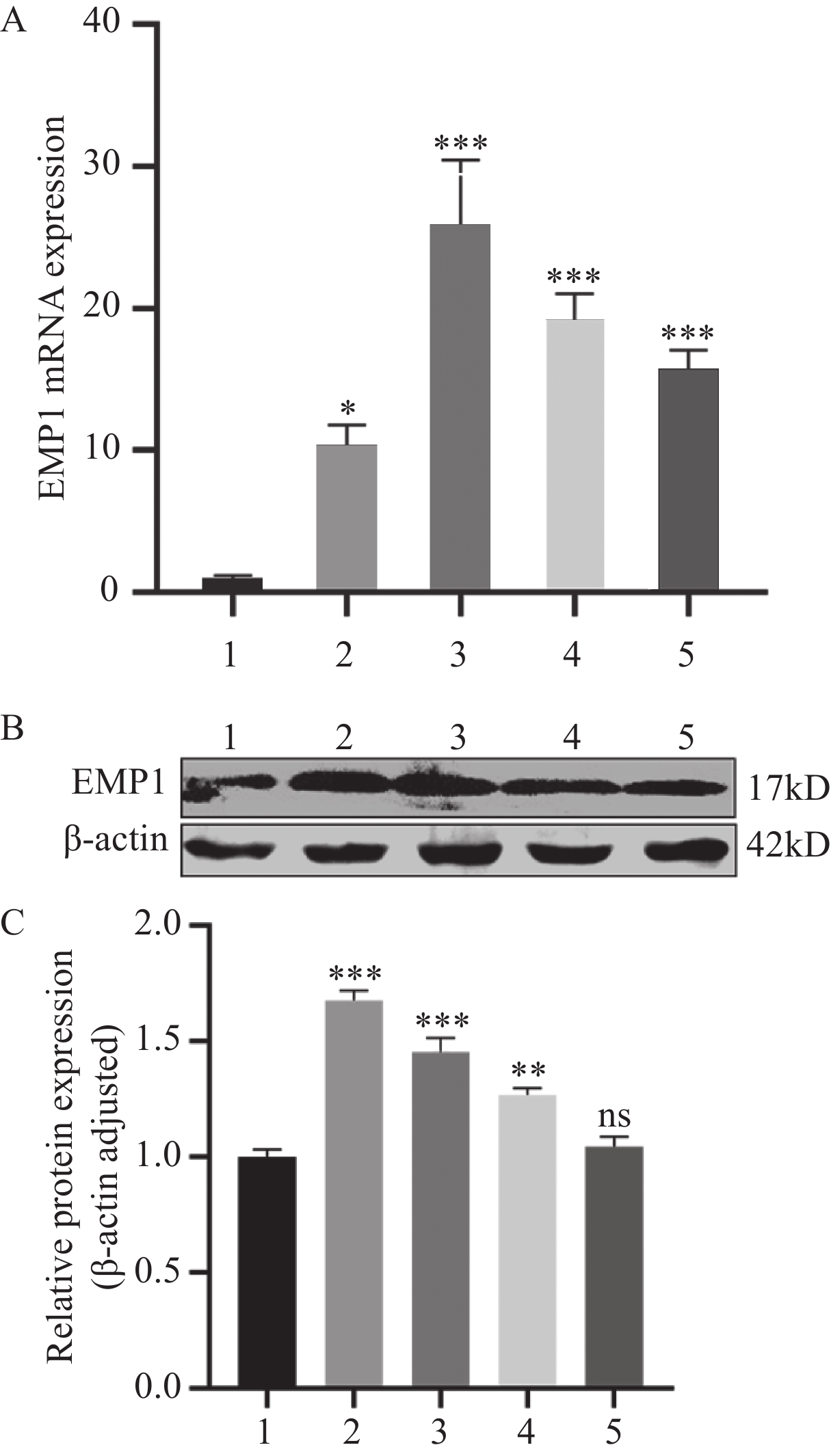
通过qRT-PCR、Western blot法检测PANC-1、AsPC-1、BxPC-3、SW1990以及HPDE细胞中EMP1的表达,结果表明EMP1在胰腺癌细胞中表达上调(图2),并且在AsPC-1、BxPC-3细胞中的表达上调更明显。因此,我们选择差异表达较高的AsPC-1、BxPC-3两株细胞进行后续功能实验。
2.4 EMP1慢病毒转染AsPC-1、BxPC-3细胞后敲低效率验证
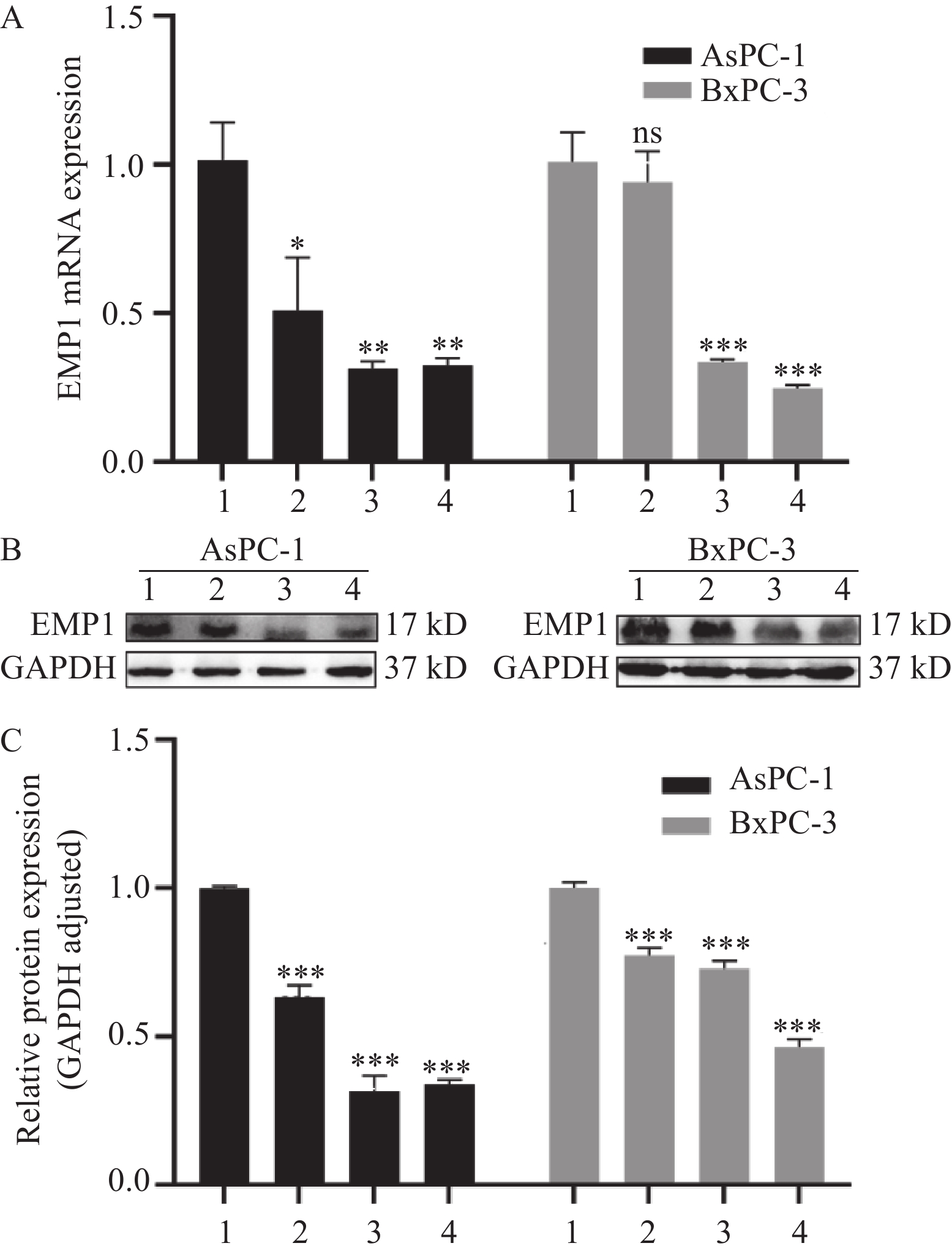
获得稳定转染的细胞后,提取细胞的RNA、蛋白,通过qRT-PCR、Western blot法验证慢病毒转染后AsPC-1、BxPC-3细胞中EMP1 mRNA、蛋白变化情况。在慢病毒转染后的阴性对照组(NC)以及三个靶点(EMP1-sh1、EMP1-sh2、EMP1-sh3)中,EMP1-sh2、EMP1-sh3两个靶点敲低效率较高(图3),故在后续实验中,选择NC、EMP1-sh2与EMP1-sh3进行功能实验。
![]() 图 3 qRT-PCR(A)和Western blot法(B、C)验证慢病毒转染后AsPC-1、BxPC-3细胞中EMP1变化情况Figure 3 Change of EMP1 in AsPC-1 and BxPC-3 cells after transfection with lentivirus verified by qRT-PCR (A) and Western blot (B, C) methods*: P<0.05; **: P<0.01; ***: P<0.001; 1: Negative control; 2: EMP1-sh1; 3: EMP1-sh2; 4: EMP1-sh3; ns: no significance.
图 3 qRT-PCR(A)和Western blot法(B、C)验证慢病毒转染后AsPC-1、BxPC-3细胞中EMP1变化情况Figure 3 Change of EMP1 in AsPC-1 and BxPC-3 cells after transfection with lentivirus verified by qRT-PCR (A) and Western blot (B, C) methods*: P<0.05; **: P<0.01; ***: P<0.001; 1: Negative control; 2: EMP1-sh1; 3: EMP1-sh2; 4: EMP1-sh3; ns: no significance.2.5 EMP1在体外加速胰腺癌细胞的增殖
为了解EMP1高表达在胰腺癌中的作用,我们使用慢病毒转染后的AsPC-1、BxPC-3细胞,探索EMP1在胰腺癌细胞增殖与迁移中的作用。CCK-8检测结果显示,与阴性对照组相比,EMP1敲低显著抑制了两株细胞系的生长(图4A、B)。同时,细胞克隆形成实验(图4C、D)也显示出同样的结果。
2.6 EMP1在体外加速胰腺癌细胞的迁移与侵袭
细胞划痕实验结果显示:与阴性对照组相比,EMP1敲低组细胞生长减慢,显著抑制了迁移能力(图5A~D)。在Transwell实验中也观察到类似的结果(图5E、F)。在添加基质胶后,结果显示:敲低EMP1表达后,细胞的侵袭能力得到抑制(图5G、H)。综上,这些结果表明EMP1增强了胰腺癌细胞的迁移与侵袭。
2.7 EMP1激活PI3K/AKT信号通路并促进胰腺癌体外生长
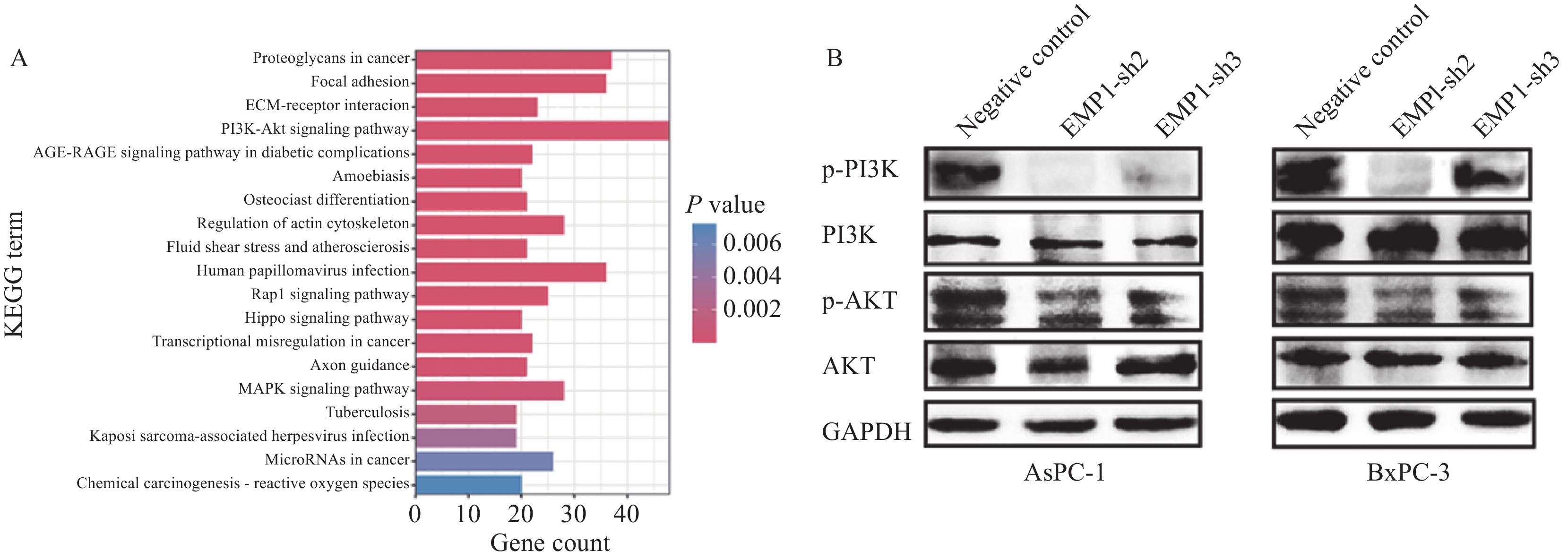
PI3K/AKT信号通路在癌细胞增殖与转移中发挥重要作用,我们通过KEGG富集分析显示,大部分基因富集在PI3K/AKT通路中(图6A)。我们假设其在EMP1促进胰腺癌细胞增殖与转移的过程中发挥作用。因此我们评估了该通路在EMP1敲低后的表达情况。Western blot结果显示,EMP1功能丧失显著降低了PI3K/P-PI3K、AKT/P-AKT的表达(图6B)。这与我们的假设一致,即EMP1介导PI3K/AKT激活促进胰腺癌的生长。
3 讨论
胰腺癌由于其易发生早期转移和诊断时已是晚期的特点,手术作为治愈的首选机会有限,导致其5年生存率只有2%~9%[13]。虽然在过去几年,手术及辅助治疗在提高生存率方面取得了一些进展,但患者总体预后仍然较差[14]。因此,早期诊断、治疗及提高患者生存率至关重要。
本研究证明了EMP1在胰腺癌细胞中表达明显上调,可能通过PI3K/AKT信号通路促进癌细胞的增殖、侵袭、迁移。由此可见,EMP1在胰腺癌中扮演癌基因的角色,可为胰腺癌的早期诊断提供重要的证据。已有研究表明EMP1在其他肿瘤的发生与进展中也有着重要作用。EMP1在人膀胱癌中低表达,通过激活PPARγ信号促进迁移,并增强对铁死亡的抵抗力来促进人膀胱癌细胞的转移[20]。另外,EMP1在头颈部鳞状细胞癌中促进RSL3诱导的铁死亡的敏感性从而增强了对吉非替尼的耐药性[21]。而在胰腺癌中,铁死亡与肿瘤抵抗和免疫浸润之间也有着密切联系,可能与化疗、免疫治疗或者其他抗肿瘤方法的联合治疗为胰腺癌提供新的治理策略[22]。在与PrS细胞共培养的前列腺癌LNCaP细胞中EMP1表达上调,并通过激活小GTPase Rac1促进肿瘤细胞迁移与转移,可能还会影响肿瘤微环境中癌细胞的表型[23]。卵巢癌中EMP1同样也高表达,增加了RAS/RAF/MAPK/c-JUN的蛋白水平,激活MAPK信号通路促进了肿瘤细胞增殖、侵袭和EMT[7]。尤其是在2022年的一项研究中提出,结直肠癌的转移性复发来源于残留的EMP1阳性细胞,EMP1可能负责肿瘤细胞的转移性复发[24]。这些研究结果拓展了我们对转移的理解,并为开发针对病程的干预措施铺平道路,探索EMP1是否参与胰腺癌转移或者复发可能为胰腺癌治疗提供新见解。
研究表明,PI3K/AKT信号通路在人类癌症中异常激活,PI3K/AKT信号通路通过直接调节营养转运蛋白和代谢酶或控制调节代谢途径关键成分表达的转录因子及下游代谢的影响来激活癌症进展[25]。已有研究表明EMP1调控PI3K/AKT通路在多种肿瘤中发挥作用,其中与EMP1有关的研究集中在胶质瘤细胞的侵袭和增殖。首先,Wang等的研究发现EMP1通过PI3K/AKT信号通路抑制胶质瘤细胞的侵袭和增殖,并且能够调节胶质瘤干细胞中CD44的表达促进干细胞性[8]。在另外一项胶质母细胞瘤的研究中同样发现了EMP1可激活PI3K/AKT信号通路促进胶质瘤的进展[26]。随后发现在EMP1转录活性降低之后,会抑制PI3K/AKT信号通路活性,从而促进细胞自噬和凋亡影响肿瘤进展[27]。其次,EMP1在部分肿瘤中可能会增加化疗过程中的耐药性。在胃癌中,miR-95-3p下调EMP1的表达以及增加PI3K/AKT通路的磷酸化后使胃癌对顺铂的治疗产生抗性[12]。胰腺癌中,与PI3K/AKT相关的抑制剂在异种移植模型和胰腺癌细胞系以及临床试验中表现出了有效的抗肿瘤潜力[28]。
综上所述,本研究表明EMP1在胰腺癌细胞中过表达,导致癌细胞的增殖、迁移及侵袭,并且EMP1通过激活PI3K/AKT信号通路促进肿瘤发生。这些发现支持EMP1作为胰腺癌预后的生物标志物和治疗靶点。通过这些研究,为胰腺癌的临床治疗提供了新视角。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:何 茹:实验设计及实施、论文撰写刘心如:数据分析姜文凯:论文框架的设计、指导实验周文策:论文的修订及终审 -
-
[1] Rawla P, Sunkara T, Gaduputi V. Epidemiology of Pancreatic Cancer: Global Trends, Etiology and Risk Factors[J]. World J Oncol, 2019, 10(1): 10-27. doi: 10.14740/wjon1166
[2] Moore A, Donahue T. Pancreatic Cancer[J]. JAMA, 2019, 322(14): 1426. doi: 10.1001/jama.2019.14699
[3] Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024[J]. CA Cancer J Clin, 2024, 74(1): 12-49.
[4] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. doi: 10.3322/caac.21551
[5] Ilic M, Ilic I. Epidemiology of pancreatic cancer[J]. World J Gastroenterol, 2016, 22(44): 9694-9705. doi: 10.3748/wjg.v22.i44.9694
[6] Park W, Chawla A, O'Reilly EM. Pancreatic Cancer: A Review[J]. JAMA, 2021, 326(9): 851-862. doi: 10.1001/jama.2021.13027
[7] Liu Y, Ding Y, Nie Y, et al. EMP1 Promotes the Proliferation and Invasion of Ovarian Cancer Cells Through Activating the MAPK Pathway[J]. Onco Targets Ther, 2020, 13: 2047-2055. doi: 10.2147/OTT.S240028
[8] Wang J, Li X, Wu H, et al. EMP1 regulates cell proliferation, migration, and stemness in gliomas through PI3K-AKT signaling and CD44[J]. J Cell Biochem, 2019, 120(10): 17142-17150. doi: 10.1002/jcb.28974
[9] Wang M, Liu T, Hu X, et al. EMP1 promotes the malignant progression of osteosarcoma through the IRX2/MMP9 axis[J]. Panminerva Med, 2020, 62(3): 150-154.
[10] Ahmat Amin MKB, Shimizu A, Zankov DP, et al. Epithelial membrane protein 1 promotes tumor metastasis by enhancing cell migration via copine-Ⅲ and Rac1[J]. Oncogene, 2018, 37(40): 5416-5434. doi: 10.1038/s41388-018-0286-0
[11] Wagner AD, Syn NL, Moehler M, et al. Chemotherapy for advanced gastric cancer[J]. Cochrane Database Syst Rev, 2017, 8(8): CD004064.
[12] Ni Q, Zhang Y, Tao R, et al. MicroRNA-95-3p serves as a contributor to cisplatin resistance in human gastric cancer cells by targeting EMP1/PI3K/AKT signaling[J]. Aging (Albany NY), 2021, 13(6): 8665-8687.
[13] Alzahrani AS. PI3K/Akt/mTOR inhibitors in cancer: At the bench and bedside[J]. Semin Cancer Biol, 2019, 59: 125-132. doi: 10.1016/j.semcancer.2019.07.009
[14] Yang J, Nie J, Ma X, et al. Targeting PI3K in cancer: mechanisms and advances in clinical trials[J]. Mol Cancer, 2019, 18(1): 26. doi: 10.1186/s12943-019-0954-x
[15] Martini M, De Santis MC, Braccini L, et al. PI3K/AKT signaling pathway and cancer: an updated review[J]. Ann Med, 2014, 46(6): 372-383. doi: 10.3109/07853890.2014.912836
[16] Xu JC, Chen TY, Liao LT, et al. NETO2 promotes esophageal cancer progression by inducing proliferation and metastasis via PI3K/AKT and ERK pathway[J]. Int J Biol Sci, 2021, 17(1): 259-270. doi: 10.7150/ijbs.53795
[17] Song H, Xu Y, Xu T, et al. CircPIP5K1A activates KRT80 and PI3K/AKT pathway to promote gastric cancer development through sponging miR-671-5p[J]. Biomed Pharmacother, 2020, 126: 109941. doi: 10.1016/j.biopha.2020.109941
[18] Sobral-Leite M, Salomon I, Opdam M, et al. Cancer-immune interactions in ER-positive breast cancers: PI3K pathway alterations and tumor-infiltrating lymphocytes[J]. Breast Cancer Res, 2019, 21(1): 90. doi: 10.1186/s13058-019-1176-2
[19] Jiang W, Kai J, Li D, et al. lncRNA HOXB-AS3 exacerbates proliferation, migration, and invasion of lung cancer via activating the PI3K-AKT pathway[J]. J Cell Physiol, 2020, 235(10): 7194-7203. doi: 10.1002/jcp.29618
[20] Liu S, Shi J, Wang L, et al. Loss of EMP1 promotes the metastasis of human bladder cancer cells by promoting migration and conferring resistance to ferroptosis through activation of PPAR gamma signaling[J]. Free Radic Biol Med, 2022, 189: 42-57.
[21] Wang Y, Zhang L, Yao C, et al. Epithelial Membrane Protein 1 Promotes Sensitivity to RSL3-Induced Ferroptosis and Intensifies Gefitinib Resistance in Head and Neck Cancer[J]. Oxid Med Cell Longev, 2022, 2022: 4750671.
[22] Dong S, Li X, Jiang W, et al. Current understanding of ferroptosis in the progression and treatment of pancreatic cancer[J]. Cancer Cell Int, 2021, 21(1): 480. doi: 10.1186/s12935-021-02166-6
[23] Sato A, Rahman NIA, Shimizu A, et al. Cell-to-cell contact-mediated regulation of tumor behavior in the tumor microenvironment[J]. Cancer Sci, 2021, 112(10): 4005-4012. doi: 10.1111/cas.15114
[24] Cañellas-Socias A, Cortina C, Hernando-Momblona X, et al. Metastatic recurrence in colorectal cancer arises from residual EMP1+ cells[J]. Nature, 2022, 611(7936): 603-613. doi: 10.1038/s41586-022-05402-9
[25] Hoxhaj G, Manning BD. The PI3K-AKT network at the interface of oncogenic signalling and cancer metabolism[J]. Nat Rev Cancer, 2020, 20(2): 74-88. doi: 10.1038/s41568-019-0216-7
[26] Miao L, Jiang Z, Wang J, et al. Epithelial membrane protein 1 promotes glioblastoma progression through the PI3K/AKT/mTOR signaling pathway[J]. Oncol Rep, 2019, 42(2): 605-614.
[27] Wang J, Sun C, Li J, et al. Knockdown of ETV4 promotes autophagy-dependent apoptosis in GBM cells by reducing the transcriptional activation of EMP1[J]. Oncol Lett, 2022, 23(2): 41.
[28] Stanciu S, Ionita-Radu F, Stefani C, et al. Targeting PI3K/AKT/mTOR Signaling Pathway in Pancreatic Cancer: From Molecular to Clinical Aspects[J]. Int J Mol Sci, 2022, 23(17): 10132. doi: 10.3390/ijms231710132




 下载:
下载: