-
-
0 引言
原发性骨淋巴瘤(Primary bone lymphoma, PBL)是一种相对罕见的骨实体肿瘤,发病率极低,仅占所有原发性骨肿瘤的3%[1],占所有结外非霍奇金淋巴瘤的4%~5%[2-3]。其中弥漫性大B细胞淋巴瘤是PBL最常见的病理类型,约占80%以上,T细胞淋巴瘤仅占PBL的1%~5%,极为罕见[4],因此少有文献为临床诊断和治疗管理提供足够的证据。本文报道国内一例原发于胫骨的T细胞淋巴瘤患者的诊治过程,以期为后续骨骼原发T细胞淋巴瘤患者提供诊疗思路。
1 临床资料
患者女,49岁,因“左膝关节疼痛进行性加重1月余”于2022年4月就诊于我院,患者否认有发热、乏力、盗汗和体重减轻症状。体格检查示右侧颌下可触及一花生粒大小淋巴结,质韧,活动度可,无触痛。咽部充血,扁桃体无肿大,余淋巴结区未触及肿大淋巴结。左膝部无肿胀、畸形,表面皮肤未出现红肿、破溃,皮温不高,左膝前内侧压痛、叩痛,活动度可,余无明显阳性体征。本病例报道获得了山东第一医科大学附属聊城市人民医院伦理委员会的批准(审批号:2024270)。
实验室检查血常规+网织红细胞计数:WBC 4.76×109/L,RBC 2.88×1012/L,HB 88 g/L,PLT 213×109/L,RC 32×109/L;生化全项:LDH 366 U/L,余指标无异常。T淋巴瘤六项:多克隆性增生,未出现克隆性重排;基因突变检测:IRF8和NF1基因变异,但该变异缺乏临床/良性证据,临床意义未明(部位:骨髓穿刺物);骨髓穿刺及活检未发现肿瘤细胞。外院左膝关节X线平片示左膝关节退变;左胫骨近端斑片状高密度影,考虑不除外骨肿瘤。于我院行左小腿计算机断层扫描(CT)示左胫骨平台及胫骨近端密度不均匀,可见大片状低密度及硬化影,骨皮质欠规则,考虑左侧胫骨上段骨软骨。
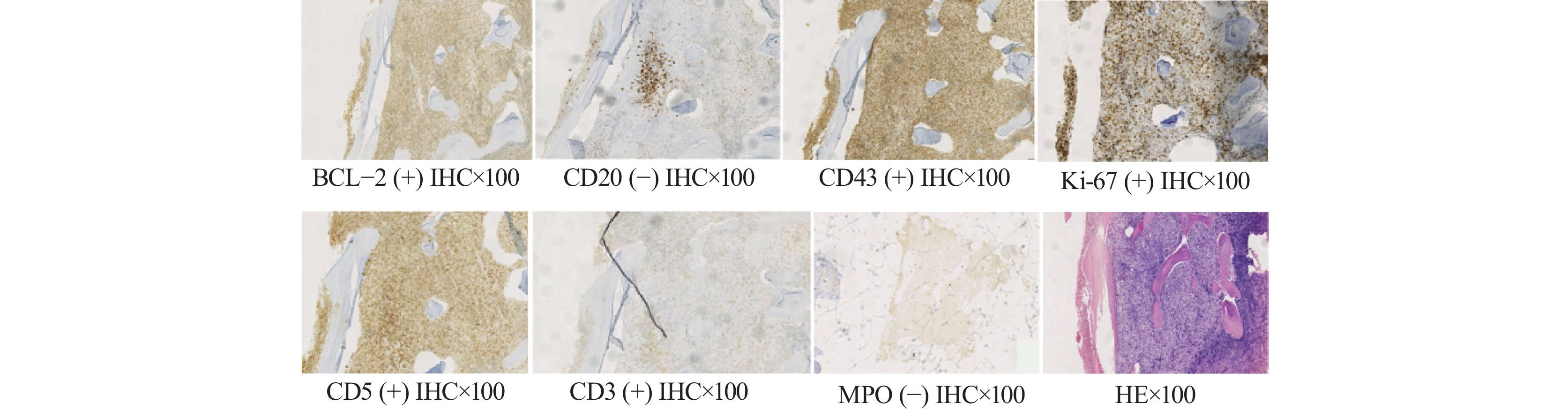
穿刺活检及病理结果显示髓腔内淋巴细胞增生性病变,细胞形态较一致,轻度异型,倾向非霍奇金T细胞淋巴瘤,免疫组织化学结果示:CD3(部分+),CD20(−),CD21(−),CD10(−),MUM-1(散在少量+)。CD23(−),CD5(+),CD43(+),CD38(少量+),cyclin D1(−),Ki-67(40%+),BCL-2(+),BCL-6(−),MPO(−),见图1。随后我们将病理组织样本送至山东大学齐鲁医院,明确诊断为外周T细胞淋巴瘤,免疫组织化学结果显示:CD79a(−),CD2(+),CD4(部分+),CD7(+),CD30(−),MPO(−),CD68(−),CD1a(−),EMA(−),TIA-1(−),CD8(少许+),CD56(−),CD123(−)。
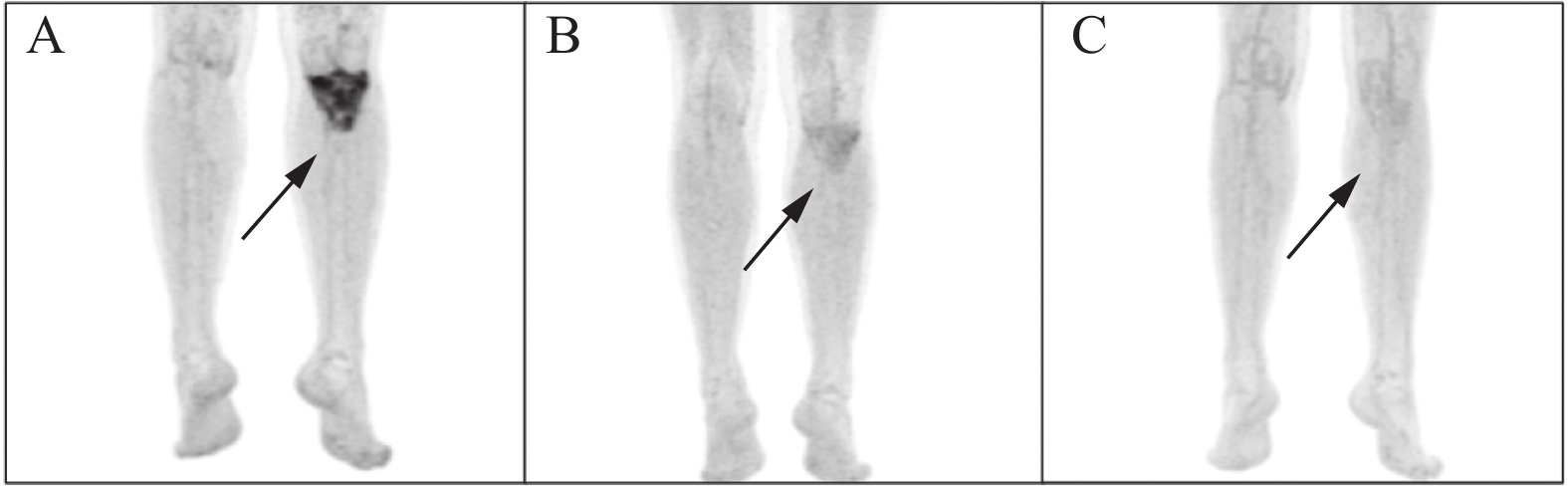
PET/CT显示左侧胫骨上段局部骨质结构不规则,密度不均匀呈溶骨及硬化混杂改变,有极强烈的局灶性摄取,FDG摄取增高,SUVmax7.8;骨髓FDG摄取弥漫略增高,SUVmax3.8;其他部位无局灶性摄取,见图2A。
综上,该患者诊断为:(1)原发骨T细胞淋巴瘤;(2)慢性上颌窦炎。Ann Arbor分期为Ⅰ期,PTCL-U预后积分为3。
2022年4月16日患者开始接受化疗,选用CHOPE方案(环磷酰胺、多柔比星脂质体、长春新碱、泼尼松龙、依托泊苷),患者第1次CHOPE方案后,左胫骨疼痛明显缓解,第二次化疗后未再出现左下肢疼痛,4个周期后, 于2022年7月11日复查PET/CT示胫骨骨破坏区FDG代谢明显减轻,SUVmax2.6,提示治疗有效,Deauville评分3分,见图2B。后给予大剂量环磷酰胺动员,BEAM方案预处理,2022年9月1日行自体造血干细胞移植,移植+12天细胞植活后顺利出仓。6个月后(2023年2月3日)复查PET/CT示左胫骨近端淋巴瘤治疗后,局部骨质结构呈不规则、密度不均匀的硬化改变,FDG摄取略增高,SUVmax1.1,见图2C。截至2024年6月,患者病情平稳,无病生存期(Disease-free survival, DFS)已2年余。
2 讨论
2.1 原发性骨淋巴瘤的定义
近年来,随着对PBL的深入了解,其定义和分类标准不断发生变化。据世界卫生组织的最新分类,原发性骨淋巴瘤被定义为一种由恶性淋巴细胞组成的、在骨内产生一个或多个病变、没有淋巴结受累或其他结外病变的骨造血肿瘤[5]。而在IELSG 14研究中,作者定义只有骨源明确的病例才能被归类为原发性骨淋巴瘤,即单个骨病变、伴或不累及区域淋巴结、或多个无淋巴结或内脏疾病的骨病变,定义为“多灶性骨性淋巴瘤”或“多骨性淋巴瘤”[6]。反之,若起源于软组织或其他器官并浸润、转移致骨受累的播散性淋巴瘤则定义为“继发性淋巴瘤”,该类病例中,骨受累被视为全身淋巴结外部位[3, 7],用于分期及预后的评估。
2.2 临床表现及诊断
PBL最常见的症状为休息后无缓解的骨痛,其他症状包括可触及的肿块、病理性骨折,极少部分可有脊髓压迫或全身性症状(包括发烧、盗汗、体重减轻等)[8]。X线片和CT检查可呈现溶骨型、硬化型、混合型或囊状型的骨质破坏,部分可出现浮冰症(大范围的骨破坏区内存在高密度的残余骨或死骨),随疾病进展,骨皮质变薄导致病理性骨折[9]。但由于PBL的临床特征及影像学检查缺乏特异性,通常难以区分疾病类别及原发部位,需与骨髓炎、骨肉瘤、软骨肉瘤、尤文氏肉瘤、恶性骨巨细胞瘤、单发骨髓瘤、骨恶性纤维组织细胞瘤及转移瘤等相关骨病鉴别。骨淋巴瘤的临床及影像学怀疑必须通过手术获取样本进行组织病理活检来明确诊断,当某些骨性部位活检较为困难,存在假阴性或延迟诊断的风险时,血清可溶性白介素-2受体(Serum soluble interleukin-2 receptor,sIL-2R)或可成为协助诊断[10]和评估预后的指标[11-12], Kitagawa等发现,sIL-2R水平与外周T细胞淋巴瘤-非特指型(Peripheral T-cell lymphoma, unspecified, PTCL-U)的活性相关,它可作为生物学预后因素[13-14]。这些发现需更多的实验数据进一步确认。
2.3 预后
PBL总体预后相对优于继发性骨受累淋巴瘤或其他类型的原发性恶性骨肿瘤,Ramadan等[15]报告了131例PBL患者的5年和10年OS分别为62%和 41%。Liu等对2 558例PLB患者进行分析,5年和10年的OS率分别为65.70%、54.40%[16]。上述数据中5年OS与其他研究结果大致相同,提示预后良好。鉴于PBL中大部分数据来自于原发性骨弥漫性大B细胞淋巴瘤(Primary bone diffuse large B-cell lymphoma, PB-DLBCL),外周T细胞淋巴瘤(PTCL)病例极少,因此,关于PTCL的良好预后尚存争议,研究人员认为,PTCL的临床行为可能因所涉及的解剖部位而异[17]。
2.4 治疗
PBL的病理分型多样,最佳治疗策略尚未达成共识,结合既往资料,联合治疗似乎能够取得更高的OS率。Beal等[18]报告了82例PBL的治疗效果,联合治疗患者较单模式治疗患者的5年OS率有所改善(95% vs. 78%),联合治疗组与单独放疗组、单独化疗组患者的5年OS率分别为95%、70%、81%。但随着治疗方案深入研究,关于放疗在PBL的生存获益和并发症仍存在许多争议[7, 19-20],放疗是否应作为PBL的标准治疗还需更多研究支持。在本例报告中,我们曾建议患者进行局部放疗,但复查局部病变一直稳定,患者家属顾虑放疗的不良反应,拒绝进行放疗。
目前国内外对PBL化疗方案的讨论主要集中在PB-DLBCL上,原发骨PTCL的化疗方案由此推演而来。T细胞淋巴瘤指南[21]指出,蒽环类化疗方案如CHOP (环磷酰胺、多柔比星、长春新碱和泼尼松)或CHOPE(依托泊苷、泼尼松、长春新碱、环磷酰胺和多柔比星)是目前最常用的一线治疗方案。结合该患者情况及既往资料,经患者及家属知情同意后,给予CHOPE方案治疗。
大剂量化疗序贯自体干细胞移植(High-dose chemotherapy sequential autologous stem cell transplantation, HDT-ASCT)在PBL中应用极少。多项研究表明[21-22],接受一线治疗达完全缓解后进行ASCT巩固治疗可为患者提供生存获益。仲凯励等报道[23],HDT-ASCT有助于提高PBL患者的PFS,但OS无统计学差异。为取得良好的预后,与患者协商后进行了ASCT。本例患者并未采用传统的联合治疗手段,而是在CHOPE方案的基础上联合HDT-ASCT,最终取得良好的治疗效果。
综上,PBL发病率相对较低,症状及影像学缺乏特异性,需慎重鉴别诊断。目前治疗方案尚未达成共识,还需更多前瞻性研究来确定最佳治疗策略,本案例中的患者接受了4周期CHOPE方案后进行HDT-ASCT,目前已取得了2年的PFS,印证了HDT-ASCT可以改善原发骨PTCL的结论,这对于后续病例的治疗具有启示意义。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:李 娜:资料收集,文章撰写王欣如、李强:获取图像资料,审阅文章 -
-
[1] Liu M, Liu B, Han F, et al. Primary bone lymphoma of the left radius: a case report and related literature review[J]. Eur J Med Res, 2014, 19(1): 19. doi: 10.1186/2047-783X-19-19
[2] Zhao XF, Young KH, Frank D, et al. Pediatric primary bone lymphoma-diffuse large B-cell lymphoma: Morphologic and immunohistochemical characteristics of 10 cases[J]. Am J Clin Pathol, 2007, 127(1): 47-54.
[3] Messina C, Christie D, Zucca E, et al. Primary and secondary bone lymphomas[J]. Cancer Treat Rev, 2015, 41(3): 235-246. doi: 10.1016/j.ctrv.2015.02.001
[4] Wu H, Zhang L, Shao H, et al. Prognostic significance of soft tissue extension, international prognostic index, and multifocality in primary bone lymphoma: a single institutional experience[J]. Br J Haematol, 2014, 166(1): 60-68. doi: 10.1111/bjh.12841
[5] Choi JH, Ro JY. The 2020 WHO Classification of Tumors of Bone: An Updated Review[J]. Adv Anat Pathol, 2021, 28(3): 119-138. doi: 10.1097/PAP.0000000000000293
[6] Bindal P, Desai A, Delasos L, et al. Primary Bone Lymphoma: A Case Series and Review of Literature[J]. Case Rep Hematol, 2020, 2020: 4254803.
[7] Tazi I, Benmoussa A, Boufarissi FZ, et al. Adult non-Hodgkin bone lymphomas[J]. Bull Cancer, 2021, 108(4): 424-434. doi: 10.1016/j.bulcan.2020.12.010
[8] Barbon DA, Williams TP, Hulse HB, et al. Primary lymphoma of bone of the little finger: a case report and review of the literature[J]. Skeletal Radiol, 2024, 53(8): 1645-1650. doi: 10.1007/s00256-024-04576-9
[9] 邱丽萍, 赵小英. 原发性骨淋巴瘤的研究进展[J]. 实用肿瘤杂志, 2018, 33(5): 470-475. [Qiu LP, Zhao XY. The progress of primary bone lymphoma[J]. Shi Yong Zhong Liu Za Zhi, 2018, 33(5): 470-475.] Qiu LP, Zhao XY. The progress of primary bone lymphoma[J]. Shi Yong Zhong Liu Za Zhi, 2018, 33(5): 470-475.
[10] Akahane T, Shimizu T, Isobe KI, et al. Serum soluble interleukin-2 receptor levels in patients with malignant lymphoma of bone[J]. J Orthop Sci, 2009, 14(3): 248-252. doi: 10.1007/s00776-009-1335-x
[11] Yabe H, Ueno H, Ochi K, et al. Possible Clinical Significance of Serum Soluble Interleukin-2 Receptor Level in Primary Bone Lymphoma: Two Case Reports[J]. Case Rep Oncol, 2011, 4(1): 125-131. doi: 10.1159/000325399
[12] Senjo H, Kanaya M, Izumiyama K, et al. Serum level of soluble interleukin-2 receptor is positively correlated with metabolic tumor volume on 18F-FDG PET/CT in newly diagnosed patients with diffuse large B-cell lymphoma[J]. Cancer Med, 2019, 8(3): 953-962. doi: 10.1002/cam4.1973
[13] Kitagawa J, Hara T, Tsurumi H, et al. Serum-soluble interleukin-2 receptor (sIL-2R) is an extremely strong prognostic factor for patients with peripheral T-cell lymphoma, unspecified (PTCL-U)[J]. J Cancer Res Clin Oncol, 2009, 135(1): 53-59. doi: 10.1007/s00432-008-0440-0
[14] Morita-Fujita M, Katoh D, Shimomura Y, et al. High Level of Serum Soluble Interleukin-2 Receptor Is Associated With Poor Survival in Patients With First Relapsed or Refractory Peripheral T-Cell Lymphoma, Not Otherwise Specified: A Retrospective Study[J]. Clin Lymphoma Myeloma Leuk, 2019, 19(7): e337-e342. doi: 10.1016/j.clml.2019.03.031
[15] Ramadan KM, Shenkier T, Sehn LH, et al. A clinicopathological retrospective study of 131 patients with primary bone lymphoma: a population-based study of successively treated cohorts from the British Columbia Cancer Agency[J]. Ann Oncol, 2007, 18(1): 129-135. doi: 10.1093/annonc/mdl329
[16] Liu CX, Xu TQ, Xu L, et al. Primary lymphoma of bone: a population-based study of 2558 patients[J]. Ther Adv Hematol, 2020, 11: 2040620720958538.
[17] Yu S, Xu J. Imaging Features of Primary T Cell Lymphoma in Bone: A Case Report and Review of Literature[J]. Front Oncol, 2021, 11: 690819. doi: 10.3389/fonc.2021.690819
[18] Beal K, Allen L, Yahalom J. Primary bone lymphoma: treatment results and prognostic factors with long-term follow-up of 82 patients[J]. Cancer, 2006, 106(12): 2652-2656. doi: 10.1002/cncr.21930
[19] Nguyen CB, Li M, Verstovsek G, et al. Primary bone lymphoma of the ilium successfully treated without radiation[J]. Clin Case Rep, 2020, 8(12): 3130-3133.
[20] Wang HH, Dai KN, Li AB. A Nomogram Predicting Overall and Cancer-Specific Survival of Patients with Primary Bone Lymphoma: A Large Population-Based Study[J]. Biomed Res Int, 2020, 2020: 4235939. doi: 10.1155/2020/4235939
[21] Horwitz SM, Ansell S, Ai WZ, et al. T-Cell Lymphomas, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2022, 20(3): 285-308. doi: 10.6004/jnccn.2022.0015
[22] Rodriguez J, Conde E, Gutierrez A, et al. The results of consolidation with autologous stem-cell transplantation in patients with peripheral T-cell lymphoma (PTCL) in first complete remission: the Spanish Lymphoma and Autologous Transplantation Group experience[J]. Ann Oncol, 2007, 18(4): 652-657. doi: 10.1093/annonc/mdl466
[23] 仲凯励, 曹宝平, 郭晓川, 等. 初治原发性骨淋巴瘤患者的临床特征和长期预后分析[J]. 中国实验血液学杂志, 2022, 30(1): 126-130. [Zhong KL, Cao BP, Guo XC, et al. Clinical Characteristics and Long-term Prognosis Analysis of Patients with Primary Bone Lymphoma[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2022, 30(1): 126-130.] Zhong KL, Cao BP, Guo XC, et al. Clinical Characteristics and Long-term Prognosis Analysis of Patients with Primary Bone Lymphoma[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2022, 30(1): 126-130.



 下载:
下载: