Effects of Sodium Cantharidinate on Proliferation and Apoptosis of Gastric Cancer Cells by Inhibiting JAK2/STAT3 Pathway
-
摘要:目的
研究斑螯酸钠(SC)通过JAK2/STAT3通路对胃癌细胞增殖及凋亡的调控作用。
方法用不同浓度SC(0.25、0.5、1.0、2.0、4.0、8.0、16.0 μmol/L)处理胃癌细胞株SGC-7901,转染对照质粒或JAK2质粒。处理48 h后检测细胞存活率、凋亡率及p-JAK2、p-STAT3、p-p38、p-ERK、p-JNK的表达水平。
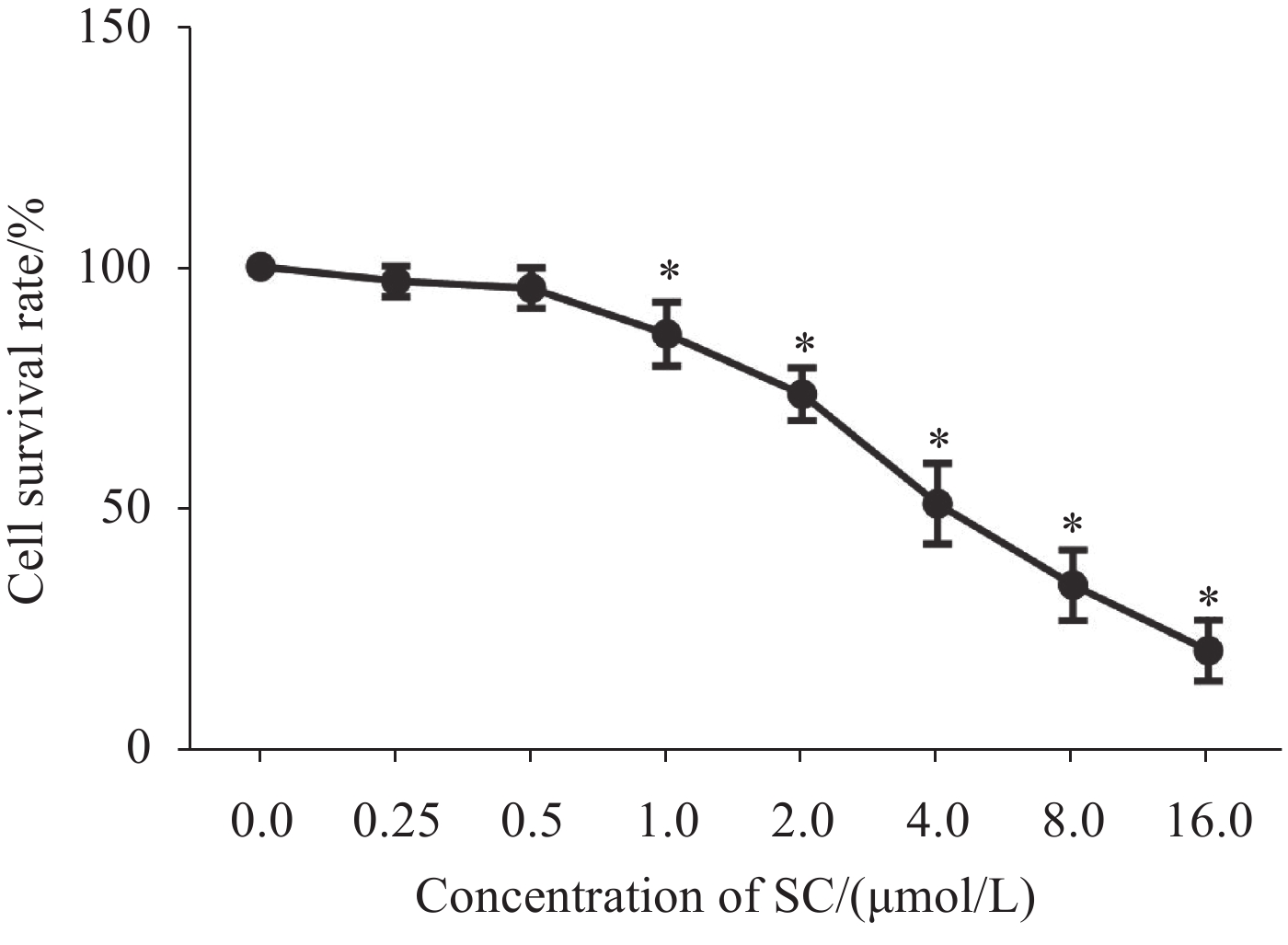
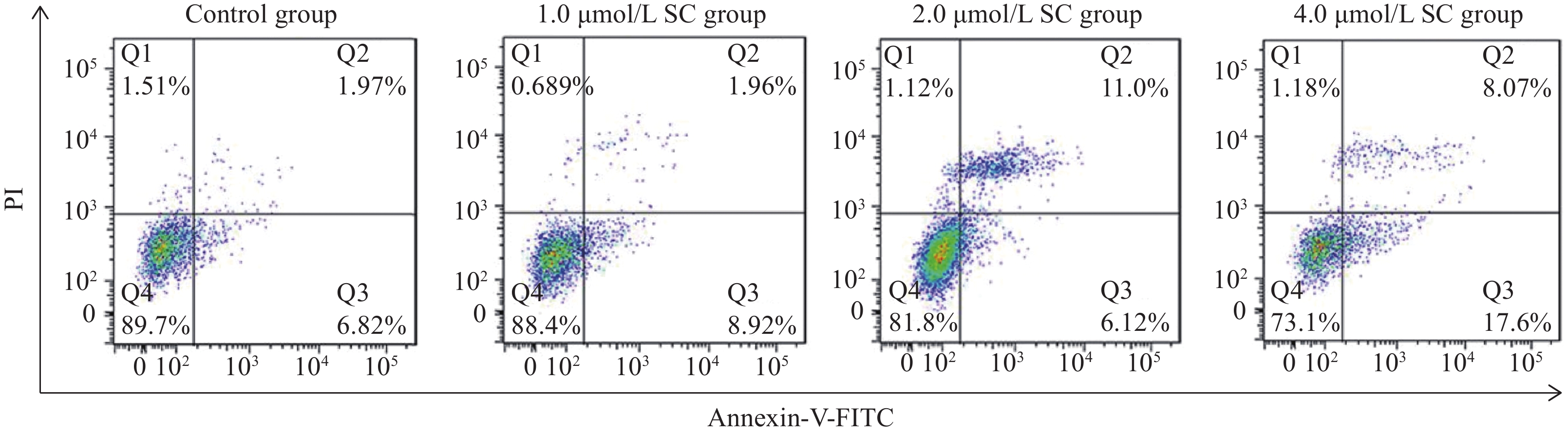
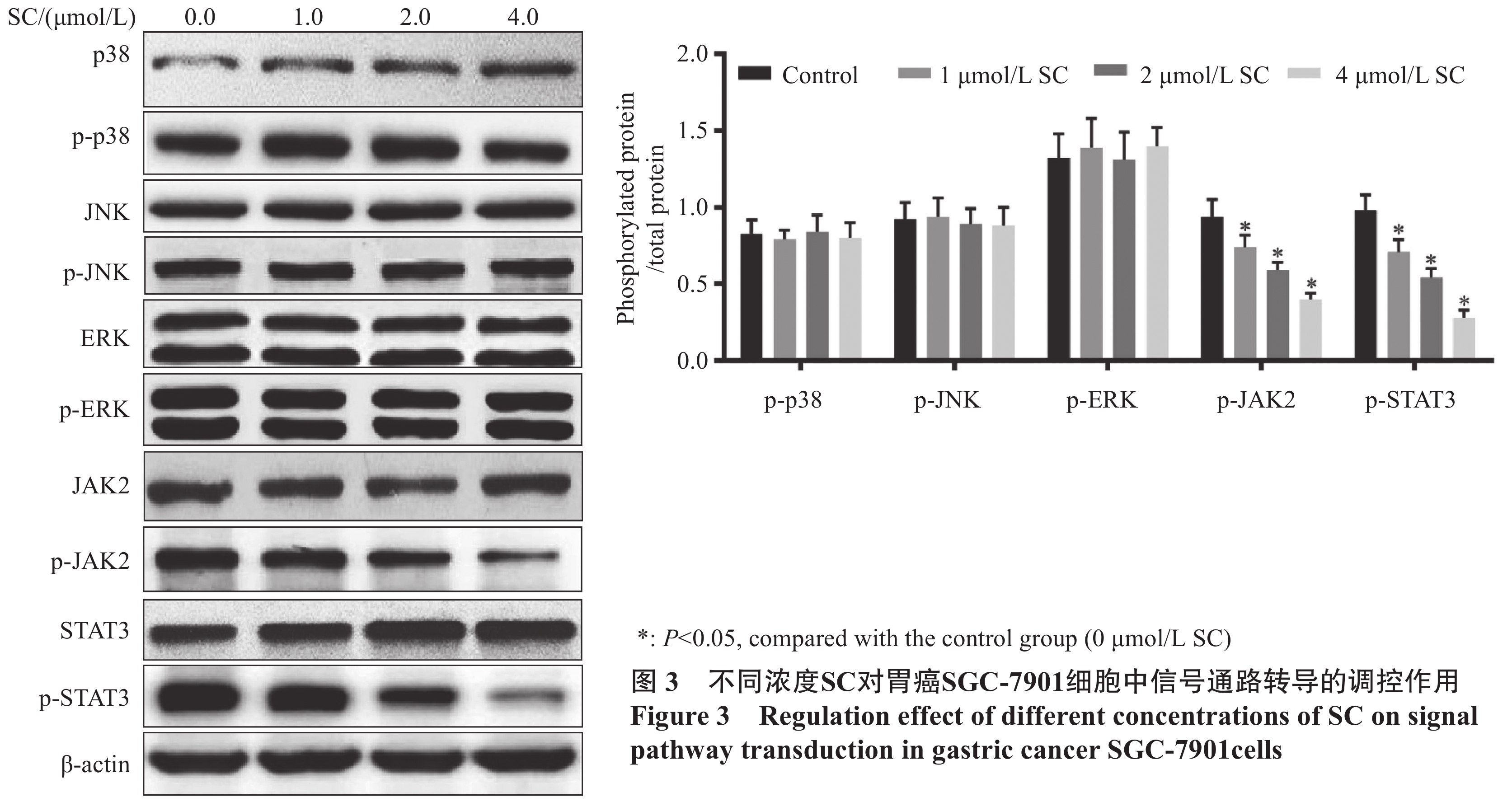
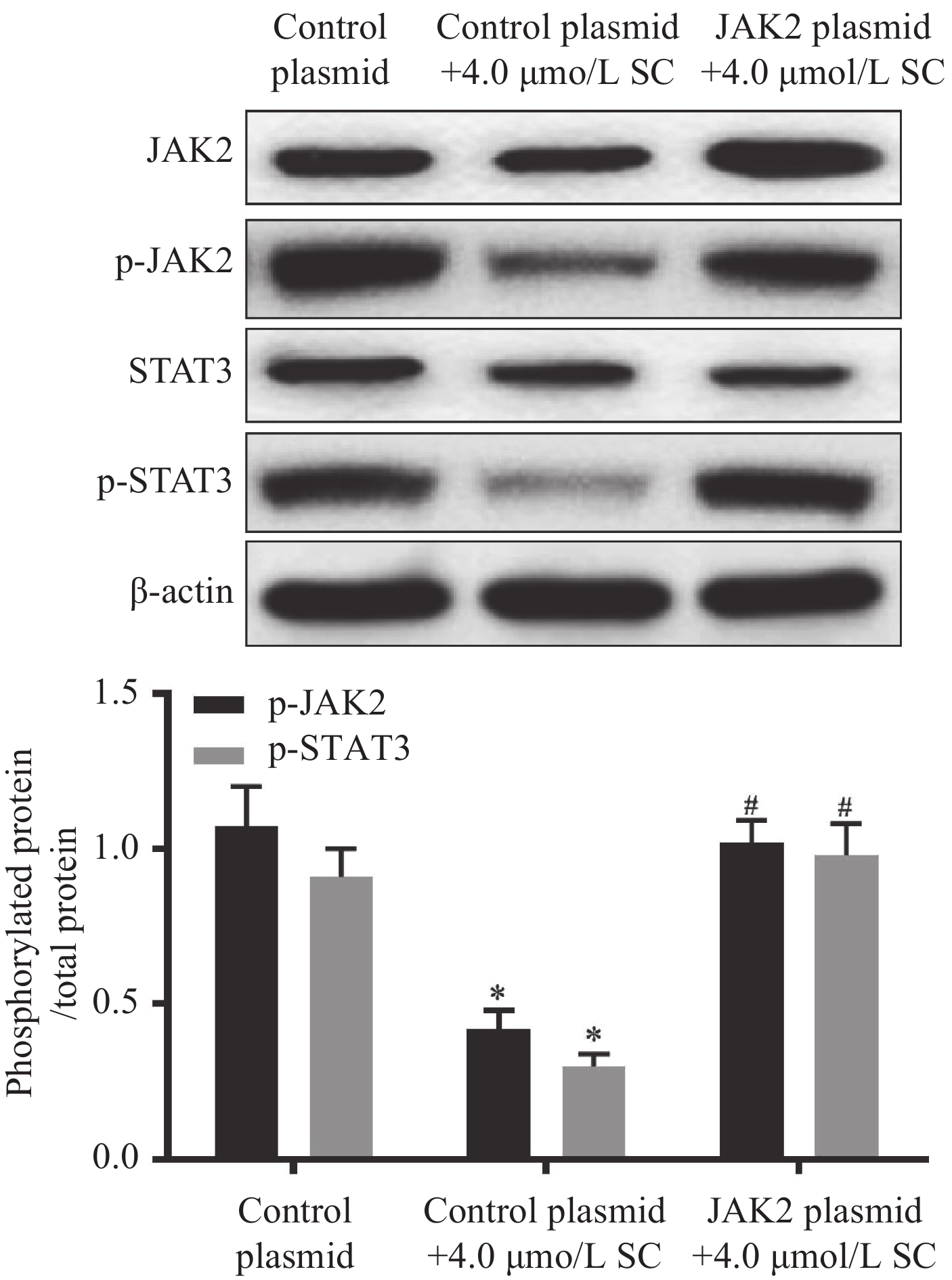
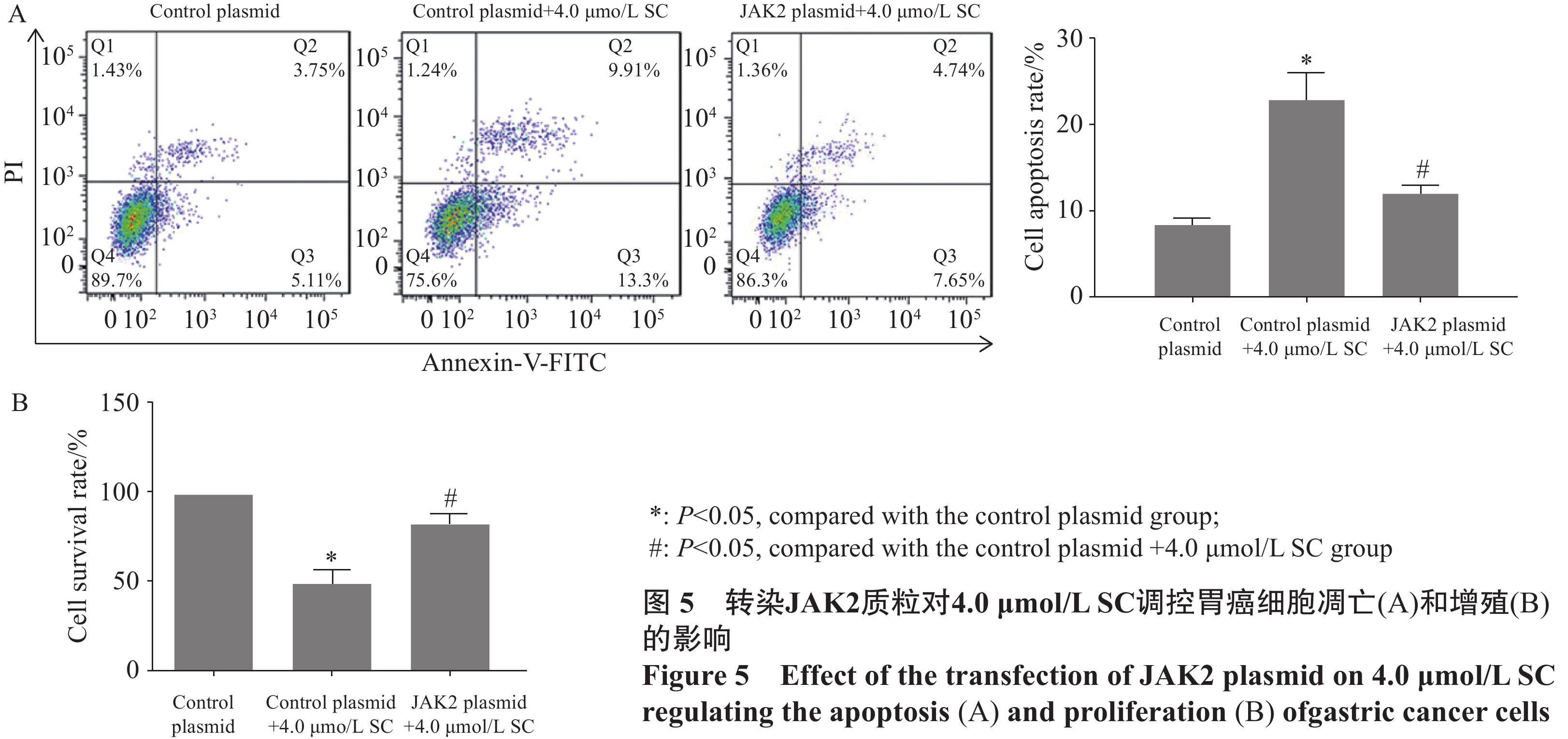
结果1.0、2.0、4.0、8.0、16.0 μmol/L SC处理后,胃癌SGC-7901细胞增殖受到抑制。随着SC浓度增加,细胞存活率降低(P<0.05);选择SC剂量1.0、2.0、4.0 μmol/L进行后续实验。与对照组比较,1.0 μmol/L SC组的细胞凋亡率无显著变化(P>0.05),2.0、4.0 μmol/L SC组的细胞凋亡率显著增加(P<0.05);1.0、2.0、4.0 μmol/L SC组的p-JAK2、p-STAT3表达水平显著降低(P<0.05),p-p38、p-ERK、p-JNK的表达水平无显著变化(P>0.05);4.0 μmol/L SC处理的同时转染JAK2质粒,细胞中p-JAK2、p-STAT3的表达水平及细胞存活率增加、凋亡率降低(P<0.05)。
结论SC能抑制胃癌SGC-7901细胞生长、促进胃癌细胞凋亡,其机制可能与抑制JAK2/STAT3通路激活有关。
-
关键词:
- 胃癌 /
- 斑螯酸钠 /
- 增殖 /
- 凋亡 /
- JAK2/STAT3通路
Abstract:ObjectiveTo study the effects of sodium cantharidinate (SC) on the proliferation and apoptosis of gastric cancer cells through JAK2/ STAT3 pathway.
MethodsGastric cancer cell line SGC-7901 was cultured and treated with different concentrations of SC (0.25, 0.5, 1.0, 2.0, 4.0, 8.0, and 16.0 μmol/L) and then transfected with control plasmid or JAK2 plasmid. Cell survival rate, apoptosis rate, and the expression levels of p-JAK2, p-STAT3, p-p38, p-ERK, and p-JNK were detected after 48 h of treatment.
ResultsThe results indicated that 1.0, 2.0, 4.0, 8.0, and 16.0 μmol/L of SC inhibited cell proliferation, and the survival rate decreased with an increase in SC concentration (P<0.05). SC doses of 1.0, 2.0, and 4.0 μmol/L were selected for the subsequent experiments. Compared with the control group, the apoptosis rate of the 1.0 μmol/L SC group exhibited no significant difference (P>0.05), while those of the 2.0 and 4.0 μmol/L SC groups increased significantly (P<0.05). The expression levels of p-JAK2 and p-STAT3 significantly decreased (P<0.05), while no significant difference was noted in the expression levels of p-p38, p-ERK, and p-JNK (P>0.05) in the 1.0, 2.0, and 4.0 μmol/L SC groups. The JAK2 plasmid was transfected simultaneously with the 4.0 μmol/L SC treatment; the expression levels of p-JAK2 and p-STAT3 and the survival rate increased, whereas the apoptosis rate decreased (P<0.05).
ConclusionSC inhibits the growth and promotes the apoptosis of gastric cancer cells, and its mechanism may be related to the inhibition of JAK2/STAT3 pathway activation.
-
Key words:
- Gastric cancer /
- Sodium cantharidininate /
- Proliferation /
- Apoptosis /
- JAK2/STAT3 pathway
-
0 引言
软组织肉瘤(soft tissue sarcoma, STS)是一种罕见的实体肿瘤,手术是其主要的治疗方法,但由于肿瘤侵袭性、浸润性生长的特点,重要的血管和神经常受侵,根治性切除会造成严重的功能障碍,如截肢或关节离断等。有研究显示,保肢手术辅助放疗与截肢手术具有相似的总生存率,因此已成为肢体软组织肉瘤的标准治疗方法。术中放疗是在手术中切除肿瘤后对瘤床、残留肿瘤进行大剂量照射的治疗方法。移动式术中光子治疗仪(INTRABEAM)使用的射线为低能X线,可应用于普通手术室。目前国内尚无INTRABEAM在软组织肉瘤保肢治疗领域应用的相关报道。甘肃省人民医院自2020年7月—2021年10月采用保肢手术联合INTRABEAM术中放疗治疗4例软组织肉瘤,现报告如下。
1 资料与方法
1.1 病例资料
患者一般资料见表 1,患者均为男性,年龄12~58岁,平均年龄39.5岁;病变位于大腿3例,手掌1例;原发3例,复发1例。病理类型:滑膜肉瘤2例,纤维肉瘤1例,上皮样肉瘤1例。美国癌症联合委员会分期T2-3N0M0~T2N1M1。4例患者均未行术前放疗,2例患者术前分别接受新辅助化疗3、4周期,1例术前行靶向治疗。3例肿瘤累及股血管神经者无明显症状,1例肿瘤位于手掌者局部疼痛明显。4例患者手术均无法达到安全的外科边界,建议行关节离断或截肢,患者及家属要求行保肢治疗。
表 1 患者一般资料Table 1 General materials of patients
1.2 手术方法及术中放疗
手术方法:根据肿瘤所在部位选择相应手术入路,手部肿瘤取肿物周缘1 cm环形切口切除肿瘤,保留屈肌腱,手术创面一期负压封闭引流,二期游离植皮。3例累及股血管神经者将股血管神经剥离后切除肿瘤,局部肌瓣转移保护股血管神经,创面一期缝合。3例为R2切除,1例为R0切除。
术中放疗方法:术中放疗设备为INTRABEAM PRS500(carl. zeiss surgical. Dberkochen.德国),根据瘤床及肿瘤残留区选择大小合适的球形或平板施用器,设备自检无偏差后将施用器安装在X射线源上,移动底座及调整机械臂使施用器紧贴瘤床及肿瘤残留区,周围正常组织用盐水纱布覆盖保护,单次放疗剂量为5.90~16 Gy。其中我院开展的第一例软组织肉瘤术中放疗患者,因肿瘤较大,且包绕股血管神经,将股血管神经从肿物表面剥离后切除肿物,为R2切除,切除后瘤床及股血管神经的腹侧及背侧各放疗一次,见图 1。平均每位患者放疗剂量为16.46 Gy,单次放疗时间为23 min 27 s~50 min 10 s,平均每位患者放疗时间53 min 24 s,施用器大小为5.0~6.0 cm。术后1例患者发生伤口愈合不良,1例患者一月后发生伤口深部组织感染。1例患者术后行外放疗,剂量为30 Gy。1例患者因同期病房内有1例外放疗导致伤口感染经久不愈而行截肢的患者,担心出现同样的结果,故未行外放疗。1例患者切缘阴性,且为低度恶性肿瘤,未进行放化疗,1例患者为姑息性手术,术后靶向药物联合化疗治疗,另2例患者完成6周期化疗。
2 结果
术后随访时间6~22个月,平均随访10.9个月。1例患者2个月后原位复发并出现腋窝淋巴结转移,术前存在肺转移,未行再次手术治疗,继续靶向药物治疗联合化疗,另3例患者随访期间局部未见复发,1例患者术后10月出现肺部单发结节,行胸腔镜下肺段切除,术后病理证实为滑膜肉瘤肺转移。
3 讨论
软组织肉瘤约占成人恶性肿瘤的1%,儿童恶性肿瘤约15%,最常发生于肢体、腹膜后、躯干、头颈部等[1]。软组织肉瘤中20%表现为生长迅速、疼痛明显的肿块,大部分患者早期容易忽视,待就诊时肿瘤体积往往较大,甚至已侵犯血管、神经等。CSCO软组织肉瘤诊疗指南对于软组织肉瘤累及主要血管者,Ⅰ级推荐为截肢,但截肢会导致患者部分机体功能丧失,给患者的生活及精神心理带来严重影响。随着肿瘤治疗理念和辅助治疗的改进,软组织肉瘤的手术切缘距离逐渐缩小,最大程度保留肢体功能的R0切除是骨肿瘤科医生争取的目标,对于肉瘤累及重要结构的患者,为了保肢,阳性切缘是可以接受的,且辅助放疗可提高局部控制率[2-3]。Call等[4]回顾性分析了61例上肢软组织肉瘤患者接受手术+术术放疗(电子线放疗或高剂量近距离放疗)+术前或术后外放疗治疗的结果,R0切除50例,R1和R2分别为10例和1例;5年的局部控制率R1和R2为100%,R0为89%,5年的总生存率分别为73%和71%,切缘阴性和切缘阳性患者5年局部控制率和总生存率差异均无统计学意义。
近距离后装治疗是术中在肿瘤切除后将导管植入瘤床,术后恢复期后将放射源放置在导管中进行放射治疗,可以单独也可作为外照射治疗的补充。刘泽等[5]回顾性分析55例行广泛手术切除治疗的软组织肉瘤患者,26例联合后装及外照射治疗,29例单纯外照射治疗,平均随访期限为46个月,联合后装放疗组复发率为7.69%,3例患者出现伤口感染及愈合不良。未联合后装组复发率为20.69%,2例患者出现伤口感染及愈合不良,两者复发率差异有统计学意义(P < 0.05),伤口并发症差异无统计学意义。张超等[6]回顾性分析手术联合后装放疗治疗的30例重要神经血管周围肉瘤患者,术后5天行后装放疗,总剂量40 Gy,2年生存率为96.7%。肿瘤局部控制率为93.3%,二级及以上放疗并发症发生率为16.7%。认为手术联合后装治疗能提高局部控制率及保肢率,但并发症发生率较高。
Sarria等[7]回顾性分析了31例接受手术+INTRABEAM术中放疗治疗的软组织肉瘤患者的结果,术中放疗剂量为5~20 Gy,15例患者接受了术后外放疗,9例接受了全身治疗。中位随访时间4.88年,中位总无进展生存期为11.0个月,7例复发,1例在10个月后发生了远处转移。原发软组织肉瘤的患者在22个月后只有1例局部复发,复发组有8例。5年总生存率为94.7%,2例患者发生了急性神经痛,6例患者出现晚期神经痛,未发生伤口相关的并发症。
本组病例中,1例患者于术后1个月发生伤口深部组织感染,手术清创及抗感染治疗后痊愈,术中见伤口内大量血凝块,瘤床周围部分肌肉组织坏死,该患者为第一例行术中放疗的患者,术中行3次放疗,总剂量26.84 Gy,总放疗时间112 min 6 s,术后深部组织感染考虑与放疗剂量大导致肌肉坏死及手术时间长有关。此后3例患者均行单次放疗,1例患者伤口愈合不良,与手部软组织少、肌腱外露及缺乏良好的植皮创面有关。末次随访时,4例中有3例患者肢体功能良好,1例患者肢体功能差。
近距离后装治疗与术中放疗治疗软组织肉瘤孰优孰劣尚无相关文献报道。由于首次本研究将INTRABEAM应用于软组织肉瘤,根据现有经验,总结以下体会:(1)球形施用器最大直径为5 cm,平板施用器最大直径为6 cm,当肿瘤直径超过5 cm时无法照射整个瘤床,建议尽可能选用大的施用器对可疑或肉眼可见的阳性区域进行照射;(2)建议行单次放疗,多次放疗可造成局部剂量叠加,导致组织损伤;(3)制定放疗计划时,需要骨肿瘤科医生、放疗科医生和物理师共同参与,根据术中情况随时调整放疗计划。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:刘兴红:研究设计、实验开展、论文写作刘瑾、陈海艳:数据收集和统计分析郭宇航:研究和实验指导、论文审校 -
-
[1] 左婷婷, 郑荣寿, 曾红梅, 等. 中国胃癌流行病学现状[J]. 中国肿瘤临床, 2017, 44(1): 52-58. [Zuo TT, Zheng RS, Zeng HM, et al. Epidemiology of stomach cancer in China[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(1): 52-58.] doi: 10.3969/j.issn.1000-8179.2017.01.881 Zuo TT, Zheng RS, Zeng HM, et al. Epidemiology of stomach cancer in China[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(1): 52-58. doi: 10.3969/j.issn.1000-8179.2017.01.881
[2] Lin Y, Zheng Y, Wang HL, et al. Global Patterns and Trends in Gastric Cancer Incidence Rates (1988-2012) and Predictions to 2030]J]. Gastroenterology, 2021, 161(1): 116-127. e8.
[3] 甘云辉, 李应军, 李凤霞, 等. 斑蝥酸钠维生素B6注射液联合SOX方案对晚期胃癌患者miR-18a、miR-34a及免疫细胞计数的影响[J]. 现代消化及介入诊疗, 2021, 26(12): 1551-1555. [Gan YH, Li YJ, Li FX, et al. Effects of sodium cantharidinate and vitamin B6 injection combined with SOX regimen on miR-18a, miR-34a and immune cell counts in patients with advanced gastric cancer[J]. Xian Dai Xiao Hua Ji Jie Ru Zhen Liao, 2021, 26(12): 1551-1555.] doi: 10.3969/j.issn.1672-2159.2021.12.016 Gan YH, Li YJ, Li FX, et al. Effects of sodium cantharidinate and vitamin B6 injection combined with SOX regimen on miR-18a, miR-34a and immune cell counts in patients with advanced gastric cancer[J]. Xian Dai Xiao Hua Ji Jie Ru Zhen Liao, 2021, 26(12): 1551-1555. doi: 10.3969/j.issn.1672-2159.2021.12.016
[4] Zhu M, Liu X, Zhou C, et al. Effect of sodium cantharidinate/vitamin B6 injection on survival, liver function, immune function, and quality of life in patients with hepatocellular carcinoma: Protocol for a meta-analysis[J]. Medicine (Baltimore), 2020, 99(34): e21952. doi: 10.1097/MD.0000000000021952
[5] Xiao Z, Wang C, Tan Z, et al. Clinical efficacy and safety of sodium cantharidinate plus chemotherapy in non-small-cell lung cancer: A systematic review and meta-analysis of 38 randomized controlled trials[J]. J Clin Pharm Ther, 2019, 44(1): 23-38. doi: 10.1111/jcpt.12761
[6] Chen X, Zhou M, Fan W, et al. Combination of Sodium Cantharidinate with Cisplatin Synergistically Hampers Growth of Cervical Cancer[J]. Drug Des Devel Ther, 2021, 13(15): 171-183.
[7] 梁金龙, 谢铭, 杨雪峰, 等. 斑蝥素、斑蝥酸钠和斑蝥酸镁抑制人胃癌 SGC -7901细胞增殖的研究[J]. 安徽医药, 2016, 20(3): 441-444. [Liang JL, Xie M, Yang XF, et al. Research on Cantharidin, Sodium cantharidinate and magnesium cantharidate Inhibition of proliferation of human gastric cancer cell SGC-7901[J]. Anhui Yi Yao, 2016, 20(3): 441-444.] doi: 10.3969/j.issn.1009-6469.2016.03.09 Liang JL, Xie M, Yang XF, et al. Research on Cantharidin, Sodium cantharidinate and magnesium cantharidate Inhibition of proliferation of human gastric cancer cell SGC-7901[J]. Anhui Yi Yao, 2016, 20(3): 441-444. doi: 10.3969/j.issn.1009-6469.2016.03.09
[8] Tao R, Sun WY, Yu DH, et al. Sodium cantharidinate induces HepG2 cell apoptosis through LC3 autophagy pathway[J]. Oncol Rep, 2017, 38(2): 1233-1239. doi: 10.3892/or.2017.5779
[9] Kong DL, Liu Y, Wang JY, et al. Sodium cantharidinate suppresses human osteosarcoma MG-63 cell proliferation and induces cell cycle arrest by inhibition of PI3K/AKT activation[J]. Oncol Rep, 2019, 41(2): 1351-1358.
[10] He S, Liao G, Liu Y, et al. Overexpression of STAT3/pSTAT3 was associated with poor prognosis in gastric cancer: a meta-analysis[J]. Int J Clin Exp Med, 2015, 8(11): 20014-20023.
[11] Lee H, Kim WJ, Kang HG, et al. Upregulation of LAMB1 via ERK/c-Jun Axis Promotes Gastric Cancer Growth and Motility[J]. Int J Mol Sci, 2021, 22(2): 626. doi: 10.3390/ijms22020626
[12] Li Y, Li D, Zhao M, et al. Long noncoding RNA SNHG6 regulates p21 expression via activation of the JNK pathway and regulation of EZH2 in gastric cancer cells[J]. Life Sci, 2018, 208: 295-304. doi: 10.1016/j.lfs.2018.07.032
[13] Yuan K, Ye J, Liu Z, et al. Complement C3 overexpression activates JAK2/STAT3 pathway and correlates with gastric cancer progression[J]. J Exp Clin Cancer Res, 2020, 39(1): 9. doi: 10.1186/s13046-019-1514-3
[14] Chen JF, Wu P, Xia R, et al. STAT3-induced lncRNA HAGLROS overexpression contributes to the malignant progression of gastric cancer cells via mTOR signal-mediated inhibition of autophagy[J]. Mol Cancer, 2018, 17(1): 6. doi: 10.1186/s12943-017-0756-y
[15] Wei KL, Chou JL, Chen YC, et al. Epigenetic Silencing of STAT3-Targeted miR-193a, by Constitutive Activation of JAK/STAT Signaling, Leads to Tumor Progression Through Overexpression of YWHAZ in Gastric Cancer[J]. Front Oncol, 2021, 11: 575667. doi: 10.3389/fonc.2021.575667
[16] Yang H, Xu W. STAT3 promotes peritoneal metastasis of gastric cancer by enhancing mesothelial-mesenchymal transition[J]. Biol Chem, 2021, 402(6): 739-748. doi: 10.1515/hsz-2021-0120



 下载:
下载: