Effect of SV2B Overexpression on Biological Behavior of Glioblastoma and Its Mechanism
-
摘要:目的
探讨SV2B过表达对胶质母细胞瘤细胞生长、侵袭及凋亡的影响及其潜在机制。
方法通过慢病毒转染胶质母细胞瘤u87、u251细胞构建SV2B过表达组,另设空白对照组。CCK-8实验、细胞划痕实验、Transwell侵袭和迁移实验分别检测过表达SV2B对u87、u251细胞增殖、迁移和侵袭能力的影响, qRT-PCR和Westen blot检测SV2B蛋白表达水平。
结果与空白对照组相比,过表达SV2B组胶质母细胞瘤细胞增殖、侵袭及迁移能力显著降低(P<0.05)。
结论SV2B过表达显著抑制胶质母细胞瘤细胞增殖、侵袭和迁移能力。
Abstract:ObjectiveTo analyze the effect of SV2B overexpression on the growth, invasion, and apoptosis of glioblastoma cells, and to explore its potential mechanism.
MethodsWe transfected glioblastoma u87 and u251 cells with lentivirus as SV2B overexpression group. And blank control group was set up. The effects of SV2B overexpression on the proliferation, migration, and invasion of u87 and u251 cells were detected by CCK-8 assay, cell scratch assay, Transwell invasion, and Transwell migration assay. The expression level of SV2B protein was detected by qRT-PCR and Western blot.
ResultsCompared with the blank control group, the proliferation, invasion, and migration abilities of u87 and u251 cells in SV2B overexpression group were significantly reduced (P<0.05).
ConclusionSV2B overexpression significantly inhibits the proliferation, invasion, and migration abilities of glioblastoma cells.
-
Key words:
- Glioblastoma /
- SV2B /
- Tumor prognosis /
- Malignant progression
-
0 引言
胶质瘤是中枢神经系统常见的原发性恶性肿瘤,预后不良[1]。目前推荐的胶质瘤治疗方法包括手术、新辅助治疗、放疗和化疗。然而,神经胶质瘤具有高度侵袭性和迁移性,边界不清晰,通过手术很难完全切除肿瘤[2],中位生存期<14.6个月,长期生存更是少数[2-3]。此外,放疗和化疗的不良反应也给患者的预后及生存质量带来重大挑战。近年来免疫疗法在恶性黑色素瘤等实体肿瘤的治疗中表现出了较好的有效性,各种免疫相关靶点相继被开发并取得一定的成果[4]。遗憾的是,这些免疫抑制靶点(如PD-1和PD-L1抑制剂)在治疗神经胶质瘤时并未表现出明显的改善,这可能与中枢神经系统特殊的免疫抑制微环境相关[5-6]。探索胶质瘤中能被特异性识别的靶点或许可以改变当前现状。目前已经开发了许多治疗胶质瘤的潜在靶点,并利用这些靶点基因成功构建了各种预后模型,但是其中一些仍需要进行进一步验证。
SV2B是一种膜糖蛋白,主要在神经系统中表达,在神经传递过程中具有重要的功能[7]。近年来的研究表明,SV2B基因在恶性肿瘤的进展中发挥重要作用,包括促进肿瘤细胞增殖、迁移、侵袭[8]。在我们之前的研究中,发现胶质瘤患者中SV2B基因的表达与预后密切相关[7],但上述结论仍需要细胞实验、动物实验进行验证。此外,我们还需要进一步探究SV2B在胶质瘤进展过程中所发挥的作用及相关机制。本研究利用多个数据库内容进一步分析了SV2B与胶质瘤患者预后、病情进展、各项临床指标的关系,然后分析SV2B富集的功能通路及可能存在调控关系的上下游相关基因,并探讨了SV2B及相关基因与胶质瘤免疫细胞浸润的相关性。最后通过体外或细胞周期实验探讨SV2B对胶质瘤细胞增殖、迁移、侵袭和活体内的影响。
1 材料与方法
1.1 材料
胶质母细胞瘤u87、u251细胞株(武汉普诺赛生物科技有限公司);慢病毒由广州艾基生物科技有限公司包装;胎牛血清、DMEM培养基均购自美国Gibco公司;胰蛋白酶、PBS、青-链霉素混合液(Penicillin-Streptomycin Solution)均购自北京赛文生物科技有限公司;细胞培养皿、Transwell小室和人工基底膜基质凝胶均购自美国Coning公司;反转录试剂盒、荧光定量试剂盒均购自日本TaKaRa公司;4%多聚甲醛、0.1%结晶紫水溶液均购自北京索莱宝生物科技有限公司。
1.2 方法
1.2.1 数据下载与整理
从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中共检索到29 338个人类脑肿瘤芯片。选取三个包含胶质母细胞瘤和正常脑组织信息的基因数据芯片GSE2223、GSE4290和GSE50161。GSE2223基于GPL1833平台(SHFK),而GSE4290和GSE50161来自GPL570平台([HG-U133 Plus 2] Affymetrix人类基因组U133 Plus 2.0阵列)。从中国胶质瘤基因组图谱数据库(CGGA,http://www.cgga.org.cn/download.jsp)下载了mRNAseq 693和mRNAseq 325数据集。对全部神经胶质瘤样本的mRNA表达数据和临床特征进行筛选与整理,选出信息完善的749例作为样本主体[9-10]。对表达数据使用log2处理(rt=log2(rt+1)),以校正批次效应,并与相应的临床数据合并。
1.2.2 细胞培养
将胶质u251、u87细胞株置于DMEM+10%FBS+1%青-链霉素混合液(武汉普诺赛,PB180120)培养基中,在37℃、5%CO2的培养箱中培养。构建稳定的细胞系:用包装好的慢病毒pCDH-CMV-Homo-SV2B-EF1-copGFP-T2A-Puro感染u251和u87细胞,并用2 mg/ml稀释的嘌呤霉素筛选,得到稳定的细胞株。
1.2.3 Western blot和qRT-PCR
分别收集两组细胞沉淀于1.5 ml的离心管中,加入含苯基甲基磺酰氟的放射免疫沉淀测定缓冲液中溶解30 min,温度4℃,标准BCA蛋白标准液测定蛋白浓度,等量蛋白质通过SDS-PAGE分离并转移到聚偏二氟乙烯膜上。5%的脱脂奶粉对PVDF膜进行封闭,孵育指定的一抗,在4℃摇床上过夜孵育,随后PVDF膜在对应二抗存在条件下室温摇晃孵育2 h。以GAPDH作为内参进行对照,ECL-plus试剂盒显色,Image-J软件进行分析。取对数生长期的u87、u251细胞进行传代培养,将细胞分为SV2B过表达组(u87oe、u251oe)和空白对照组(u87nc、u251nc),SV2B过表达组加入包装好的过表达SV2B病毒,转染72 h后用嘌呤霉素筛选进行筛选转染SV2B慢病毒的细胞,一周后得到稳定过表达SV2B的细胞株,并收集稳定过表达SV2B的细胞沉淀进行Western blot和qRT-PCR验证SV2B表达效率。
1.2.4 CCK-8检测细胞增殖能力
CCK-8试剂盒分别检测u87oe、u25oe和u87nc、u251nc细胞在0、24、48和72 h的增殖活性,在酶标仪450 nm波长下检测各孔OD值大小;同时采用划痕实验检测两组细胞的迁移能力,将生长状态良好的两组细胞分别铺到六孔板内,使其密度达到80%~90%后取0、24 、48 h的照片,根据细胞划痕伤口愈合的面积来分析结果。
1.2.5 荧光定量PCR检测两组细胞的mRNA表达量
取适量对数生长期两组细胞沉淀,RNAiso Plus Kit从两组细胞中提取RNA,并测量其浓度。将RNA转化为cDNA后放于−80℃冰箱内保存以备用;LightCycler系统和扩增试剂盒进行PCR扩增,扩增周期为95℃ 5 min,95℃ 30 s,57℃ 30 s,72℃ 45 s,共40个周期, 2−ΔΔCt方法对数据进行分析。SV2B引物序列正向:5′-CCACCAACCAGAGAGCAACAGC-3′;反向:5′-GAGAAGCAGCAGCCAGAAGGATG-3′。GAPDH引物序列正向: 5′-AATCCCATCACCATCTTC-3′;反向:5′-AGGCTGTTGTCATACTTC-3′。
1.2.6 Transwell实验检测胶质母细胞瘤细胞u87、u251细胞迁移及侵袭能力变化
首先消化转染了SV2B病毒的对数生长期u87、u251细胞并计数,使用无血清培养基清洗两次后制成细胞悬液。微量移液器取200 µl细胞悬液于细胞培养小室的上室中,调整细胞数为3×104,下室加入500 µl含血清的培养基,以提供化学诱导剂。37℃,4%CO2培养箱条件下培养24 h,用棉签擦去上室中未迁移的细胞,4%多聚甲醛固定液中固定30 min,0.1%结晶紫水溶液中染色30 min,光学显微镜(放大×200)下拍照计数。
基质胶在4℃冷藏过夜,用DMEM培养基稀释基质胶,以6∶1比例取100 µl稀释后的基质胶置于细胞培养小室的上室,在37℃的培养箱水化4 h后,取200 µl无血清细胞悬液均匀铺于水化的基质胶上,调整细胞密度为3×104,下室加入500 µl含血清的培养基,以提供化学诱导剂。在37℃,4%CO2 培养箱条件下培养24 h,用棉签擦去上室中未侵袭的细胞,在4%的多聚甲醛固定液中固定30 min,0.1%的结晶紫水溶液中染色30 min,光学显微镜(放大×200)下拍照计数。
1.2.7 细胞集落形成实验
将两组细胞铺于六孔板中,以每组每孔600个细胞为宜,培养到14天(期间每间隔三天换一次液),用4%的多聚甲醛固定15 min,0.5%的结晶紫染色15 min,PBS洗掉多余的结晶紫染液,干燥后拍照留存,以每个集落大于50个细胞计数集落统计成图。
1.2.8 裸鼠皮下成瘤实验
雌性BALB/C裸鼠(n=7),4~6周龄,体重16~20 g,购自北京华阜康生物科技有限公司。饲养在环境温度为26℃~28℃,湿度为40%~60%的带有密封空气过滤装置的无菌塑料笼中。对水、食物和垫料进行消毒,每周至少更换一次垫料。将对照组、过表达组的u87细胞按每只小鼠1×108细胞皮下植入。从皮下接种后2周开始,每隔3天记录裸鼠肿瘤体积和重量。肿瘤体积计算为V=(长径×短径2)/2。30天后,裸鼠腹腔注射戊巴比妥溶液,剂量为每只150 mg/kg。完全麻醉后,以脱位法处死小鼠,取出肿瘤并称重供后续分析。所有动物实验均经山西医科大学第一医院动物使用与护理委员会批准。遵守所有适用的国际、国家和(或)机构的动物护理和使用准则。伦理委员会批号为DWLL-2024-002。
1.2.9 免疫组织化学染色
通过免疫组织化学实验验证在u87细胞中过表达SV2B基因和u87阴性对照组中的差异表达。并获得山西医科大学第一医院伦理委员会对本实验进行充分审查后已发布批准文书,认定实验符合赫尔辛基宣言。两组无毛小鼠,每组7只,皮下成瘤的瘤体取出后进行常规石蜡包埋,取组织切片,放在载玻片上,脱蜡,再水化。抗原修复和内源性过氧化物酶阻断后,将它们暴露于单基因多克隆抗体(SV2B、SYT1,Bioss)和酶标记的IgG聚合物。使用二氨基联苯胺显色溶液和苏木精作为复染剂观察抗体的存在。Image J软件进行免疫组织化学图像分析,结合阳性神经元的面积百分比和染色灰度的相对强度进行定量分析。
1.3 统计学方法
所有实验数据均采用Graphpad prism 8.0.1统计学软件进行分析。Image J软件处理实验图片,数据以均数±标准差表示。单因素方差分析和Bonferroni检验比较组间差异。P<0.05为差异有统计学意义。
2 结果
2.1 SV2B在胶质母细胞瘤中表达下调且与不良预后相关
分析所选GEO数据库中的40个正常样品和142个来自胶质母细胞瘤患者的总样品中的表达差异基因,结果显示肿瘤组织中SV2B的表达显著低于正常样本中的表达(图1A)。我们通过UALCAN数据库进一步从蛋白水平分析了SV2B在正常脑与胶质母细胞瘤组织中的表达,同样提示SV2B在胶质母细胞瘤组织中表达下调(图1B)。CGGA的生存分析表明,SV2B高表达组的生存期长于低表达组。这表明SV2B的低表达是神经胶质瘤预后不良的危险因素(图1C)。
![]() 图 1 SV2B在胶质母细胞瘤组织中表达下调Figure 1 Downregulation of SV2B expression in glioblastoma tissueA: SV2B exhibits differential expression between glioblastoma and normal brain tissue, with upregulation in normal brain tissue and downregulation in glioblastoma tissue (P<0.05); B: in UALCAN, SV2B protein exhibits differential expression between normal brain tissue and glioblastoma tissue (P<0.05); C: relationship between SV2B expression in glioblastoma samples and patient age (P<0.05).
图 1 SV2B在胶质母细胞瘤组织中表达下调Figure 1 Downregulation of SV2B expression in glioblastoma tissueA: SV2B exhibits differential expression between glioblastoma and normal brain tissue, with upregulation in normal brain tissue and downregulation in glioblastoma tissue (P<0.05); B: in UALCAN, SV2B protein exhibits differential expression between normal brain tissue and glioblastoma tissue (P<0.05); C: relationship between SV2B expression in glioblastoma samples and patient age (P<0.05).2.2 SV2B过表达细胞系的构建检测
qRT-PCR和Western blot实验结果均显示,空白对照组SV2B表达量显著低于SV2B过表达组,见图2。
2.3 SV2B过表达对胶质母细胞瘤细胞增殖能力的影响
通过集落形成和CCK-8实验发现,空白对照组细胞增殖活性较SV2B过表达组细胞显著增加,见图3。
2.4 SV2B过表达对胶质母细胞瘤细胞迁移及侵袭能力的影响
Transwell迁移及侵袭实验结果提示空白对照组细胞的迁移及侵袭能力较SV2B过表达组细胞显著增加。说明过表达SV2B可以抑制u87、u251细胞的迁移及侵袭能力,见图4。
2.5 SV2B对胶质母细胞瘤细胞u87、u251迁移能力的影响
通过划痕实验检测发现,SV2B过表达组细胞伤口愈合速度明显低于空白对照组,即提示SV2B过表达可以抑制胶质母细胞瘤的迁移能力,见图5。
2.6 SV2B过表达可抑制人胶质母细胞u87移植无毛小鼠的致瘤性
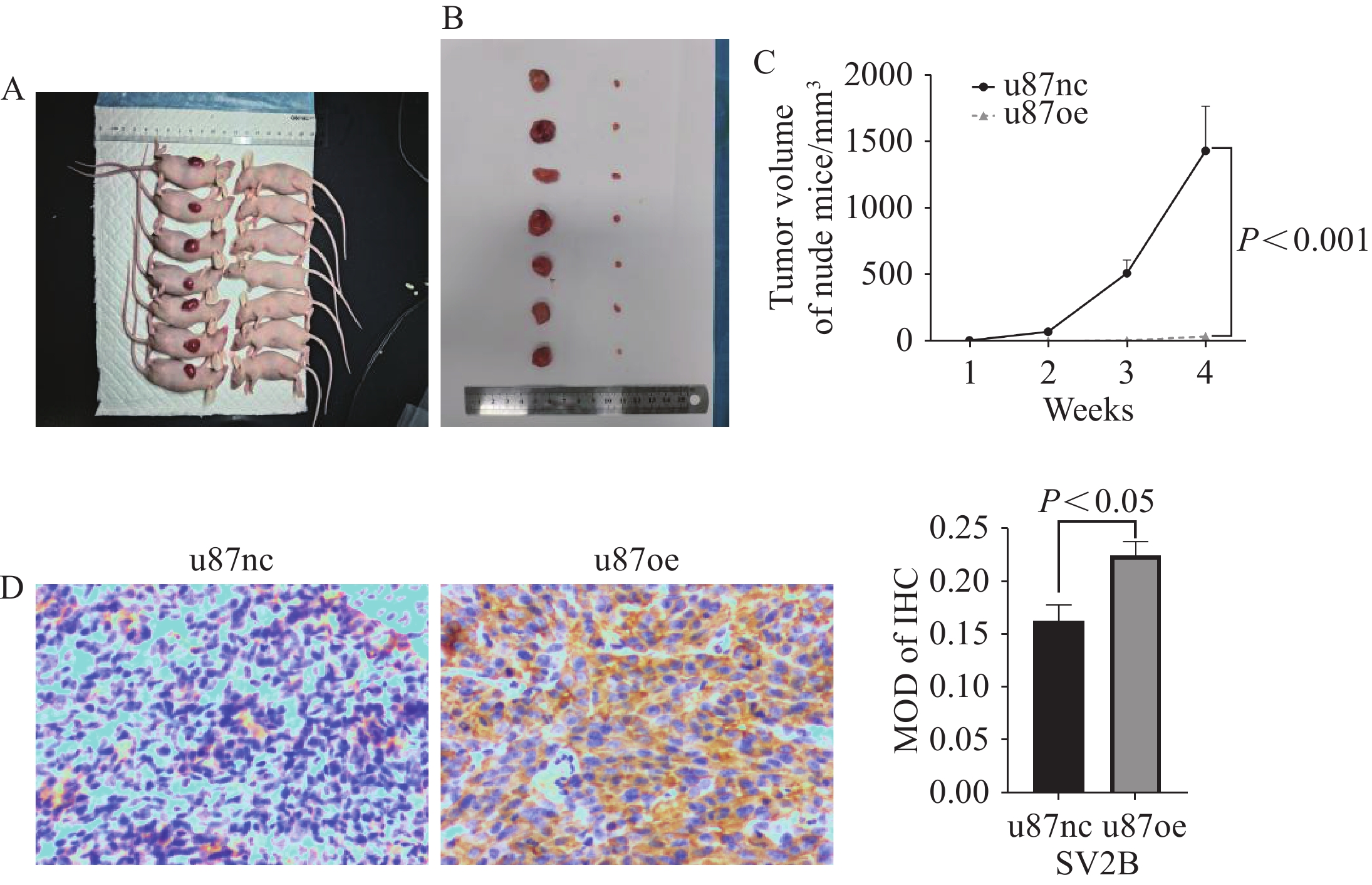
在小鼠模型中,与SV2B过表达组相比,空白对照组的肿瘤体积和重量更大。这表明SV2B影响胶质母细胞瘤细胞的增殖和生长,见图6A~C。具体而言,SV2B的高表达在一定程度上抑制了胶质母细胞瘤细胞的增殖和生长。免疫组织化学染色实验发现过表达SV2B组的SV2B蛋白表达量明显高于空白对照组,见图6。
![]() 图 6 SV2B过表达抑制胶质母细胞瘤细胞体外的增殖Figure 6 Overexpression of SV2B inhibited glioblastoma cell proliferation in vitroA: comparison of tumors between the u87nc group (left) and u87oe group (right) of nude mice after 30 days of subcutaneous tumor experiment; B: comparison of tumors extracted from the u87nc group (left) and u87oe group (right) of nude mice under subcutaneous conditions; C: tumor volumes of nude mice in the u87nc and u87oe groups at weeks 0, 1, 2, 3, and 4 during subcutaneous tumor experiment (****: P<0.001); D: expression of SV2B protein in u87nc and u87oe groups detected by immunohistochemical methods (Scale bar=0.1 mm) (*: P<0.05).
图 6 SV2B过表达抑制胶质母细胞瘤细胞体外的增殖Figure 6 Overexpression of SV2B inhibited glioblastoma cell proliferation in vitroA: comparison of tumors between the u87nc group (left) and u87oe group (right) of nude mice after 30 days of subcutaneous tumor experiment; B: comparison of tumors extracted from the u87nc group (left) and u87oe group (right) of nude mice under subcutaneous conditions; C: tumor volumes of nude mice in the u87nc and u87oe groups at weeks 0, 1, 2, 3, and 4 during subcutaneous tumor experiment (****: P<0.001); D: expression of SV2B protein in u87nc and u87oe groups detected by immunohistochemical methods (Scale bar=0.1 mm) (*: P<0.05).3 讨论
癌症是现代社会危害最大的疾病之一,给患者、家庭和社会带来了极高的负担。尽管三级预防体系不断完善,但目前仍缺乏多样化、个体化的肿瘤治疗方案[11]。
本研究发现SV2B在胶质母细胞瘤细胞中具有抗肿瘤作用。SV2是一类广泛分布于动物神经元和内分泌细胞的跨膜细胞表面蛋白,在细胞中起着神经递质释放、内分泌囊泡增胞、突触囊泡稳态的维持、神经肌肉连接的形成和肾上腺素能受体的定位等重要作用[12]。只有SV2蛋白家族的少数成员,如SV2B和SV2C,被发现在Ⅱ级胶质瘤中有差异表达[13]。
多项研究发现,在胃肠道间质肿瘤中,SV2常与神经内分泌相关[14]。此外,SV2的各种亚型在乳腺癌细胞系中大量分泌,提示其潜在的神经内分泌特性[15]。具体而言,过度表达SV2B与胶质母细胞瘤患者的预后相关,而SV2B的过表达则与较好的预后相关。为了解其中的机制,我们这次进行了更深入的研究并完善了细胞及动物实验验证,即SV2B高表达可能与胶质瘤患者较好的预后相关。Zhang等证实了SV2B在促进肿瘤方面的潜在作用,而MMP9、COL3A1和SV2B被确定为与ECM-受体相互作用相关的重要基因[7,16]。Wang等同样也通过富集分析证实了SV2B参与ECM-受体相互作用调控胶质母细胞瘤的恶性生物学行为[17]。SV2B已被证实在许多消化道肿瘤中过表达,特别是在胰腺和胃肠道肿瘤中。有人认为该蛋白可能是肿瘤中神经内分泌分泌的指示物[18]。microRNA也参与了SV2B的调控,例如,在前列腺癌中,miR-106a-5p被发现可以调节SV2B的表达,并调节囊泡易位和细胞增生[19]。SV2B调节转运蛋白和跨膜转运蛋白的活性,然后将葡萄糖诱导的颗粒引入质膜,已被证明在为肿瘤细胞提供营养物质方面是必不可少的。其他一些疾病,如白血病错义突变、阿尔茨海默病、视网膜神经病变和肾脏疾病,已被发现与SV2B密切相关,表明该蛋白参与了人类疾病的许多方面[20-22]。
多种生物信息学分析显示SV2B与胶质母细胞瘤患者预后相关,体外和体内实验也证实了其抗肿瘤作用。生物信息学结果也表明SV2B与胶质母细胞瘤免疫浸润有关[23]。这些发现可能为治疗胶质母细胞瘤提供新的治疗靶点。胶质瘤是人类中枢神经系统高度恶性的致死性肿瘤,目前的治疗策略均未达到令人满意的临床疗效。肿瘤微环境(tumor micro-environment, TME)在肿瘤行为中起重要作用,影响肿瘤对治疗的反应。因此,鉴定与TME相关的基因对于提供潜在的治疗靶点以制定有效的治疗胶质瘤的策略是有价值的[24]。SV2B在多种肿瘤中的重要作用已被报道;然而,SV2B在胶质瘤中的研究仍然缺乏。SV2B是否作为肿瘤进展的调节因子并影响胶质瘤免疫微环境尚未报道。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:陈 倩:动物实验和论文撰写徐长玉:分析数据陈祺宁:细胞实验段虎斌:设计实验并提供资金支持 -
-
[1] Cai J, Hu Y, Ye Z, et al. Immunogenic cell death-related risk signature predicts prognosis and characterizes the tumor microenvironment in lower-grade grioma[J]. Front Immunol, 2022, 13: 1011757.
[2] Brown TJ, Brennan MC, Li M, et al. Association of the Extent of Resection With Survival in Glioblastoma: A Systematic Review and Meta-analysis[J]. JAMA Oncol, 2016, 2(11): 1460-1469. doi: 10.1001/jamaoncol.2016.1373
[3] 唐树军, 胡峻华, 施登超, 等. siRNA沉默钙蛋白酶1对人脑胶质瘤细胞LN229增殖及侵袭的影响[J]. 解剖学研究, 2023, 45(6): 518-522. [Tang SJ, Hu JH, Shi DC, et al. Effect of siRNA silencing calpain 1 on proliferation and invasion of human glioma cell line LN229[J]. Jie Pou Xue Yan Jiu, 2023, 45(6): 518-522.] Tang SJ, Hu JH, Shi DC, et al. Effect of siRNA silencing calpain 1 on proliferation and invasion of human glioma cell line LN229[J]. Jie Pou Xue Yan Jiu, 2023, 45(6): 518-522.
[4] Toker J, Iorgulescu JB, Ling AL, et al. Clinical Importance of the lncRNA NEAT1 in Cancer Patients Treated with Immune Checkpoint Inhibitors[J]. Clin Cancer Res, 2023, 29(12): 2226-2238. doi: 10.1158/1078-0432.CCR-22-3714
[5] Li H, Sun X, Zhao Y, et al. Pan-cancer analysis of TASL: a novel immune infiltration-related biomarker for tumor prognosis and immunotherapy response prediction[J]. BMC Cancer, 2023, 23(1): 528. doi: 10.1186/s12885-023-11015-w
[6] Zhang W, Li L, Bian PP, et al. PLEKHA4 Is a Prognostic Biomarker and Correlated with Immune Infiltrates in Glioma[J]. Biomed Res Int, 2023, 2023: 4504474.
[7] Zhang Y, Yang X, Zhu XL, et al. Bioinformatics analysis of potential core genes for glioblastoma[J]. Biosci Rep, 2020, 40(7): BSR20201625. doi: 10.1042/BSR20201625
[8] Nilsson O, Jakobsen AM, Kölby L, et al. Importance of vesicle proteins in the diagnosis and treatment of neuroendocrine tumors[J]. Ann N Y Acad Sci, 2004, 1014: 280-283. doi: 10.1196/annals.1294.032
[9] Ming Y, Luo C, Ji B, et al. ARPC5 acts as a potential prognostic biomarker that is associated with cell proliferation, migration and immune infiltrate in gliomas[J]. BMC Cancer, 2023, 23(1): 937. doi: 10.1186/s12885-023-11433-w
[10] Sun R, Shao X, Akter F, et al. PRIM2: A Marker of MYC-driven Hyper-proliferation, Disease Progression, Tumor Aggressiveness and Poor Survival in Glioma Patients[J]. Cancer Genomics Proteomics, 2024, 21(2): 186-202. doi: 10.21873/cgp.20440
[11] 张东辉, 潘泽民, 张玉根, 等. 协作预防癌症是应对癌症危害的重要举措[J]. 安徽预防医学杂志, 2018, 24(2): 151-152. [Zhang DH, Pan ZM, Zhang YG, et al. Collaborative prevention of cancer is an important measure to deal with the harm of cancer[J]. Anhui Yu Fang Yi Xue Za Zhi, 2018, 24(2): 151-152.] Zhang DH, Pan ZM, Zhang YG, et al. Collaborative prevention of cancer is an important measure to deal with the harm of cancer[J]. Anhui Yu Fang Yi Xue Za Zhi, 2018, 24(2): 151-152.
[12] Stout KA, Dunn AR, Hoffman C, et al. The Synaptic Vesicle Glycoprotein 2: Structure, Function, and Disease Relevance[J]. ACS Chem Neurosci, 2019, 10(9): 3927-3938. doi: 10.1021/acschemneuro.9b00351
[13] Hu G, Wei B, Wang L, et al. Analysis of gene expression profiles associated with glioma progression[J]. Mol Med Rep, 2015, 12(2): 1884-1890. doi: 10.3892/mmr.2015.3583
[14] Jakobsen AM, Ahlman H, Wängberg B, et al. Expression of synaptic vesicle protein 2 (SV2) in neuroendocrine tumours of the gastrointestinal tract and pancreas[J]. J Pathol, 2002, 196(1): 44-50. doi: 10.1002/path.1002
[15] Gibson SV, Bort ET, Rodríguez-Fernández L, et al. TGFβ-mediated MMP13 secretion drives myoepithelial cell dependent breast cancer progression[J]. NPJ Breast Cancer, 2023, 9(1): 9. doi: 10.1038/s41523-023-00513-6
[16] Long H, Liang C, Zhang X, et al. Prediction and Analysis of Key Genes in Glioblastoma Based on Bioinformatics[J]. Biomed Res Int, 2017, 2017: 7653101.
[17] Wang H, Liu D, Yang J. Prognostic risk model construction and molecular marker identification in glioblastoma multiforme based on mRNA/microRNA/long non-coding RNA analysis using random survival forest method[J]. Neoplasma, 2019, 66(3): 459-469. doi: 10.4149/neo_2018_181008N746
[18] Fazliana M, Nor Hanipah Z, Mohd Yusof BN, et al. Molecular, Metabolic, and Nutritional Changes after Metabolic Surgery in Obese Diabetic Patients (MoMen): A Protocol for a Multicenter Prospective Cohort Study[J]. Metabolites, 2023, 13(3): 413. doi: 10.3390/metabo13030413
[19] Yang G, Li T, Liu J, et al. lncRNA MAGI2-AS3 suppresses castration-resistant prostate cancer proliferation and migration via the miR-106a-5p/RAB31 axis[J]. Genomics, 2023, 115(2): 110599. doi: 10.1016/j.ygeno.2023.110599
[20] 葛义, 王丽琨, 伍国锋. 突触囊泡蛋白2A在癫痫相关认知功能障碍中的作用机制研究进展[J]. 山东医药, 2022, 62(17): 94-96. [Ge Y, Wang LK, Wu GF. Research progress on the mechanism of synaptic vesicle protein 2A in epilepsy-associated cognitive dysfunction[J]. Shandong Yi Yao, 2022, 62(17): 94-96.] doi: 10.3969/j.issn.1002-266X.2022.17.024 Ge Y, Wang LK, Wu GF. Research progress on the mechanism of synaptic vesicle protein 2A in epilepsy-associated cognitive dysfunction[J]. Shandong Yi Yao, 2022, 62(17): 94-96. doi: 10.3969/j.issn.1002-266X.2022.17.024
[21] 张羽航, 徐向平. 儿童良性癫疒间伴中央颞区棘波与SV2A基因多态性的研究[J]. 中国生育健康杂志, 2021, 32(6): 546-552. [Zhang YH, Xu XP. Study on the relationship between benign epilepsy with centrotemporal spikes and SV2A gene polymorphism[J]. Zhongguo Sheng Yu Jian Kang Za Zhi, 2021, 32(6): 546-552.] doi: 10.3969/j.issn.1671-878X.2021.06.008 Zhang YH, Xu XP. Study on the relationship between benign epilepsy with centrotemporal spikes and SV2A gene polymorphism[J]. Zhongguo Sheng Yu Jian Kang Za Zhi, 2021, 32(6): 546-552. doi: 10.3969/j.issn.1671-878X.2021.06.008
[22] 张晓敏, 王培昌, 刘静. SV2A基因真核表达质粒构建及其在HEK293T细胞中的表达[J]. 国际检验医学杂志, 2020, 41(3): 274-277. [Zhang XM, Wang PC, Liu J. Construction of eukaryotic expression plasmid of SV2A gene and its expression in HEK293T cells[J]. Guo Ji Jian Yan Yi Xue Za Zhi, 2020, 41(3): 274-277.] doi: 10.3969/j.issn.1673-4130.2020.03.005 Zhang XM, Wang PC, Liu J. Construction of eukaryotic expression plasmid of SV2A gene and its expression in HEK293T cells[J]. Guo Ji Jian Yan Yi Xue Za Zhi, 2020, 41(3): 274-277. doi: 10.3969/j.issn.1673-4130.2020.03.005
[23] Perland E, Bagchi S, Klaesson A, et al. Characteristics of 29 novel atypical solute carriers of major facilitator superfamily type: evolutionary conservation, predicted structure and neuronal co-expression[J]. Open Biol, 2017, 7(9): 170142. doi: 10.1098/rsob.170142
[24] 唐科, 黄妮, 谭亲友. 细胞焦亡与药物治疗及免疫治疗在胶质母细胞瘤中的研究进展[J]. 中国现代应用药学, 2024, 41(2): 287-294. [Tang K, Huang N, Tan QY. Research progress on cell necroptosis and the role of drug treatment and immunotherapy in glioblastom[J]. Zhongguo Xian Dai Ying Yong Yao Xue, 2024, 41(2): 287-294.] Tang K, Huang N, Tan QY. Research progress on cell necroptosis and the role of drug treatment and immunotherapy in glioblastom[J]. Zhongguo Xian Dai Ying Yong Yao Xue, 2024, 41(2): 287-294.




 下载:
下载: