Predictive Value of Immune Inflammation Combined with Liver Function Hematological Indicators for Metastasis of Colorectal Cancer
-
摘要:目的
探讨免疫炎症联合肝脏功能血液学指标对结直肠癌转移的预测价值。
方法回顾性分析133例结直肠癌患者临床资料,根据术后随访24个月的疾病进展情况,将其分为无转移组(n=38)、肝转移组(n=43)和非肝远处转移组(n=52),分析无进展生存期的免疫炎症指标和肝脏功能血液学指标,单因素和多因素Logistic回归分析结直肠癌发生转移的风险因素,构建列线图预测模型。采用受试者工作特征曲线(ROC)和校准曲线验证列线图的准确度,通过决策曲线和临床影响曲线评价列线图的临床预测效能。
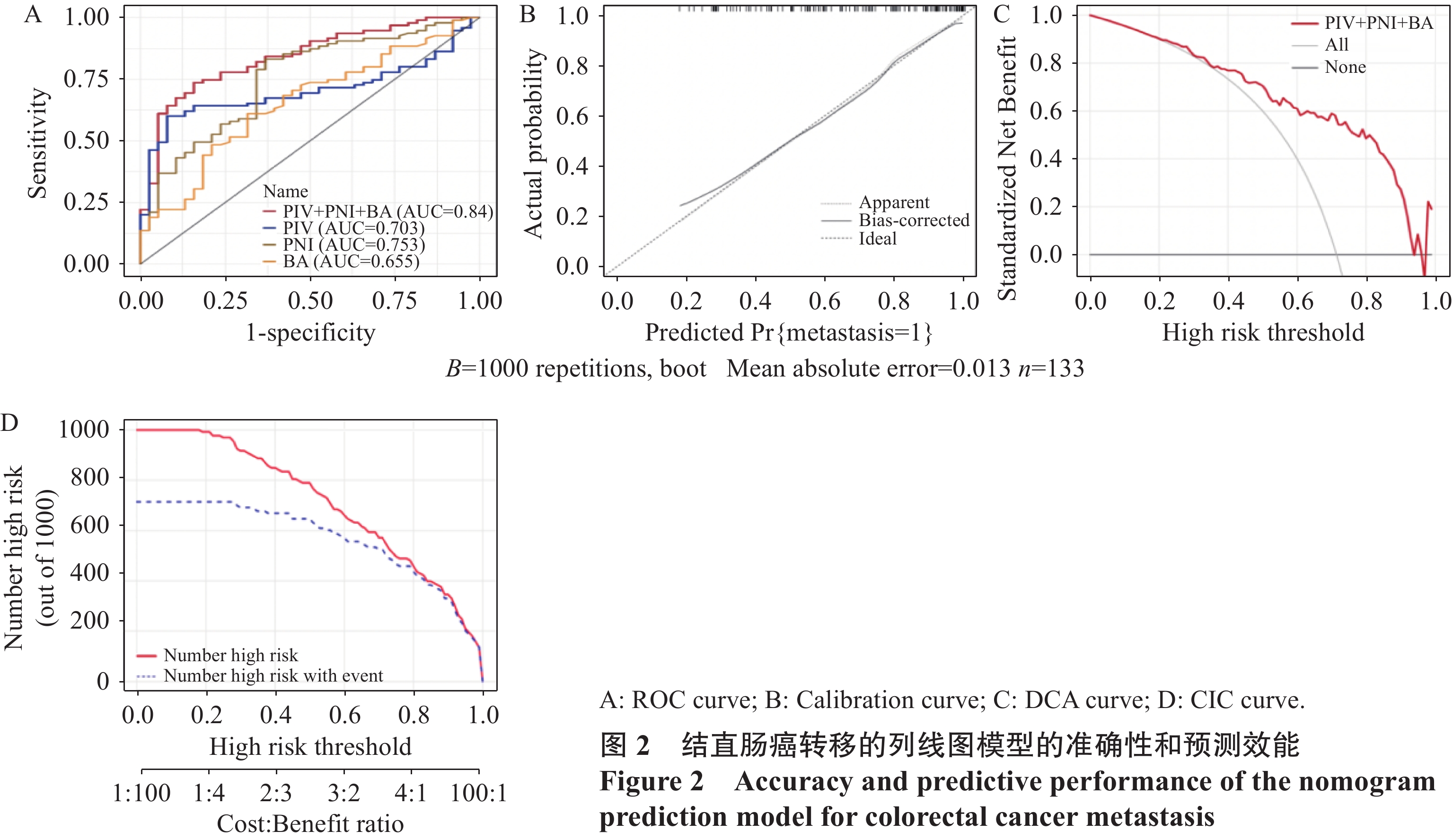
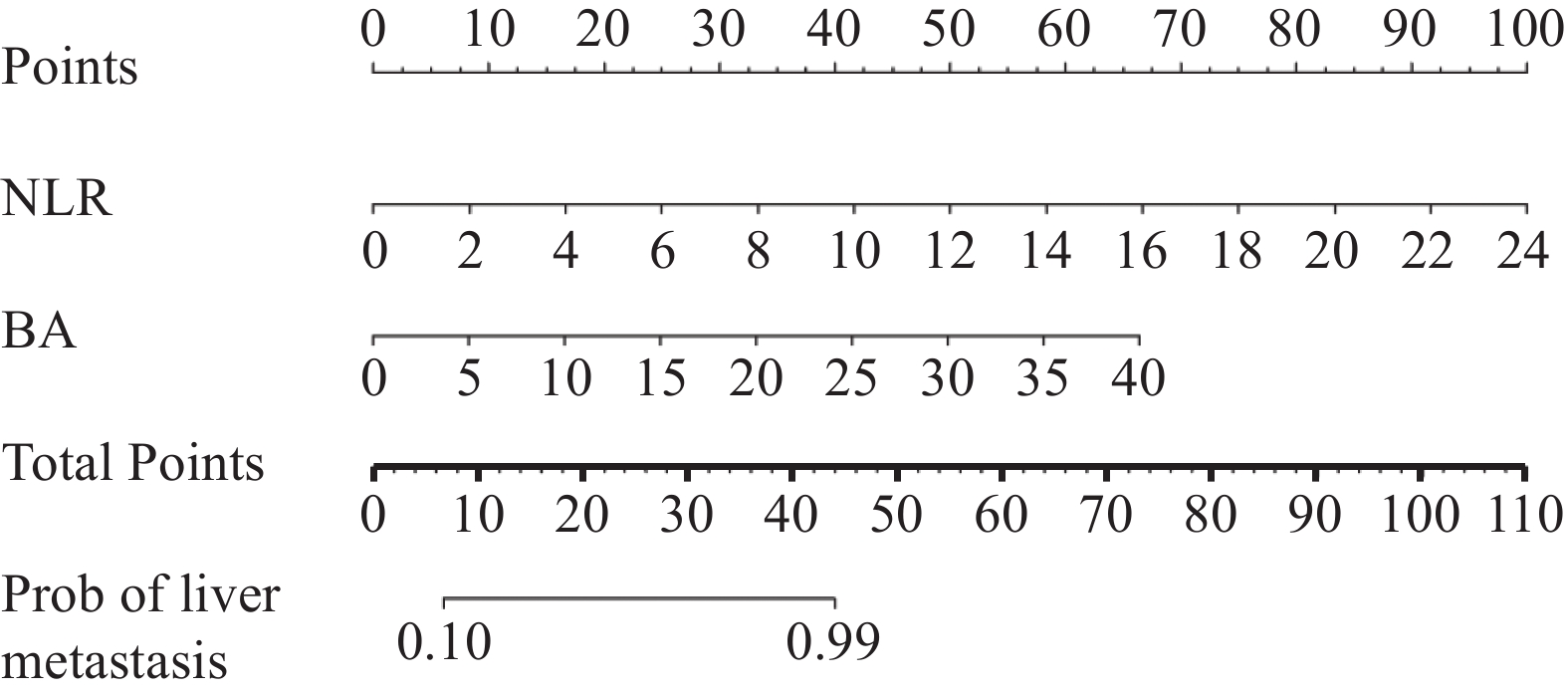
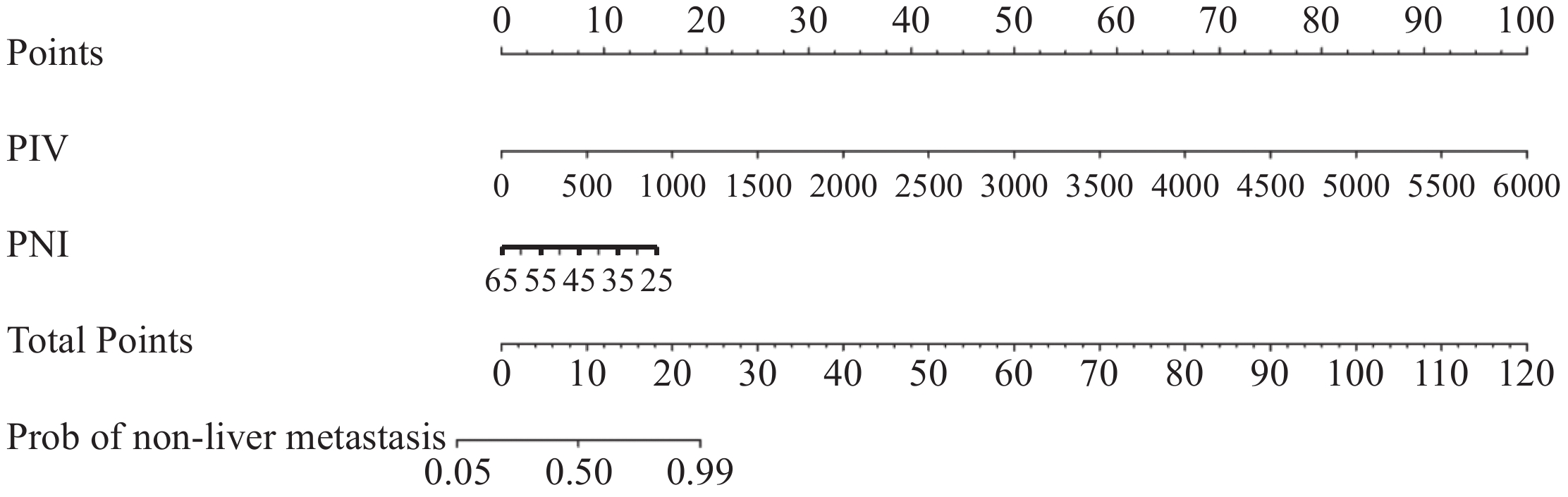
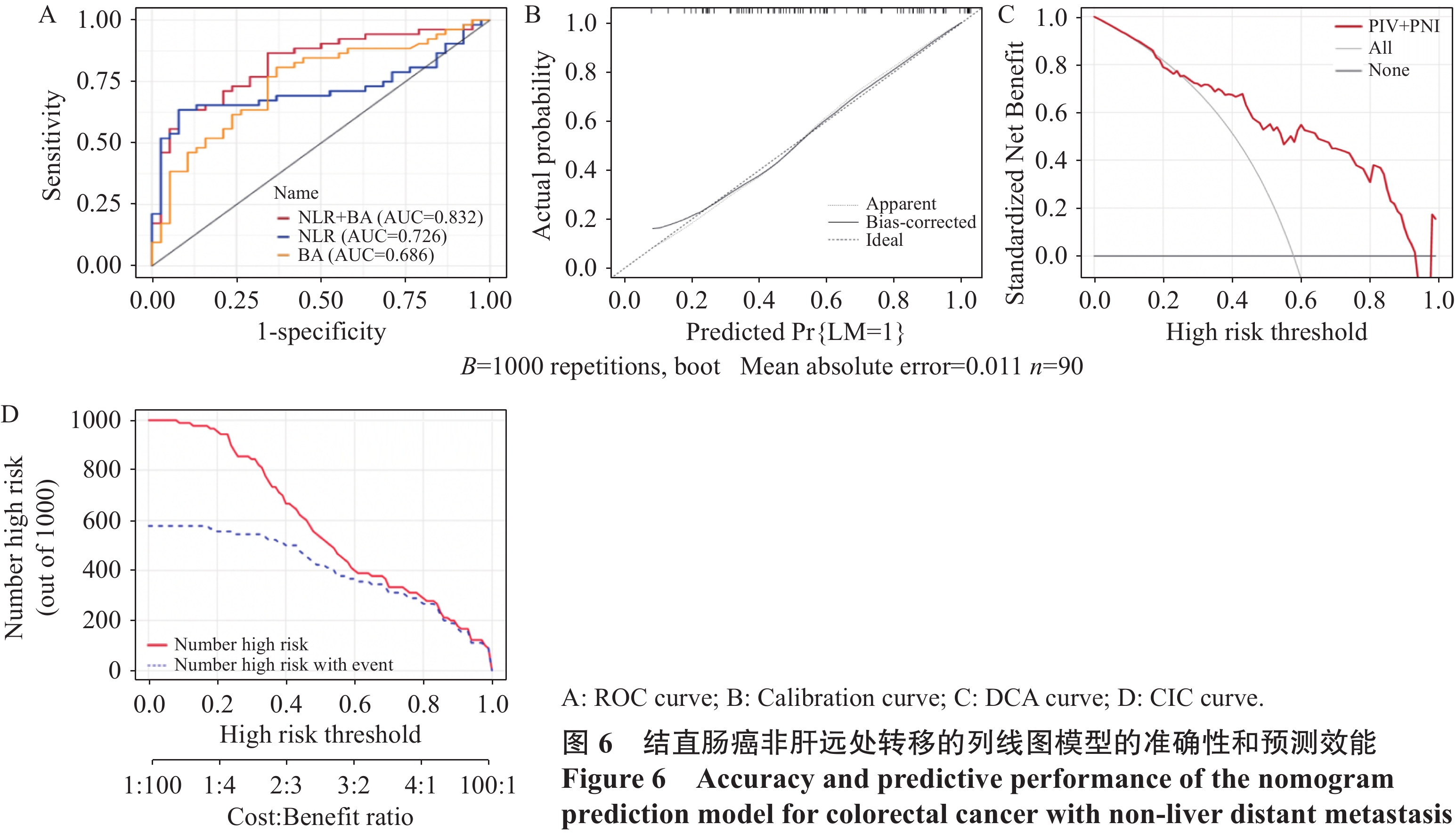
结果单因素及多因素Logistic回归分析显示泛免疫炎症值(PIV)、预后营养指数(PNI)与胆汁酸(BA)是结直肠癌发生转移的独立预测因素,三者联合预测转移的ROC曲线下面积为0.84;中性粒细胞/淋巴细胞比值(NLR)和BA是结直肠癌发生肝转移的独立预测因素,二者联合预测肝转移的ROC曲线下面积为0.83;PIV和PNI是结直肠癌发生非肝远处转移的独立预测因素,二者联合预测非肝远处转移的ROC曲线下面积为0.83;校准曲线、决策曲线和临床影响曲线显示该三种模型具有良好的准确度及净效益值。
结论基于免疫炎症和肝脏功能血液学指标构建的列线图可预测结直肠癌患者的转移情况,具有较高的预测效能及临床应用前景。
Abstract:ObjectiveTo explore the predictive value of immune inflammation combined with liver function hematological indicators for the metastasis of colorectal cancer.
MethodsA retrospective analysis of clinical data of 133 patients with colorectal cancer was conducted. The patients were divided into three groups based on disease progression after 24 months of postoperative follow-up: non-metastasis group (n=38), liver metastasis group (n=43), and non-liver distant metastasis group (n=52). The immune inflammatory markers and liver function hematological indicators of progression-free survival were analyzed. Nomogram prediction models were constructed using univariate and multivariate logistic regression analyses to identify risk factors for metastasis of colorectal cancer. The accuracy of the nomogram was validated using receiver operating characteristic (ROC) curve and calibration curve, and the clinical predictive efficacy was evaluated through decision curve and clinical impact curve.
ResultsUnivariate and multivariate logistic regression analyses showed that pan-immune-inflammatory value (PIV), prognostic nutritional index (PNI), and bile acid (BA) were independent predictors of colorectal cancer metastasis. The area under the ROC curve of the combined prediction of metastasis was 0.84; neutrophil/lymphocyte ratio (NLR) and BA were independent predictors of liver metastasis from colorectal cancer. The area under the ROC curve of the combined prediction of liver metastasis was 0.83; PIV and PNI were independent predictive factors for the occurrence of non-liver distant metastasis from colorectal cancer. The area under the ROC curve for the combined prediction of non-liver distant metastasis was 0.83. The calibration curve, decision curve, and clinical impact curve showed that the three models had good accuracy and net benefit value.
ConclusionThe nomogram constructed based on immune inflammation and liver function hematological indicators can predict the metastasis of patients with colorectal cancer and has high predictive efficacy and clinical application prospects.
-
Key words:
- Immune inflammation /
- Liver function /
- Hematological indicators /
- Colorectal cancer /
- Metastasis /
- Predictive value
-
0 引言
乳腺癌是全球女性最常见、致死人数最多的恶性肿瘤[1-3]。尽管乳腺癌均起源于乳腺组织,不同亚型的乳腺癌却表现出明显的异质性。目前已在分子遗传水平上对乳腺癌的亚型进行了广泛的研究,其分型标准主要依赖于肿瘤组织中雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)和人表皮生长因子受体-2(human epidermal growth factor receptor-2, HER-2)的表达情况。一部分乳腺癌表现为ER、PR、HER-2均为阴性,即三阴性乳腺癌(triple negative breast cancer, TNBC)占乳腺癌所有类型的10%~20%[4-5]。由于缺少分子靶点目前尚无有效的靶向药物。本研究将通过查找和整理大量相关文献,对TNBC的治疗策略进行综述。
1 局部治疗
乳腺癌的局部治疗以手术治疗为主,手术方式包括乳房切除术和保留乳房切除术,TNBC的手术治疗与其他类型乳腺癌基本一致。一些前瞻性和回顾性随机对照试验表明,早期乳腺癌患者接受保乳手术联合放疗后的长期生存率与乳房切除术治疗的疗效相当[6]。Abdulkarim等[7]研究发现,对于cT1~2N0的早期TNBC患者,选择保乳手术联合放射治疗相比于改良根治术5年无复发生存率提高(94% vs. 85%);Chen等[8]研究表明,保乳手术联合放射治疗相比于乳房切除术可以显著提高TNBC患者的乳腺癌特异性生存率和总生存率。因此,多数学者认为早期TNBC提倡创伤较少的保乳手术联合放射治疗,而切缘阳性或不明的高风险患者提倡乳腺癌根治术。
除手术治疗外,放射治疗也是乳腺癌的重要局部治疗手段。多项研究结果[7-8]显示,早期TNBC术后联合放射治疗能有效降低局部复发风险。另外,Haffty等[9]研究表明,行保乳手术联合放射治疗的乳腺癌患者,TNBC相比其他类型乳腺癌的5年无远处转移生存率明显降低(67% vs. 82%),而局部复发率两者没有差别(17% vs. 17%)。
2 化疗
2.1 新辅助化疗
新辅助化疗联合手术的全身治疗模式可有效改善早期TNBC患者的预后。实施新辅助化疗能有效抑制肿瘤病灶的远处转移,控制癌细胞转移、增殖,降低临床分期,达到病理完全缓解(pathological complete response, pCR),增加手术机会,扩大保乳根治术的应用范围,提高治愈率。目前TNBC的常规新辅助化疗方案是以蒽环类和(或)紫杉类药物为基础的联合化疗。
Keam等[10]的研究纳入了47例Ⅱ~Ⅲ期TNBC患者,应用蒽环联合紫杉类(anthracycline combined with taxane, AT)药物的新辅助化疗方案,其pCR率为17%。近年来,白蛋白结合型紫杉醇的临床应用不断扩大,一项Ⅲ期临床试验(GeparSepto GBG 69)在276例早期TNBC患者中比较了在蒽环联合环磷酰胺(anthracycline combined with cyclophosphamide, AC)方案基础上应用纳米白蛋白结合型紫杉醇与普通紫杉醇作为新辅助治疗的疗效差异,结果发现前者的pCR率显著高于后者(56% vs. 37%)[11]。然而,在另一项类似的Ⅲ期临床试验ETNA研究中发现二者的pCR率差异并无统计学意义(41.3% vs. 37.3%, P > 0.05)[12]。
在传统化疗方案中添加铂类药物或单独使用铂类药物的新辅助化疗方案在临床上也获得了一定的应用。在CALGB 40603研究的Ⅱ~Ⅲ期TNBC患者中,紫杉醇联合密集型多柔比星和密集型环磷酰胺方案的pCR率为44%,在此基础上加用卡铂后pCR率达到60%,二者差异有统计学意义(P=0.002)[13]。对于Ⅱ~Ⅲ期TNBC,紫杉醇联合卡铂与紫杉醇联合表柔比星的方案相比,前者的pCR率(38.6% vs. 14.0%, P=0.014)和5年无复发生存期(RFS)(77.6% vs. 56.2%; P=0.043)均优于后者,但二者的总生存期(OS)相似[14]。然而,在GEICAM/2006-03等Ⅱ期研究中,在蒽环、紫杉、环磷酰胺为基础的方案上加用卡铂对TNBC患者的pCR率无明显影响[15]。
由于铂类药物可引起DNA损伤,破坏基因组稳定性,导致细胞凋亡,故BRCA基因突变的肿瘤细胞对铂类药物十分敏感。有研究表明,在BRCA基因突变的Ⅱ~Ⅲ期乳腺癌中,应用顺铂单药进行新辅助治疗可以达到61%的pCR率[16]。GeparSixto等的研究纳入了146例Ⅱ~Ⅲ期TNBC患者接受含卡铂的新辅助化疗,其中26例BRCA基因突变者获得了较高的pCR率(65.4% vs. 55.0%; OR: 1.55, 95% CI: 0.64~3.74; P=0.33),但差异无统计学意义[17]。对于BRCA基因突变的TNBC患者,可以考虑在新辅助化疗方案中应用铂类药物,这对提高新辅助疗效有积极的作用。
2.2 辅助化疗
早期乳腺癌辅助化疗的目的是争取治愈,所以要强调标准、规范的化疗方案,同时还需考虑化疗药物的不良反应和个体差异问题。对于BRCA基因突变的TNBC患者,可在蔥环和紫杉药物基础上加用铂类药物用于辅助治疗。AC序贯紫杉醇三周方案与AC辅助化疗相比,前者在激素受体阴性的人群中具有更好的DFS。因此,目前推荐对于复发风险相对较高的患者行AC-T化疗方案。BCIRG005研究[18]显示,AC-T与TAC辅助化疗疗效在DFS和OS上无明显差异,但序贯组血液学毒性显著低于联合组。因此,考虑到患者耐受性,对于高危患者优先推荐AC-T的辅助化疗。SYSUCC-001研究[19]结果发现,对完成标准治疗的早期TNBC患者接受1年卡培他滨节拍化疗的维持治疗后,在56.5个月的中位随访期间内,其5年DFS明显优于观察组。这提示TNBC患者标准化疗后,继续1年的卡培他滨强化治疗可以降低患者的复发风险。最新一项Ⅲ期临床试验OlympiA研究[20]纳入了BRCA1/2突变的高危HER-2阴性患者,在完成术后辅助化疗后,发现加用1年奥拉帕利强化治疗组的患者比安慰剂组患者具有更好的3年DFS和远期DFS。
2.3 晚期解救化疗
TNBC晚期解救化疗的目的是控制疾病进展,改善患者生活质量,延长生存期。治疗选择应综合考虑患者一般情况、既往治疗情况(疗效、不良反应、耐受性)、肿瘤负荷等因素。一线化疗药物以蒽环类、紫杉类药物为主,化疗方案包括单药序贯化疗或联合化疗。对于既往蒽环类和紫杉类治疗失败的患者,可加用铂类、长春瑞滨或吉西他滨等。晚期TNBC药物治疗重要临床研究见表 1。
表 1 晚期三阴性乳腺癌药物治疗重要临床研究Table 1 Important clinical trials of drug therapy on advanced TNBC
铂类药物对TNBC具有较高的有效率,含铂方案可作为其解救化疗的选择之一。Ⅱ期临床试验TBCRC009分别研究了顺铂和卡铂单药治疗转移性TNBC患者的临床疗效,发现二者的ORR分别为32.6%和25.6%[21]。tnAcity研究结果显示,白蛋白紫杉醇联合卡铂与白蛋白紫杉醇联合吉西他滨或吉西他滨联合卡铂组相比,可延长晚期TNBC患者的PFS(8.3月vs. 5.5月,P=0.02;8.3月vs. 6.0月,P=0.02)[22]。
对于BRCA1/2胚系突变的TNBC患者,应用铂类不失为一种更优的临床选择。TNT研究纳入了未经选择的晚期TNBC患者,比较了卡铂单药和多西他赛单药作为治疗方案的临床疗效,发现二者的ORR、PFS及OS均相似;但在BRCA1/2胚系突变的乳腺癌中,卡铂组患者获益明显高于多西他赛组(ORR: 68.0% vs. 33.3%, P=0.03; PFS: 6.8月vs. 4.4月,P=0.002)[23]。在Ⅲ期临床试验CBCSG006中纳入了236位转移性TNBC患者,顺铂联合吉西他滨与紫杉醇联合吉西他滨的方案相比,前者能更好地提高患者的总缓解率(64% vs. 49%, P=0.018)和PFS(7.73月vs. 6.47月,P=0.009),但二者的OS相似(41% vs. 42%, P=0.611)[24]。亚组分析显示,gBRCA1/2突变的患者顺铂联合吉西他滨组ORR及PFS均显著提高。
另外,对于晚期TNBC的后线挽救治疗,有多项研究观察了洛铂治疗晚期乳腺癌的临床疗效,发现在蒽环、紫杉类药物治疗失败的转移性乳腺癌中应用洛铂的PFS优于顺铂(13.2月vs. 4.7月,P < 0.001)[25]。也有研究表明,艾立布林较长春瑞滨可明显延长PFS和ORR,且不良事件发生率相似[26]。另外,BG01-1312L研究结果显示,我国原创药物优替德隆联合卡培他滨对比卡培他滨单药可明显延长PFS和OS,为晚期乳腺癌患者提供了新的有效治疗方案[27]。
3 靶向治疗
3.1 PARP抑制剂
PARP抑制剂(PARPi)通过抑制PARP酶活性和增加PARP-DNA复合物的形成,导致肿瘤细胞DNA损伤修复障碍并诱发肿瘤细胞凋亡,故对BRCA突变型乳腺癌有一定疗效。常用的PARPi药物包括奥拉帕利、他拉唑帕利、Veliparib以及依尼帕利。一项Ⅲ期临床试验比较了奥拉帕利单药治疗和常规单药化疗(卡培他滨、长春瑞滨、艾日布林)在BRCA基因突变的转移性TNBC中的疗效,发现前者具有更好的PFS(HR: 0.43, 95%CI: 0.29~0.63),但OS差异无明显统计学意义(HR: 0.93,95%CI: 0.62~1.43)[28-29]。另一项Ⅲ期临床试验比较了他拉唑帕利单药治疗和常规单药化疗(卡培他滨、阿霉素、吉西他滨、艾日布林),在190例BRCA基因突变的晚期TNBC患者中的疗效,发现前者具有更好的PFS(HR: 0.60, 95%CI: 0.41~0.87)[30]。
在一项针对转移性TNBC的Ⅱ期临床研究中,在吉西他滨联合卡铂方案基础上加用依尼帕利后可使总反应率(OR)从34%提高至56%,中位PFS从3.6个月提升至5.9个月,中位OS从7.7个月提升至12.3个月,且未显著增加药物毒性[31]。然而,在随后的Ⅲ期临床研究中,依尼帕利+吉西他滨+卡铂与吉西他滨+卡铂治疗晚期TNBC乳腺癌相比,OS和PFS均无显著差异,但在二、三线亚组分析中观察到了前者的潜在优势[32]。总体而言,关于PARPi与铂类药物联合治疗的疗效结果并不统一,仍需更多的临床研究来进一步证实。
3.2 抗体偶联药物
抗体偶联药物(antibody-drug conjugate, ADC)采用特定的连接子将抗体和小分子细胞毒性药物连接起来,抗体分子主要发挥靶向投递作用,小分子药物发挥杀伤肿瘤细胞效应,作为一种新型抗肿瘤治疗手段正获得越来越多的关注。目前应用于TNBC的ADC主要是Sacituzumab govitecan和Ladiratuzumab vedotin。
Sacituzumab govitecan是一种抗滋养细胞表面抗原(trophoblast cell-surface antigen 2, Trop-2)抗体,通过酸碱敏感的可切割连接物与一种强效DNA破坏剂SN-38偶联。Trop-2是一种分子量为46 kD的跨膜糖蛋白,涉及许多细胞内信号通路,因其在多种肿瘤组织中的表达往往高于正常组织,已成为肿瘤靶向治疗的生物标志物[33]。进一步研究发现,Trop-2在80%的TNBC患者中有表达,提示其可以作为TNBC的靶向治疗[34]。最近一项Ⅲ期随机临床试验评估了Sacituzumab govitecan与单药化疗(艾日布林、长春瑞滨、卡培他滨或吉西他滨)在复发或难治性转移TNBC患者(排除脑转移患者)中的疗效[35]。共有468例患者被随机分组,分别接受Sacituzumab govitecan或单药化疗,发现前者具有更好的PFS(HR: 0.41, 95%CI: 0.32~0.52; P < 0.001)和OS(HR: 0.48, 95%CI: 0.38~0.59; P < 0.001),但其出现骨髓抑制和腹泻的比例更高。Ladiratuzumab vedotin是由一种抗LIV-1受体通过可裂解连接物连接到微管破坏剂组成的抗体偶联药物。目前正在进行Ladiratuzumab vedotin安全性的Ⅰ期临床试验,其治疗TNBC的临床疗效仍在进一步评估中[36]。以上研究证明,ADC在治疗TNBC上可能优于传统的标准化疗方案,但此类研究目前数量较少,还需要更多的循证医学证据支持。
3.3 抗VEGF治疗
TNBC是一种高度增殖的肿瘤,在其发生发展的所有阶段都存在血管的不断生成,故抗VEGF治疗能够抑制肿瘤的生长,其中贝伐单抗是最常用的抗VEGF药物。Ⅲ期临床试验RIBBON-1研究中,在常规卡培他滨或蒽环/紫杉方案中加用贝伐单抗可改善局部复发或转移性TNBC患者的中位PFS,且患者耐受性良好[37]。该试验进一步分析了在转移性HER-2阴性乳腺癌二线治疗中应用贝伐单抗的疗效。结果显示,加用贝伐单抗后TNBC患者的中位PFS显著提高(6.0月vs. 2.7月;P < 0.001),且具有改善OS的趋势[38]。
化疗联合靶向治疗可以作为TNBC患者术前新辅助治疗的有效方案。GeparSixto研究中,Ⅱ~Ⅲ期TNBC患者应用紫杉醇、多柔比星和贝伐单抗的新辅助治疗方案后pCR率为36.9%(95%CI: 29.4%~44.5%),在此基础上加用卡铂后pCR率达到53.2%(54.4%~60.9%)[39]。GeparQuinto研究纳入了678例早期TNBC患者,在给予蒽环、紫杉类药物作为新辅助化疗的方案上加用贝伐单抗,可将pCR率从27.9%提升到39.3%(P=0.003)[40]。值得一提的是,该研究中TNBC的诊断标准为激素受体阳性细胞比例 < 10%,不同于最新标准中激素受体阳性细胞比例 < 1%。相反,NSABP B-27试验发现,在蒽环、紫杉的新辅助化疗方案上加用贝伐单抗虽然可以提高ER+乳腺癌患者的pCR率,但并不能改善TNBC患者的pCR率,且贝伐单抗的应用会增加高血压、左室收缩功能障碍、手足综合征和黏膜炎的发生[41]。
由于抗VEGF治疗在TNBC治疗中的有效性尚不明确,且不良反应常见,FDA在2011年宣布撤销贝伐单抗治疗乳腺癌的许可。总体而言,抗VEGF在TNBC中的应用价值仍需要更多的临床试验加以佐证。
4 免疫治疗
虽然乳腺癌一般不被视为免疫原性肿瘤,但肿瘤浸润淋巴细胞(tumor-infiltrating-lymphocytes, TILs)已被证实存在于乳腺癌组织中,其水平与TNBC的结局密切相关[42]。此外,由于TNBC属于高突变型肿瘤,对检查点的抑制反应显著,因此,免疫检查点抑制剂——细胞毒性淋巴细胞抗原-4(CTLA-4)和PD-1以及程序性死亡配体1(PD-L1),可显著改善TNBC的治疗效果。目前研究较多的治疗TNBC的PD-1抑制剂主要包括阿替利珠单抗、帕博利珠单抗以及纳武单抗等,正在进行的主要Ⅱ~Ⅲ期临床试验见表 2。
表 2 正在进行的三阴性乳腺癌免疫治疗Ⅱ~Ⅲ期临床试验Table 2 Ongoing phase Ⅱ-Ⅲ clinical trials related to TNBC immunotherapy
目前多项研究表明,靶向PD-1/PD-L1免疫治疗能改善晚期TNBC的疗效,尤其对PD-1阳性的患者。KEYNOTE-086研究分析了帕博利珠单抗单药作为转移性TNBC一线治疗的疗效,ORR为21.4%(95%CI: 13.9%~31.4%),疾病控制率为23.8%(95%CI: 15.9%~34.0%),中位缓解持续时间为10.4月,中位PFS为2.1月(95%CI: 2.0~2.2月), 中位OS为18.0月(95%CI: 12.9~23.0月)[43]。该研究进一步分析了帕博利珠单抗单药作为既往蒽环/紫杉类治疗后的转移性TNBC二线治疗的疗效,总体ORR为5.3%(95%CI: 2.7%~9.9%),疾病控制率为7.6%(95%CI: 4.4%~12.7%),中位PFS为2.0月(95%CI: 1.9~2.0月),中位OS为9.0月(95%CI: 7.6~11.2月);在PD-1阳性的TNBC患者中,总体ORR为5.7%(95%CI: 2.4%~12.2%),疾病控制率为9.5%(95%CI: 5.1%~16.8%)[44]。一项Ⅲ期临床试验IMpassion130研究纳入902例晚期TNBC,比较白蛋白紫杉醇联合PD-L1抗体阿替利珠单抗和白蛋白紫杉醇联合安慰剂的疗效,结果发现前者的中位PFS更长(7.2 vs. 5.5月;HR: 0.80,95%CI: 0.69~0.92; P=0.002),中位OS也有延长趋势(21.3 vs. 17.6月;HR: 0.84, 95%CI: 0.69~1.02; P=0.08);对于两组中PD-1阳性的患者,前者的中位PFS(7.5 vs. 5.0月;HR: 0.62, 95%CI: 0.49~0.78; P < 0.001)和OS(25.0 vs. 15.5月;HR: 0.62, 95%CI: 0.45~0.86; P < 0.05)均更长;同时,应用阿替利珠单抗的患者未见新的不良反应[45]。该研究还进行了更长时间的随访,白蛋白紫杉醇联合阿替利珠单抗组随访至中位18.5月,白蛋白紫杉醇联合安慰剂组随访至17.5月,结果显示中位OS分别为21.0月和18.7月(HR: 0.86, 95%CI: 0.72~1.02; P=0.078);对于两组中PD-1阳性的患者,前者的中位OS显著延长(25.0 vs. 18.0月;HR: 0.71, 95%CI: 0.54~0.94; P < 0.05)[46]。另一项KEYNOTE-355研究[47]共入组847例晚期TNBC患者,研究结果显示,在晚期转移性三阴型乳腺癌PD-L1阳性患者中,一线应用PD-1抗体帕博利珠单抗联合化疗与单独化疗相比,PFS显著改善,且帕博利珠单抗的治疗效果随着PD-L1表达水平增加而提高。一项FUTURE研究结果显示,免疫调节型晚期TNBC患者经过多线治疗后接受卡瑞丽珠单抗联合白蛋白紫杉醇仍显示出良好疗效,ORR可达到52.6%[48]。
另外,多项临床研究表明,新辅助免疫治疗联合化疗提高了早期TNBC的pCR率及无事件生存率(event-free survival, EFS)。Ⅲ期临床试验KEYNOTE-522研究比较了早期TNBC患者接受紫杉醇联合卡铂的基础上加用帕博利珠单抗的疗效,结果显示,与安慰剂组相比,帕博利珠单抗组的pCR率更高(64.8% vs. 51.2%; P < 0.001),经过15.5个月的随访后,帕博利珠单抗组发生肿瘤进展的比例更低(7.4% vs. 11.8%; HR: 0.63, 95%CI: 0.43~0.93; P < 0.05),不良反应发生率稍高于安慰剂组(78% vs. 73%)[49]。IMpassion031研究[50]是一项随机、国际性多中心的Ⅲ期临床研究,共入组333例早期TNBC患者,旨在评估阿替利珠单抗联合化疗在新辅助治疗中的疗效和安全性。研究结果显示,阿替利珠单抗联合化疗相比于安慰剂联合化疗组,pCR率显著提高(57.6% vs. 41.1%, P=0.0044),且不论PD-L1状态如何,在整个临床亚组中均观察到获益。同时,Ⅱ期临床试验I-SPY2研究[51]也证实,与单纯化疗相比,帕博利珠单抗联合新辅助化疗可明显改善TNBC患者的pCR。然而,Ⅲ期临床试验NeoTRIPaPDL1研究[52]得出相反结论,在新辅助化疗的基础上加入PD-L1抑制剂阿替利珠单抗未能显著提高TNBC患者的pCR。
5 总结
TNBC约占乳腺癌的10%~20%。对于早期的TNBC,可用手术完整切除,或是术前新辅助治疗。对于转移性或晚期TNBC,以蒽环/紫杉类药物为基础的联合化疗是一线治疗手段。合并BRCA基因突变的患者,加用铂类药物或PARPi具有积极的作用。除此之外,抗VEGF药物可以通过抑制血管生成延缓肿瘤的进展,但其临床有效性和安全性仍需要进一步验证。随着PD-1抑制剂在实体肿瘤中的广泛应用,其对TNBC的疗效被逐渐关注,尤其在PD-1阳性患者中具有良好的应用前景。除此之外,新的药物和联合治疗方案也在不断涌现,这对未来TNBC的治疗策略可能会发生重要的影响。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:褚雪镭:研究分析和撰写论文安宸、席玲泽、谢虹亭、宗铭桐:数据整理薛 鹏:数据校对朱世杰:研究设计和资金支持 -
表 1 结直肠癌无转移组、肝转移组、非肝远处转移组的一般资料比较
Table 1 Comparison of general data among the non-metastasis group, liver metastasis group, and non-liver distant metastasis group of patients with colorectal cancer
Factors NM group(n=38) LM group(n=43) NLM group(n=52) χ2/F P Age($ \bar{x} $± s, years) 65.55 ± 7.89 65.35 ± 12.22 66.77 ± 10.51 1.178 0.555 Gender(male/female, n) 26/12 28/15 28/24 2.295 0.317 Hypertension(yes/no, n) 19/19 17/26 22/30 0.957 0.620 Hyperglycemia(yes/no, n) 10/28 14/29 13/39 0.729 0.694 Drinking(yes/no, n) 14/24 12/31 16/36 0.771 0.680 Smoking(yes/no, n) 14/24 14/29 19/33 0.216 0.898 Position(colon/rectum, n) 20/18 25/18 28/24 0.285 0.867 BMI($ \bar{x} $± s, kg/m2) 23.57 ± 3.05 22.49 ± 3.72 22.82 ± 3.93 0.934 0.396 Notes: NM: Non-metastasis; LM: Liver metastasis; NLM: Non-liver distant metastasis. 表 2 结直肠癌无转移组、肝转移组、非肝远处转移组的血液学资料比较
Table 2 Comparison of hematological data among the non-metastasis group, liver metastasis group, and non-liver distant metastasis group of patients with colorectal cancer
Factors NM group(n=38) LM group(n=43) NLM group(n=52) χ2/F P NEUT 3.00(1.11) 3.88(2.94) 4.26(2.92) 10.592 0.005 LYM 1.52(0.77) 1.10(1.06) 1.34(0.52) 7.058 0.029 MONO 0.33±0.11 0.43±0.26 0.45±0.22 5.687 0.058 PLT 175.00(51.00) 201.00(113.00) 208.00(144.50) 3.834 0.147 ALB 42.52±4.03 37.93±5.33 38.10±5.73 10.303 <0.001 ALT 16.40(13.43) 16.90(11.70) 12.20(10.05) 12.274 0.002 AST 17.40(10.88) 24.80(27.70) 17.10(11.73) 14.329 0.001 BA 2.67(2.69) 5.46(7.55) 3.48(2.86) 10.680 0.005 TC 4.27±0.92 4.44±1.37 4.44±1.02 0.330 0.719 HDL-C 1.13(0.35) 1.18(0.49) 1.07(0.43) 2.309 0.315 LDL-C 2.77±0.87 3.02±1.32 3.00±0.98 0.653 0.522 ApoB 0.91(0.44) 0.98(0.34) 0.98(0.44) 2.121 0.346 ApoA1 1.35(0.25) 1.21(0.44) 1.16(0.31) 15.882 <0.001 CEA 2.60(2.04) 40.12(126.65) 15.42(113.48) 48.968 <0.001 NLR 2.01(1.22) 3.33(3.65) 3.17(3.50) 17.222 <0.001 MLR 0.21(0.13) 0.29(0.38) 0.32(0.21) 12.162 0.002 PLR 124.93(61.67) 154.78(161.30) 157.96(150.78) 11.637 0.003 SII 352.76(197.03) 585.66(851.08) 739.99(966.08) 17.152 <0.001 PIV 123.26(84.58) 229.32(384.18) 299.03(520.59) 13.683 0.001 PNI 51.25(8.56) 45.97(11.10) 45.09(8.85) 20.665 <0.001 ALRI 12.88(10.31) 19.49(38.61) 13.27(16.90) 12.613 0.002 APRI 0.10(0.06) 0.14(0.11) 0.08(0.08) 15.064 0.001 表 3 结直肠癌术后转移影响因素的单因素分析
Table 3 Univariate analysis of factors influencing postoperative metastasis of colorectal cancer
Factors NM group(n=38) M group(n=95) HR(95%CI) t/z P PIV 123.26(84.58) 261.63(401.42) 0.995(0.992-0.998) −3.651 0.003 PNI 50.51±5.76 44.53±6.73 1.167(1.084-1.255) −4.811 <0.001 ALRI 12.88(10.31) 15.28(17.34) 0.957(0.920-0.995) −2.107 0.027 BA 2.67(2.69) 4.15(4.60) 0.802(0.678-0.947) −2.782 0.010 TC 4.27±0.92 4.44±1.19 0.864(0.609-1.226) 0.816 0.414 ApoB 0.91(0.44) 0.98(0.40) 0.328(0.093-1.155) −1.455 0.083 ApoA1 1.36±1.19 1.16±0.28 26.080(4.385-155.107) −4.708 <0.001 Note: M group: metastasis group. 表 4 结直肠癌术后转移影响因素的多因素分析
Table 4 Multivariate analysis of factors influencing postoperative metastasis of colorectal cancer
Factors β SE Wald χ2 P OR 95%CI PIV −0.004 0.002 6.246 0.012 0.996 0.992-0.999 PNI 0.105 0.047 5.037 0.025 1.110 1.013-1.216 ALRI −0.015 0.024 0.374 0.541 0.985 0.940-1.033 BA −0.216 0.099 4.795 0.029 0.806 0.664-0.978 ApoA1 0.861 1.117 0.595 0.440 2.366 0.265-21.112 Constant −4.964 2.665 3.470 0.062 0.007 — 表 5 结直肠癌患者术后肝转移较无转移影响因素的多因素分析
Table 5 Multivariate analysis of factors influencing postoperative liver metastasis compared with non-metastasis in colorectal cancer patients
Factors β SE Wald χ2 P OR 95%CI NLR −0.538 0.257 4.389 0.036 0.584 0.353-0.966 PNI 0.096 0.058 2.709 0.100 1.101 0.982-1.234 BA −0.292 0.103 7.967 0.005 0.747 0.610-0.915 Constant −1.833 3.198 0.328 0.567 0.160 表 6 结直肠癌患者术后非肝远处转移较无转移影响因素的多因素分析
Table 6 Multivariate analysis of factors influencing non-hepatic distant metastasis compared with non-metastasis in colorectal cancer patient after surgery
Factors β SE Wald χ2 P OR 95%CI PIV 0.005 0.002 6.535 0.011 1.005 1.001-1.009 PNI −0.107 0.047 5.230 0.022 0.898 0.820-0.985 ApoA1 −1.106 1.189 0.866 0.352 0.331 0.032-3.400 constant 5.800 2.380 5.940 0.015 330.350 — -
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263. doi: 10.3322/caac.21834
[2] Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53. doi: 10.1016/j.jncc.2024.01.006
[3] Chaffer C L, Weinberg R A. A perspective on cancer cell metastasis[J]. Science, 2011, 331(6024): 1559-1564. doi: 10.1126/science.1203543
[4] Hernandez-Alejandro R, Ruffolo L I, Sasaki K, et al. Recipient and Donor Outcomes After Living-Donor Liver Transplant for Unresectable Colorectal Liver Metastases[J]. JAMA Surg, 2022, 157(6): 524-530. doi: 10.1001/jamasurg.2022.0300
[5] Masi G, Vasile E, Loupakis F, et al. Randomized trial of two induction chemotherapy regimens in metastatic colorectal cancer: an updated analysis[J]. J Natl Cancer Inst, 2011, 103(1): 21-30. doi: 10.1093/jnci/djq456
[6] 苏阜力, 张补文. 血清酶活性联检在肝病中的应用[J]. 实用医技杂志, 2006, 13(14): 2435-2436. [Su FL, Zhang BW. Application of combined detection of serum enzyme activity in liver disease[J]. Shi Yong Yi Ji Za Zhi, 2006, 13(14): 2435-2436.] doi: 10.3969/j.issn.1671-5098.2006.14.043 Su FL, Zhang BW. Application of combined detection of serum enzyme activity in liver disease[J]. Shi Yong Yi Ji Za Zhi, 2006, 13(14): 2435-2436. doi: 10.3969/j.issn.1671-5098.2006.14.043
[7] Tian S, Chu Y, Hu J, et al. Tumour-associated neutrophils secrete AGR2 to promote colorectal cancer metastasis via its receptor CD98hc-xCT[J]. Gut, 2022, 71(12): 2489-2501. doi: 10.1136/gutjnl-2021-325137
[8] Khan U, Chowdhury S, Billah MM, et al. Neutrophil Extracellular Traps in Colorectal Cancer Progression and Metastasis[J]. Int J Mol Sci, 2021, 22(14): 7260. doi: 10.3390/ijms22147260
[9] Wang H, Zhang B, Li R, et al. KIAA1199 drives immune suppression to promote colorectal cancer liver metastasis by modulating neutrophil infiltration[J]. Hepatology, 2022, 76(4): 967-981. doi: 10.1002/hep.32383
[10] Lin N, Li J, Yao X, et al. Prognostic value of neutrophil-to-lymphocyte ratio in colorectal cancer liver metastasis: A meta-analysis of results from multivariate analysis[J]. Int J Surg, 2022, 107: 106959. doi: 10.1016/j.ijsu.2022.106959
[11] Tang H, Li B, Zhang A, et al. Prognostic Significance of Neutrophil-to-Lymphocyte Ratio in Colorectal Liver Metastasis: A Systematic Review and Meta-Analysis[J]. PLoS One, 2016, 11(7): e0159447. doi: 10.1371/journal.pone.0159447
[12] Kim H, Jung HI, Kwon SH, et al. Preoperative neutrophil-lymphocyte ratio and CEA is associated with poor prognosis in patients with synchronous colorectal cancer liver metastasis[J]. Ann Surg Treat Res, 2019, 96(4): 191-200. doi: 10.4174/astr.2019.96.4.191
[13] Shibutani M, Maeda K, Nagahara H, et al. The peripheral monocyte count is associated with the density of tumor-associated macrophages in the tumor microenvironment of colorectal cancer: a retrospective study[J]. BMC Cancer, 2017, 17(1): 404. doi: 10.1186/s12885-017-3395-1
[14] Shaul ME, Fridlender ZG. Tumour-associated neutrophils in patients with cancer[J]. Nat Rev Clin Oncol, 2019, 16(10): 601-620. doi: 10.1038/s41571-019-0222-4
[15] Kassassir H, Papiewska-Pająk I, Kryczka J, et al. Platelet-derived microparticles stimulate the invasiveness of colorectal cancer cells via the p38MAPK-MMP-2/MMP-9 axis[J]. Cell Commun Signal, 2023, 21(1): 51. doi: 10.1186/s12964-023-01066-8
[16] Fucà G, Guarini V, Antoniotti C, et al. The Pan-Immune-Inflammation Value is a new prognostic biomarker in metastatic colorectal cancer: results from a pooled-analysis of the Valentino and TRIBE first-line trials[J]. Br J Cancer, 2020, 123(3): 403-409. doi: 10.1038/s41416-020-0894-7
[17] Yang XC, Liu H, Liu DC, et al. Prognostic value of pan-immune-inflammation value in colorectal cancer patients: A systematic review and meta-analysis[J]. Front Oncol, 2022, 12: 1036890. doi: 10.3389/fonc.2022.1036890
[18] Argilés JM, Busquets S, Stemmler B, et al. Cancer cachexia: understanding the molecular basis[J]. Nat Rev Cancer, 2014, 14(11): 754-762. doi: 10.1038/nrc3829
[19] Almasaudi AS, Dolan RD, Edwards CA, et al. Hypoalbuminemia Reflects Nutritional Risk, Body Composition and Systemic Inflammation and Is Independently Associated with Survival in Patients with Colorectal Cancer[J]. Cancers (Basel), 2020, 12(7): 1986. doi: 10.3390/cancers12071986
[20] Hu Z, Li Y, Mao W, et al. Impact of Nutritional Indices on the Survival Outcomes of Patients with Colorectal Cancer[J]. Cancer Manag Res, 2020, 12: 2279-2289. doi: 10.2147/CMAR.S243172
[21] Jung SH, Hao J, Shivakumar M, et al. Development and validation of a novel strong prognostic index for colon cancer through a robust combination of laboratory features for systemic inflammation: a prognostic immune nutritional index[J]. Br J Cancer, 2022, 126(11): 1539-1547. doi: 10.1038/s41416-022-01767-w
[22] Bian X, Liu R, Meng Y, et al. Lipid metabolism and cancer[J]. J Exp Med, 2021, 218(1): e20201606. doi: 10.1084/jem.20201606
[23] Zhang KL, Zhu WW, Wang SH, et al. Organ-specific cholesterol metabolic aberration fuels liver metastasis of colorectal cancer[J]. Theranostics, 2021, 11(13): 6560-6572. doi: 10.7150/thno.55609
[24] Kühn T, Stepien M, López-Nogueroles M, et al. Prediagnostic Plasma Bile Acid Levels and Colon Cancer Risk: A Prospective Study[J]. J Natl Cancer Inst, 2020, 112(5): 516-524. doi: 10.1093/jnci/djz166
[25] Zheng Z, Wei J, Hou X, et al. A High Hepatic Uptake of Conjugated Bile Acids Promotes Colorectal Cancer-Associated Liver Metastasis[J]. Cells, 2022, 11(23): 3810. doi: 10.3390/cells11233810
[26] Thomas DS, Fourkala EO, Apostolidou S, et al. Evaluation of serum CEA, CYFRA21-1 and CA125 for the early detection of colorectal cancer using longitudinal preclinical samples[J]. Br J Cancer, 2015, 113(2): 268-274. doi: 10.1038/bjc.2015.202
[27] Pakdel A, Malekzadeh M, Naghibalhossaini F. The association between preoperative serum CEA concentrations and synchronous liver metastasis in colorectal cancer patients[J]. Cancer Biomark, 2016, 16(2): 245-252. doi: 10.3233/CBM-150561
[28] Lee JH, Lee SW. The Roles of Carcinoembryonic Antigen in Liver Metastasis and Therapeutic Approaches[J]. Gastroenterol Res Pract, 2017, 2017: 7521987.



 下载:
下载: