Folic Acid-Modified Liposome Quercetin Induces Apoptosis of Triple-Negative Breast Cancer Cells via Mitochondrial Apoptosis Mediated by JAK2/STAT3 Signaling Pathway
-
摘要:目的
探讨叶酸修饰脂质体槲皮素对三阴性乳腺癌细胞增殖、凋亡的影响及潜在的调控机制。
方法叶酸修饰脂质体槲皮素处理三阴性乳腺癌细胞MDA-MB-231后,CCK-8法检测细胞活力;平板克隆实验检测细胞增殖克隆能力;流式细胞术检测细胞凋亡、细胞活性氧(ROS)水平及线粒体膜电位的变化;Western blot检测酪氨酸蛋白激酶2(JAK2)-信号转导与转录激活因子3(STAT3)信号通路相关蛋白及凋亡相关蛋白的表达水平。
结果叶酸修饰脂质体槲皮素抑制MDA-MB-231细胞增殖(P=0.023)、促进其凋亡(P<0.001),促进MDA-MB-231细胞线粒体膜电位坍塌(P=0.003),提升MDA-MB-231细胞内ROS水平(P=0.034),抑制JAK2和STAT3磷酸化水平(P<0.001),下调抗凋亡蛋白Bcl2、Bcl-xL表达(P=0.037,0.028),上调促凋亡蛋白Bax、Bak、Cyt C、Cleaved-Caspase-3表达(P<0.001)。
结论叶酸修饰脂质体槲皮素抑制三阴性乳腺癌细胞MDA-MB-231增殖并诱导其凋亡,其作用机制可能与抑制JAK2/STAT3信号通路活化并激活线粒体凋亡途径有关。
-
关键词:
- 三阴性乳腺癌 /
- 叶酸修饰脂质体槲皮素 /
- 线粒体凋亡途径 /
- JAK2/STAT3信号通路
Abstract:ObjectiveTo investigate the effect of folic acid–modified liposome quercetin (FLQ) on the proliferation and apoptosis of triple negative breast cancer (TNBC) cells and explore its underlying mechanism.
MethodsCCK-8 was used to detect the effect of FLQ on TNBC cell viability. Colony formation assay was conducted to detect the effect of FLQ on TNBC cell proliferation. Flow cytometry was performed to detect the effect of FLQ on TNBC cell apoptosis, the levels of intracellular ROS, and mitochondrial membrane potential. Western blot analysis was conducted to detect the expression levels of JAK2/STAT3 signaling pathway-related and apoptosis-related proteins.
ResultsFLQ inhibited the proliferation and promoted the apoptosis of MDA-MB-231 cells (P=0.023, P<0.001). It promoted mitochondrial membrane potential collapse and increased the intracellular ROS levels of MDA-MB-231 cells (P=0.003, P=0.034); inhibited the phosphorylation levels of JAK2 and STAT3; upregulated the expression levels of the proapoptotic proteins Bax, Bak, cytochrome C, and Cleaved-Caspase-3 (P<0.001, P<0.001); and downregulated the expression levels of the antiapoptotic proteins Bcl2 and Bcl-xL (P=0.037, 0.028).
ConclusionFLQ inhibits the proliferation and induces the apoptosis of MDA-MB-231 cells. These effects may be related to the activation of the mitochondrial apoptosis pathway through the inhibition of the JAK2/STAT3 signaling pathway.
-
0 引言
三阴性乳腺癌(triple-negative breast cancer, TNBC)恶性程度高,易出现早期复发和内脏转移,是乳腺癌中侵袭性最强,预后最差的亚型[1]。由于缺乏特异性治疗靶点,内分泌治疗和靶向治疗基本无效,化疗仍是晚期TNBC主要的治疗手段。TNBC早期对化疗相对敏感,但随着治疗推进,患者逐渐产生耐药,导致治疗失败及预后不良。接受常规化疗的转移性TNBC患者的中位总生存期仅9~12月[2]。此外,化疗带来的不良反应如心脏毒性、神经毒性、胃肠道反应、骨髓抑制等也不容小觑,严重影响患者生活质量[3]。因此,研发新型抗肿瘤药物是一个亟待解决的难题。
中医药是临床抗癌治疗的重要组成部分,具有多途径、多靶点、多通路的协同抗肿瘤特点,可逆转肿瘤化疗耐药、提高机体免疫功能、抑制肿瘤远处转移[4-5]。槲皮素是一种广泛存在于多种中草药(白花蛇舌草、黄芩、三七)中的黄酮类化合物,具有抗炎、抗氧化、抗病毒、抗肿瘤等药理作用[6-7]。研究表明,槲皮素可通过抑制肿瘤细胞增殖、转移及诱导凋亡等多种途径来发挥抗肿瘤作用[7]。其中,细胞凋亡是诸多抗肿瘤药物杀伤肿瘤细胞的重要途径。文献证实槲皮素在宫颈癌、肺癌、肝癌等多种肿瘤中可通过促进细胞凋亡发挥抗肿瘤作用[8-10]。槲皮素的促凋亡作用涉及多种分子和信号通路,如通过内质网应激途径诱导宫颈癌细胞凋亡[8];通过抑制磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases, PI3K)/丝氨酸/苏氨酸蛋白激酶B(RAC-α serine/threonine-protein kinase, AKT)信号通路促进肺腺癌细胞凋亡等[9]。TNBC中,槲皮素是否也通过诱导凋亡发挥抗肿瘤作用也是本研究探索的目的。
JAK2/STAT3信号通路是细胞内重要信号转导通路,通过影响下游多种效应分子的活化状态,参与调控肿瘤发生、发展等多个环节[11]。研究表明富含黄酮物质的中药可抑制JAK2/STAT3通路发挥抗肿瘤作用。甘草总黄酮抑制 JAK2/STAT3通路可减小异种移植乳腺癌肿瘤体积[12]。槲皮素可通过抑制JAK2/STAT3信号通路促进直肠癌细胞和卵巢癌细胞凋亡[13-14]。这些研究为我们深入探索槲皮素在TNBC中的促凋亡机制提供了新的思路。本课题组前期利用叶酸修饰构建脂质体槲皮素(folic acid-modified liposome quercetin, FLQ)[15],克服了槲皮素水溶性差、靶向性不足、生物利用度低等问题,旨在探索叶酸修饰脂质体槲皮素是否通过JAK2/STAT3信号通路促进TNBC细胞线粒体途径凋亡,为叶酸修饰脂质体槲皮素应用于临床TNBC治疗提供理论依据。
1 材料与方法
1.1 细胞系及主要试剂
人三阴性乳腺癌细胞系(MDA-MB-231)购自武汉普诺赛生命科技有限公司;DMEM试剂盒、胎牛血清、胰酶和青/链霉素均购自美国Gibco公司;细胞周期检测试剂盒、线粒体膜电位试剂盒和ROS检测试剂盒均购自上海碧云天生物技术有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购自杭州联科生物;RIPA裂解液、PMSF蛋白酶抑制剂及5×蛋白上样缓冲液购自北京索莱宝科技有限公司;ECL发光试剂盒购自美国Advansta公司;JAK2抗体(74987)、STAT3抗体(30835)、p-JAK2抗体(4406)和p-STAT3抗体(9145)均购自美国Cell Signaling Technology公司;细胞色素C(Cytochrome C, Cyt C)抗体(ab133504)和Cleaved-Caspase-3抗体(ab2302)均购自英国Abcam公司;Bcl2抗体(68103-1-Ig)、Bcl-xL抗体(26967-1-AP)、Bax抗体(50599-2-Ig)、Bak抗体(29552-1-AP)、GAPDH抗体(60004-1-Ig)、辣根过氧化物酶标记的山羊抗鼠(SA00001-1)和山羊抗兔(SA00001-2)二抗均购自武汉三鹰生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养
将人三阴性乳腺癌细胞系(MDA-MB-231)置于含10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的DMEM培养基中,在含5%CO2、37℃恒温培养箱中培养,待细胞融合至80%~90%进行传代。
1.2.2 叶酸修饰脂质体槲皮素的制备
将槲皮素与卵磷脂、脑磷脂、胆固醇、聚乙二醇混合,再与氯仿混合后溶解于二甲基亚砜中,经真空干燥、水合反应、超声波破碎和微孔滤膜过滤,得到槲皮素脂质体,与N, N-羰基二咪唑和吡啶混合搅拌后加入三乙胺,避光反应6 h后加入含叶酸的二甲基亚砜溶液,再避光反应24 h后加入冰乙醚,抽滤得到滤饼后溶于丙酮,过滤再旋转蒸发至半干状,真空干燥备用,进行细胞实验室时用DMSO溶解,再用完全培养基稀释成需要的浓度。
1.2.3 CCK-8法检测FLQ对TNBC细胞活力的影响
取对数生长期的MDA-MB-231细胞,按3×103/孔接种于96孔板内,24 h后更换为不同浓度的FLQ(0、1、2、4、8、16、32、64、128 μmol/L),分别于FLQ处理后48 h,按照CCK-8试剂盒说明书,向每孔加入100 µl检测液,置于培养箱中孵育2 h,酶标仪检测450 nm处的吸光度值,选择合适的FLQ浓度进行后续实验。细胞活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.2.4 克隆形成实验检测FLQ对TNBC细胞增殖能力的影响
取对数生长期的MDA-MB-231细胞消化离心(1 000 r/min, 5 min),按200个/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,置于细胞培养箱中连续培养14天,终止培养后,用甲醛固定后结晶紫染色,计数>50个细胞的克隆数。
1.2.5 流式细胞术检测FLQ对TNBC细胞凋亡的影响
取对数生长期的MDA-MB-231细胞消化离心,按3×105/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,置于细胞培养箱中培养48 h,收集细胞,预冷的PBS冲洗,1 200 r/min,离心5 min,弃上清液,100 μl Binding buffer制细胞悬液,依次加入Annexin V-FITC和PI染色液各5 μl,室温避光孵育15 min。加入400 μl Binding buffer混悬细胞后上流式细胞仪检测细胞凋亡率。
1.2.6 流式细胞术检测FLQ对TNBC细胞内ROS水平的影响
按照1.2.5分组给药处理细胞48 h,收集细胞,PBS冲洗,1 500 r/min,离心5 min,弃上清液,加入100 μl稀释好的DCFH-DA探针,37℃避光孵育20 min,流式细胞仪检测细胞内ROS水平。
1.2.7 流式细胞术检测FLQ对TNBC细胞线粒体膜电位的影响
按照1.2.5分组给药处理细胞48 h,收集细胞,PBS冲洗,每孔加入1 ml培养基+1 ml JC-1工作液,充分混匀后37℃孵育20 min,1 500 r/min,离心5 min,弃上清液,1×JC-1染色缓冲液洗涤,最后加入适量JC-1染色缓冲液冲悬后,流式细胞仪检测线粒体膜电位。
1.2.8 Western blot检测JAK2/STAT3信号通路及凋亡相关蛋白的表达
取对数生长期的MDA-MB-231细胞以4×105个/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,48 h后提取总蛋白,BCA定量法定量后,加入5×蛋白上样缓冲液,100℃水浴使蛋白变性。每孔20 μg进行蛋白凝胶电泳,湿法转至PVDF膜,5%脱脂奶粉封闭,TBST洗膜,一抗4℃孵育过夜,TBST洗涤后加入二抗,室温下孵育1 h,TBST洗膜,加入ECL发光液,凝胶成像采集系统采集凝胶图像,Image J软件进行后续分析。
1.3 统计学方法
SPSS 23.0和Graphpad 9.0软件进行统计学分析,结果以均数±标准差表示。两独立样本间的比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 FLQ对MDA-MB-231细胞活力的抑制作用
为检测FLQ对MDA-MB-231细胞活性的影响,我们使用不同浓度的FLQ作用于MDA-MB-231细胞48 h后,CCK-8检测细胞活性。结果显示:FLQ可抑制MDA-MB-231细胞活性,并且药物浓度越大,抑制作用越强,呈现剂量依赖性,见图1;FLQ作用于MDA-MB-231的IC50为20.69 μmol/L,因此,采用20 μmol/L的FLQ浓度作用48 h进行后续实验。
2.2 FLQ对MDA-MB-231细胞增殖的抑制作用
与对照组相比,FLQ处理组克隆数量明显减少(P=0.023),说明FLQ可以抑制MDA-MB-231细胞增殖,图2。
2.3 FLQ诱导MDA-MB-231细胞凋亡
与对照组相比,FLQ处理组细胞凋亡显著,细胞凋亡率明显升高(P<0.001),说明FLQ可以诱导MDA-MB-231细胞凋亡,见图3。
2.4 FLQ促进MDA-MB-231细胞线粒体膜电位坍塌
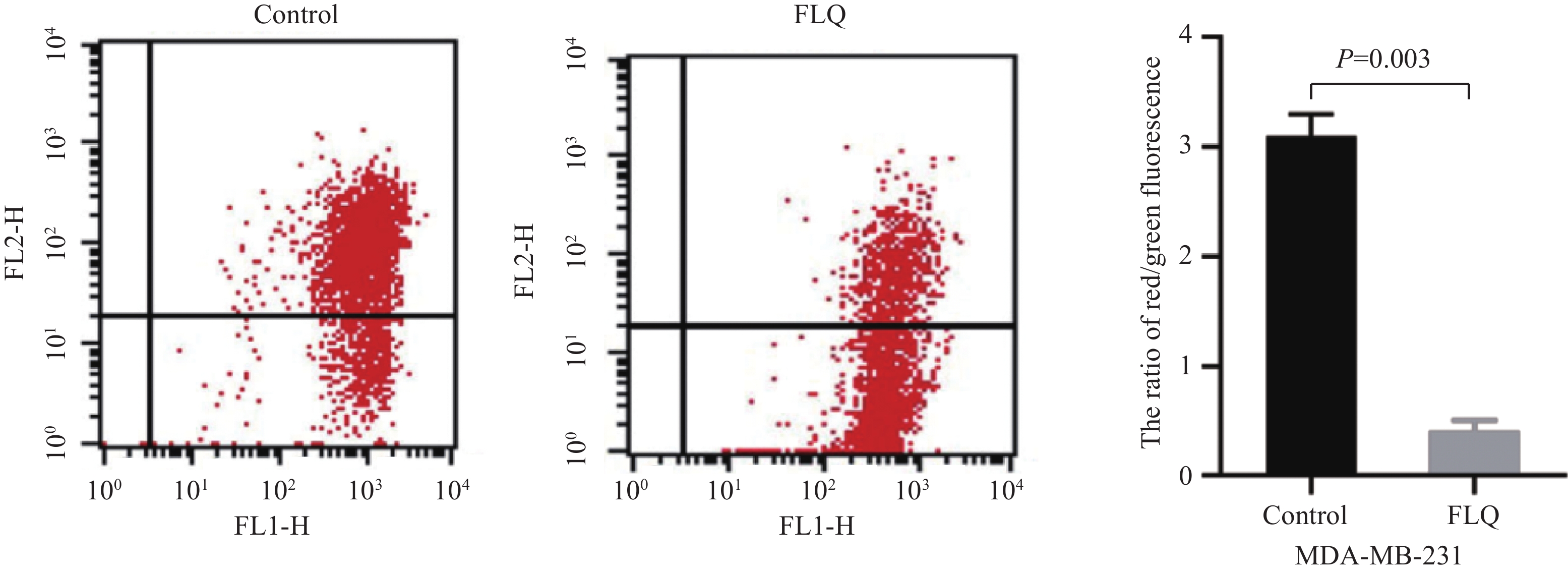
线粒体膜电位下降是凋亡的早期表现,一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程。我们用JC-1染料检测了MDA-MB-231细胞线粒体膜电位的变化。流式细胞术检测结果显示:对照组细胞线粒体膜电位处于较高水平,FLQ处理组细胞线粒体膜电位处于较低水平,两组差异有统计学意义(P=0.003),见图4。提示FLQ对线粒体功能有不利影响,导致MDA-MB-231细胞线粒体膜电位坍塌。
2.5 FLQ促进MDA-MB-231细胞ROS生成
与对照组相比,FLQ处理组生成绿色DCFH荧光信号的细胞比例明显升高(P=0.034),见图5,表明FLQ促进MDA-MB-231细胞内ROS的生成。
2.6 FLQ通过靶向JAK2/STAT3信号通路促进MDA-MB-231细胞凋亡
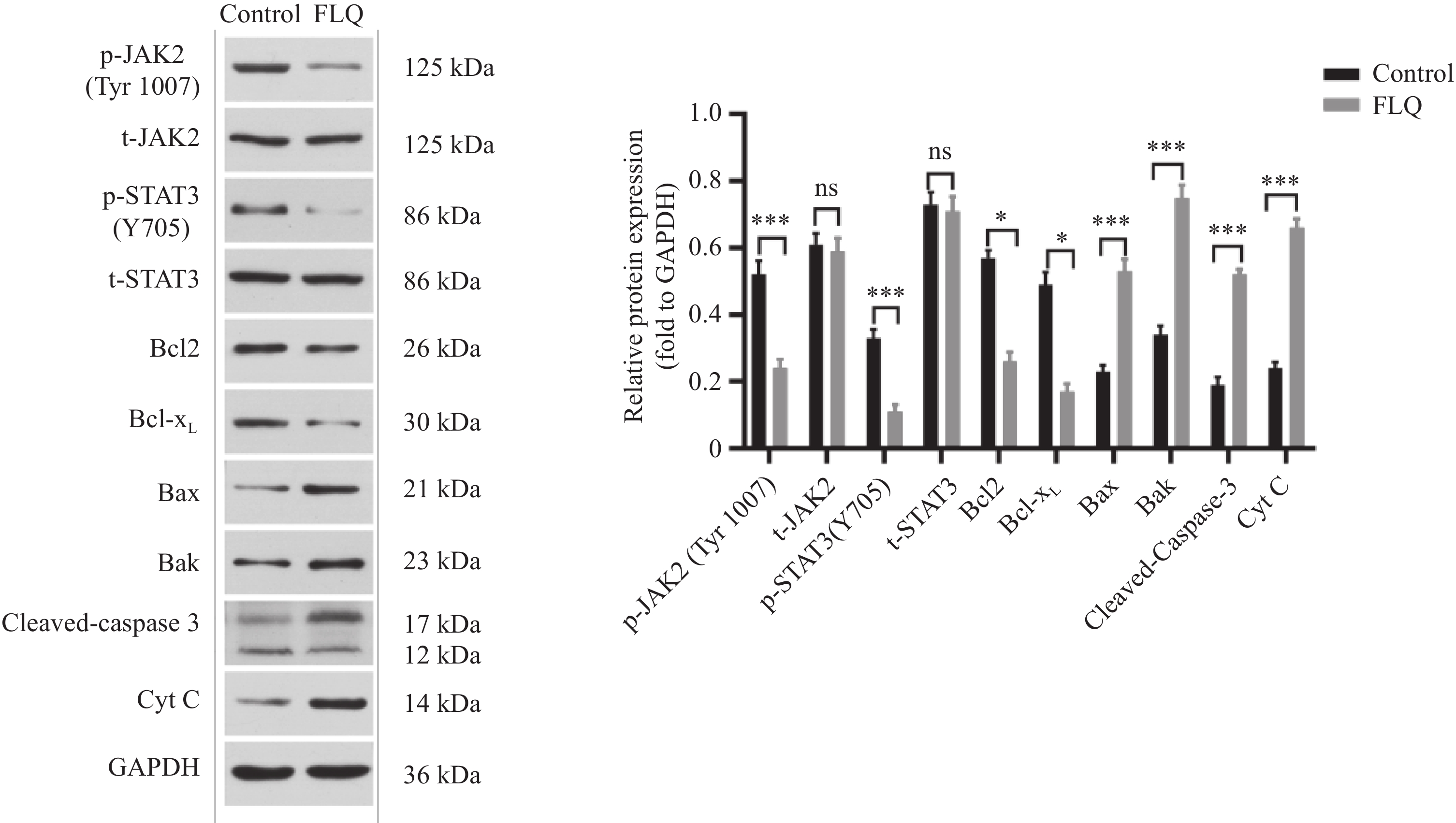
Western blot检测JAK2/STAT3信号通路中相关蛋白t-JAK2、p-JAK2、t-STAT3、p-STAT3及凋亡相关蛋白Bcl2、Bcl-xL、Bax、Bak、Cyt C、Cleaved-Caspase-3表达。结果显示:与对照组相比,FLQ处理组p-JAK2、p-STAT3表达量明显降低(P<0.001),但t-JAK2、t-STAT3的表达量无明显变化;促凋亡蛋白Bax、Bak、Cyt C、Cleaved-Caspase-3表达量明显升高(P<0.001),而抗凋亡蛋白Bcl2、Bcl-xL表达量明显降低(P=0.037,0.028),见图6。
3 讨论
TNBC是雌激素受体、孕激素受体以及人表皮生长因子受体2均阴性的乳腺癌,约占所有乳腺癌的10%~15%。由于缺乏有效的治疗靶点,TNBC的治疗一直极具挑战性。尽管目前探索TNBC潜在治疗靶点的研究较多,但一直未有突破性进展。TNBC仍缺乏特异有效的治疗药物,整体预后较差[16]。近年来,中药在肿瘤治疗中因其高效低毒的特点受到了越来越多的关注。不断有研究证实中药单体成分可通过调节多种生物学过程,发挥抗肿瘤作用[17-18]。
槲皮素作为多种中药的黄酮类成份,具有多靶点和不易耐药的优势,可以通过调节多种信号通路靶点蛋白抑制肿瘤的发生和发展进程,还可逆转化疗耐药、增加放疗敏感性[19-20]。但槲皮素水溶性较差、代谢较快、半衰期较短,生物利用度较低的特点,限制了其在临床上的使用[21]。近年来,纳米靶向给药体系的研究发展迅速, 将传统的抗肿瘤药物分子以包埋、吸附、囊封或者共价键合的形式,结合在具有纳米尺度的载体上(如脂质体、胶束、纳米粒等),可以一定程度上提高药物溶解性,增加药物的靶向性,延长药物体内循环时间[22]。
基于肿瘤微环境对纳米载体进行有效的表面修饰,可进一步提高药物的靶向递送效率。叶酸是一种小分子维生素,具有无毒、无免疫原性、生物相容性好、结构稳定性高、易于合成与修饰等优点[23]。叶酸受体是一种N-糖基化蛋白,与叶酸有很高的结合亲和力,包括乳腺癌在内的许多肿瘤细胞表面高度表达,但在正常组织中表达水平非常低[24]。在肿瘤治疗中利用叶酸与其受体的特异性结合,能将药物聚集于肿瘤部位,同时减少对正常细胞的毒性,显著增加疗效[25]。
基于此,本研究将槲皮素包载在脂质体中,并用叶酸加以修饰,构建了FLQ,赋予其肿瘤靶向性,在提高其在体内的生物利用度的同时降低全身的不良反应[15]。不受控制的细胞增殖和逃避细胞凋亡是肿瘤的两大特征,抑制增殖和诱导凋亡成为治疗肿瘤的重要途径。本研究结果显示,FLQ可抑制TNBC细胞MDA-MB-231增殖,并呈浓度依赖性;还可促进MDA-MB-231细胞凋亡。
线粒体凋亡途径是细胞凋亡的主要分子途径,线粒体膜电位降低是其发生的特征性标志[17]。本研究中,FLQ可诱导MDA-MB-231细胞线粒体膜电位坍塌,并上调细胞内ROS水平,提示FLQ可能诱导线粒体凋亡途径。线粒体凋亡途径主要受Bcl-2家族蛋白调控。Bcl-2家族蛋白由促凋亡蛋白(Bax等)和抗凋亡蛋白(Bcl-2等)构成,Bcl-2与Bax构成异源二聚体,维持线粒体外膜的完整性,阻止线粒体凋亡反应。在凋亡信号刺激下,Bcl2/Bax比值的发生变化,导致线粒体膜电位降低及通透性增加,释放Cyt C,激活下游Caspase级联反应,启动线粒体凋亡途径[17]。本研究中,FLQ下调Bcl2/Bax比值以及上调Cyt C、Cleaved-Caspase-3蛋白表达,进一步说明FLQ通过诱导线粒体凋亡途径而发挥体外抗TNBC作用。
大量研究表明,JAK2/STAT3信号通路在多种肿瘤中异常活化,发挥其促进肿瘤生长、转移、增强耐药及免疫逃逸的作用。JAK2、STAT3是该通路主要效应子。胞外信号与受体胞外域结合后,激活JAK2并使之磷酸化,随后p-JAK2磷酸化其下游底物STAT3,p-STAT3发生二聚化并转移到细胞核,在细胞核内调节基因转录[26]。既往研究发现,抑制JAK2/STAT3信号通路可诱导肝癌细胞经线粒体途径凋亡,提示该通路参与调控线粒体凋亡通路[27]。本研究结果显示,FLQ显著降低JAK2、STAT3磷酸化水平,同时显著上调Bcl2表达而下调Bax表达,说明FLQ通过作用JAK2/STAT3信号通路而激活线粒体凋亡途径。
综上所述,本研究证实FLQ抑制TNBC细胞MDA-MB-231细胞增殖并诱导其凋亡,阐明FLQ通过靶向JAK2/STAT3信号通路而激活线粒体凋亡途径的分子机制,揭示了FLQ抗TNBC的科学内涵,为FLQ的药效发挥提供理论依据。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:陈凤霞:实验操作、论文撰写、数据整理、统计学分析浦飞飞:研究指导、论文审阅及修改 -
-
[1] Chen FX, Wang QQ, Yu XY, et al. MCPIP1-mediated NFIC alternative splicing inhibits proliferation of triple-negative breast cancer via cyclin D1-Rb-E2F1 axis[J]. Cell Death Dis, 2021, 12(4): 370. doi: 10.1038/s41419-021-03661-4
[2] Waks AG, Wuner EP. Breast Cancer Treatment: A Review[J]. JAMA, 2019, 321(3): 288-300. doi: 10.1001/jama.2018.19323
[3] Nyrop KA, Damone EM, Deal AM, et al. Patient-reported treatment toxicity and adverse events in Black and White women receiving chemotherapy for early breast cancer[J]. Breast Cancer Res Treat, 2022, 191(2): 409-422. doi: 10.1007/s10549-021-06439-6
[4] Cheng GR, Pi ZF, Zhuang XY, et al. The effects and mechanisms of aloe-emodin on reversing adriamycin-induced resistance of MCF-7/ADR cells[J]. Phytother Res, 2021, 35(7): 3886-3897. doi: 10.1002/ptr.7096
[5] 王博, 卢义, 魏莱, 等. 基于网络药理学探讨柴胡对4种分子分型乳腺癌的治疗机制[J]. 世界中医药, 2022, 17(11): 1547-1552. [Wang B, Lu Y, Wei L, et al. Mechanism of bupleuri radix in treatment of four molecular types of breast cancer based on network pharmacology[J]. Shi Jie Zhong Yi Yao, 2022, 17(11): 1547-1552.] doi: 10.3969/j.issn.1673-7202.2022.17.010 Wang B, Lu Y, Wei L, et al. Mechanism of bupleuri radix in treatment of four molecular types of breast cancer based on network pharmacology[J]. Shi Jie Zhong Yi Yao, 2022, 17(11): 1547-1552. doi: 10.3969/j.issn.1673-7202.2022.17.010
[6] 马纳, 李亚静, 范吉平. 槲皮素药理作用研究进展[J]. 辽宁中医药大学学报, 2018, 20(8): 221-224. [Ma N, Li YJ, Fang JP. Research Progress on Pharmacological Action of Quercetin[J]. Liaoning Zhong Yi Yao Da Xue Xue Bao, 2018, 20(8): 221-224.] Ma N, Li YJ, Fang JP. Research Progress on Pharmacological Action of Quercetin[J]. Liaoning Zhong Yi Yao Da Xue Xue Bao, 2018, 20(8): 221-224.
[7] 徐瑞雪, 王宇. 槲皮素抗肿瘤作用研究进展[J/OL]. 中成药, (2023-05-31). https://kns.cnki.net/kcms2/detail/31.1368.R.20230530.1600.002.html. [Xu RX, Wang Y. Research progress on antitumor effects of quercetin[J/OL]. Zhong Cheng Yao, (2023-05-31). https://kns.cnki.net/kcms2/detail/31.1368.R.20230530.1600.002.html.] Xu RX, Wang Y. Research progress on antitumor effects of quercetin[J/OL]. Zhong Cheng Yao, (2023-05-31). https://kns.cnki.net/kcms2/detail/31.1368.R.20230530.1600.002.html.
[8] He CX, Lu XH, Li J, et al. The effect of quercetin on cervical cancer cells as determined by inducing tumor endoplasmic reticulum stress and apoptosis and its mechanism of action[J]. Am J Transl Res, 2021, 13(5): 5240-5247.
[9] 吴洪皓, 杨华, 吴鹏. 槲皮素对A549细胞PI3K/Akt信号通路及肿瘤恶性特征的调控机制[J]. 中成药, 2021, 43(12): 3476-3479. [Wu HH, Yang H, Wu P. Regulation mechanism of quercetin on PI3K/Akt signaling pathway and malignant characteristics of A549 cells[J]. Zhong Cheng Yao, 2021, 43(12): 3476-3479.] doi: 10.3969/j.issn.1001-1528.2021.12.042 Wu HH, Yang H, Wu P. Regulation mechanism of quercetin on PI3K/Akt signaling pathway and malignant characteristics of A549 cells[J]. Zhong Cheng Yao, 2021, 43(12): 3476-3479. doi: 10.3969/j.issn.1001-1528.2021.12.042
[10] 高丽枫, 李秀丽, 张雪辉, 等. 槲皮素在肝细胞癌中的作用机制研究进展[J]. 赤峰学院学报(自然科学版), 2021, 37(6): 65-70. [Gao LF, Li XL, Zhang XH, et al. Research progress on the mechanism of quercetin in hepatocellular carcinoma[J]. Chifeng Xue Yuan Xue Bao (Zi Ran Ke Xue Ban), 2021, 37(6): 65-70.] Gao LF, Li XL, Zhang XH, et al. Research progress on the mechanism of quercetin in hepatocellular carcinoma[J]. Chifeng Xue Yuan Xue Bao (Zi Ran Ke Xue Ban), 2021, 37(6): 65-70.
[11] Ayele TM, Muche ZT, Teklemariam AB, et al. Role of JAK2/STAT3 Signaling Pathway in the Tumorigenesis, Chemotherapy Resistance, and Treatment of Solid Tumors: A Systemic Review[J]. J Inflamm Res, 2022, 15: 1349-1364. doi: 10.2147/JIR.S353489
[12] Jiang YX, Di YY, Pan YF, et al. Total Flavonoids from Radix Glycyrrhiza Exert Anti-Inflammatory and Antitumorigenic Effects by Inactivating iNOS Signaling Pathways[J]. Evid Based Complement Alternat Med, 2018, 2018: 6714282.
[13] 吕琳, 李静. 槲皮素调控JAK2/STAT3对直肠癌细胞生物活性的影响[J]. 中国现代普通外科进展, 2023, 26(1): 7-12. [Lyu L, Li J. Mechanism of quercetin on regulating the biological activity of the JAK2/STAT3 signaling pathway on rectal cancer cells[J]. Zhongguo Xian Dai Pu Tong Wai Ke Jin Zhan, 2023, 26(1): 7-12.] Lyu L, Li J. Mechanism of quercetin on regulating the biological activity of the JAK2/STAT3 signaling pathway on rectal cancer cells[J]. Zhongguo Xian Dai Pu Tong Wai Ke Jin Zhan, 2023, 26(1): 7-12.
[14] 赵艳, 郑彩霞, 万秋园, 等. 槲皮素与FSCN1基因siRNA联合对卵巢癌生长抑制及免疫功能的影响研究[J]. 临床和实验医学杂志, 2018, 17(18): 1947-1951. [Zhao Y, Zheng CX, Wan QY, et al. Effects of quercetin combined with FSCN1 gene siRNA on growth inhibition and immune function in ovarian cancer[J]. Lin Chuang He Shi Yan Yi Xue Za Zhi, 2018, 17(18): 1947-1951.] doi: 10.3969/j.issn.1671-4695.2018.18.013 Zhao Y, Zheng CX, Wan QY, et al. Effects of quercetin combined with FSCN1 gene siRNA on growth inhibition and immune function in ovarian cancer[J]. Lin Chuang He Shi Yan Yi Xue Za Zhi, 2018, 17(18): 1947-1951. doi: 10.3969/j.issn.1671-4695.2018.18.013
[15] Jing DD, Wu W, Chen FX, et al. Quercetin encapsulated in folic acid-modified liposomes is therapeutic against osteosarcoma by non-covalent binding to the JH2 domain of JAK2 Via the JAK2-STAT3-PDL1[J]. Pharmacol Res, 2022, 182: 106287. doi: 10.1016/j.phrs.2022.106287
[16] So JY, Ohm J, Lipkowitz S, et al. Triple negative breast cancer (TNBC): Non-genetic tumor heterogeneity and immune microenvironment: Emerging treatment options[J]. Pharmacol Ther, 2022, 237: 108253. doi: 10.1016/j.pharmthera.2022.108253
[17] 郑倩, 王晓珊, 林蔓婷, 等. 异乌药内酯通过ROS介导的线粒体凋亡途径诱导A549细胞凋亡的研究[J]. 惠州学院学报, 2023, 43(3): 35-39. [Zheng Q, Wang XS, Lin MT, et al. Isolinderalactone induced A549 cells apoptosis via ROS-mediated mitochondrial apoptotic pathway[J]. Huizhou Xue Yuan Xue Bao, 2023, 43(3): 35-39.] Zheng Q, Wang XS, Lin MT, et al. Isolinderalactone induced A549 cells apoptosis via ROS-mediated mitochondrial apoptotic pathway[J]. Huizhou Xue Yuan Xue Bao, 2023, 43(3): 35-39.
[18] Jing DD, Chen XZ, Zhang ZH, et al. 2-Hydroxy-3-methylanthraquinone inhibits homologous recombination repair in osteosarcoma through the MYC-CHK1-RAD51 axis[J]. Mol Med, 2023, 29(1): 15. doi: 10.1186/s10020-023-00611-y
[19] Zhou YY, Zhang JH, Wang KL, et al. Quercetin overcomes colon cancer cells resistance to chemotherapy by inhibiting solute carrier family 1, member 5 transporter[J]. Eur J Pharmacol, 2020, 881: 173185. doi: 10.1016/j.ejphar.2020.173185
[20] 李怡, 陈其章, 范临夏, 等. 槲皮素协同影响DNA修复和ROS水平提高NSCLC细胞的放疗敏感性[J]. 中药药理与临床, 2023, 39(11): 62-67. [Li Y, Chen QZ, Fan LX, et al. Quercetin Affects Both DNA Repair and ROS Level to Improve Radiosensitivity of NSCLC Cells[J]. Zhong Yao Yao Li Yu Lin Chuang, 2023, 39(11): 62-67.] Li Y, Chen QZ, Fan LX, et al. Quercetin Affects Both DNA Repair and ROS Level to Improve Radiosensitivity of NSCLC Cells[J]. Zhong Yao Yao Li Yu Lin Chuang, 2023, 39(11): 62-67.
[21] 李阳杰, 姜亚玲, 刘秋伟, 等. 槲皮素衍生物的生物活性研究进展[J]. 中国药学杂志, 2021, 56(3): 175-180. [Li YJ, Jiang YL, Liu QW, et al. Progress in research on biological activity of quercetin derivatives[J]. Zhongguo Yao Xue Za Zhi, 2021, 56(3): 175-180.] Li YJ, Jiang YL, Liu QW, et al. Progress in research on biological activity of quercetin derivatives[J]. Zhongguo Yao Xue Za Zhi, 2021, 56(3): 175-180.
[22] Hettiarachchi SD, Graham RM, Mintz KJ, et al. Triple conjugated carbon dots as a nano-drug delivery model for glioblastoma brain tumors[J]. Nanoscale, 2019, 11(13): 6192-6205. doi: 10.1039/C8NR08970A
[23] Liu HF, Li ZH, Sun YQ, et al. Synthesis of Luminescent Carbon Dots with Ultrahigh Quantum Yield and Inherent Folate Receptor-Positive Cancer Cell Targetability[J]. Sci Rep, 2018, 8(1): 1086. doi: 10.1038/s41598-018-19373-3
[24] Bittleman KR, Dong S, Roman M, et al. Folic Acid-Conjugated Cellulose Nanocrystals Show High Folate-Receptor Binding Affinity and Uptake by KB and Breast Cancer Cells[J]. ACS Omega, 2018, 3(10): 13952-13959. doi: 10.1021/acsomega.8b01619
[25] Afzal SM, Shareef MZ, Dinesh T, et al. Folate-PEG-decorated docetaxel lipid nanoemulsion for improved antitumor activity[J]. Nanomedicine (Lond), 2016, 11(16): 2171-2184. doi: 10.2217/nnm-2016-0120
[26] 李馥延, 霍达, 栾诗佳, 等. IL-6/JAK2/STAT3信号通路在肿瘤中的作用[J]. 生命的化学, 2021, 41(3): 535-540. [Li FY, Huo D, Luan SJ, et al. The role of the IL-6/JAK2/STAT3 signaling pathway in tumors[J]. Sheng Ming De Hua Xue, 2021, 41(3): 535-540.] Li FY, Huo D, Luan SJ, et al. The role of the IL-6/JAK2/STAT3 signaling pathway in tumors[J]. Sheng Ming De Hua Xue, 2021, 41(3): 535-540.
[27] Liu YY, Zheng Q, Fang B, et al. Germacrone induces apoptosis in human hepatoma HepG2 cells through inhibition of the JAK2/STAT3 signalling pathway[J]. J Huazhong Univ Sci Technolog Med Sci, 2013, 33(3): 339-345. doi: 10.1007/s11596-013-1121-z




 下载:
下载: