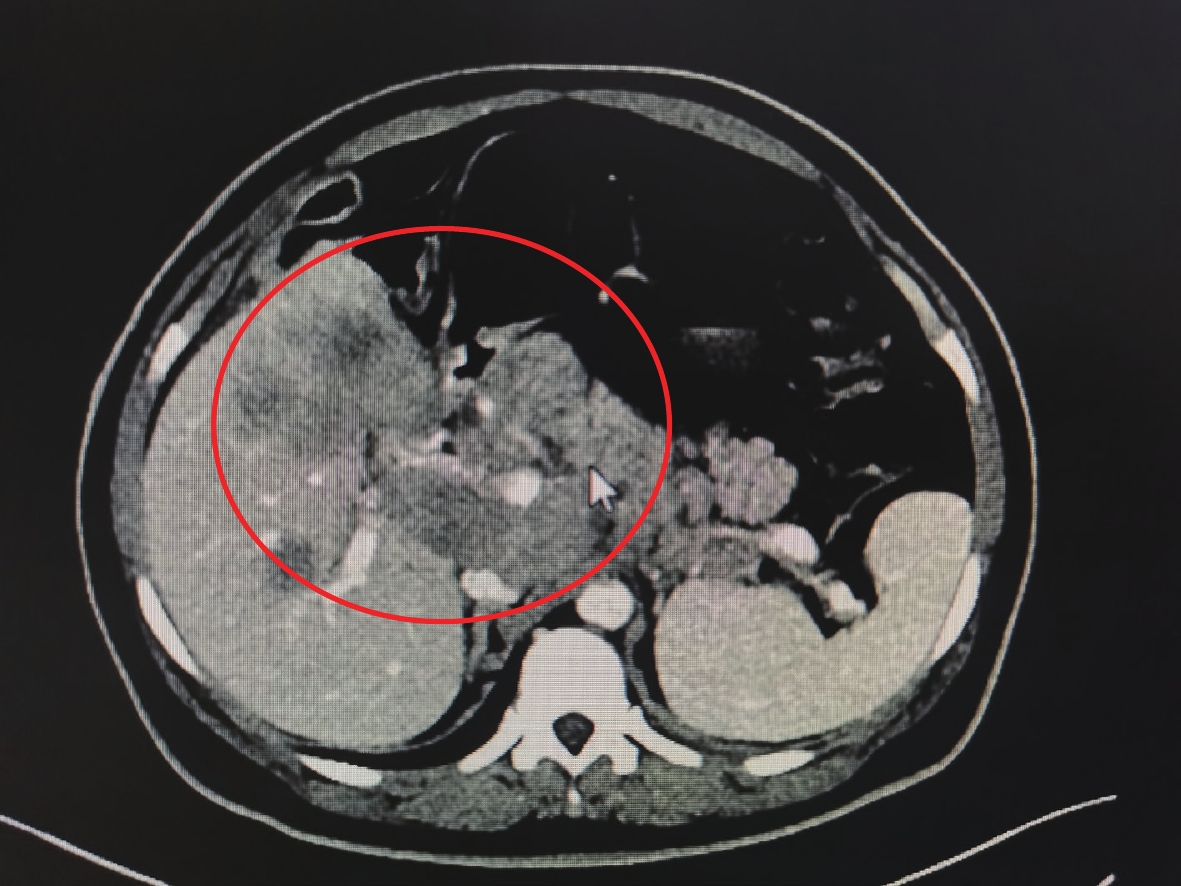
Small-Cell Neuroendocrine Carcinoma of Gallbladder Complicated with Intestinal Obstruction: A Case Report and Literature Review
-
-
关键词:
- 胆囊小细胞神经内分泌癌 /
- 病理组织学 /
- 免疫组织化学 /
- 转移 /
- 预后
-
0 引言
神经胶质瘤是脑肿瘤中最具侵袭性的类型,目前的标准治疗方式以完全/亚完全手术切除、化学药物治疗、放射治疗为主,其余治疗方法还包括免疫治疗、分子靶向治疗等。2021年世界卫生组织改编的中枢神经系统肿瘤分类第五版根据其组织学和分子特征将弥漫性胶质瘤分为成人型和儿童型,同时成人型又分为IDH野生型胶质母细胞瘤、IDH突变型星形细胞瘤、IDH突变型和1p/19q共缺失少突胶质细胞瘤三种[1]。近年来相关研究揭示了胶质瘤不同亚型的位置分布存在差异,尽管现在已经有关于部分胶质瘤细胞解剖起源的解释[2-3],但对于胶质瘤存在的空间分布差异机制仍不清楚。胶质瘤的解剖学特性及生物学特征赋予了其抵抗治疗的能力,本文回顾和总结了当前对于脑胶质瘤分布差异机制的研究进展,以及这些机制在胶质瘤的发生发展过程中的作用,并提出了一些潜在的治疗策略。
1 胶质瘤的位置特征
胶质瘤在大脑的分布较为广泛,但常见于额叶、颞叶、顶叶等幕上位置。过去对胶质瘤的解剖性特点并没有太多关注,一度被认为是随机事件。近年来,CT和MRI等影像技术在脑肿瘤的解剖及诊断方面起到了广泛且不可替代的作用,但是少有研究去分析胶质瘤分布的定量放射原理。随着脑网络连接组学的深入,基于体素的成像分析方法已被开发和应用于中枢神经系统疾病的解剖相关分析研究,与传统的图像分析技术相比,它具有自动化、客观性、全面性和可重复性等优点[4-5]。有研究首次使用神经影像定量分析,验证了低级别胶质瘤在分子生物的定位特征以额叶的IDH1突变最为常见,其起源细胞很有可能位于室管膜下区[6]。往后证实胶质瘤位于额叶的患者往往较年轻,IDH1突变常见,生存时间也更长[7],说明低级别胶质瘤的解剖发生位置与其分子特征特异匹配。胶质母细胞瘤是成人中最常见和最具侵袭性的脑肿瘤,具有高度的分子异质性[8-9]。它常发生于大脑的皮质,通过建立放射基因组模型发现EGFR、TP53及PTEN等与胶质瘤的成像显著相关[10]。有研究经过测序分析得到IDH1突变型胶质母细胞瘤表现出脑室下区延伸至周围额叶的高倾向性,且不受组织学亚型影响[2]。另外,通过基于体素水平的影像学定量分析发现P53突变状态与肿瘤位置相关,P53突变的胶质母细胞瘤往往位于侧脑室下区延伸至周围的额叶,而P53突变的低级别胶质瘤倾向位于颞叶[11]。
既然胶质瘤的发生并不是随机的,那么它的起源细胞在大脑发育的初级阶段是否就已经具备一定的解剖特征呢?答案是肯定的。解剖学定位、遗传生物标志物和组织学诊断是高度相关且交织在一起的,不同分子表型之间存在明显的解剖分布[12]。此前,许多发表的论文已经提出生物标志物和解剖定位之间可能存在联系的细胞起源理论[13-14],海马的脑室下区和齿状回是成人脑中的两个主要的神经干细胞生态位点[15-16],是目前最受公认的支持细胞起源理论的证据,大部分研究支持它们是幕上神经上皮肿瘤的来源[17-18]。
现代认知神经科学将大脑功能定义为由多个高度复杂的拓扑网络连接运作形成,功能区胶质瘤的发生位点往往侵犯拓扑网络结构的关键连接处,直接或间接地造成患者运动、语言、记忆和认知等重要神经功能的损伤,结合分子特征的改变,预后往往较差。目前对大脑功能网络的研究仍处于初期探索阶段,并为胶质瘤的空间分布作出了三个主要假设,分别为“连接组假设”、“细胞假设”和“遗传假设”。其中连接组学认为维持大量功能连接且代谢需求较高的中枢脑区发生肿瘤的概率更高[19-20]。有研究通过脑病变网络映射模型发现癫痫的发生和全脑功能网络之间的密切联系,当致痫性的肿块暴露于某些因素下时,可能引发多个静息态网络同时参与,而边缘和额顶的网络对于发生癫痫时的抵抗能力更脆弱一些[21]。这也许可以解释为什么处于额叶、颞叶以及顶叶等位置的脑胶质瘤容易诱发癫痫,也促使我们思考着肿瘤位点的特异性与肿瘤临床预后所存在的可能联系。
大量结果表明,胶质瘤的空间分布并不是随意发生的结果,大脑的解剖分区与生物标志存在着一定相匹配的联系,在系统发生和个体发生的背景下了解大脑肿瘤的时空进展顺序以及肿瘤解剖特征有助于为脑胶质瘤治疗长征的第一步指明方向。
2 肿瘤的信息交互通路
胶质瘤以弥漫性侵袭正常脑实质为主要特征,这种侵袭模式以往被称为谢勒二级结构,是胶质瘤局部复发的重要因素,相关研究通过特定诱导条件下引起某些趋化因子的表达来验证了谢勒结构[22]。趋化因子信号转导对于癌变、生长、血管生成、肿瘤浸润和转移至关重要。在高度血管化的胶质母细胞瘤中,受到某些信号调控后生成新的血管,来支持肿瘤的生长和迁移。其中SDF-1α/CXCR4分子信号在胶质瘤沿室管膜下区的增殖和肿瘤进展中发挥了重要作用[23]。其余相关如旁分泌因子Neuroligin-3(NLGN3)表达加强神经元活动可以刺激胶质瘤生长[24]。胶质瘤中有着活跃的神经通讯,神经元到部分神经胶质瘤细胞之间功能性突触结构及电回路的发现,表明了这种整合回路可能是胶质瘤恶性循环的基础[25]。谷氨酸作为大脑中介导兴奋的神经递质,其受体在皮质中广泛表达,分为离子型谷氨酸受体(iGluR)和代谢型谷氨酸受体(mGluR)两种类型,iGluR中又包括了三个亚型。当胶质瘤细胞中谷氨酸能系统过度活跃时,胞内升高的Ca2+能够影响神经胶质细胞代谢重编程、迁移、兴奋性毒性与癫痫,甚至潜在地促进低级别胶质瘤向高级别胶质瘤进展[26]。
另外谷氨酸能神经胶质细胞突触部分还能通过由α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor, AMPAR)亚型谷氨酸受体介导的神经胶质细胞突触(neurogliomal synapses, NGS)来影响肿瘤微管网络中的钙通讯,以形成回路的方式刺激胶质瘤的生长和侵袭[27],现有的AMPAR抑制性抗癫痫药物——吡仑帕奈的临床试验正是针对谷氨酸能机制治疗的重要体现[28]。神经营养因子对胶质瘤的增殖也具有一定调节作用,比如脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)能够结合胶质瘤干细胞的TrkB受体,驱动其生长[29]。肿瘤细胞劫取信号交流和对突触活跃区域的倾向机制是庞大而复杂的,结合其他的信号通路,针对胶质瘤主要的谷氨酸能系统也许能开发更有效的靶点。
3 肿瘤的炎性反应和免疫微环境景观
所有类型的恶性肿瘤几乎都会在原发部位中引起炎性反应和免疫应答,其所在的肿瘤微环境(tumor microenvironment, TME)是脑恶性肿瘤进展过程中的关键调节点。胶质瘤的微环境中除肿瘤细胞外,还包含了神经元、各类胶质细胞、胞外基质、周围血管、各种免疫细胞及许多非细胞成分(由肿瘤实质细胞表达或基质分泌)等,它们通过形成一个相对稳定的免疫抑制环境来支持着肿瘤的生长。虽然先前多数研究者认为大脑拥有免疫抑制特权,但是现在这个观点已经被推翻。现有的研究认为,大脑对一些具有抗原呈递特性的活化淋巴细胞和小胶质细胞的免疫攻击是敏感的[30]。近来的研究证实,在癌症进展过程中,多种炎性反应分子直接或间接通过招募免疫细胞促进癌变[31]。由于细胞起源及进化的原因,不同肿瘤类型所处的微环境也不相同,其生物学行为多种多样,包括自分泌和旁分泌、肿瘤细胞和非肿瘤基质细胞中的信号通路激活等。在胶质母细胞瘤中,富含炎性反应的TME已被证明是导致肿瘤进展为高度恶性肿瘤的原因[32],胶质瘤细胞还能通过某些代谢路径诱导和改变免疫细胞表型,促进肿瘤增殖、免疫抑制、转移及肿瘤耐药性的产生[33],下面简单概述肿瘤微环境中的炎性反应发生和免疫景观。
早期脑肿瘤的微环境是免疫抑制的,基本上没有外周免疫细胞的巡视;免疫细胞激活后,会产生具有细胞毒性并导致神经变性的炎性反应因子[34]。以往对中性粒细胞在肿瘤免疫环境中的作用研究并不深入,而后发现肿瘤细胞及其微环境中的其他细胞可以分泌相关生长因子和趋化因子来招募中性粒细胞,以IL-8为主[35]。相关研究认为,不同级别人脑胶质瘤组织中的中性粒细胞浸润水平与胶质瘤级别具有正相关性。中性粒细胞在肿瘤免疫中具有双重功能,在胶质瘤生长的早期,嗜中性粒细胞具有抗肿瘤的特性,一旦中性粒细胞被募集到神经胶质瘤微环境中,它们将被赋予新的分子特征[36]。中性粒细胞分泌的弹性蛋白酶是一种中性蛋白酶和细胞毒性介质,在损害脑组织的同时帮助胶质瘤细胞侵袭[37]。S100蛋白家族基因表达与神经胶质瘤的免疫细胞浸润显著相关[38],胶质瘤患者中表达S100A8和S100A9的髓源性抑制细胞水平升高,精氨酸酶生成增加,提示了化疗效果不佳的可能原因[39]。结合先前的研究结果,S100蛋白家族可能在发生失调后通过参与慢性炎性反应的形成从而改变微环境来促进肿瘤的进一步发展甚至转移。
髓样细胞在肿瘤微环境中同样起到了重要的作用。胶质瘤相关巨噬细胞属于髓系细胞系,定义为中枢神经系统驻留的小胶质细胞和骨髓来源的巨噬细胞,是胶质瘤炎性反应浸润中的主要免疫细胞群,二者的分化取决于多种细胞因子激活,在微环境中以不同的极化形式促进或抑制肿瘤进展[40]。骨髓来源的抑制细胞在胶质瘤的炎性反应环境影响下可形成MHCⅡ类分子的缺失,扰乱T细胞的免疫功能来负向调控TME的免疫性能,不难得知髓系细胞是胶质瘤免疫治疗抵抗的重要媒介[41]。
大部分活跃的胶质瘤都具有相适应的炎性反应环境,它们劫取和控制着炎性反应细胞及趋化因子,这和肿瘤处于血供丰富的位置特点是相关的。尽管免疫治疗在了解胶质瘤的病理生理学以及在当前临床研究和试验中显示出巨大的潜在前景,但收效并不十分乐观,需要我们更深入地了解肿瘤微环境的成分及其功能,发现更多新的免疫生物机制。
4 肿瘤的代谢
细胞代谢的适应性改变是胶质瘤的重要特征之一,多种多样的代谢途径形成了一个高度可塑的生化网络,受基因、酶类和营养因子等众多因素的影响,高度代谢支持着细胞内稳态、生长、信号传递以及表观修饰。早在1930年,德国的生物化学家Otto Warburg就发现了沃伯格效应。在实体肿瘤中,由于肿瘤组织迅速增长,而肿瘤组织内部血管系统尚不成熟时,导致了肿瘤组织内氧气和能量供应不足,微环境呈现出整体缺氧的趋势。因这部分能量主要靠糖酵解供应,不依赖氧的使用,该修饰细胞代谢又被称为“有氧糖酵解”,是癌细胞的典型特征。微血管是肿瘤细胞氧和营养物质的供应所,胶质母细胞瘤是血管高度异常化的肿瘤,由于异常血管导致氧压不平衡,肿瘤内大量血管坏死,同时又加剧了微血管增生。缺氧诱导因子1(HIF-1α)是缺氧激活的主要转录因子,受到氧和多种信号通路的调节,参与激活血管生成(上调血管内皮生长因子等)、免疫抑制和代谢重编程,其中代谢方面通过激活无氧和有氧糖酵解、帮助癌细胞摄取谷氨酰胺[42]和调节脂质代谢来产生和积累乳酸,确保氧化还原稳态以及满足肿瘤细胞代谢增殖的需求[43],因此HIF-1α在加强有氧糖酵解表观修饰中尤为重要[44]。肿瘤代谢途径除了糖酵解,氧化磷酸化也是肿瘤细胞活跃发展的模式[45]。免疫细胞在胶质细胞癌变和加速其发展中同样受代谢的影响,微环境往往通过影响新陈代谢方式诱导免疫细胞发生表观遗传的可塑性改变,支持胶质瘤的进展[46]。脂质代谢也有助于免疫细胞重编程和免疫反应,脂质代谢对于肿瘤相关巨噬细胞至关重要,它会产生更多癌细胞存活所必需的细胞因子和趋化因子[47]。此外,其余分子如色氨酸代谢、谷氨酰胺代谢等和脂质代谢及糖代谢相关联,形成了一个推动肿瘤发展密不可分的整体[48]。
不同的器官在营养和氧气利用以及氧化应激水平方面都有独特的倾向,以利于免疫抑制和代谢改变的环境塑造。大脑需要通过高度代谢来维持脑网络连接的正常工作,这可能是胶质瘤位置常常处于脑功能结构关键点的原因之一。
5 肿瘤的血流灌注
血脑屏障是大脑组织与其他组织的交界地和保护墙,当胶质瘤形成,血脑屏障的结构和功能也随之发生变化:新生血管连接缺损、形成不良、某些转运蛋白的上调等,并在肿瘤不同区域表现出高渗透和分流,导致药物效率大大降低。纵使遗传特征与肿瘤解剖位置之间的联系已经得到一些探索,但关于血管生长调节最重要的因子——血管内皮生长因子(vascular endothelial growth factor, VEGF)与肿瘤之间的解剖关联仍不清楚。VEGF是参与内皮细胞激活的主要促血管生成因子,有研究报道基于体素的映射分析,发现VEGF高表达的胶质瘤可能起源于左侧顶叶和右侧尾状核,低表达的胶质瘤可能起源于右侧脑室后部[49]。了解VEGF遗传特性与脑肿瘤解剖特征的相关性,有助于改进病理分类和改善肿瘤治疗方案。目前关于血管生成的机制仍然是个复杂的问题,像比较熟悉的PI3K/AKT/mTOR通路控制着神经胶质瘤干细胞增殖、侵袭、血管生成和转移,诱导关键血管内皮因子的过度表达在血管生成中发挥关键作用,靶向血管生成因子也是当下正在研究的目标之一。
6 讨论
胶质瘤是神经外科学长期以来难以取得有效治疗的疾病,患者的预后极差。肿瘤细胞的生长机制复杂且难以调控,针对性的靶向药物及相关免疫治疗面临着巨大的挑战,术后积极的放化疗具有一定的局限性。近年来随着对脑连接组学的研究越来越深入,我们知道不同类型的神经胶质瘤定位于不同的大脑区域[5],并通过建立放射基因组模型分析大脑区域的分子遗传关联,从临床应用上看,影像组学特征所预测的内容与胶质瘤生物学特性密切关联,了解神经胶质瘤定位的机制可以更好地制定个性化治疗方案。
胶质瘤顽固的生长模式表现为它的无限增殖能力。细胞焦亡本质是一种程序性细胞死亡方式,对肿瘤生长发挥着双重作用,不同的焦亡修饰所带来的影响也不同[50];针对肿瘤的免疫治疗方面,比如中性粒细胞的浸润,这涉及免疫抑制形成和血管生成的调节,根据它的双重调节作用,我们可以调节中性粒细胞的数量及功能来提高TME疗效。改变焦亡调节模式、调控中性粒细胞和调节性T细胞等细胞亚群的信号通路及其与免疫检查点的相互作用,将为神经胶质瘤患者提供更合适的免疫疗法。另外我们仍需积极探究更好的药物作用方式,以优化药物向中枢系统的输送。分子和组织学诊断的整合有助于神经胶质瘤患者的预测和预后价值,但与图像的完美集成还需要进行长期的大规模队列临床验证。
7 结论
不同类型的胶质瘤可能源于不同的前体细胞,这些前体细胞在大脑发育初期或发育过程中相对具有区域特异性,是有可能支持胶质瘤位置分布的证据之一。从胶质瘤的细胞起源理论到肿瘤生长中涉及的众多因素我们一并进行了讨论,揭示了胶质瘤非随机分布的事实。同时随着影像技术的创新开发,使用图像结合分子生物标志物的方法开始受到重用。我们探究肿瘤位置特征与生物标志物之间的关联,并分析其位置分布特征背后的原因,希望在不久的将来能够通过影像联合特异性分子标志使我们有更多的预判空间、治疗时限和精准治疗方案。后续我们仍需要解决比如图像配准带来的精确度挑战,同时,胶质瘤及其微环境背后蕴藏的众多生物学机制也值得我们不断挖掘。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:张 倩:文章撰写及修改徐志宏:病例提供及文章修改 -
-
[1] Wang P, Chen J, Jiang Y, et al. Neuroendocrine neoplasms of the gallbladder: a clinicopathological analysis of 13 patients and a review of the literature[J]. Gastroenterol Res Pract, 2021, 2021: 5592525.
[2] Do MY, Jang SI, Kang HP, et al. Comparison of the clinical features and outcomes of gallbladder neuroendocrine carcinoma with those of adenocarcinoma: a propensity scorematched analysis[J]. Cancers (Basel), 2021, 13(18): 4713. doi: 10.3390/cancers13184713
[3] Kumar K, Tariq H, Ahmed R, et al. Small-cell type, poorly differentiated neuroendocrine carcinoma of the gallbladder: a case report and review of the literature[J]. Case Rep Oncol Med, 2019, 2019: 8968034.
[4] Singh R, Balasubramanian I, Zhang L, et al. Metaplastic Paneth cells in extra-intestinal mucosal niche indicate a link to microbiome and inflammation[J]. Front Physiol, 2020, 11: 280. doi: 10.3389/fphys.2020.00280
[5] Shi CJ, Tian R, Wang M, et al. CD44+ CD133+ population exhibits cancer stem cell-like characteristics in human gallbladder carcinoma[J]. Cancer Biol Ther, 2010, 10(11): 1182-1190. doi: 10.4161/cbt.10.11.13664
[6] Park JH, Hong JY, Han KD, et al. Light-to-Moderate Alcohol Consumption Increases the Risk of Biliary Tract Cancer in Prediabetes and Diabetes, but Not in Normoglycemic Status: A Nationwide Cohort Study[J]. J Clin Oncol, 2022, 40(31): 3623-3632. doi: 10.1200/JCO.22.00145
[7] 郑强, 赵斌, 刘旭东, 等. 胆囊小细胞型神经内分泌癌并发副肿瘤性低钠血症1例报告[J]. 中国微创外科杂志, 2021, 21(10): 954-957. [Zheng Q, Zhao B, Liu XD, et al. Small-cell neuroendocrine carcinoma of gallbladder complicated by paraneoplastic hyponatremia: a case report[J]. Zhongguo Wei Chuang Wai Ke Za Zhi, 2021, 21(10): 954-957.] Zheng Q, Zhao B, Liu XD, et al. Small-cell neuroendocrine carcinoma of gallbladder complicated by paraneoplastic hyponatremia: a case report[J]. Zhongguo Wei Chuang Wai Ke Za Zhi, 2021, 21(10): 954-957.
[8] Adachi T, Haraguchi M, Irie J, et al. Gallbladder small-cell carcinoma: a case report and literature review[J]. Surg Case Rep, 2016, 2(1): 71. doi: 10.1186/s40792-016-0200-3
[9] 周东奎, 鲁明骞, 林雅欣, 等. 胆囊小细胞癌伴肝脏和腹膜后淋巴结转移1例报告及文献复习[J]. 吉林大学学报(医学版), 2021, 47(3): 747-752. [Zhou DK, Lu MQ, Lin YX, et al. Small-cell carcinoma of gallbladder with liver and retroperitoneal lymph node metastasis: A case report and literature review[J]. Jilin Da Xue Xue Bao(Yi Xue Ban), 2021, 47(3): 747-752.] Zhou DK, Lu MQ, Lin YX, et al. Small-cell carcinoma of gallbladder with liver and retroperitoneal lymph node metastasis: A case report and literature review[J]. Jilin Da Xue Xue Bao(Yi Xue Ban), 2021, 47(3): 747-752.
[10] Inoue D, Ozaka M, Muramatsu Y, et al. Neuroendocrine gallbladder cancer treated with cisplatin plus irinotecan-a case report[J]. Gan To Kagaku Ryoho, 2014, 41(6): 765-767.
[11] Okuyama Y, Fukui A, Enoki Y, et al. A large cell neuroendocrine carcinoma of the gall bladder: diagnosis with 18FDG-PET/CT-guided biliary cytology and treatment with combined chemotherapy achieved a long-term stable condition[J]. Jpn J Clin Oncol, 2013, 43(5): 571-574. doi: 10.1093/jjco/hyt033
[12] Usmani S, Pazooki M, Bilgrami SF. Small-cell carcinoma of the gallbladder: role of adjuvant chemotherapy[J]. J Gastrointest Cancer, 2010, 41(1): 84-87. doi: 10.1007/s12029-009-9122-7
[13] Ueno M, Ikeda M, Morizane C, et al. Nivolumab alone or in combination with cisplatin plus gemcitabine in Japanese patients with unresectable or recurrent biliary tract cancer: a non-randomised, multicentre, open-label, phase Ⅰ study[J]. Lancet Gastroenterol Hepatol, 2019, 4(8): 611-621. doi: 10.1016/S2468-1253(19)30086-X
[14] Vinik A, Bang Y, Raoul J, et al. Patient-reported outcomes (PROs) in patients (pts) with pancreatic neuroendocrine tumors (NET) receiving sunitinib (SU) in a phase Ⅲ trial[J]. J Clin Oncol, 2010, 28(15_suppl): 4003. doi: 10.1200/jco.2010.28.15_suppl.4003
[15] Elahi F, Ahmadzadeh A, Yadollahzaden M, et al. Neuroendocrine tumor of the gallbladder[J]. Arch Iran Med, 2013, 16(2): 123-125.
[16] Shimono C, Suwa K, Sato M, et al. Large cell neuroendocrine carcinoma of the gallbladder: Long survival achieved by multimodal treatment[J]. Int J Clin Oncol, 2009, 14(4): 351-355. doi: 10.1007/s10147-008-0843-6



 下载:
下载:




