DCLK1 Promotes Malignancy of A549 Cell Line by Activating FAK/PI3K/AKT/mTOR Pathway
-
摘要:目的
探讨双肾上腺素皮质样激酶1(DCLK1)对A549细胞增殖、迁移、侵袭等恶性生物学行为的影响,并探究可能涉及的相关分子机制。
方法慢病毒感染法建立稳定表达DCLK1分子的A549细胞系,反转录-聚合酶链技术和蛋白质印记法进行鉴定。CCK-8与平板克隆实验检测过表达DCLK1后细胞增殖能力变化。Transwell实验观察过表达DCLK1对细胞迁移与侵袭能力的影响。癌症基因组图谱(TCGA) 数据库分析DCLK1对肺腺癌细胞的调控富集通路,蛋白质印记法进行验证。
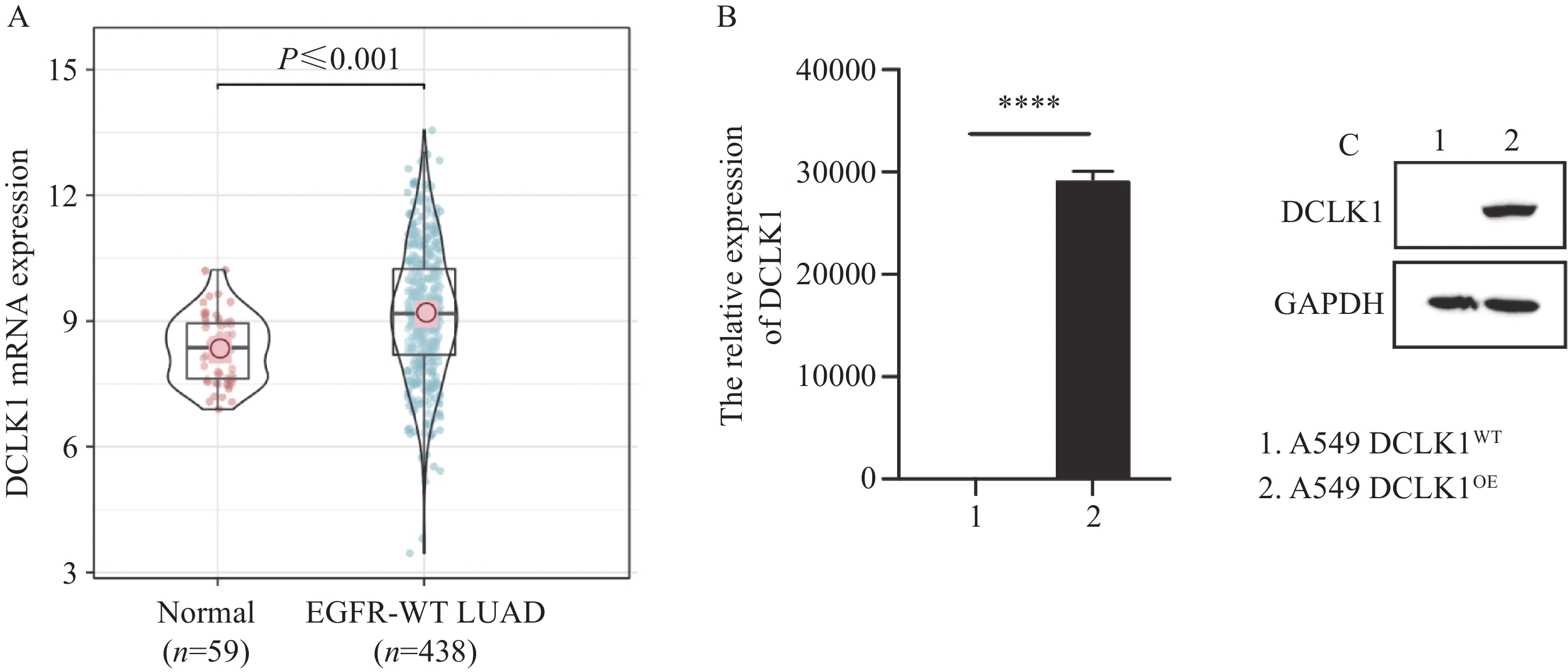
结果DCLK1在A549细胞中过表达可增加细胞的增殖、迁移与侵袭等能力,而抑制FAK/PI3K/AKT/mTOR信号通路可削弱DCLK1对A549细胞的恶性调控。
结论DCLK1通过激活FAK/PI3K/AKT/mTOR信号通路,促进A549细胞的恶性生物学行为。
-
关键词:
- 双肾上腺素皮质样激酶1 /
- A549细胞系 /
- FAK/PI3K/AKT/mTOR信号通路 /
- 增殖 /
- 迁移与侵袭
Abstract:ObjectiveTo investigate the effects of doublecortin-like kinase 1 (DCLK1) on the malignant biological behaviors, such as proliferation, migration, and invasion, of A549 cell line and their corresponding mechanisms.
MethodsDCLK1-overexpressing A549 cell lines were established through lentiviral infection, and DCLK1 expression was validated by using RT-PCR and Western blot analysis. Proliferation ability was assessed with CCK-8 and plate cloning assays, and migration and invasion abilities were examined with Transwell assays. The pathway regulated by DCLK1 in lung adenocarcinoma was analyzed on the basis of the TCGA lung adenocarcinoma cohort with pathway enrichment analysis and verified through Western blot analysis.
ResultsDCLK1 overexpression in A549 cells promoted cell proliferation, migration, and invasion. The inhibition of the FAK/PI3K/AKT/mTOR signaling pathway impaired the DCLK1-mediated malignant behavior of A549 cells.
ConclusionDCLK1 promotes the malignant behavior of A549 cells through the activation of the FAK/PI3K/AKT/mTOR signaling pathway.
-
0 引言
肝细胞癌是全球第六大常见癌症,同时也是癌症相关死亡的第三大原因。数据显示2020年全球新增肝癌病例超过900000例[1]。目前,甲胎蛋白(alpha-fetoprotein, AFP)是临床上诊治肝细胞癌最常用的生物标志物,但其特异性较差,筛查和诊断价值并不高[2-4]。因此,寻找新的肝细胞癌早期诊断标志物是临床实践的迫切需要。穿透素-3(pentraxin-3, PTX3)是由8个亚基组成的同源多聚糖蛋白,属于正五聚蛋白家族[5]。功能上,PTX3在炎性反应、组织修复及肿瘤免疫中发挥重要作用[6-8]。近年来有研究表明,PTX3也与某些类型癌症的预后有关,比如结直肠癌[9]、肺癌[10]、胃癌[11]等。此外,PTX3已被证明能够促进肝癌的进展,且肿瘤组织PTX3高表达与肝癌患者的不良预后具有相关性[12]。但血清中PTX3水平在肝细胞癌中的作用仍待进一步研究,本研究旨在分析血清中PTX3水平在肝细胞癌中的诊断价值,以期为此类疾病的早期诊断提供参考。
1 资料与方法
1.1 一般资料
选择2019年1月—2020年7月平顶山市第一人民医院收治的78例肝癌患者,其中27例病因与非酒精性脂肪肝有关、30例合并乙型肝炎病毒(hepatitis B virus, HBV)感染、8例酒精性肝病和13例隐源性肝癌。根据《原发性肝癌诊疗规范》[13]中所述中国肝癌的分期方案(China liver cancer staging, CNLC)进行分期:Ⅰ期20例(Ⅰa期13例、Ⅰb期7例)、Ⅱ期27例(Ⅱa期6例、Ⅱb期21例)、Ⅲ期31例(Ⅲa期4例、Ⅲb期27例)。纳入标准:(1)根据病史、临床症状、实验室、影像学及病理学检查确诊为原发性肝癌;(2)采集血液前未接受放化疗及免疫抑制剂治疗;(3)无家族遗传病和精神疾病史。排除标准:(1)有自身免疫性肝炎、系统性红斑狼疮等自身免疫性疾病及其他系统严重疾病者;(2)妊娠或哺乳期阶段妇女。同时选取本院健康体检者78例作为对照组。本研究获得医院伦理委员会批准,所有患者均签署知情同意书。
1.2 实验方法
采集患者的清晨空腹静脉血5 ml,于4℃离心机中以3 000 r/min的速度离心15 min后将上清液置于-80℃冰箱保存待检。采用酶联免疫吸附法检测血清PTX3水平,试剂盒购自上海艾博抗贸易有限公司,操作步骤根据试剂盒中提供的说明书进行。
1.3 统计学方法
采用SPSS21.0软件进行数据统计学分析,计量资料用(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析。计数资料的组间比较采用卡方分析。采用MedCalc 20.009软件构建受试者工作特征(receiver operating characteristics, ROC)曲线。检验水准α设为0.05。
2 结果
2.1 两组研究对象的一般资料比较
本研究共纳入肝癌患者78例,健康对照组78例。肝癌组男45例、女33例,平均年龄为(49.44±8.21)岁;健康对照组男42例、女36例,平均年龄为(48.98±9.34)。两组研究对象在年龄和性别资料上差异均无统计学意义(P > 0.05),见表 1。
表 1 两组一般资料比较Table 1 Comparison of basic characteristics between two groups
2.2 两组血清中PTX3表达的比较
肝癌组血清PTX3表达水平为14.88±2.13,健康对照组血清PTX3表达水平为5.24±0.49。两组间比较差异有统计学意义(t=25.631, P=0.002)。
2.3 不同分期肝癌患者血清中PTX3表达的比较
Ⅰ期肝癌组血清PTX3水平高于Ⅱ期组,Ⅱ期肝癌组血清PTX3水平高于Ⅲ期组,差异有统计学意义(P < 0.05),见表 2。
表 2 不同分期肝癌患者血清PTX3表达水平比较(x±s)Table 2 Comparison of serum PTX3 expression levels in patients with different stages of hepatocellular carcinoma (x±s)
2.4 PTX3水平与肝癌患者病理特征的关系
肿瘤直径≥5 cm患者血清中PTX3水平明显低于肿瘤直径 < 5 cm患者(P < 0.05)。合并HBV感染的肝癌患者血清中PTX3水平高于无HBV感染的患者(P < 0.05),见表 3。
表 3 血清PTX3水平与患者病理特征的关系(x±s)Table 3 Relation between serum PTX3 level and pathological characteristics of patients with hepatocellular carcinoma (x±s)
2.5 PTX3对肝癌的诊断价值
ROC曲线分析结果显示:血清PTX3水平辅助诊断肝癌ROC曲线的AUC为0.938,95%CI为0.888~0.970,敏感度为88.5%,特异性为84.6%,约登指数为0.731,可见其对肝癌诊断的预测能力具有较高的准确性,见图 1。
3 讨论
肝癌是一种发生于肝脏的常见恶性肿瘤[14],分为原发性和转移性肝癌,以原发性更多见。肝癌发病隐匿,患者早期无特异性症状,多数患者在中晚期寻求诊断和治疗,往往错过最佳的治疗时间[15]。因此,寻求一种操作简便、非介入性且重复性好的早期肝癌筛查诊断方法一直受到关注。近年来,研究表明多种血液标志物对肝癌的诊断具有良好的预测价值[16-18]。
PTX3又称肿瘤坏死因子刺激基因14(tumor necrosis factor-stimulated gene 14, TSG-14),与C反应蛋白(C reactive protei, CRP)同属于一种在进化中高度保守的正五聚蛋白家族[19-20]。结构上,PTX3有一个与其他已知蛋白无序列相似性的N端结构域和一个C端结构域,由8个亚基组成,含有381个氨基酸[19]。PTX3已在某些肿瘤中被证实是一种外在抑癌因子,通过调节巨噬细胞介导肿瘤进展[7]。然而,PTX3在癌症中是否起到保护或促进作用仍未完全明确。但有研究发现在肝细胞癌中PTX3高表达并通过驱动上皮-间充质转化加速肿瘤转移,提示其与预后不良相关[12]。这提示血清中PTX3水平可能与肝癌的发展相关。
肝癌的诊断主要依靠影像学,但由于影像学检查的放射性,降低了用于肝癌筛查的可能性;又由于影像学检查的敏感度,降低了早期诊断的可能性。相反,血清标志物由于简便快速且成本低廉的特点,普遍被患者所接受。目前,血清AFP水平的检测是最常用的诊断方法。有研究显示,血清AFP水平在部分良性肝病患者中也会处于高水平,但其并未出现肝癌的迹象,而在少数HCC患者AFP呈阴性或水平较低,这导致AFP对肝癌的误诊率较高[2, 21]。因此,临床实践迫切需要发现一种新的肝癌诊断生物标志物。
本研究将肝癌患者及健康体检者作为研究对象,分析血清中PTX3表达水平,并采用ROC曲线分析血清PTX3对肝癌的辅助诊断价值。结果显示,肝癌患者血清中PTX3水平显著升高,提示通过测定机体血清中PTX3水平可能有助于诊断肝细胞癌。Deng等[20]研究表明慢性HBV感染患者血清PTX3水平高于健康对照者,而HCC患者血清PTX3水平高于慢性HBV感染患者,与本研究结果相类似。通过构建裸鼠肝癌模型[12]发现PTX3与上皮间质转分化(epithelial-mesenchymal transition, EMT)相关,可能通过激活EMT加速肝癌细胞的增殖和生长,这提示PTX3可能通过EMT参与调控肝癌进展。有研究结果显示,随着肿瘤分期的增加,肝癌患者血清PTX3水平相应降低,Feder等[22]研究发现肝癌患者中血清PTX3水平并不随着TNM分期而相应增加,而Song等[12]应用免疫组织化学方法检测210例HCC患者肿瘤组织及癌旁组织中的PTX3水平,发现其在肿瘤组织中的表达异常升高,且与肝癌TNM分期显著相关。此外,现有研究证明在癌症中PTX3与补体C1q和H因子相互作用,激活并调节补体级联,从而在人体内作为外源性抑癌因子抑制肿瘤相关炎性反应[23]。不同研究相悖的结果提示PTX3控制肿瘤发展过程中可能有多种因素参与,或许存在一种还未阐明的复杂的调控网络,具体机制仍待进一步研究。
本研究进一步采用ROC曲线分析血清PTX3对肝癌(包括HBV感染者和非HBV感染者)的辅助诊断价值,AUC为0.938,说明血清PTX3表达水平对肝癌的诊断具有较高的准确性,但样本量较少,可能存在一定的偏移,需进一步扩大样本量进行深入研究。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:闫 锐:实验设计与论文撰写肖泽儒、黄旭颖:数据分析安广宇:核查与修订论文葛 洋:提出研究思路及进行总体把关与修订 -
-
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. doi: 10.3322/caac.21708
[2] Relli V, Trerotola M, Guerra E, et al. Abandoning the Notion of Non-Small Cell Lung Cancer[J]. Trends Mol Med, 2019, 25(7): 585-594. doi: 10.1016/j.molmed.2019.04.012
[3] Gelatti ACZ, Drilon A, Santini FC. Optimizing the sequencing of tyrosine kinase inhibitors (TKIs) in epidermal growth factor receptor (EGFR) mutation-positive non-small cell lung cancer (NSCLC)[J]. Lung Cancer, 2019, 137: 113-122. doi: 10.1016/j.lungcan.2019.09.017
[4] Lu T, Yang X, Huang Y, et al. Trends in the incidence, treatment, and survival of patients with lung cancer in the last four decades[J]. Cancer Manag Res, 2019, 11: 943-953. doi: 10.2147/CMAR.S187317
[5] Francis F, Koulakoff A, Boucher D, et al. Doublecortin is a developmentally regulated, microtubule-associated protein expressed in migrating and differentiating neurons[J]. Neuron, 1999, 23(2): 247-256. doi: 10.1016/S0896-6273(00)80777-1
[6] Burgess HA, Reiner O. Doublecortin-like kinase is associated with microtubules in neuronal growth cones[J]. Mol Cell Neurosci, 2000, 16(5): 529-541. doi: 10.1006/mcne.2000.0891
[7] Patel O, Roy MJ, Kropp A, et al. Structural basis for small molecule targeting of Doublecortin Like Kinase 1 with DCLK1-IN-1[J]. Commun Biol, 2021, 4(1): 1105. doi: 10.1038/s42003-021-02631-y
[8] Chandrakesan P, Yao J, Qu D, et al. Dclk1, a tumor stem cell marker, regulates pro-survival signaling and self-renewal of intestinal tumor cells[J]. Mol Cancer, 2017, 16(1): 30. doi: 10.1186/s12943-017-0594-y
[9] Qu D, Weygant N, Yao J, et al. Overexpression of DCLK1-AL Increases Tumor Cell Invasion, Drug Resistance, and KRAS Activation and Can Be Targeted to Inhibit Tumorigenesis in Pancreatic Cancer[J]. J Oncol, 2019, 2019: 6402925.
[10] Ge Y, Fan X, Huang X, et al. DCLK1-Short Splice Variant Promotes Esophageal Squamous Cell Carcinoma Progression via the MAPK/ERK/MMP2 Pathway[J]. Mol Cancer Res, 2021, 19(12): 1980-1991. doi: 10.1158/1541-7786.MCR-21-0161
[11] Weygant N, Ge Y, Qu D, et al. Survival of Patients with Gastrointestinal Cancers Can Be Predicted by a Surrogate microRNA Signature for Cancer Stem-like Cells Marked by DCLK1 Kinase[J]. Cancer Res, 2016, 76(14): 4090-4099. doi: 10.1158/0008-5472.CAN-16-0029
[12] Panneerselvam J, Mohandoss P, Patel R, et al. DCLK1 Regulates Tumor Stemness and Cisplatin Resistance in Non-small Cell Lung Cancer via ABCD-Member-4[J]. Mol Ther Oncolytics, 2020, 18: 24-36. doi: 10.1016/j.omto.2020.05.012
[13] Ge Y, Liu H, Zhang Y, et al. Inhibition of DCLK1 kinase reverses epithelial-mesenchymal transition and restores T-cell activity in pancreatic ductal adenocarcinoma[J]. Transl Oncol, 2022, 17: 101317. doi: 10.1016/j.tranon.2021.101317
[14] Liu Q, Liu H, Huang X, et al. A targetable MYBL2-ATAD2 axis governs cell proliferation in ovarian cancer[J]. Cancer Gene Ther, 2023, 30(1): 192-208. doi: 10.1038/s41417-022-00538-2
[15] Li L, Liu J, Xue H, et al. A TGF-β-MTA1-SOX4-EZH2 signaling axis drives epithelial-mesenchymal transition in tumor metastasis[J]. Oncogene, 2020, 39(10): 2125-2139. doi: 10.1038/s41388-019-1132-8
[16] Caffa I, Spagnolo V, Vernieri C, et al. Fasting-mimicking diet and hormone therapy induce breast cancer regression[J]. Nature, 2020, 583(7817): 620-624. doi: 10.1038/s41586-020-2502-7
[17] Jiao W, Mi X, Yang Y, et al. Mesenchymal stem cells combined with autocrosslinked hyaluronic acid improve mouse ovarian function by activating the PI3K-AKT pathway in a paracrine manner[J]. Stem Cell Res Ther, 2022, 13(1): 49. doi: 10.1186/s13287-022-02724-3
[18] Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380-2388. doi: 10.1056/NEJMoa0909530
[19] Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-957. doi: 10.1056/NEJMoa0810699
[20] Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735-742. doi: 10.1016/S1470-2045(11)70184-X
[21] Kim JH, Park SY, Jeon SE, et al. DCLK1 promotes colorectal cancer stemness and aggressiveness via the XRCC5/COX2 axis[J]. Theranostics, 2022, 12(12): 5258-5271. doi: 10.7150/thno.72037
[22] Liu H, Yan R, Xiao Z, et al. Targeting DCLK1 attenuates tumor stemness and evokes antitumor immunity in triple-negative breast cancer by inhibiting IL-6/STAT3 signaling[J]. Breast Cancer Res, 2023, 25(1): 43. doi: 10.1186/s13058-023-01642-3
[23] Yang WQ, Zhao WJ, Zhu LL, et al. XMD-17-51 Inhibits DCLK1 Kinase and Prevents Lung Cancer Progression[J]. Front Pharmacol, 2021, 12: 603453. doi: 10.3389/fphar.2021.603453
[24] Yan R, Fan X, Xiao Z, et al. Inhibition of DCLK1 sensitizes resistant lung adenocarcinomas to EGFR-TKI through suppression of Wnt/beta-Catenin activity and cancer stemness[J]. Cancer Lett, 2022, 531: 83-97. doi: 10.1016/j.canlet.2022.01.030
[25] Sureban SM, Berahovich R, Zhou H, et al. DCLK1 Monoclonal Antibody-Based CAR-T Cells as a Novel Treatment Strategy against Human Colorectal Cancers[J]. Cancers (Basel), 2019, 12(1): 54. doi: 10.3390/cancers12010054
[26] Ferguson FM, Nabet B, Raghavan S, et al. Discovery of a selective inhibitor of doublecortin like kinase 1[J]. Nat Chem Biol, 2020, 16(6): 635-643. doi: 10.1038/s41589-020-0506-0
-
期刊类型引用(2)
1. 程轩,孟璠璐,孙海凤,蒋喆,姚俊涛. 合并肺癌的多原发恶性肿瘤70例临床病理特征分析. 现代肿瘤医学. 2022(23): 4365-4369 .  百度学术
百度学术
2. 吕佰瑞,尹培,张晓慧,赵剑平,刘春海,霍红旗. 转录调节因子c-Myb通过炎症因子Ccl2抑制乳腺癌肺转移的实验研究. 现代肿瘤医学. 2021(19): 3347-3350 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: