Molecular Pathological Risk Grade Evaluates Biological Behavior and Prognosis of Patients with WHO Grade 1 Meningiomas
-
摘要:目的
探讨分子病理分级与WHO1级脑膜瘤复发、恶性进展以及患者生存的关系。
方法收集我科行手术治疗的WHO1级脑膜瘤病例资料及石蜡包埋切片。采纳Maas等建议的分子病理风险分级方法将本组病例分为低危、中危及高危级。先行Log rank单因素分析,继行Cox回归多因素分析,判断上述风险分级与患者无症状生存期(PFS)、恶性进展期(MPFS)以及总生存期(OS)的关系。
结果共198例资料完整的WHO1级病例,分子病理评估为低危级152例(76.8%),表现为无1p缺失;中危级42例(21.2%),其中1p缺失18例,1p合并6q缺失10例,1p合并14q缺失14例;高危级4例(2%),其中TERT启动子突变2例,CDKN2A/B纯合缺失1例,1p、6q、14q联合缺失1例。多因素分析显示分子病理风险级别与患者PFS(HR:0.029,95%CI:0.011~0.080)、MPFS(HR:0.032,95%CI:0.004~0.274)以及OS(HR:0.074,95%CI:0.032~0.174)显著负相关(P<0.05)。
结论组织学1级脑膜瘤生物学行为仍具异质性,进一步的分子病理风险分级可更精准反映其生物学行为并评估患者预后。
Abstract:ObjectiveTo explore the correlation of molecular pathological grading with WHO grade 1 meningioma recurrence, malignant progression, and patients’ survival.
MethodsThe medical records and paraffin-embedded tissues of patients with surgically resected WHO grade 1 meningioma were collected. The molecular pathological risk grading suggested by Maas et al. was adopted, and the patients were graded as low, intermediate, and high risk. Univariate log-rank test and multivariate Cox regression analyses were performed to determine the relationship between molecular risk grading and patient progression-free survival (PFS), malignant progression-free survival (MPFS), and overall survival (OS).
ResultsAmong 198 patients, 152 (76.8%) were graded as low risk, showing no 1p deletion; 42 (21.2%) patients were graded as intermediate risk, including 18 patients with 1p deletion, 10 patients with 1p combined with 6q deletion, and 14 patients with 1p combined with 14q deletion; and 4 (2%) patients were graded as high risk, including two patients with TERT promoter mutation, one patient with CDKN2A/B homozygous deletion, and one patient with 1p, 6p, and 14q combined deletion. Multivariate analysis showed that molecular risk grading was negatively associated with PFS (HR: 0.029, 95%CI: 0.011-0.080), MPFS (HR: 0.032, 95%CI: 0.004-0.274), and OS (HR: 0.074, 95%CI: 0.032-0.174; P<0.05).
ConclusionThe biological behavior of histological grade 1 meningiomas still exhibits heterogeneity, and further molecular pathological risk grading can more accurately reflect their biological behavior and evaluate patient prognosis.
-
Key words:
- Meningioma /
- Molecular pathology /
- Prognosis
-
0 引言
脑膜瘤是成年人颅内常见的肿瘤,其中80%~85%在组织学上呈良性,WHO分级为1级。一般认为该类患者预后佳,手术全切除后可以治愈,即使未能全切除,残余肿瘤在术后很长时间也可以保持稳定。但在临床工作中仍观察到少数WHO1级脑膜瘤全切除后频繁复发,甚至出现恶性进展的情况,文献中也时有报道,提示该类肿瘤细胞在基因层面存在差异,从而影响其生物学行为[1]。
在许多其他中枢神经系统肿瘤例如脑胶质瘤中,基因层面的分子病理检测已成为传统组织病理的重要补充,组织病理整合分子病理的风险分级体系对于肿瘤的生物学行为以及患者预后的判断体现了更精准的特点[2],但在脑膜瘤中仍缺乏类似的系统整合分子病理的分级体系。Maas等2021年发表了在脑膜瘤中整合组织和分子病理的分级体系建议[3],提出了基于WHO分级、甲基化分组及拷贝数分析的3层评分分级体系,各层依据风险因素高低进行评分,综合3层评分,进行低、中、高危分级,评分越高,肿瘤复发风险越高。该分级体系的实用性在其184例多中心回顾性病例和287例多中心前瞻性病例中得以验证,体现了相较于传统WHO组织学分级更优的患者预后相关性,而且该整合分级体系更有助于低级别脑膜瘤中复发高风险病例的早期识别。该整合分级体系针对临床可应用性特别提出了具体的分级流程建议,本研究拟将该分级体系应用于传统的WHO1级脑膜瘤中,对其进一步进行低、中、高危分级,并验证该分级体系与肿瘤复发、恶性进展以及患者生存的关系。
1 资料与方法
1.1 患者资料
回顾性收集华中科技大学同济医学院附属同济医院神经外科于2012年1月1日至2012年12年31日期间行手术切除的资料完整的原发WHO1级脑膜瘤成年患者病历资料及石蜡切片。患者一般资料包括性别、年龄、KPS评分。依据术前磁共振检查结果收集肿瘤部位和大小:肿瘤部位划分为浅部和深部两大类,其中浅部脑膜瘤包括基底位于大脑半球凸面硬膜、大脑镰旁、矢状窦旁、天幕、横窦上下以及小脑凸面硬膜的肿瘤,深部脑膜瘤包括颅底和脑组织深部脑膜瘤,具体包括基底位于额底、嗅沟、蝶骨嵴、鞍结节、海绵窦、中颅窝底、岩骨斜坡、枕大孔以及脑组织深部脑室内及松果体区的肿瘤;肿瘤大小评估依据肿瘤最大径。收集组织学亚型。依据手术记录以及术后1~3月增强磁共振检查结果判断Simpson级别,其中Simpson Ⅰ~Ⅲ级归类为全切除,Ⅳ~Ⅴ级归类为非全切除。
术后随访于门诊或电话沟通进行,如患者无特殊不适,一般于术后半年、1年、此后每年进行增强磁共振检查以评估肿瘤复发与否,如果患者症状与肿瘤复发相关,则随时行增强磁共振检查。
1.2 分子病理诊断分级
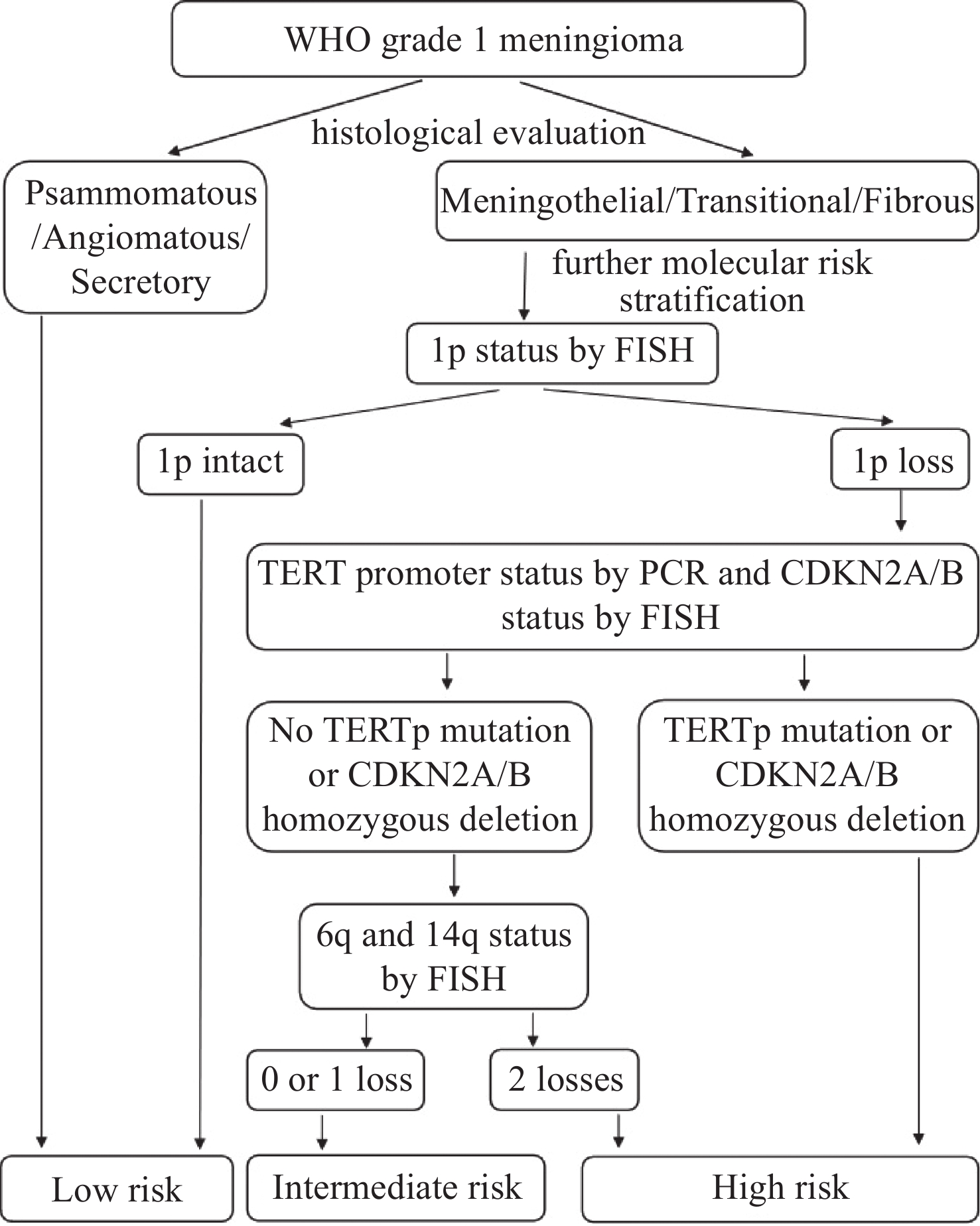
依据Maas等建议的诊断流程对本组病例进行了低、中及高危分级,分级流程参见图1。
1.3 染色体1p、6q、14q和CDKN2A/B荧光原位杂交检测
应用分别靶向染色体1p36、6q21、14q13和9p21位点的红色荧光标记DNA探针(Vysis Inc, Downers Grove, IL)以及相对应的靶向1号、6号、14号和9号染色体着丝粒绿色荧光标记探针(Abbott Molecular, Abbott Park, IL)在石蜡包埋的4 µm脑膜瘤组织切片上进行双色免疫荧光原位杂交以检测1p、6q、14q缺失和CDKN2A/B纯合缺失。杂交过程按照厂家指导步骤进行。荧光显微镜下(Olympus BX60)观察边界清楚、无重叠、结构完整的间期细胞核。无1p,6q和14q缺失的细胞表现为2红/2绿,当1红/2绿或0红/2绿时判断为阳性细胞。无CDKN2A/B纯合缺失的细胞表现为2红/2绿、1红/2绿或1红/1绿,当0红/2绿或0红/1绿时判断为CDKN2A/B纯合缺失阳性细胞。计数200个间期细胞,计算阳性细胞百分率。对10例正常脑组织对照组的检测结果取均值,计算标准差(s),以均值+3 s为阈值。病例组检测的异常细胞百分率大于阈值判定为阳性。
1.4 TERT启动子突变检测
福尔马林固定、石蜡包埋的脑膜瘤组织DNA提取通过QIAamp DNA Mini Kit 50试剂盒(QIAGEN Inc., 浦东, 上海)按厂家指导步骤进行。继而TERT启动子起始部位ATG上游-70 bp到-220 bp包含突变热点C228T(-124 bp)和C250T(-146 bp)的区域通过PCR扩增,正向引物 5ʹ-AGTGGATTCGCGGGCACAGA-3ʹ,反向引物 5ʹ-CAGCGCTGCCTGAAACTC-3ʹ。所获得的PCR产物测序由厂家采用Sanger技术进行。
1.5 生存评估
无进展生存期(progression-free survival, PFS)的计算始自首次手术切除日期至磁共振显示肿瘤复发或残存肿瘤的明显增长。恶性进展期(malignant progression-free survival, MPFS)的计算自首次手术切除日期至复发手术切除标本病理级别为WHO2级或3级。总生存期(overall survival, OS)的计算始自首次手术切除日期至患者死亡。对于在最终随访日期2022年12月31日时肿瘤仍未复发或恶性进展或死亡时,PFS、MPFS及OS的计算均截止于该日期。
1.6 统计学分析
应用软件IBM SPSS26.0完成统计分析。多组间计数资料的对比分析采用Kruskal-Wallis H检验。生存相关因素的单因素分析行Logrank检验,并绘制Kaplan-Meier生存曲线。单因素分析得出的具有统计学显著意义的因素纳入多因素Cox回归分析。P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征
共收集198例患者的临床资料,临床特征见表1。男∶女=1∶2.8。中位年龄50岁(22~74岁)。中位KPS评分80分(70~100分)。肿瘤位于颅腔浅部∶深部=1∶0.8。中位肿瘤大小4 cm(1.5~8.0 cm)。84.8%的病例经历了Simpson Ⅰ-Ⅲ级切除。
表 1 WHO1级脑膜瘤198例临床特征Table 1 Clinical characteristics of 198 cases of WHO grade 1 meningiomaVariables n (%) Gender Male 52 (26.3) Female 146 (73.7) KPS scale 70 15 (7.6) 80-90 163 (82.3) 100 20 (10.1) Age (years) 20-40 40 (20.2) 41-60 131 (66.2) 61-80 27 (13.6) Tumor site Superficial 112 (56.6) Deep 86 (43.4) Tumor size (cm) < 4 54 (27.3) 4-6 110 (55.6) ≥ 6 34 (17.1) Simpson grade Ⅰ-Ⅲ 168 (84.8) Ⅳ-Ⅴ 30 (15.2) Histological subtype Meningothelial 51 (25.8) Transitional 87 (43.9) Psammomatous 5 (2.5) Fibrous 40 (20.2) Angiomatous 15 (7.6) 2.2 分子病理特征
依据分子病理结果重新分级为低危级152例(76.8%)、中危级42例(21.2%)、高危级4例(2%)。在各组织学亚型中,20例砂粒体及血管瘤亚型均归为低危级;51例脑膜上皮亚型中,低危级占66.7%,中危级占29.4%,高危级占3.9%;87例过渡型中,低危级占82.8%,中危级占16.1%,高危级占1.1%;40例纤维型中,低危级占65%,中危级占32.5%,高危级占2.5%。Kruskal-Wallis H检验显示脑膜上皮型、过渡型以及纤维型之间分子病理分级差别无统计学意义(P=0.855)。各组织学亚型脑膜瘤具体分子病理结果及分级见表2。代表性低危、中危及高危病例FISH图片见图2。
表 2 WHO1级脑膜瘤依据分子病理结果风险分级Table 2 Molecular pathological risk grading of WHO grade 1 meningioma casesMolecular pathological grading Psammomatous /Angiomatous Meningothelial Transitional Fibrous Total (%) Low risk 152 (76.8) No 1p loss 20 34 72 26 Intermediate risk 42 (21.2) 1p loss 0 6 7 5 1p and 6q losses 0 4 3 3 1p and 14q losses 0 5 4 5 High risk 4 (2.0) TERT promoter mutation 0 0 1 1 CDKN2A/B homozygous deletion 0 1 0 0 1p, 6q, and 14q losses 0 1 0 0 ![]() 图 2 代表性低危、中危及高危WHO1级脑膜瘤病例FISH图片Figure 2 Representative FISH images of low-risk, medium-risk, and high-risk cases of WHO grade 1 meningiomaA: a low-risk case had no 1p loss and the nuclei displayed the fluorescence mode of 2 red/2 green; B1-2: an intermediate-risk case showed 1p loss (0 red/2 green) and 6q loss (0 red/2 green or 1 red/2 green); C: a high-risk case showed homozygous deletion of CDKN2A/B (0 red/2 green or 0 red/1 green); D1-3: another high-risk case showed 1p loss (0 red/2 green), 6q loss (0 red/2 green or 1 red/2 green), and 14q loss (0 red/2 green or 1 red/2 green).
图 2 代表性低危、中危及高危WHO1级脑膜瘤病例FISH图片Figure 2 Representative FISH images of low-risk, medium-risk, and high-risk cases of WHO grade 1 meningiomaA: a low-risk case had no 1p loss and the nuclei displayed the fluorescence mode of 2 red/2 green; B1-2: an intermediate-risk case showed 1p loss (0 red/2 green) and 6q loss (0 red/2 green or 1 red/2 green); C: a high-risk case showed homozygous deletion of CDKN2A/B (0 red/2 green or 0 red/1 green); D1-3: another high-risk case showed 1p loss (0 red/2 green), 6q loss (0 red/2 green or 1 red/2 green), and 14q loss (0 red/2 green or 1 red/2 green).2.3 单因素分析
2.3.1 PFS相关影响因素分析
共40例复发,总复发率20.2%,其中低危级别组复发22例(14.5%),中危组复发15例(35.7%),高危组复发3例(75.0%)。统计分析显示性别、年龄及肿瘤大小与PFS无显著相关,而全切除、肿瘤位于浅部与PFS显著正相关,分子病理分级与PFS显著负相关(P<0.05),见表3和图3。
表 3 PFS、MPFS和OS相关因素的Log rank单因素分析Table 3 Log rank univariate analysis for PFS-, MPFS-, and OS-related factorsVariables PFS MPFS OS HR 95%CI P HR 95%CI P HR 95%CI P Gender
(Male vs. Female)0.460 0.230 -0.919 0.072 0.945 0.101 -8.8030.961 0.508 0.231 -1.1180.157 Age
(≤ 40 vs. > 40 years)1.398 0.637 -3.0690.355 4.007 0.345 -46.4900.133 1.763 0.717 -4.3390.146 Maximal diameter
(≤ 4 vs. > 4 cm)1.174 0.632 -2.1820.613 0.927 0.130 -6.5870.939 1.019 0.504 -2.0600.959 Tumor site
(Superficial vs. Deep)0.160 0.085 -0.302 <0.001 2.299 0.318 -16.6100.458 0.161 0.078 -0.329 <0.001 Extent of resection
(Total resection vs.
Non-total resection)0.031 0.010 -0.095 <0.001 3.255 0.213 -49.6400.396 0.040 0.012 -0.127 <0.001 Molecular risk grade
(Low risk vs.
Intermediate/high risk)0.287 0.130 -0.632 <0.001 0.012 0.001 -0.126 < 0.001 0.341 0.141 -0.825 0.002 Notes: HR: hazard ratio; CI: confidence interval. 2.3.2 MPFS相关影响因素分析
4例发生恶性进展,总恶性进展率2%。其中低危级别组无恶性进展,中危组恶性进展2例(4.8%),其中1例表现为1p合并6q缺失,另1列表现为1p合并14q缺失;高危组恶性进展2例(50%),其中1例表现为TERT启动子突变,另1例表现为CDKN2A/B纯合缺失。统计分析显示性别、年龄、肿瘤部位、肿瘤大小及全切除与MPFS无显著相关,而分子病理分级与MPFS显著负相关(P<0.05),见表3和图3。
2.3.3 OS相关影响因素分析
截至随防结束,31例死亡,总死亡率15.7%,其中低危级别组死亡18例(11.8%),中危组死亡10例(23.8%),高危组死亡3例(75%)。统计分析显示,性别、年龄及肿瘤大小与OS无显著相关,而全切除、肿瘤部位与OS显著正相关,分子病理分级与OS显著负相关(P<0.05),见表3和图3。
2.4 多因素分析
将单因素分析中具有统计学意义的因素纳入Cox回归分析,结果显示全切除依然与PFS和OS显著正相关,而分子病理分级依然与PFS、MPFS和OS显著负相关(P<0.05),见表4。基于全切除对患者生存的显著意义,我们仅纳入全切除病例进行了全切除亚组的多因素Cox回归分析,结果证实了分子病理分级确实为独立于手术切除程度而与患者PFS、MPFS和OS显著相关的因素(P<0.05),见表4。
表 4 PFS、MPFS及OS相关因素的Cox回归分析Table 4 Cox regression multivariate analysis for PFS-, MPFS-, and OS-related factorsVariables PFS MPFS OS HR 95%CI P HR 95%CI P HR 95%CI P Whole group Molecular risk grade
(Low risk vs.
Intermediate/high risk)0.029 0.011-0.080 < 0.001 0.032 0.004-0.274 0.002 0.074 0.032-0.174 < 0.001 Extent of resection
(Total resection vs.
None total resection)0.005 0.001-0.019 < 0.001 0.235 0.022-3.189 0.988 0.012 0.003-0.050 < 0.001 Tumor site
(Superficial vs. Deep)0.536 0.152-1.890 0.332 3.030 0.142-66.667 0.478 0.880 0.219-3.546 0.858 Total resection subgroup Molecular risk grade
(Low risk vs.
Intermediate/high risk)0.086 0.019-0.378 0.001 0.071 0.009-0.530 0.010 0.011 0.002-0.059 < 0.001 Tumor site
(Superficial vs. Deep)0.422 0.111-1.607 0.206 1.737 0.173-17.434 0.639 0.659 0.149-2.911 0.582 3 讨论
分子病理层面的改变相较于组织形态的改变更早,但对肿瘤生物学行为的引导更关键[4-5]。在细胞遗传层面上,不同个体的1级脑膜瘤之间可以呈现复杂的核型改变,即使在单一脑膜瘤组织内也可呈现复杂的多细胞克隆发生,此为1级脑膜瘤生物学行为异质性的重要原因,而核型改变的复杂程度或关键染色体的缺失与肿瘤细胞的恶性行为密切相关[6-9]。在Maas等研究的分级体系中建议评估1p、6q和14q缺失状态[3]。1p缺失为仅次于22q缺失在脑膜瘤中第二常见的染色体改变,在良性脑膜瘤细胞中发生率不到10%,而在非典型性以及恶性脑膜瘤细胞中的发生则高达80%以上,1p的缺失为脑膜瘤细胞恶性转化的重要标志[4,10-11]。14q缺失在不典型及恶性脑膜瘤细胞中的发生则高达50%左右,很少见于良性脑膜瘤细胞,而存在14q缺失的良性脑膜瘤全切术后复发的风险与不典型脑膜瘤相当,因此14q的缺失同样提示脑膜瘤细胞的恶性转化倾向[4,12]。6q的缺失未见于良性脑膜瘤,在不典型和恶性脑膜瘤发生率约40%左右,而且常与1p缺失和(或)14q缺失同时存在,而1p、6q、14q的联合缺失则多见于恶性脑膜瘤细胞[10,13]。因此,1p、6q和14q为影响脑膜瘤细胞恶性行为的关键染色体。此外,在Maas等的分级建议中,TERT启动子突变或CDKN2A/B纯合缺失病例分级为高危,WHO在2021年版的中枢神经系统肿瘤分类中建议将存在上述两种基因改变的脑膜瘤无论其组织学改变如何均归类为3级。
本组病例中也观察到了部分病例在复发后呈现恶性进展特征,即组织学级别升高为2级或3级,总恶性进展率约为2%。应用分子病理分级后,低危组无恶性进展病例,中危组恶性进展率4.8%,而高危组恶性进展率高达50%。多因素分析显示分子病理分级为与脑膜瘤的恶性进展呈显著相关的唯一因素,提示组织学1级而后期可能发生恶性进展的病例实属分子病理评估的中、高危级。对不同个体不同级别的脑膜瘤群体对比研究发现,随脑膜瘤恶性级别的增高,在原较低级别脑膜瘤细胞染色体或核型异常的基础上会出现更多新的染色体或核型异常,从而导致肿瘤的恶性进展[14-15]。进展特点符合肿瘤细胞克隆进展理论,该理论认为单个细胞发生突变获得生长优势,继而克隆增殖,而在其增殖过程中可能会获得更多的突变,导致具有更快生长能力的亚克隆出现[14-15]。因此,高级别肿瘤中相对于较低级别肿瘤中新出现的核型改变和基因异常对于恶性进展起着关键作用,例如位于染色体9p的CDKN2A/B基因纯合缺失可见于40%~50%的恶性脑膜瘤,而在良性和非典型脑膜瘤中的发生则不到10%,如在低级别脑膜瘤核型背景下新出现CDKN2A/B纯合缺失则提示肿瘤细胞已经发生了恶性转化[10,16]。也有许多学者对同一个体脑膜瘤发生恶性进展前后的肿瘤组织进行对比研究,试图理解脑膜瘤细胞恶性进展机制。例如,Al-Mefty等对比了4例患者肿瘤组织恶性进展前后的核型,发现其中3例进展前后均呈现相同的复杂核型改变:染色体22、1p和14q的缺失[5];Goutagny等对比了18例患者肿瘤组织恶性进展前后的核型,发现其中16例进展前后均呈现相同的复杂核型改变,进展前呈良性或不典型的脑膜瘤往往表现有较高级别脑膜瘤常见的1p、6q和14q的缺失[16]。
除外某些特征性核型改变,既往研究提示较低组织学级别的脑膜瘤细胞如果TERT启动子呈突变状态,则其发生恶性进展的概率显著增高,TERT启动子突变同时存在于低级别以及恶性转化的高级别脑膜瘤中[17-18]。TERT启动子突变可导致TERT高表达及活力增强,从而导致细胞增殖能力显著增强。Goutagny等发现TERT启动子突变脑膜瘤复发后发生组织学级别进展的比例(5/6,88%)显著高于无TERT启动子突变的脑膜瘤(13/67,19%)[17]。本研究中同样观察到TERT启动子突变组中较高的恶性进展比率(1/2,50%),同时,TERT启动子野生型的病例中也有一定比例的恶性进展发生(3/196,1.5%)。Juratli等同样报道TERT启动子野生型低级别病例恶性进展后获得TERT启动子突变[19],Peyre等发现脑膜瘤恶性进展前后均维持TERT启动子野生型状态[20]。因此,上述结果提示TERT启动子突变虽然对于恶性进展很重要,但并非恶性进展的唯一机制或途径。
脑膜瘤细胞恶性进展机制仍较复杂,恶性进展可能为前述机制的综合作用。比如,具有恶性进展潜力的细胞早期即呈现复杂异常核型,决定了此类细胞在其发展过程中容易在环境应激下发生特定基因突变(例如TERT启动子突变)或获得更多或更复杂的关键核型改变(例如CDKN2A/B纯合缺失),诱发异常增殖,从而注定其高级别发展方向。Maas等的分级体系优势在于反映了核型改变的复杂程度,而且前述与恶性进展相关的关键染色体及基因改变均为该分级体系的重要评估指标,因此,依据该分子病理分级可达到恶性进展风险病例早筛的目的。对于组织学1级而分子病理中高危分级的病例,需警惕其后期恶性进展的可能。
本研究多因素分析也显示手术全切除与肿瘤复发以及患者总体生存显著相关,与既往研究结果相一致[21]。因此,对于脑膜瘤应力争全切除,本研究中即使分子病理评估为中、高危级的患者,手术全切除也显著延缓了复发,改善了生存。但本研究显示手术全切除与肿瘤是否恶性进展无显著相关,也提示肿瘤细胞的恶性进展倾向由其内在特性所决定。许多学者也观察到类似的现象,例如,Takei等报道了3例手术全切除的组织学1级脑膜瘤,术后未接受放疗,但在随访中出现了2级或3级的恶性进展[22];Zhi等报道的149例非典型脑膜瘤中有5例出现组织学3级转化,而这5例恶性进展前均手术全切除,仅1例术后接受了放疗[23]。
总之,本研究结果显示组织学1级脑膜瘤生物学行为仍呈异质性,可通过整合Maas等建议的分子病理评估方法进一步进行低危、中危和高危风险分级。随其风险分级的增高,肿瘤复发倾向和恶性进展特性显著增强而患者生存显著恶化。无论脑膜瘤风险分级,均应力争全切除,因其显著延缓了肿瘤复发并延长了患者总体生存。未来研究中,低、中、高危分子病理分级似乎有利于个体化治疗方案的拟定,例如,对组织学1级脑膜瘤进一步细化分级,更有利于全切术后辅助治疗措施例如放疗效应的评估和制定。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:曾令成:思路设计、数据分析及文章撰写厉 华:资料收集、数据分析陈如东:实验操作、数据统计杨洪宽:实验操作、数据统计陈 坚:课题指导、论文审阅及修改于加省:思路设计、课题指导及论文审阅修改 -
表 1 WHO1级脑膜瘤198例临床特征
Table 1 Clinical characteristics of 198 cases of WHO grade 1 meningioma
Variables n (%) Gender Male 52 (26.3) Female 146 (73.7) KPS scale 70 15 (7.6) 80-90 163 (82.3) 100 20 (10.1) Age (years) 20-40 40 (20.2) 41-60 131 (66.2) 61-80 27 (13.6) Tumor site Superficial 112 (56.6) Deep 86 (43.4) Tumor size (cm) < 4 54 (27.3) 4-6 110 (55.6) ≥ 6 34 (17.1) Simpson grade Ⅰ-Ⅲ 168 (84.8) Ⅳ-Ⅴ 30 (15.2) Histological subtype Meningothelial 51 (25.8) Transitional 87 (43.9) Psammomatous 5 (2.5) Fibrous 40 (20.2) Angiomatous 15 (7.6) 表 2 WHO1级脑膜瘤依据分子病理结果风险分级
Table 2 Molecular pathological risk grading of WHO grade 1 meningioma cases
Molecular pathological grading Psammomatous /Angiomatous Meningothelial Transitional Fibrous Total (%) Low risk 152 (76.8) No 1p loss 20 34 72 26 Intermediate risk 42 (21.2) 1p loss 0 6 7 5 1p and 6q losses 0 4 3 3 1p and 14q losses 0 5 4 5 High risk 4 (2.0) TERT promoter mutation 0 0 1 1 CDKN2A/B homozygous deletion 0 1 0 0 1p, 6q, and 14q losses 0 1 0 0 表 3 PFS、MPFS和OS相关因素的Log rank单因素分析
Table 3 Log rank univariate analysis for PFS-, MPFS-, and OS-related factors
Variables PFS MPFS OS HR 95%CI P HR 95%CI P HR 95%CI P Gender
(Male vs. Female)0.460 0.230 -0.919 0.072 0.945 0.101 -8.8030.961 0.508 0.231 -1.1180.157 Age
(≤ 40 vs. > 40 years)1.398 0.637 -3.0690.355 4.007 0.345 -46.4900.133 1.763 0.717 -4.3390.146 Maximal diameter
(≤ 4 vs. > 4 cm)1.174 0.632 -2.1820.613 0.927 0.130 -6.5870.939 1.019 0.504 -2.0600.959 Tumor site
(Superficial vs. Deep)0.160 0.085 -0.302 <0.001 2.299 0.318 -16.6100.458 0.161 0.078 -0.329 <0.001 Extent of resection
(Total resection vs.
Non-total resection)0.031 0.010 -0.095 <0.001 3.255 0.213 -49.6400.396 0.040 0.012 -0.127 <0.001 Molecular risk grade
(Low risk vs.
Intermediate/high risk)0.287 0.130 -0.632 <0.001 0.012 0.001 -0.126 < 0.001 0.341 0.141 -0.825 0.002 Notes: HR: hazard ratio; CI: confidence interval. 表 4 PFS、MPFS及OS相关因素的Cox回归分析
Table 4 Cox regression multivariate analysis for PFS-, MPFS-, and OS-related factors
Variables PFS MPFS OS HR 95%CI P HR 95%CI P HR 95%CI P Whole group Molecular risk grade
(Low risk vs.
Intermediate/high risk)0.029 0.011-0.080 < 0.001 0.032 0.004-0.274 0.002 0.074 0.032-0.174 < 0.001 Extent of resection
(Total resection vs.
None total resection)0.005 0.001-0.019 < 0.001 0.235 0.022-3.189 0.988 0.012 0.003-0.050 < 0.001 Tumor site
(Superficial vs. Deep)0.536 0.152-1.890 0.332 3.030 0.142-66.667 0.478 0.880 0.219-3.546 0.858 Total resection subgroup Molecular risk grade
(Low risk vs.
Intermediate/high risk)0.086 0.019-0.378 0.001 0.071 0.009-0.530 0.010 0.011 0.002-0.059 < 0.001 Tumor site
(Superficial vs. Deep)0.422 0.111-1.607 0.206 1.737 0.173-17.434 0.639 0.659 0.149-2.911 0.582 -
[1] Birzu C, Peyre M, Sahm F. Molecular alterations in meningioma: prognostic and therapeutic perspectives[J]. Curr Opin Oncol, 2020, 32(6): 613-622. doi: 10.1097/CCO.0000000000000687
[2] Louis DN, Perry A, Wesseling P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary[J]. Neuro Oncol, 2021, 23(8): 1231-1251. doi: 10.1093/neuonc/noab106
[3] Maas SLN, Stichel D, Hielscher T, et al. Integrated Molecular-Morphologic Meningioma Classification: A Multicenter Retrospective Analysis, Retrospectively and Prospectively Validated[J]. J Clin Oncol, 2021, 39(34): 3839-3852. doi: 10.1200/JCO.21.00784
[4] Cai DX, Banerjee R, Scheithauer BW, et al. Chromosome 1p and 14q FISH analysis in clinicopathologic subsets of meningioma: diagnostic and prognostic implications[J]. J Neuropathol Exp Neurol, 2001, 60(6): 628-636. doi: 10.1093/jnen/60.6.628
[5] Suppiah S, Nassiri F, Bi WL, et al. Molecular and translational advances in meningiomas[J]. Neuro Oncol, 2019, 21(Suppl 1): i4-i17.
[6] Perry A, Gutmann DH, Reifenberger G. Molecular pathogenesis of meningiomas[J]. J Neurooncol, 2004, 70(2): 183-202. doi: 10.1007/s11060-004-2749-0
[7] Sayagués JM, Tabernero MD, Maíllo A, et al. Intratumoral patterns of clonal evolution in meningiomas as defined by multicolor interphase fluorescence in situ hybridization (FISH): is there a relationship between histopathologically benign and atypical/anaplastic lesions?[J]. J Mol Diagn, 2004, 6(4): 316-325. doi: 10.1016/S1525-1578(10)60527-2
[8] Shintaku M, Adachi Y, Arai A, et al. Anaplastic and meningothelial meningiomas in a single tumor: A "dedifferentiated meningioma"?[J]. Neuropathology, 2016, 36(6): 584-590. doi: 10.1111/neup.12313
[9] Williams EA, Santagata S, Wakimoto H, et al. Distinct genomic subclasses of high-grade/progressive meningiomas: NF2-associated, NF2-exclusive, and NF2-agnostic[J]. Acta Neuropathol Commun, 2020, 8(1): 171. doi: 10.1186/s40478-020-01040-2
[10] Galani V, Lampri E, Varouktsi A, et al. Genetic and epigenetic alterations in meningiomas[J]. Clin Neurol Neurosurg, 2017, 158: 119-125. doi: 10.1016/j.clineuro.2017.05.002
[11] Singh J, Sharma R, Shukla N, et al. DNA methylation profiling of meningiomas highlights clinically distinct molecular subgroups[J]. J Neurooncol, 2023, 161(2): 339-356. doi: 10.1007/s11060-022-04220-3
[12] Driver J, Hoffman SE, Tavakol S, et al. A molecularly integrated grade for meningioma[J]. Neuro Oncol, 2022, 24(5): 796-808. doi: 10.1093/neuonc/noab213
[13] Pérez-Magán E, Rodríguez de Lope A, Ribalta T, et al. Differential expression profiling analyses identifies downregulation of 1p, 6q, and 14q genes and overexpression of 6p histone cluster 1 genes as markers of recurrence in meningiomas[J]. Neuro Oncol, 2010, 12(12): 1278-1290. doi: 10.1093/neuonc/noq081
[14] Youngblood MW, Günel M. Molecular genetics of meningiomas[J]. Handb Clin Neurol, 2020, 169: 101-119.
[15] Pawloski JA, Fadel HA, Huang YW, et al. Genomic Biomarkers of Meningioma: A Focused Review[J]. Int J Mol Sci, 2021, 22(19): 10222. doi: 10.3390/ijms221910222
[16] Goutagny S, Yang HW, Zucman-Rossi J, et al. Genomic profiling reveals alternative genetic pathways of meningioma malignant progression dependent on the underlying NF2 status[J]. Clin Cancer Res, 2010, 16(16): 4155-4164. doi: 10.1158/1078-0432.CCR-10-0891
[17] Goutagny S, Nault JC, Mallet M, et al. High incidence of activating TERT promoter mutations in meningiomas undergoing malignant progression[J]. Brain Pathol, 2014, 24(2): 184-189. doi: 10.1111/bpa.12110
[18] Sahm F, Schrimpf D, Olar A, et al. TERT Promoter Mutations and Risk of Recurrence in Meningioma[J]. J Natl Cancer Inst, 2015, 108(5): djv377.
[19] Juratli TA, Thiede C, Koerner MVA, et al. Intratumoral heterogeneity and TERT promoter mutations in progressive/higher-grade meningiomas[J]. Oncotarget, 2017, 8(65): 109228-109237. doi: 10.18632/oncotarget.22650
[20] Peyre M, Gauchotte G, Giry M, et al. De novo and secondary anaplastic meningiomas: a study of clinical and histomolecular prognostic factors[J]. Neuro Oncol, 2018, 20(8): 1113-1121. doi: 10.1093/neuonc/nox231
[21] Goldbrunner R, Stavrinou P, Jenkinson MD, et al. EANO guideline on the diagnosis and management of meningiomas[J]. Neuro Oncol, 2021, 23(11): 1821-1834. doi: 10.1093/neuonc/noab150
[22] Takei J, Tanaka T, Teshigawara A, et al. Alteration of FOXM1 expression and macrophage polarization in refractory meningiomas during long-term follow-up[J]. Transl Cancer Res, 2021, 10(1): 553-566. doi: 10.21037/tcr-20-1896
[23] Zhi M, Girvigian MR, Miller MJ, et al. Long-Term Outcomes of Newly Diagnosed Resected Atypical Meningiomas and the Role of Adjuvant Radiotherapy[J]. World Neurosurg, 2019, 122: e1153-e1161. doi: 10.1016/j.wneu.2018.11.006



 下载:
下载:



