Construction and Verification of A Nomogram Model for Predicting Invasive Risk of Ground Glass Nodules
-
摘要:目的
探讨基于生物标志物和CT征象构建的Nomogram模型对磨玻璃结节侵袭性风险的预测价值。
方法回顾性分析322例磨玻璃结节患者资料,其中模型组患者240例,验证组患者82例。经Logistic单因素及多因素分析后筛选出磨玻璃结节侵袭性风险的独立危险因素,使用R软件构建出列线图模型,同时绘制临床决策曲线(DCA)、ROC曲线、校准曲线对模型进行内外部验证。
结果本研究中磨玻璃结节侵袭性风险的5个独立危险因素分别为系统免疫炎症指数(SII)、CYFRA21-1、边缘、血管集束征和结节实性成分占比(CTR)。由此构建的列线图模型ROC曲线下面积为0.946,外部验证组ROC曲线下面积为0.932,提示该模型具有良好的预测磨玻璃结节侵袭性风险能力。通过Bootstrap 1000次自动抽样绘制校准曲线对模型进行内部验证,结果示模型曲线与实际曲线一致性指数为0.955,绝对误差较小,拟合度良好。DCA曲线显示出较好的临床实用性。同时结节边缘、血管集束征和CTR与浸润性腺癌病理亚型相关。
结论基于生物标志物和CT征象构建的Nomogram模型对磨玻璃结节侵袭性风险具有较好的预测价值和临床实用性。
Abstract:ObjectiveTo investigate the importance of a nomogram model based on biomarkers and CT signs in the prediction of the invasive risk of ground glass nodules.
MethodsA total of 322 patients with ground glass nodule, including 240 and 82 patients in the model and verification groups, respectively, were retrospectively analyzed. Independent risk factors for the invasive risk of ground glass nodules were screened out after using single and multiple Logistic analysis. R software was used to construct the nomogram model, and clinical decision curve analysis (DCA), receiver operating curve (ROC), and calibration curve were used for internal and external verification of the model.
ResultsIn this study, the independent risk factors for the invasive risk of ground glass nodules included systemic immune-inflammation index (SII), CYFRA21-1, edge, vascular cluster sign, and nodular consolidation tumor ratio (CTR). The area under the ROC curve of the constructed nomogram model had a value of 0.946, and that of the external validation group reached 0.932, which suggests the good capability of the model in predicting the invasive risk of ground glass nodules. The model was internally verified through drawing of calibration curves of Bootstrap 1000 automatic sampling. The results showed that the consistency index between the model and actual curves reached 0.955, with a small absolute error and good fit. The DCA curve revealed a good clinical practicability. In addition, nodule margin, vascular cluster sign, and CTR were correlated with the grade of pathological subtype of invasive adenocarcinoma.
ConclusionA nomogram model based on biomarkers and CT signs has good value and clinical practicability in the prediction of the invasive risk of ground glass nodules.
-
Key words:
- Ground glass nodules /
- Biomarkers /
- Nomogram model /
- CT signs /
- Pathological subtype /
- Invasive adenocarcinoma of lung
-
0 引言
随着大众健康意识的提高和胸部CT在健康体检中的广泛应用,磨玻璃结节(ground glass nodule, GGN)的检出率越来越高。GGN作为肺腺癌或癌前病变的一种表现形式已被证实[1],其CT图像主要表现为最大直径小于3 cm,密度轻微增高且未遮挡下支气管结构或血管边缘。血管集束征等CT征象也早已成为鉴别浸润性腺癌(invasive adenocarcinoma, IAC)和癌前病变的重要诊断依据。肿瘤标志物和炎性指标检测的引入也使肺癌筛查更多样化且正在成为检测早期诊断的工具。手术切除是治疗GGN最有效的方法。癌前病变和微浸润性腺癌可能仅通过肺楔形切除或肺段切除达到较好的治疗效果,术后5年生存率接近100%;IAC则可能需要标准肺叶切除术且存在淋巴结转移风险,术后5年生存率不足20%[2-4]。不同病理亚型的IAC预后存在差异,能够早期通过影像学特征判断对GGN患者尤为重要。本研究旨在通过结合相关炎症指标、肿瘤标志物和CT征象构建Nomogram模型对GGN侵袭性风险进行预测,为临床工作提供可靠依据。
1 资料与方法
1.1 一般资料
选取2021年1月至2023年1月在锦州医科大学附属第一医院心胸外科检查诊断为GGN且均进行手术治疗的322例患者作为研究对象,按照3:1的比例随机将其分为模型组和验证组。模型组患者240例,良性结节127例,微浸润性腺癌69例,IAC 44例;验证组患者82例,良性结节40例,微浸润性腺癌22例,IAC 20例。收集患者基本资料,如性别、年龄、吸烟史等。纳入标准:(1)年龄18岁以上,未患其他系统恶性肿瘤;(2)胸部CT影像特征符合GGN影像学表现且结节直径≤3 cm,未见远处转移;(3)临床各项资料完备。排除标准:(1)长期使用激素或其他影响血液指标的药物;(2)合并有血液系统疾病或凝血功能障碍患者;(3)已发生远处转移;(4)病史及临床资料不全者。本研究已获得我院伦理委员会审批。
1.2 血液学相关指标及影像学资料采集
所有患者均在采血前禁食水8小时以上,由我科护士根据相关血液学指标要求选用配套抽血管进行外周静脉血采集后送往检验科,检验科严格按照仪器及相关指标说明书进行检测。同时患者术前均完善心电图、心脏超声、肺功能、胸部CT、肝胆胰脾超声、双肾及肾上腺超声、颈及双下肢静脉超声、头颅CT或MRI、全身骨显像等影像学检查,排除手术禁忌。
1.3 结节病理类型确定
根据术后病理结果统一分为肺良性结节和肺腺癌。IAC病理亚型按照2021年国际肺腺癌分类标准及2020年国际肺癌协会分级标准进行划分:G1级贴壁生长为主型;G2级腺泡及乳头生长为主型;G3级微乳头及实体生长为主型,其中G1为低危级别,G2为中危级别,G3为高危级别。以上均由3位或3位以上经验丰富的病理科医师共同完成。
1.4 观察指标
(1)相关肿瘤标志物及正常值区间:CEA: 0~5 ng/ml、CYFRA21-1: 0~3.3 ng/ml、NSE: 0~16.3 ng/ml、ProGRP: 0~66.5 pg/ml、CA125: 0~35 U/ml;(2)炎性指标:NLR=中性粒细胞计数/淋巴细胞计数,PLR=血小板计数/淋巴细胞计数,SII=中性粒细胞计数×血小板计数/淋巴细胞计数;(3)影像学特征观察:结节直径、边缘、空泡征、血管集束征、支气管空气征、胸膜凹陷征和实性成分占比(CTR)。结节直径=(最大直径+最小直径)/2,CTR=实性成分最大直径/结节最大直径。以上指标均由3位或3位以上经验丰富的影像科医师配合AI系统完成,如对结果存在异议,则由上级医师确定最终结果。
1.5 统计学方法
采用SPSS25.0软件进行统计学处理。所有数据使用Q-Q图检验是否正态分布,符合正态分布的计量资料以均数±标准差(x±s)表示,两独立样本t检验进行组间比较。不符合正态分布的计量资料以四分位数间距(M(P25, P75))表示,秩和检验进行组间比较。计数资料使用例数和百分比来表示,组间比较采用χ2检验。Logistic单因素及多因素分析确定GGN侵袭性风险独立影响因素后,使用R4.3.1软件根据多因素分析结果构建列线图,同时绘制临床决策曲线(DCA)、ROC曲线和校准曲线。
2 结果
2.1 基本资料及各标志物水平对比
共纳入322例GGN患者,模型组和验证组患者基本资料的差异均无统计学意义(P>0.05),见表 1;模型组患者240例,平均年龄(57.18±12.14)岁,其中,良性结节组和肺腺癌组CYFRA21-1、PLR、SII、结节直径、CTR、边缘、空泡征、血管集束征和胸膜凹陷征间差异具有统计学意义(P<0.05),见表 2;二元Logistic回归分析结果显示:CYFRA21-1、SII、CTR、边缘和血管集束征为GGN侵袭性风险独立危险因素(P<0.05),见表 3。
表 1 模型组与验证组患者基本资料对比结果(n(%))Table 1 Comparison of basic data between the model and verified groups (n(%)) 表 2 模型组患者基本资料对比结果(n(%))Table 2 Comparison results of basic data of patients in the model group (n(%))
表 2 模型组患者基本资料对比结果(n(%))Table 2 Comparison results of basic data of patients in the model group (n(%)) 表 3 Logistic多因素回归分析GGN侵袭性风险独立危险因素Table 3 Logistic multivariate regression analysis of independent risk factors for GGN invasiveness
表 3 Logistic多因素回归分析GGN侵袭性风险独立危险因素Table 3 Logistic multivariate regression analysis of independent risk factors for GGN invasiveness
2.2 IAC病理亚型与影像学特征的关联
所有GGN患者中IAC患者64例,其中低危级(G1)26例,中危级(G2)16例,高危级(G3)22例,结节直径、CTR、边缘、血管集束征和支气管空气征组间差异存在统计学意义(P<0.05),见表 4。二元Logistic回归分析结果显示:边缘、CTR和血管集束征为中高危IAC的独立危险因素(P<0.05),见表 5。
表 4 IAC病理亚型与影像学特征的关联(n(%))Table 4 Relevance of pathological subtypes and imaging features of IAC (n(%)) 表 5 Logistic多因素回归分析中高危IAC独立危险因素Table 5 Logistic multivariate regression analysis of independent risk factors for intermediate- and high-risk IAC
表 5 Logistic多因素回归分析中高危IAC独立危险因素Table 5 Logistic multivariate regression analysis of independent risk factors for intermediate- and high-risk IAC
2.3 GGN侵袭性风险的列线图模型建立与验证
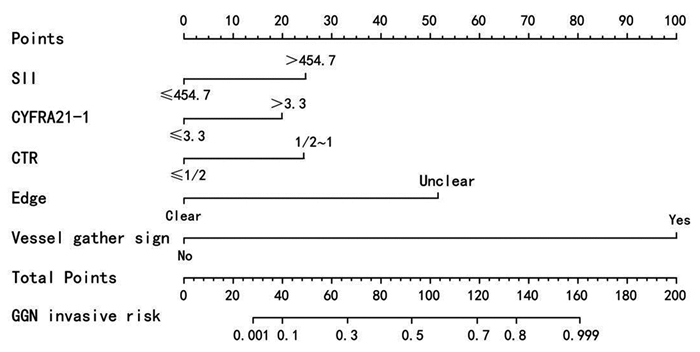
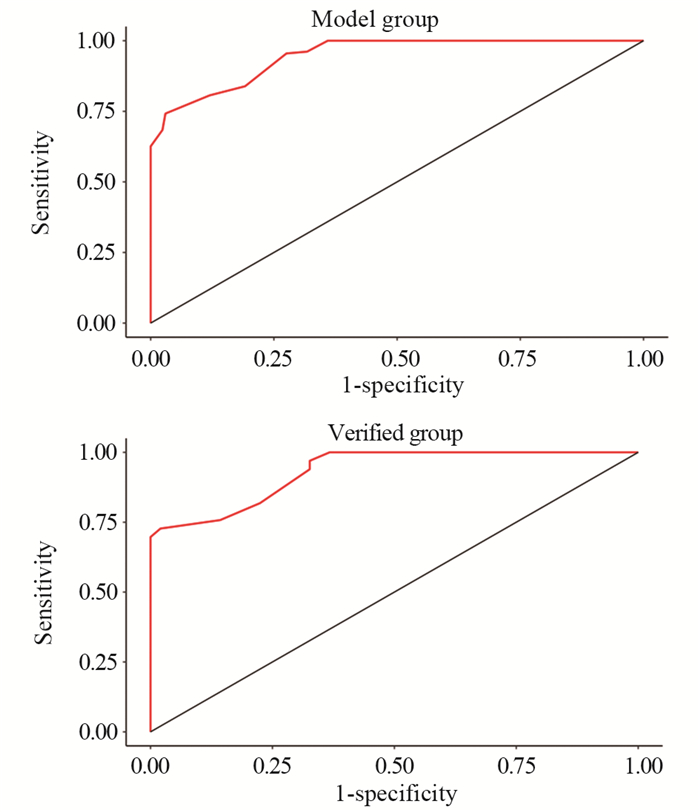
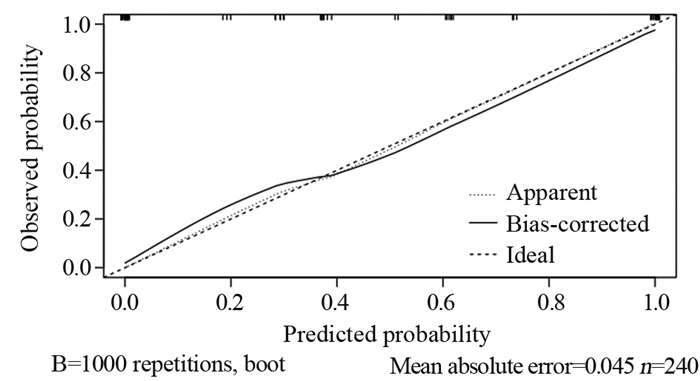
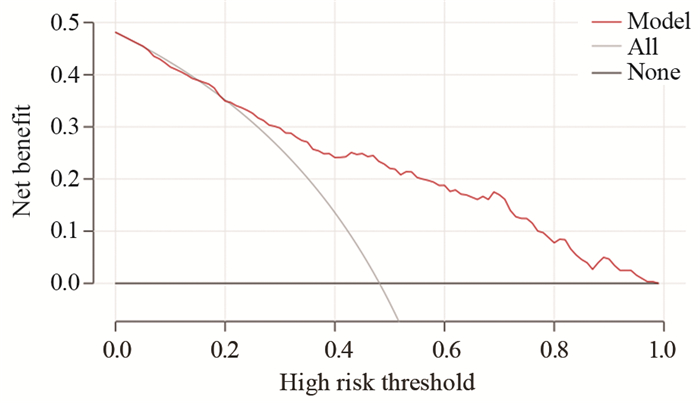
基于二元Logistic回归用以下变量:SII、CYFRA21-1、边缘、血管集束征和CTR构建列线图(图 1),每个点可以通过从每个变量到点轴画一条线来建立,总点计算为5个点的和,总点的轴线找到对应值来确定GGN侵袭性风险概率。经ROC曲线分析,SII的最佳截断值为454.7,AUC为0.785(95%CI: 0.692~0.804)。模型组及外部验证组ROC曲线(图 2)AUC分别为0.946(95%CI: 0.742~0.970)和0.932(95%CI: 0.727~0.980),提示该模型对GGN侵袭性风险预测性能良好。利用1 000次Bootstrap随机抽样对模型进行内部验证并绘制校准曲线(图 3),预测曲线与实际曲线一致性指数为0.955,拟合度较好。决策曲线(图 4)显示,风险阈值概率在20%~98%时该模型有较高的净获益值,有助于临床医师更好的了解病情进展,并适时选择手术时机。
3 讨论
生物标志物是指在疾病发生发展过程中发生变化的生化指标,其水平有时可以在成像和其他评估方法之前表明肿瘤的早期存在和性质。然而,所有的生物标志物都是非特异性的,其敏感性和特异性各不相同。因此,多种标志物的联合使用可以提高GGN侵袭性风险预测的准确性。良性结节和微浸润性腺癌多不影响患者术后生存率,所以我们着重研究了IAC病理亚型与影像学特征的关联。
CYFRA21-1是上皮细胞的特征性标志物,当肿瘤细胞死亡和溶解时,CYFRA21-1的可溶性片段可以释放到血液中,导致肿瘤患者血清中CYFRA21-1的浓度升高,是肺癌的有效生物标志物。一项Meta分析通过双变量随机效应模型计算CYFRA21-1检测对所有非小细胞肺癌的总敏感性和特异性分别为0.60(95%CI: 0.58~0.61)和0.90(95%CI: 0.89~0.91),高于其他肿瘤标志物[5]。作为本研究独立危险因素之一,CYFRA21-1≥3.3 ng/mL也被证实在肺腺癌中更常见[6],且水平越高,肺腺癌的风险越大[7-8]。
NLR、PLR和SII与癌症的相关性已有不少研究,但先前的肺癌研究一直关注这些参数对已确诊患者的预后价值,较少有研究调查这些指标与肺癌风险之间的关系。在一项SII、NLR、PLR相关的癌症调查中,SII被证明与结直肠癌和肺癌风险的关联最强,并且具有在临床诊断前的最后一年早期识别疾病的潜力[9]。Tian等[10]研究表明高水平炎症标志物与肺结节肺癌阳性风险相关,全身免疫反应可能是早期识别疾病的重要临床前特征。本研究中SII有效预测GGN侵袭性时的最佳截断值为454.7,AUC为0.785(95%CI: 0.692~0.804),与其研究结果一致。
影像学特征对鉴别侵袭前病变、微浸润性腺癌和浸润性腺癌具有较高的诊断价值。CTR、边缘和血管集束征作为本研究中GGN侵袭性的独立危险因素(P<0.05),同时也是鉴别IAC病理亚型不同分级的独立危险因素(P<0.05)。CTR<0.5时病变多为侵袭性较弱的肿瘤,如癌前病变和微浸润性腺癌[11]。本研究中,结节实性成分相对较少的GGN中G1级占比77.8%,而实性成分占比一半以上的GGN中G2和G3级占比达86.5%,由此说明实性成分越多,GGN病理亚型分级越接近G3级,与Volmonen等[12]的高级别肿瘤表现为较多实变的研究结果一致。但是在Zhang等[13]研究中,CTR的截断值为0.25时敏感性和特异性较高。因此,CTR最佳截止值的确定还需要更多的临床研究来补充和证实。结节边缘和血管集束征作为本研究的独立危险因素也已被证实可用于识别恶性病变。Lee等[14]研究发现结节边缘外观是恶性肿瘤的独立危险因素,其OR值高达13.8。Wu等[15]表明GGN的血管改变和边缘不光滑提示浸润性。Gao等[16]也得出结论IAC更有可能出现血管僵硬、扭曲、扩张或矫正。Zhang等[1]研究结果显示结节边缘和血管的改变可能提示非贴壁样为主的IAC。本研究也发现GGN病理亚型分级为G2和G3级时多伴有边界不清和血管集束征,占比分别为73.0%和85.7%。实性占比和明确的边缘被证明是区分浸润性亚型和肺腺癌新分级的最佳影像学表现[12]。血管集束征作为GGN侵袭性风险及其病理亚型与影像学特征的关联中OR值最高的危险因素,其OR值分别为7.202和2.462,即其他危险因素不变的情况下,血管集束征的出现使GGN的肺浸润性腺癌风险增加至少2倍以上。因此当GGN伴有血管集束征像时临床医生应该高度警惕中高级别IAC的可能性。
综上,生物标志物联合CT征象构建的Nomogram模型对磨玻璃结节侵袭性风险预测效能良好,临床实用性较强。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:李晓宇:研究实施、论文撰写及修改刘志良:研究指导金炳基、苗野:数据收集 -
表 1 模型组与验证组患者基本资料对比结果(n(%))
Table 1 Comparison of basic data between the model and verified groups (n(%))

表 2 模型组患者基本资料对比结果(n(%))
Table 2 Comparison results of basic data of patients in the model group (n(%))

表 3 Logistic多因素回归分析GGN侵袭性风险独立危险因素
Table 3 Logistic multivariate regression analysis of independent risk factors for GGN invasiveness

表 4 IAC病理亚型与影像学特征的关联(n(%))
Table 4 Relevance of pathological subtypes and imaging features of IAC (n(%))

表 5 Logistic多因素回归分析中高危IAC独立危险因素
Table 5 Logistic multivariate regression analysis of independent risk factors for intermediate- and high-risk IAC

-
[1] Zhang P, Li T, Tao X, et al. HRCT features between lepidic-predominant type and other pathological subtypes in early-stage invasive pulmonary adenocarcinoma appearing as a ground-glass nodule[J]. BMC Cancer, 2021, 21(1): 1124. doi: 10.1186/s12885-021-08821-5
[2] Jiang X, Gao Y, Zhang N, et al. Establishment of Immune-related Gene Pair Signature to Predict Lung Adenocarcinoma Prognosis[J]. Cell Transplant, 2020, 29: 963689720977131.
[3] Yu Z, Xu C, Zhang Y, et al. A triple-classification for the evaluation of lung nodules manifesting as pure ground-glass sign: a CT-based radiomic analysis[J]. BMC Med Imaging, 2022, 22(1): 133. doi: 10.1186/s12880-022-00862-x
[4] Zheng H, Zhang H, Wang S, et al. Invasive Prediction of Ground Glass Nodule Based on Clinical Characteristics and Radiomics Feature[J]. Front Genet, 2022, 12: 783391. doi: 10.3389/fgene.2021.783391
[5] Chu XY, Hou XB, Song WA, et al. Diagnostic values of SCC, CEA, Cyfra21-1 and NSE for lung cancer in patients with suspicious pulmonary masses: a single center analysis[J]. Cancer Biol Ther, 2011, 11(12): 995-1000. doi: 10.4161/cbt.11.12.15526
[6] Li J, Chen Y, Wang X, et al. The value of combined detection of CEA, CYFRA21-1, SCC-Ag, and pro-GRP in the differential diagnosis of lung cancer[J]. Transl Cancer Res, 2021, 10(4): 1900-1906. doi: 10.21037/tcr-21-527
[7] Yu L, Zhang B, Zou H, et al. Multivariate Analysis on Development of Lung Adenocarcinoma Lesion from Solitary Pulmonary Nodule[J]. Contrast Media Mol Imaging, 2022, 2022: 8330111.
[8] Wu H, Wang Q, Liu Q, et al. The Serum Tumor Markers in Combination for Clinical Diagnosis of Lung Cancer[J]. Clin Lab, 2020, 66(3).
[9] Nøst TH, Alcala K, Urbarova I, et al. Systemic inflammation markers and cancer incidence in the UK Biobank[J]. Eur J Epidemiol, 2021, 36(8): 841-848. doi: 10.1007/s10654-021-00752-6
[10] Tian T, Lu J, Zhao W, et al. Associations of systemic inflammation markers with identification of pulmonary nodule and incident lung cancer in Chinese population[J]. Cancer Med, 2022, 11(12): 2482-2491. doi: 10.1002/cam4.4606
[11] Ye T, Deng L, Xiang J, et al. Predictors of Pathologic Tumor Invasion and Prognosis for Ground Glass Opacity Featured Lung Adenocarcinoma[J]. Ann Thorac Surg, 2018, 106(6): 1682-1690. doi: 10.1016/j.athoracsur.2018.06.058
[12] Volmonen K, Sederholm A, Rönty M, et al. Association of CT findings with invasive subtypes and the new grading system of lung adenocarcinoma[J]. Clin Radiol, 2023, 78(3): e251-e259. doi: 10.1016/j.crad.2022.11.011
[13] Zhang N, Liu JF, Wang YN, et al. A nomogram to predict invasiveness in lung adenocarcinoma presenting as ground glass nodule[J]. Transl Cancer Res, 2020, 9(3): 1660-1669. doi: 10.21037/tcr.2020.01.55
[14] Lee HJ, Goo JM, Lee CH, et al. Predictive CT findings of malignancy in ground-glass nodules on thin-section chest CT: the effects on radiologist performance[J]. Eur Radiol, 2009, 19(3): 552-560. doi: 10.1007/s00330-008-1188-2
[15] Wu F, Tian SP, Jin X, et al. CT and histopathologic characteristics of lung adenocarcinoma with pure ground-glass nodules 10 mm or less in diameter[J]. Eur Radiol, 2017, 27(10): 4037-4043. doi: 10.1007/s00330-017-4829-5
[16] Gao F, Sun Y, Zhang G, et al. CT characterization of different pathological types of subcentimeter pulmonary ground-glass nodular lesions[J]. Br J Radiol, 2019, 92(1094): 20180204.



 下载:
下载: