Research Progress in Mitochondrial Treatment and Mechanism in Occurrence of Lung Cancer
-
摘要:
肺癌具有高发生率、高侵袭性和高致亡率的特点,其发生发展受多方面因素影响。线粒体作为普遍存在于人体内的细胞器,通过调节细胞代谢、信号转导、氧化应激和基因组不稳定性等过程,影响肺癌的发生和发展。本文总结近年来有关线粒体靶向药物、线粒体转移和线粒体基因疗法等治疗肺癌的研究进展,探讨线粒体治疗肺癌的原理和前景,以期为肺癌的治疗提供新的思路。
Abstract:Lung cancer is characterized by high incidence and mortality rates and invasiveness, and its occurrence and development are influenced by various factors. Mitochondria, as ubiquitous organelles in the human body, regulate cellular processes, such as metabolism, signal transduction, oxidative stress, and genomic instability, thereby affecting the initiation and progression of lung cancer. This article summarizes the recent research progress on mitochondrial-targeted drugs, mitochondrial transfer, and mitochondrial gene therapy for lung cancer treatment. This work also discusses the principles and prospects of mitochondrial therapy to provide new insights for lung cancer treatment.
-
Key words:
- Mitochondria /
- Lung cancer /
- Mechanism /
- Treatment
-
0 引言
肺癌是常见的癌症,全球每年新增肺癌病例220万例,占全部恶性肿瘤发病的11.4%;每年新增死亡病例180万例,占全部癌症死亡病例的18.0%[1]。造成严重的社会负担和经济损失。早期肺癌的一些常见症状是咳嗽、低热、痰中带血,然而,部分患者在癌症扩散前期可能没有任何症状, 存在一定的隐匿性,对临床诊疗带来一定挑战。肺癌的临床治疗方案由多个因素决定,如肿瘤的病理类型、临床分期和解剖位置,以及患者基础身体条件等。临床常用的治疗方法包括手术、放疗、化疗、免疫、靶向及中医药治疗等。其中靶向药物治疗是目前肺癌临床治疗中常见的重要手段。线粒体是几乎所有真核细胞中都存在的膜结合细胞器,主要通过氧化磷酸化为细胞提供能量。最近的研究表明,线粒体通过多种途径影响肺癌发生、进展和耐药性,靶向线粒体药物治疗已成为目前肺癌治疗研究中的热点。本文就线粒体在肺癌发展中的作用机制及治疗中的研究进展作一综述。
1 线粒体的结构与功能
线粒体广泛存在于人体的细胞内,它是由外膜、膜间隙、内膜和基质组成的双膜细胞器。其主要功能是通过氧化磷酸化的过程将葡萄糖和脂肪酸等有机分子分解,以三磷酸腺苷的形式为细胞提供能量。线粒体的功能还包括调节活性氧(reactive oxygen species, ROS)的产生与代谢、细胞信号转导[2],以及对细胞凋亡的调控作用[3]。最近研究还发现,线粒体参与了癌症生物学的各个方面,如癌基因的活化、能量代谢途径的改变、氧化应激、动力学等均受到线粒体的调控[4],这直接导致肿瘤的发生或间接促进了肿瘤的发生与侵袭。通过对线粒体作用机制的进一步研究,可为肿瘤的预防及治疗提供新的思路。
2 线粒体在肺癌发展中的作用机制
2.1 线粒体DNA突变
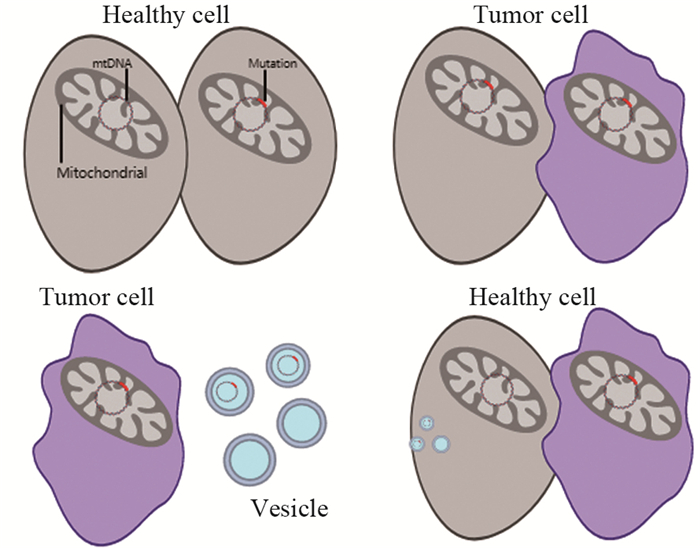
线粒体有自己的基因组,包含一个16.6 kb的环状基因组,它编码37个基因(13个呼吸酶复合蛋白、22个tRNA和2个rRNA),这些基因对于电子传递和氧化磷酸化所涉及的蛋白质的产生至关重要[5]。由于线粒体DNA(mitochondria DNA, mtDNA)直接暴露在基质当中,缺少相应的保护,这导致mtDNA突变在人体细胞中十分常见。随着近年来对mtDNA研究的深入,mtDNA突变被证实在肿瘤的发生、进展中发挥重要作用。Stewart等[6]通过对癌症基因组图谱(TCGA)联盟的全基因组测序(WGS)数据来绘制来自527种人类癌症的14种肿瘤的体细胞线粒体基因组测序数据进行分析,发现近2/3的实体瘤至少携带一个mtDNA突变,且突变常发生在薄弱的D环区。有研究发现,在高转移性肺癌细胞中,具有NADH脱氢酶亚基6(ND6)致病突变的mtDNA,在体外和肿瘤微环境中通过细胞外囊泡转移到低转移性肿瘤细胞和基质细胞当中[7],表明mtDNA的细胞间转移,可能成为肺癌转移的重要通道,见图 1。Horibe等研究证明,mtDNA突变还可以通过提高内在ROS水平,激活NF-κB信号转导和诱导A549肺癌细胞中的凋亡蛋白抑制剂表达来降低肿瘤对顺铂的敏感性[8]。除了mtDNA序列变异外,mtDNA拷贝数变异导致mtDNA耗竭或积累也被证实可能导致癌症的发生及进展[9]。
![]() 图 1 线粒体DNA突变引起细胞的癌变Figure 1 Canceration of cells caused by mitochondrial DNA mutationsMutations in mitochondrial DNA in normal cells flow through replication. When the mutations reach a certain threshold, the normal cells will be transformed into tumour cells in the next replication. The mutated mitochondrial DNA in the tumour cells can also be transferred to the normal cells through vesicles, thereby causing cancerous transformation.
图 1 线粒体DNA突变引起细胞的癌变Figure 1 Canceration of cells caused by mitochondrial DNA mutationsMutations in mitochondrial DNA in normal cells flow through replication. When the mutations reach a certain threshold, the normal cells will be transformed into tumour cells in the next replication. The mutated mitochondrial DNA in the tumour cells can also be transferred to the normal cells through vesicles, thereby causing cancerous transformation.2.2 线粒体自噬
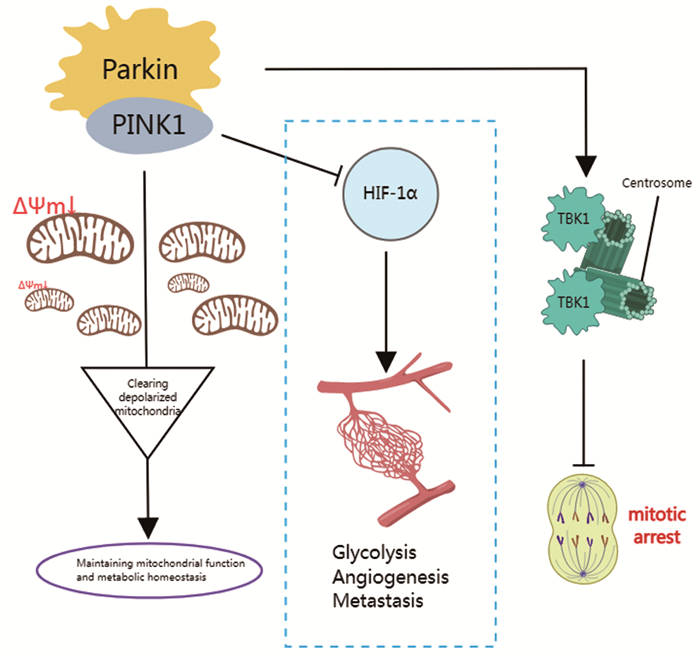
线粒体自噬作为人体自噬反应中的一种[10],对线粒体质量控制非常重要,在ROS刺激、营养物质剥夺、细胞衰老等条件下,线粒体经历膜电位去极化。去极化线粒体被和细胞蛋白隔离在自噬体中,自噬体随后与溶酶体融合并降解,维持细胞内环境的稳定性和线粒体适应性。PINK1/Parkin途径被认为是线粒体自噬的主要途径。它清除去极化的线粒体,以维持线粒体功能和代谢稳态,防止Warburg代谢和过量ROS产生[11]。除了在促进去极化线粒体自噬中的典型作用外,研究还发现,Parkin与HIF-1α相互作用,通过泛素化促进HIF-1α降解,从而抑制乳腺癌细胞的转移[12]。而HIF-1α通过诱导HIF靶基因来促进肿瘤发生,从而增强糖酵解、血管生成和转移[13]。因此,Parkin或Pink1的缺失可能会引发HIF-1α的高表达进而促进肿瘤发生。此外,Pink1/Parkin诱导的线粒体自噬还通过将TBK1束缚在中心体上、促进纺锤体组装和有丝分裂来调节细胞周期检查点。因此,增加线粒体自噬可以抑制细胞周期的进展,从而抑制肿瘤细胞的快速增殖[14],见图 2。
![]() 图 2 PINK1/Parkin通过线粒体自噬途径影响肿瘤的发生Figure 2 Tumourigenesis affected by PINK1/Parkin through the mitochondrial autophagy pathwayThe PINK1/Parkin pathway maintains normal intracellular mitochondrial function by inducing autophagy in depolarised mitochondria; Parkin also promotes the degradation of HIF-1α and inhibits glycolysis, angiogenesis, and tumor metastasis; in addition, Pink1/Parkin-induced mitochondrial autophagy promotes spindle assembly and mitophagy by binding TBK1 to the centrosome.
图 2 PINK1/Parkin通过线粒体自噬途径影响肿瘤的发生Figure 2 Tumourigenesis affected by PINK1/Parkin through the mitochondrial autophagy pathwayThe PINK1/Parkin pathway maintains normal intracellular mitochondrial function by inducing autophagy in depolarised mitochondria; Parkin also promotes the degradation of HIF-1α and inhibits glycolysis, angiogenesis, and tumor metastasis; in addition, Pink1/Parkin-induced mitochondrial autophagy promotes spindle assembly and mitophagy by binding TBK1 to the centrosome.2.3 线粒体动力学障碍
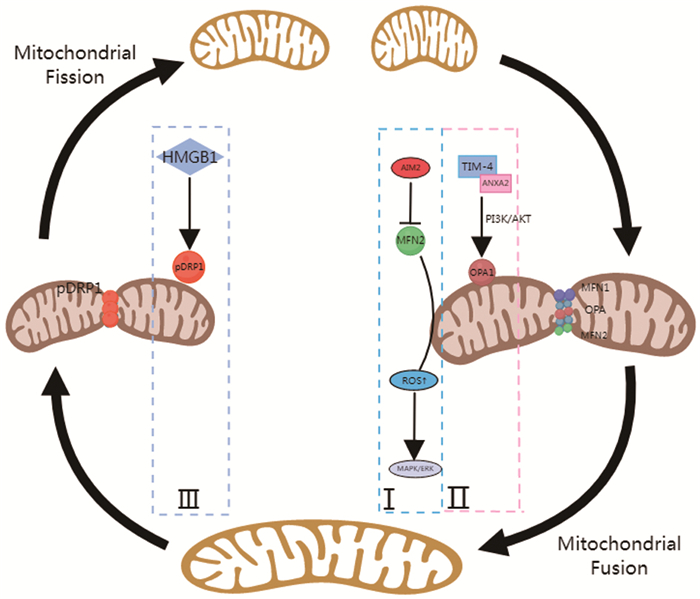
线粒体动力学是指线粒体通过动态的分裂和融合循环以维持其形状、分布和大小的高度动力学性质,线粒体动力学障碍主要分为融合和分裂失衡。这种动态平衡的打破,与肿瘤的发生与进展,以及肿瘤的耐药密切相关。第一,从融合方面来看,线粒体的融合是由两种属于大型GTPases的动力蛋白相关家族成员调节包括MFN1、MFN2、OPA1调控。Qi等[15]通过对癌症基因组图谱数据库进行分析,证实与邻近正常组织相比,炎性小体家族重要成员黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)在肺腺癌和鳞状细胞癌中显著上调,且高AIM2表达与非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的不良预后有关。进一步的研究表明,AIM2与NSCLC细胞中的线粒体共定位,AIM2的过度表达通过抑制MFN2合成,减少细胞内线粒体的融合,从而促进肿瘤进展。与之相反的是,AIM2敲除导致线粒体融合增强、细胞增殖减少、细胞内ROS产生减少,进而导致MAPK/ERK信号通路失活,抑制肿瘤细胞生长。此外,Wang等的研究表明,在肺癌细胞中,T细胞免疫球蛋白和含黏蛋白结构域的分子4(T-cell immunoglobulin and mucin domain-containing molecule 4, TIM-4)通过增强视神经萎缩蛋白1(optic atrophy 1, OPA1)表达促进线粒体融合,其具体机制涉及PI3K/AKT通路,TIM-4与负载膜联蛋白A2(annexin A2, ANXA2)相互作用,激活PI3K/AKT信号转导,并通过PI3K/AKT途径增强L-OPA1蛋白的表达,促进肺癌细胞的氧化磷酸化以加速肿瘤进展[16]。第二,从裂变方面来看,线粒体的分裂主要由线粒体动力相关蛋白1(dynamin-related protein 1, DRP1)介导[17]。Yu等[18]收集70例肺癌和正常组织,并采用免疫组织化学法检测组织中DRP1的表达,结果显示DRP1在肺癌组织中显著过表达,证实DRP1的表达与肺癌的发生密切相关。Liu等的研究则进一步证实了这一点,高迁移率族蛋白B1(high mobility group box 1, HMGB1)通过促进磷酸化DRP1的表达,增加肺癌细胞中的线粒体裂变,促进肺癌迁移[19]。此外,在KRAS突变的NSCLC中,DRP1被证实可以通过利用乳酸为肿瘤细胞生长提供能量,还可以阻止ROS诱导的肿瘤细胞的氧化清除,从而促进细胞增殖[20]。线粒体的融合和分裂过程见图 3。
![]() 图 3 线粒体的融合与分裂Figure 3 Mitochondrial fusion and divisionⅠ: AIM2 overexpression inhibits MFN2 synthesis and suppresses mitochondrial fusion; Ⅱ: TIM-4 interacts with ANXA2 to enhance L-OPA1 protein expression and promote mitochondrial fusion via the PI3K/AKT pathway; Ⅲ: HMGB1 increases mitochondrial fission in lung cancer cells by promoting the expression of phosphorylated DRP1.
图 3 线粒体的融合与分裂Figure 3 Mitochondrial fusion and divisionⅠ: AIM2 overexpression inhibits MFN2 synthesis and suppresses mitochondrial fusion; Ⅱ: TIM-4 interacts with ANXA2 to enhance L-OPA1 protein expression and promote mitochondrial fusion via the PI3K/AKT pathway; Ⅲ: HMGB1 increases mitochondrial fission in lung cancer cells by promoting the expression of phosphorylated DRP1.2.4 能量代谢路径的改变
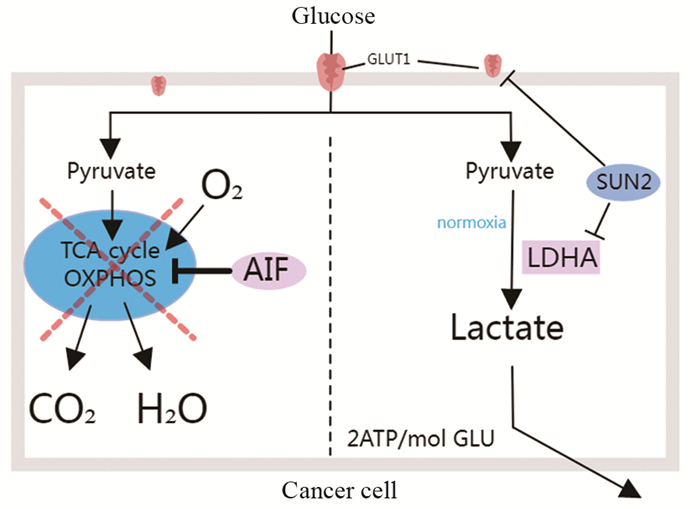
线粒体能量代谢相关途径主要包括糖酵解、三羧酸循环、氧化磷酸化、酮体代谢、脂肪代谢和糖异生。约90%的细胞ATP通过这种氧化磷酸化(OXPHOS)途径在线粒体中产生。然而大多数癌细胞具有与正常组织根本不同的代谢特征。由于肿瘤微环境的局部缺氧环境,线粒体ATP合成途径从氧化磷酸化向高糖酵解速率的转变,称为Warburg效应。这种能量代谢路径的改变,满足了肿瘤细胞对能量的旺盛需求,为癌症细胞的生长提供了优势,被认为是癌症发生的重要标志。细胞凋亡诱导因子(apoptosis-inducing factor, AIF)是调节细胞死亡重要因素之一。最近研究发现,AIF在线粒体能量代谢中发挥重要的调节功能。Rao等[21]通过敲除肺癌细胞AIF基因,观察到AIF的遗传失活能够显著降低小鼠的肿瘤负荷,延长小鼠的生存期。更进一步的机制研究发现,AIF的缺失会损害呼吸链复合物I的功能,降低OXPHOS的速率,增强糖酵解和对葡萄糖剥夺的敏感性,导致细胞代谢向糖酵解的转变。SUN2(SAD1/UNC84 domain containing protein-2, SUN2)蛋白是位于内核膜的核骨架和细胞骨架的连接子复合物的关键成分,其通过抑制葡萄糖转运蛋白GLUT1和LDHA基因的表达,调控Warburg效应中葡萄糖摄取和丙酮酸向乳酸的转化,见图 4,抑制肺癌中的Warburg效应来发挥肿瘤抑制作用[22]。
![]() 图 4 线粒体能量代谢途径改变Figure 4 Changes in the mitochondrial energy metabolism pathwayAIF deficiency reduces the rate of OXPHOS, enhances glycolysis and sensitivity to glucose deprivation, and leads to a shift in cellular metabolism toward glycolysis. The SUN2 protein regulates glucose uptake and the conversion of pyruvate into lactate in the Warburg effect by repressing the expression of the glucose transport proteins and GLUT1 and LDHA genes.
图 4 线粒体能量代谢途径改变Figure 4 Changes in the mitochondrial energy metabolism pathwayAIF deficiency reduces the rate of OXPHOS, enhances glycolysis and sensitivity to glucose deprivation, and leads to a shift in cellular metabolism toward glycolysis. The SUN2 protein regulates glucose uptake and the conversion of pyruvate into lactate in the Warburg effect by repressing the expression of the glucose transport proteins and GLUT1 and LDHA genes.3 靶向线粒体治疗在肺癌治疗中的运用
3.1 增加肺癌放化疗疗效
放疗及化疗作为经典的治疗手段,在肺癌的治疗中发挥了中流砥柱的作用。近年来研究发现,靶向线粒体药物可以通过线粒体相关途径增强肺癌放化疗的疗效。Dong等[23]研究表明,莫布替尼在与顺铂联合使用时,通过降低PI3K/mTOR信号通路的活化,提高ROS水平并诱导氧化应激,破坏线粒体功能,引起NSCLC细胞能量代谢的紊乱。与单药比较,对肺癌细胞的生长起到了更好的抑制效果。Bajpai等[24]设计并构建了一种基于胆固醇靶向线粒体的嵌合纳米颗粒(mt-CNPs),由顺铂、喜树碱和替加环素组成,可同时损害mtDNA、线粒体拓扑异构酶Ⅰ和线粒体核糖体。并在体外实验通过共聚焦显微镜证实,mt-CNPs在6小时内有效定位于A549肺癌细胞的线粒体中,导致线粒体形态损伤和ROS的产生,相比于单纯的化疗药物,mt-CNP在肺癌中显示出更强的癌细胞杀伤能力。Tsakiridis等[25]通过对腺癌A549和NSCLC H1299细胞进行卡格列净、放疗和顺铂化疗处理,并进行增殖、克隆存活和免疫印迹实验分析,结果显示卡格列净抑制了线粒体OXPHOS级联反应并激活AMPK,抑制脂肪、蛋白质和mTOR,增强了NSCLC细胞对放疗和顺铂的敏感性。
3.2 逆转肺癌细胞对化疗药物的耐药性
肺癌化疗中会不可避免地出现耐药的情况。逆转癌症化疗耐药性仍然是化疗的关键挑战。随着对线粒体研究的进一步深入,证实可以通过靶向线粒体等方式将药物输送至肿瘤部位,从而克服耐药。Tian等[26]发现一种由透明质酸包裹的紫杉醇(paclitaxel, PTX)脂质体,利用自身负zeta电位和纳米级尺寸减少了免疫系统对其的清除,直接作用肿瘤部位,随后HA被溶酶体中丰富的HAase降解,脂质体的zeta电位由阴性变为阳性,DQA包封的脂质体通过其亲脂性和离域阳离子性质靶向线粒体,将PTX传递给线粒体,这使得PTX克服一般耐药,同时在细胞质和线粒体内发挥作用。Ruan等[27]通过研究发现,热响应纳米载体N-异丙基丙烯酰胺(N-isopropylacrylamide, PNIPAM)可以防止阿霉素(doxorubicin, DOX)流出并促进DOX在耐药肺癌中的积累和线粒体靶向。体外实验证实,负载DOX的PNIPAM通过增强DOX与线粒体的共定位,显著降低肺癌H69AR细胞中的ATP水平,使肿瘤细胞中ATP依赖性药物外排泵活性减弱,从而抑制H69AR细胞中的药物外排,逆转DOX耐药小细胞肺癌细胞中DOX耐药性。普朗尼克85(pluronic 85, P85)在许多研究中被证明可以逆转耐药性[28],Wang等[29]构建了一种新的使用酸裂解的二甲基马来酸酐(DA)以二硫键为中间接头(DA-P85-SS-TPP和DA-P-SS-T)修饰多产酸P85共轭线粒体靶向三苯基膦(TPP)的纳米载体,这种纳米载体在肺癌组织的酸性环境(pH=6.5)下显示明显的线粒体靶向性质,通过延长其在血液中的循环时间并增加肿瘤细胞的内吞作用。而具有TPP的聚合物可用作将PTX靶向递送到线粒体的有效载体,随后PTX诱导线粒体膜电位降低,导致ATP水平降低,阻断能量供应并显著抑制P-糖蛋白的生物活性,最终克服A549/ADR细胞的TPX耐药性。
3.3 与中医药联合应用研究
传统中医药以其独特的整体观念和辨证论治体系,在肺癌特别是中晚期肺癌治疗中疗效甚佳,中医药与手术、放化疗、靶向治疗的联合运用更是表现出巨大的优势。随着对中医药抗肿瘤作用机制的深入研究,证实中药单药和复方具有强大线粒体功能的调控作用,并通过此途径参与地参与肿瘤的治疗[30]。苦杏仁属于止咳化痰药,广泛运用于肺癌治疗当中,苦杏仁苷是传统中药苦杏仁中的有效成分。Lin等[31]研究发现,苦杏仁苷在体外实验中抑制肺癌A9和PC8细胞的增殖,进一步的机制研究证实,苦杏仁苷可以增强NFκB-1基因在肺癌细胞中的表达,NF-κB的持续性激活改变了与细胞凋亡相关的蛋白质(Bax、Bcl-2、细胞色素C、半胱天冬酶9、半胱天冬酶3和PARP)的表达,最终导致肺癌细胞中线粒体介导的细胞凋亡。同时,Wang等[32]也发现,中国传统抗癌药物土贝母苷I(tubeimoside I, Tub),通过破坏了线粒体和溶酶体通路及其相互作用,从而表现出对癌症细胞具有特异性和增强的杀伤作用。其具体机制包括增强DRP1介导的线粒体分裂以及阻断了功能失调的线粒体的去除,最终导致ROS的积累,并通过ROS介导的Bax、Bcl-2以及细胞色素C改变诱导的肺癌细胞凋亡。Zhang等[33]研究发现,中药复方蟾蝓保元汤,可以通过增加Bax/Bcl-2蛋白比例,将细胞色素c从线粒体释放到细胞质中,随后激活半胱天冬酶-9和下游激活半胱天冬酶-3来诱导细胞凋亡,显著抑制人肺腺癌细胞的生长并诱导凋亡。另外,桔贝合剂是一种由桔梗、浙贝母、苦杏仁、麦冬、黄芩、枇杷叶、甘草组成的中成药口服液,被证实增强了吉非替尼在NSCLC细胞中的敏感性,其具体机制涉及对PI3K/AKT和MAPK信号通路的抑制,进而诱导线粒体介导的细胞凋亡[34]。
4 结论
在既往观念中,线粒体对肺癌的影响主要涉及能量合成及代谢过程,随着对线粒体作用机制的深入研究,发现线粒体还可以通过对细胞间信号转导、细胞凋亡进行调控,其功能障碍在肺癌发生和侵袭中发挥至关重要的作用,且被证实在临床治疗中引起部分化学药物的耐药。目前,对线粒体功能障碍特异性诱导的肺癌体内模型有限,缺乏有效的数据支撑,靶向线粒体治疗肺癌药物的开发及临床试验数量较少,需要更多的研究工作,今后还需加强相关药物的研发并积极投入临床试验,以期为肺癌治疗提供新的思路及药物选择。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:吴发胜:论文撰写,数据处理张晖:参与论文撰写,图表制作谢家童、李建福、陈慧:参与论文撰写鲁世金:论文审校 -
-
[1] Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021; 71: 209-249. doi: 10.3322/caac.21660
[2] Pathak T, Trebak M. Mitochondrial Ca2+ signaling[J]. Pharmacol Ther, 2018, 192: 112-123. doi: 10.1016/j.pharmthera.2018.07.001
[3] Green DR, Reed JC. Mitochondria and Apoptosis[J]. Science, 1998, 281(5381): 1309-1312. doi: 10.1126/science.281.5381.1309
[4] Yanes B, Rainero E. The Interplay between Cell-Extracellular Matrix Interaction and Mitochondria Dynamics in Cancer[J]. Cancers (Basel), 2022, 14(6): 1433. doi: 10.3390/cancers14061433
[5] Omasanggar R, Yu CY, Ang GY, et al. Mitochondrial DNA mutations in Malaysian female breast cancer patients[J]. PLoS One, 2020, 15(5): e0233461. doi: 10.1371/journal.pone.0233461
[6] Stewart JB, Alaei-Mahabadi B, Sabarinathan R, et al. Simultaneous DNA and RNA Mapping of Somatic Mitochondrial Mutations across Diverse Human Cancers[J]. PLoS Genet, 2015, 11(6): e1005333. doi: 10.1371/journal.pgen.1005333
[7] Takenaga K, Koshikawa N, Nagase H. Intercellular Transfer of Mitochondrial DNA Carrying Metastasis-enhancing pathogenic mutations from high- to low-metastatic tumor cells and stromal cells via extracellular vesicles[J]. BMC Mol Cell Biol, 2021, 22(1): 52. doi: 10.1186/s12860-021-00391-5
[8] Horibe S, Ishikawa K, Nakada K, et al. Mitochondrial DNA Mutations are involved in the acquisition of cisplatin resistance in human lung cancer A549 cells[J]. Oncol Rep, 2021, 47(2): 32. doi: 10.3892/or.2021.8243
[9] Reznik E, Miller ML, Şenbabaoğlu Y, et al. Mitochondrial DNA Copy number variation across human cancers[J]. Elife, 2016, 5: e10769. doi: 10.7554/eLife.10769
[10] 张宁, 刘璐瑶, 张艺凡, 等. 自噬在钙化性主动脉瓣膜病中的研究进展[J]. 心肺血管病杂志, 2023, 42(5): 514-517, 522. https://www.cnki.com.cn/Article/CJFDTOTAL-XFXZ202305025.htm Zhang N, Liu LY, Zhang YF, et al. Advances in Autophagy in Calcific Aortic Valve Disease[J]. Xin Fei Xue Guan Bing Za Zhi, 2023, 42(5): 514-517, 522. https://www.cnki.com.cn/Article/CJFDTOTAL-XFXZ202305025.htm
[11] Salazar C, Ruiz-Hincapie P, Ruiz LM. The Interplay among PINK1/PARKIN/Dj-1 Network during Mitochondrial Quality Control in Cancer Biology: Protein Interaction Analysis[J]. Cells, 2018, 7(10): 154. doi: 10.3390/cells7100154
[12] Liu J, Zhang C, Zhao Y, et al. Parkin targets HIF-1α for ubiquitination and degradation to inhibit breast tumor progression[J]. Nat Commun, 2017, 8(1): 1823. doi: 10.1038/s41467-017-01947-w
[13] Jin X, Dai L, Ma Y, et al. Implications of HIF-1α in the tumorigenesis and progression of pancreatic cancer[J]. Cancer Cell Int, 2020, 20: 273. doi: 10.1186/s12935-020-01370-0
[14] Sarraf SA, Sideris DP, Giagtzoglou N, et al. PINK1/Parkin Influences Cell Cycle by Sequestering TBK1 at Damaged Mitochondria, Inhibiting Mitosis[J]. Cell Rep, 2019, 29(1): 225-235. e5. doi: 10.1016/j.celrep.2019.08.085
[15] Qi M, Dai D, Liu J, et al. AIM2 promotes the development of non-small cell lung cancer by modulating mitochondrial dynamics[J]. Oncogene, 2020, 39(13): 2707-2723. doi: 10.1038/s41388-020-1176-9
[16] Wang Y, Wang Y, Liu W, et al. TIM-4 orchestrates mitochondrial homeostasis to promote lung cancer progression via ANXA2/PI3K/AKT/OPA1 axis[J]. Cell Death Dis, 2023, 14(2): 141. doi: 10.1038/s41419-023-05678-3
[17] Lennon FE, Salgia R. Mitochondrial dynamics: biology and therapy in lung cancer[J]. Expert Opin Investig Drugs, 2014, 23(5): 675-692. doi: 10.1517/13543784.2014.899350
[18] Yu L, Xiao Z, Tu H, et al. The expression and prognostic significance of Drp1 in lung cancer: A bioinformatics analysis and immunohistochemistry[J]. Medicine (Baltimore), 2019, 98(48): e18228. doi: 10.1097/MD.0000000000018228
[19] Liu WL, Li CY, Cheng WC, et al. High Mobility Group Box 1 Promotes Lung Cancer Cell Migration and Motility via Regulation of Dynamin-Related Protein 1[J]. Int J Mol Sci, 2021, 22(7): 3628. doi: 10.3390/ijms22073628
[20] Hu M, Zhao Y, Cao Y, et al. DRP1 promotes lactate utilization in KRAS-mutant non-small-cell lung cancer cells[J]. Cancer Sci, 2020, 111(10): 3588-3599. doi: 10.1111/cas.14603
[21] Rao S, Mondragón L, Pranjic B, et al. AIF-regulated oxidative phosphorylation supports lung cancer development[J]. Cell Res, 2019, 29(7): 579-591. doi: 10.1038/s41422-019-0181-4
[22] Lv XB, Liu L, Cheng C, et al. SUN2 exerts tumor suppressor functions by suppressing the Warburg effect in lung cancer[J]. Sci Rep, 2015, 5: 17940. doi: 10.1038/srep17940
[23] Dong J, Zhu D, Chen M, et al. Mubritinib enhanced the inhibiting function of cisplatin in lung cancer by interfering with mitochondrial function[J]. Thorac Cancer, 2022, 13(10): 1513-1524. doi: 10.1111/1759-7714.14425
[24] Bajpai A, Desai NN, Pandey S, et al. Chimeric nanoparticles for targeting mitochondria in cancer cells[J]. Nanoscale Adv, 2022, 4(4): 1112-1118. doi: 10.1039/D1NA00644D
[25] Tsakiridis T, Villani L, Broadfield L, et al. 69P The diabetes drug canagliflozin sensitizes non-small cell lung cancer (NSCLC) to radiotherapy and chemotherapy[J]. J Thorac Oncol, 2018, 13(4 Suppl): S37.
[26] Tian Y, Zhang H, Qin Y, et al. Overcoming drug-resistant lung cancer by paclitaxel-loaded hyaluronic acid-coated liposomes targeted to mitochondria[J]. Drug Dev Ind Pharm, 2018, 44(12): 2071-2082. doi: 10.1080/03639045.2018.1512613
[27] Ruan L, Chen J, Du C, et al. Mitochondrial temperature-responsive drug delivery reverses drug resistance in lung cancer[J]. Bioact Mater, 2021, 13: 191-199.
[28] Hong W, Chen D, Zhang X, et al. Reversing multidrug resistance by intracellular delivery of Pluronic® P85 unimers[J]. Biomaterials, 2013, 34(37): 9602-9614. doi: 10.1016/j.biomaterials.2013.08.032
[29] Wang H, Shi W, Zeng D, et al. pH-activated, mitochondria-targeted, and redox-responsive delivery of paclitaxel nanomicelles to overcome drug resistance and suppress metastasis in lung cancer[J]. J Nanobiotechnology, 2021, 19(1): 152. doi: 10.1186/s12951-021-00895-4
[30] Wang S, Fu JL, Hao HF, et al. Metabolic reprogramming by traditional Chinese medicine and its role in effective cancer therapy[J]. Pharmacol Res, 2021, 170: 105728. doi: 10.1016/j.phrs.2021.105728
[31] Lin S, Wen J, Xu X, et al. Amygdalin Induced Mitochondria-Mediated Apoptosis of Lung Cancer Cells via Regulating NFκB-1/NFκB Signaling Cascade in Vitro and in Vivo[J]. Am J Chin Med, 2022, 50(5): 1361-1386. doi: 10.1142/S0192415X22500586
[32] Wang K, Zhan Y, Chen B, et al. Tubeimoside I-induced lung cancer cell death and the underlying crosstalk between lysosomes and mitochondria[J]. Cell Death Dis, 2020, 11(8): 708. doi: 10.1038/s41419-020-02915-x
[33] Zhang Y, Zeng F, Liu X, et al. Chan-Yu-Bao-Yuan-Tang induces apoptosis in NSCLC and SCLC cell lines via a mitochondria-mediated pathway[J]. Xenobiotica, 2011, 41(7): 593-602. doi: 10.3109/00498254.2011.565818
[34] Pan Z, Chen Q, Zheng X, et al. JuBei Oral Liquid Induces Mitochondria-Mediated Apoptosis in NSCLC Cells[J]. Onco Targets Ther, 2020, 13: 7585-7598. doi: 10.2147/OTT.S254464
-
期刊类型引用(1)
1. 陈园丽,祖璎玲. 同胞全相合与单倍体相合外周血造血干细胞移植对急性髓系白血病患者的疗效比较. 实用癌症杂志. 2025(06): 1023-1025+1029 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: