-
摘要:目的
探讨二甲双胍对卵巢癌细胞增殖、周期、凋亡和迁移的影响及其作用机制。
方法选取卵巢癌A2780、CAOV3、SKOV3细胞为研究对象,MTT和克隆形成实验检测二甲双胍对细胞增殖的影响,划痕实验和Transwell实验检测二甲双胍对细胞迁移能力的影响,流式细胞术检测二甲双胍对细胞周期和凋亡的影响,Western blot法检测二甲双胍对细胞AMPK磷酸化、mTOR磷酸化、CXCR4和Wnt/β-catenin蛋白表达的影响。
结果随着二甲双胍浓度增加和作用时间延长,卵巢癌细胞存活率明显下降。A2780、CAOV3及SKOV3细胞48 h的IC50分别为16.36、36.65和43.44 mmol/L。与对照组相比,二甲双胍处理后,细胞克隆形成能力和迁移能力被明显抑制,细胞周期阻滞于G0/G1期,细胞凋亡率增加。随着二甲双胍浓度增加,磷酸化AMPK蛋白表达逐渐增加,磷酸化mTOR、CXCR4、Dvl3、β-catenin、CyclinD1、CDK1蛋白表达逐渐降低。
结论二甲双胍对卵巢癌细胞具有抗肿瘤作用,其机制可能与激活AMPK抑制CXCR4介导的Wnt/β-catenin信号通路有关。
Abstract:ObjectiveTo explore the antitumor effects of metformin on ovarian cancer cells in vitro, particularly on tumor cell proliferation, cell cycle, apoptosis, migration, and possible mechanism.
MethodsOvarian cancer cell lines (A2780, CAOV3, and SKOV3) were treated with different concentrations of metformin. Their proliferation was explored using the MTT and clone formation assays, cell migration was examined using the scratch and Transwell assays, and cell cycle and apoptosis were examined using flow cytometry. In addition, metformin’s effects on the phosphorylation of AMPK and mTOR and the expression of CXCR4 and Wnt/β-catenin protein was measured by Western blot.
ResultsThe survival rates of ovarian cancer cells decreased significantly with increasing metformin concentration and metformin treatment time. The IC50 values of metformin at 48 h for A2780, CAOV3, and SKOV3 cells were 16.36, 36.65, and 43.44 mmol/L, respectively. Compared with the control group, the clone formation ability and cell migration ability of ovarian cancer cells were significantly inhibited by metformin treatment and cell cycle arrested at the G0/G1 phase, and the apoptosis rate increased. As metformin concentration increased, the expression of phosphorylated AMPK protein gradually increased, and the expression levels of phosphorylated mTOR, CXCR4, Dvl3, β-catenin, cyclin D1, and CDK1 decreased.
ConclusionMetformin exerts an antitumor effect on ovarian cancer cells, which is related to the activation of AMPK to inhibit CXCR4-mediated Wnt/β-catenin signaling pathway.
-
Key words:
- Metformin /
- Ovarian cancer /
- Proliferation /
- Migration /
- CXCR4
-
0 引言
卵巢癌是常见的妇科恶性肿瘤之一,其发病率排妇科恶性肿瘤第2位,死亡率居妇科恶性肿瘤首位[1]。临床上一线治疗方式是肿瘤细胞减灭术联合化疗,新兴治疗方式还有免疫治疗和靶向治疗[2]。大多数患者确诊时已达肿瘤晚期,发生远处转移并易复发,预后极差[2]。因此,亟需探索新的治疗方案以改善卵巢癌患者的预后。二甲双胍是一种常用的降糖药,基于人群的回顾性研究发现,二甲双胍在糖尿病患者的治疗中对癌症发生发展有一定程度的保护作用,可降低癌症发病风险和癌症相关死亡率[3-5]。有研究发现接受过二甲双胍/胰岛素治疗的患者卵巢癌发病率低于未接受过二甲双胍及胰岛素治疗的女性[6]。一项Meta分析显示使用二甲双胍的糖尿病患者其卵巢癌患病风险降低,因此推测二甲双胍具有潜在预防卵巢癌的作用[7]。但是二甲双胍的抗癌机制尚不明确。有研究表明,二甲双胍主要通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)通路而改变肿瘤细胞的代谢进而抑制卵巢癌细胞的增殖与转移[8]。CXCR4为趋化因子家族成员中的主要研究靶点,在多种恶性肿瘤的转移中也起重要作用。我们前期研究发现CXCR4在卵巢癌中高表达,参与卵巢癌的侵袭转移,并调控Wnt/β-catenin通路[9]。因此本研究拟探讨二甲双胍对卵巢癌细胞的体外抗肿瘤作用,及其是否对AMPK、CXCR4、Wnt/β-catenin通路产生影响,从而为二甲双胍应用于卵巢癌的临床治疗提供基础理论依据。
1 材料与方法
1.1 实验材料
人卵巢癌细胞株SKOV3、A2780(中国科学院细胞库,上海),CAOV3(吉凯基因,上海),DMEM高糖培养基、RPMI1640培养基(美国Gibco公司),胎牛血清(Gemini,澳达利亚)。二甲双胍购自美国MCE公司,溶于无菌PBS中,储存液浓度为500 mmol/L。MTT购自美国Sigma公司,Transwell小室购自美国Millipore公司,BCA蛋白定量试剂盒购自美国赛默飞公司。兔抗mTOR(#2983)、p-mTOR(#5536)、AMPK(#5831)、p-AMPK(#2535)均购自美国Cell Signaling Technology公司,兔抗CXCR4(ab181020)、Dvl3(ab76081)、β-catenin(ab32572)均购自美国Abcam公司。
1.2 细胞培养
SKOV3和CAOV3使用含10%胎牛血清的DMEM培养基,A2780细胞使用含10%胎牛血清的RPMI1640培养基,置于37℃、5%CO2培养箱,2~3天换液,待细胞融合至80%~90%,用0.25%胰酶消化传代。
1.3 MTT实验
将200 μl细胞悬液种于96孔板(5×103个/孔),过夜细胞贴壁后,将不同浓度的二甲双胍溶液(5、10、15、20、25、35、40、50和60 mmol/L)加入每孔中,同时正常培养基设为对照组,每组5个复孔。药物孵育24、48和72 h后取出96孔板,加入MTT溶液(终浓度0.5 mg/ml)后置于培养箱孵育3 h,吸净孔中溶液,加入200 μl DMSO,振荡器振荡10 min。酶标仪490 nm波长下测吸光度。细胞相对存活率=(OD实验组-OD空白组)/(OD对照组-OD空白组)。
1.4 平板克隆实验
将细胞悬液以1×103个/孔接种至6孔板,过夜细胞贴壁后,加入不同浓度二甲双胍(5、10 mmol/L),每3天换液,继续培养1~2周,待肉眼可见明显细胞集落后,PBS清洗3次,4%多聚甲醛固定15 min,0.1%结晶紫染色15 min,PBS洗3次,室温干燥后拍照,统计集落形成个数。实验重复3次。
1.5 流式细胞仪检测细胞周期
药物处理24 h后,用无EDTA胰酶消化细胞,收集细胞,1 500 r/min离心5 min,预冷PBS洗3次,70%乙醇4℃固定细胞过夜,PBS洗2次,加入RnaseA(50 μg/ml)孵育15 min,加入PI(50 μg/ml)避光孵育15 min,PBS重悬上流式细胞仪(美国BD公司)。
1.6 流式细胞仪检测细胞凋亡
药物处理24 h后,收集细胞中的培养基,用不含EDTA的胰酶将细胞消化下来,中止消化,收集细胞,1 500 r/min离心5 min,PBS洗3次,加入FITC Annexin V和PI,轻轻混匀,避光孵育15 min,同时设置空白对照组。再加入1×缓冲液,重悬后上流式细胞仪。
1.7 划痕实验
将细胞悬液种于6孔板,待细胞融合至100%,用200 μl枪头在单层细胞中垂直划过,形成划痕,PBS洗去漂浮细胞,加入含有不同浓度二甲双胍(5、10 mmol/L)的无血清培养基,间隔12 h拍照观察划痕愈合情况,直至划痕完全愈合。用Image J计算划痕愈合面积进行对比。
1.8 Transwell实验
下室加入500 μl含10%FBS的培养基,轻轻放入小室,将200 μl无血清培养基重悬的细胞悬液(5×104个)加入小室内,培养箱培养24 h后取出,4%多聚甲醛固定15 min,0.1%结晶紫染色,PBS清洗,用棉签小心擦拭小室内表面的细胞,室温晾干后于显微镜下拍照,计数。
1.9 Western blot实验
药物处理48 h后,冰化PBS清洗3次,冰上用含蛋白酶和磷酸酶抑制剂的裂解液裂解细胞15 min,4℃、12 000 r/min离心15 min,收集上清液,用BCA试剂盒进行蛋白定量,其余上清中加入上样缓冲液沸水煮10 min使蛋白变性。将20 μg蛋白在凝胶电泳系统中分离,再转移到NC膜上,牛奶室温封闭4 h,根据分子marker裁剪膜,分别置于一抗中孵育过夜。第二天用TBST洗膜3次后,室温孵育二抗1 h,再次洗膜3次,用ECL化学免疫发光液浸染条带置于Bio-Rad成像系统显影。
1.10 qRT-PCR实验
药物处理24 h后,按照FAST 200试剂盒(上海飞捷生物技术有限公司)的说明书提取细胞RNA,并用酶标仪在260 nm下定量RNA浓度。用Prime Script RT-PCR试剂盒(日本TaKaRa公司)将RNA反转录为cDNA后,与CXCR4引物(Forward Primer: ACTACACCGAGGAAATGGGCT,Reverse Primer: CCCACAATGCCAGTTAAGAAGA)和SYBR-Green PCR Master Mix(日本TaKaRa公司)进行扩增,利用CFX96 Real-time PCR系统(美国Bio-Rad公司)对CXCR4的表达进行检测。基因的表达量用2–ΔΔCT法计算,并以对照组进行标化。
1.11 统计学方法
组间比较使用t检验和One-way ANOVA,使用GraphPad Prism 8进行作图及统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍抑制卵巢癌细胞的增殖
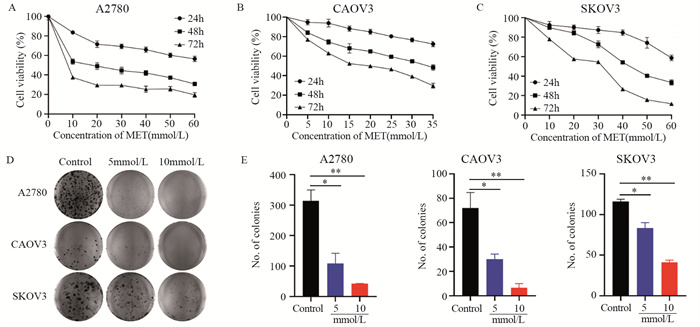
MTT实验评估二甲双胍对卵巢癌细胞(A2780、CAOV3、SKOV3)的细胞毒性,结果显示,二甲双胍对卵巢癌细胞的增殖具有抑制作用,且呈剂量及时间相关性。A2780细胞24小时IC50为91.5 mmol/L,48小时IC50为16.36 mmol/L,见图 1A;CAOV3细胞24小时IC50为78.2 mmol/L,48小时IC50为36.65 mmol/L,见图 1B;SKOV3细胞24小时IC50为78.25 mmol/L,48小时IC50为43.44 mmol/L,见图 1C。同时,二甲双胍对单个卵巢癌细胞的克隆形成能力具有明显抑制作用,且呈剂量依赖关系,见图 1D、1E。
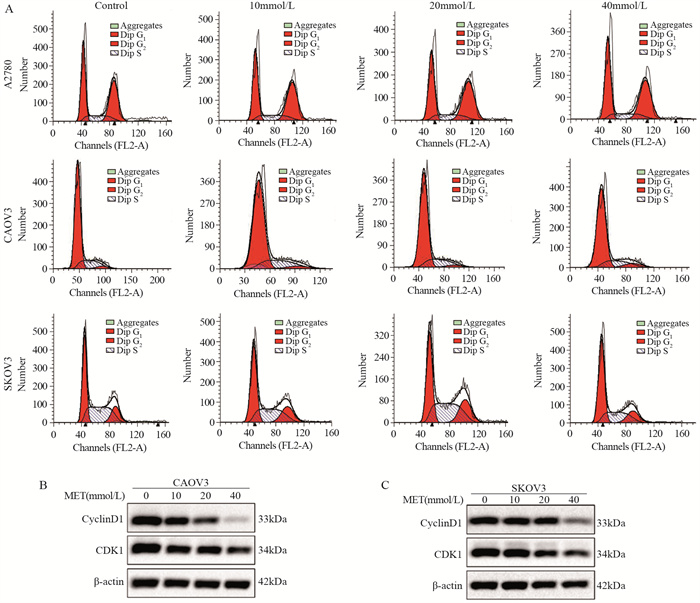
2.2 二甲双胍导致卵巢癌细胞周期阻滞
二甲双胍导致卵巢癌细胞周期阻滞,细胞阻滞于G0/G1期,见图 2A。同时通过Western blot检测周期蛋白Cyclin D1和CDK1的表达,与对照组相比,10、20和40 mmol/L的二甲双胍处理CAOV3和SKOV3细胞48小时后,Cyclin D1和CDK1表达水平降低,见图 2B、C。
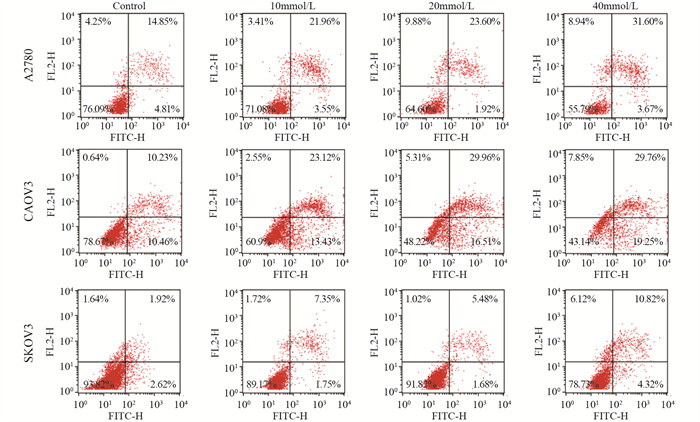
2.3 二甲双胍诱导卵巢癌细胞凋亡
用Annexin V-FITC/PI对卵巢癌细胞进行染色后,通过流式细胞仪检测凋亡细胞。不同浓度的二甲双胍处理细胞24小时后,与对照组相比均可明显促进细胞凋亡,见图 3。
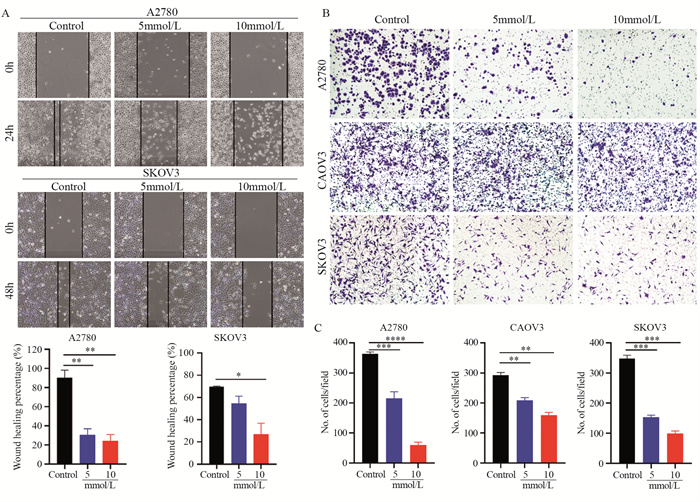
2.4 二甲双胍抑制卵巢癌细胞的迁移
选取增殖抑制率不超过10%的药物浓度进行划痕实验,观察二甲双胍对卵巢癌细胞迁移能力的影响。划痕处理24小时后,对照组的划痕区域被细胞覆盖(99.44%),空白划痕面积减小,二甲双胍组的划痕区域面积仍较大,说明经二甲双胍处理后的A2780细胞迁移能力减弱,且10 mmol/L的迁移抑制(24.26%, P=0.0051)较5 mmol/L(30.47%, P=0.0067)明显;划痕处理48小时后,对照组的划痕区域被细胞覆盖(69.59%),空白划痕区域面积减小,而二甲双胍处理的细胞划痕创面仍较大,说明经二甲双胍处理后的SKOV3细胞迁移能力减弱(P=0.0172),见图 4A。
通过Transwell实验也观察到同样的现象:与对照组相比,二甲双胍处理24小时后,穿过Transwell小室的卵巢癌细胞较少,说明二甲双胍明显抑制卵巢癌细胞的迁移能力(P<0.01),见图 4B、4C。
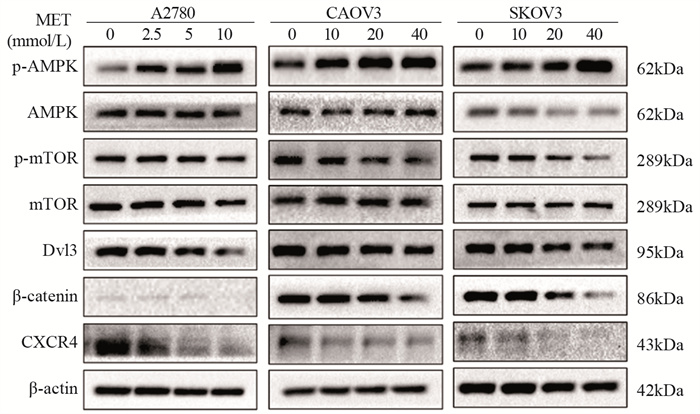
2.5 二甲双胍抑制卵巢癌细胞增殖、迁移的机制
Western blot结果证明二甲双胍可以激活AMPK的磷酸化,抑制mTOR的磷酸化,抑制Dvl3和β-catenin及CXCR4的表达,见图 5。
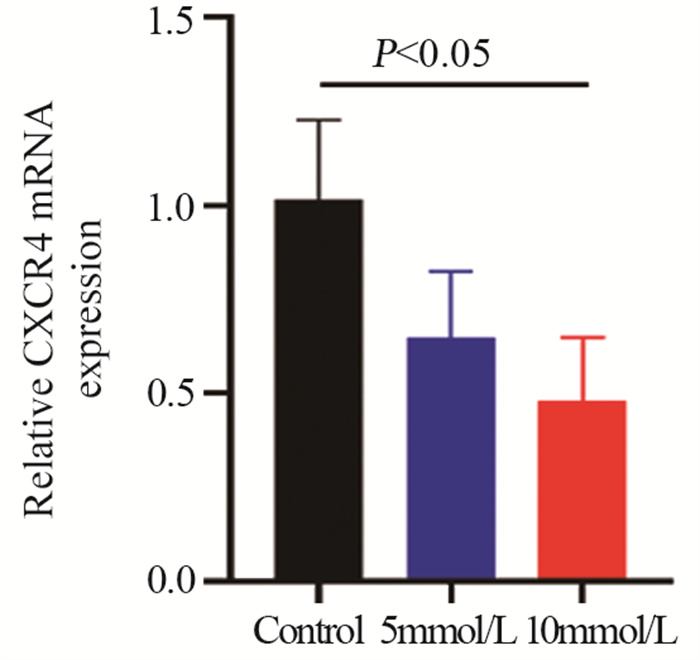
二甲双胍处理CAOV3细胞24小时后,提取RNA进行RT-qPCR检测CXCR4 mRNA的变化,发现在转录水平二甲双胍抑制CXCR4的表达(P=0.0296),见图 6。
3 讨论
在体外细胞培养模型中,二甲双胍可以抑制多种肿瘤细胞的增殖,包括乳腺癌、前列腺癌、子宫内膜癌、宫颈癌[10-13]。既往研究表明,二甲双胍通过直接作用和间接作用发挥抗癌潜能:通过抑制线粒体呼吸链复合物Ⅰ降低肿瘤细胞的能量消耗直接抑制肿瘤生长,也可以通过降低空腹血浆胰岛素水平并增加骨骼肌葡萄糖摄取来减弱胰岛素抵抗,抑制肿瘤细胞的有丝分裂和生长而发挥间接抗癌作用[14]。这些抗癌作用都是通过细胞能量监测器AMPK介导的,AMPK的活化是二甲双胍发挥抗癌作用的主要效应分子[15]。AMPK依赖性抑制mTOR信号对肿瘤细胞的生长和增殖至关重要,是目前双胍类药物研究最多的抗肿瘤机制[15]。有研究发现,二甲双胍通过抑制CyclinD1而抑制前列腺癌的细胞增殖[11]。二甲双胍还可以通过卵巢癌细胞的AMPK/GSK3β轴诱导CyclinD1降解而导致细胞周期发生G1期阻滞[16],通过促进Parkin诱导的P53泛素化而抑制卵巢癌细胞生长[17]。
本研究发现二甲双胍可以有效抑制卵巢癌A2780、CAOV3、SKOV3的增殖、迁移,诱导细胞周期阻滞,促进细胞凋亡,在细胞水平发挥抑制肿瘤恶性行为的作用,还说明了二甲双胍可降低卵巢癌细胞中CXCR4蛋白及转录水平的表达。CXCR4属于趋化因子受体的CXC家族,可以被单一配体CXCL12特异性激活[18]。低氧条件下,癌细胞产生的CXCL12与内皮细胞表面的CXCR4相互作用可能会增强卵巢癌的血管生成[18]。Scotton等在卵巢癌细胞中检测了14种趋化因子受体,其中CXCR4是唯一表达于卵巢癌细胞的趋化因子受体[19]。我们的前期研究结果显示卵巢癌组织中CXCR4 mRNA的表达显著高于正常卵巢组织[9, 20]。多项研究表明CXCR4在卵巢癌组织中高表达,且是上皮性卵巢癌患者的独立预后因素,CXCR4表达水平高预示着卵巢癌的预后较差[9, 21-23]。CXCR4在卵巢癌的发生发展中具有促进肿瘤细胞迁移、侵袭及EMT转化的作用,有望成为治疗靶标[24-26]。因此,二甲双胍降低卵巢癌细胞中CXCR4的水平,可能是其发挥抗肿瘤作用的原因。有研究报道二甲双胍在杜氏肌营养不良症的动物模型中可以降低CXCL12和CXCR4的水平[27],还可以显著降低成纤维细胞中CXCR4的表达[28]。Dirat等[29]提出二甲双胍通过降低CXCR4的表达而抑制前列腺癌细胞的迁移。但二甲双胍单独作用时并不影响乳腺癌细胞中CXCR4蛋白的变化,仅在与熊果酸协同作用时才下调CXCR4的表达从而抑制乳腺癌细胞的侵袭和迁移[30]。本研究进一步拓展了二甲双胍在不同疾病模型中对CXCR4的影响形式。
总之,本研究提示二甲双胍可以抑制卵巢癌细胞的增殖,且呈时间-浓度依赖性。二甲双胍可以诱导细胞发生周期阻滞和细胞凋亡,并抑制细胞的迁移能力。本研究进行了二甲双胍发挥作用的初步机制探讨,这些作用可能是通过激活AMPK磷酸化、抑制mTOR磷酸化、抑制CXCR4的表达及Wnt/β-catenin通路来实现的,具体作用机制还需要进一步研究。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:余慧:实验实施、数据分析、论文撰写和修改李臻:实验构思、方法设计、论文审阅王佳:实验指导、论文修改、基金支持 -
-
[1] Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. doi: 10.3322/caac.21763
[2] Colombo N, Sessa C, du Bois A, et al. ESMO-ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent diseasedagger[J]. Ann Oncol, 2019, 30(5): 672-705. doi: 10.1093/annonc/mdz062
[3] Buczyńska A, Sidorkiewicz I, Krętowski AJ, et al. Metformin Intervention-A Panacea for Cancer Treatment?[J]. Cancers (Basel), 2022, 14(5): 1336. doi: 10.3390/cancers14051336
[4] Kim YS, Choi EA, Lee JW, et al. Metformin use reduced the overall risk of cancer in diabetic patients: A study based on the Korean NHIS-HEALS cohort[J]. Nutr Metab Cardiovasc Dis, 2020, 30(10): 1714-1722. doi: 10.1016/j.numecd.2020.05.010
[5] Hua Y, Zheng Y, Yao Y, et al. Metformin and cancer hallmarks: shedding new lights on therapeutic repurposing[J]. J Transl Med, 2023, 21(1): 403. doi: 10.1186/s12967-023-04263-8
[6] Wen KC, Sung PL, Wu A, et al. Neoadjuvant metformin added to conventional chemotherapy synergizes anti-proliferative effects in ovarian cancer[J]. J Ovarian Res, 2020, 13(1): 95. doi: 10.1186/s13048-020-00703-x
[7] Lu MZ, Li DY, Wang XF. Effect of metformin use on the risk and prognosis of ovarian cancer: an updated systematic review and meta-analysis[J]. Panminerva Med, 2023, 65(3): 351-361.
[8] Li C, Liu VW, Chiu PM, et al. Reduced expression of AMPK-beta1 during tumor progression enhances the oncogenic capacity of advanced ovarian cancer[J]. Mol Cancer, 2014, 13: 49.
[9] Wang J, Cai J, Han F, et al. Silencing of CXCR4 blocks progression of ovarian cancer and depresses canonical Wnt signaling pathway[J]. Int J Gynecol Cancer, 2011, 21(6): 981-987. doi: 10.1097/IGC.0b013e31821d2543
[10] Nurzhan S, Bekezhankyzy Z, Ding H, et al. The Effect of Different Glucose Concentrations on the Antiproliferative Activity of Metformin in MCF-7 Breast Cancer Cells[J]. Pharmaceutics, 2023, 15(9): 2186. doi: 10.3390/pharmaceutics15092186
[11] Papachristodoulou A, Heidegger I, Virk RK, et al. Metformin Overcomes the Consequences of NKX3.1 Loss to Suppress Prostate Cancer Progression[J]. Eur Urol, 2023. S0302-2838(23)03106-6. Online ahead of print.
[12] Zhang J, Kuang L, Li Y, et al. Metformin Regulates TET2 Expression to Inhibit Endometrial Carcinoma Proliferation: A New Mechanism[J]. Front Oncol, 2022, 12: 856707. doi: 10.3389/fonc.2022.856707
[13] Chen YH, Yang SF, Yang CK, et al. Metformin induces apoptosis and inhibits migration by activating the AMPK/p53 axis and suppressing PI3K/AKT signaling in human cervical cancer cells[J]. Mol Med Rep, 2021, 23(1): 88.
[14] Urpilainen E, Puistola U, Boussios S, et al. Metformin and ovarian cancer: the evidence[J]. Ann Transl Med, 2020, 8(24): 1711. doi: 10.21037/atm-20-1060
[15] Steinberg GR, Carling D. AMP-activated protein kinase: the current landscape for drug development[J]. Nat Rev Drug Discov, 2019, 18(7): 527-551. doi: 10.1038/s41573-019-0019-2
[16] Gwak H, Kim Y, An H, et al. Metformin induces degradation of cyclin D1 via AMPK/GSK3beta axis in ovarian cancer[J]. Mol Carcinog, 2017, 56(2): 349-358. doi: 10.1002/mc.22498
[17] Min X, Zhang T, Lin Y, et al. Metformin inhibits the growth of ovarian cancer cells by promoting the Parkin-induced p53 ubiquitination[J]. Biosci Rep, 2020. BSR20200679. Online ahead of print. doi: 10.1042/BSR20200679
[18] Yang Y, Li J, Lei W, et al. CXCL12-CXCR4/CXCR7 Axis in Cancer: from Mechanisms to Clinical Applications[J]. Int J Biol Sci, 2023, 19(11): 3341-3359. doi: 10.7150/ijbs.82317
[19] Scotton CJ, Wilson JL, Milliken D, et al. Epithelial cancer cell migration: a role for chemokine receptors?[J]. Cancer Res, 2001, 61(13): 4961-4965.
[20] Zhang J, Huang S, Quan L, et al. Determination of Potential Therapeutic Targets and Prognostic Markers of Ovarian Cancer by Bioinformatics Analysis[J]. Biomed Res Int, 2021, 2021: 8883800.
[21] Lim H, Kim SI, Kim EN, et al. Tissue Expression and Prognostic Role of CXCL12 and CXCR4 in High-grade Serous Ovarian Carcinoma[J]. Anticancer Res, 2023, 43(7): 3331-3340. doi: 10.21873/anticanres.16509
[22] Liu CF, Liu SY, Min XY, et al. The prognostic value of CXCR4 in ovarian cancer: a meta-analysis[J]. PLoS One, 2014, 9(3): e92629. doi: 10.1371/journal.pone.0092629
[23] Huang X, Hao J, Tan YQ, et al. CXC Chemokine Signaling in Progression of Epithelial Ovarian Cancer: Theranostic Perspectives[J]. Int J Mol Sci, 2022, 23(5): 2642. doi: 10.3390/ijms23052642
[24] Zheng N, Liu W, Chen J, et al. CXCR7 is not obligatory for CXCL12-CXCR4-induced epithelial-mesenchymal transition in human ovarian cancer[J]. Mol Carcinog, 2019, 58(1): 144-155. doi: 10.1002/mc.22916
[25] Luo N, Chen DD, Liu L, et al. CXCL12 promotes human ovarian cancer cell invasion through suppressing ARHGAP10 expression[J]. Biochem Biophys Res Commun, 2019, 518(3): 416-422. doi: 10.1016/j.bbrc.2019.07.098
[26] Liu Y, Ren CC, Yang L, et al. Role of CXCL12-CXCR4 axis in ovarian cancer metastasis and CXCL12-CXCR4 blockade with AMD3100 suppresses tumor cell migration and invasion in vitro[J]. J Cell Physiol, 2019, 234(4): 3897-3909. doi: 10.1002/jcp.27163
[27] Lai X, Chen J. C-X-C motif chemokine ligand 12: a potential therapeutic target in Duchenne muscular dystrophy[J]. Bioengineered, 2021, 12(1): 5428-5439. doi: 10.1080/21655979.2021.1967029
[28] Stuermer EK, Besser M, Terberger N, et al. Side effects of frequently used oral antidiabetics on wound healing in vitro[J]. Naunyn Schmiedebergs Arch Pharmacol, 2019, 392(3): 371-380. doi: 10.1007/s00210-018-01597-9
[29] Dirat B, Ader I, Golzio M, et al. Inhibition of the GTPase Rac1 mediates the antimigratory effects of metformin in prostate cancer cells[J]. Mol Cancer Ther, 2015, 14(2): 586-596. doi: 10.1158/1535-7163.MCT-14-0102
[30] Zheng G, Shen Z, Xu A, et al. Synergistic Chemopreventive and Therapeutic Effects of Co-drug UA-Met: Implication in Tumor Metastasis[J]. J Agric Food Chem, 2017, 65(50): 10973-10983. doi: 10.1021/acs.jafc.7b04378
-
期刊类型引用(0)
其他类型引用(2)



 下载:
下载: