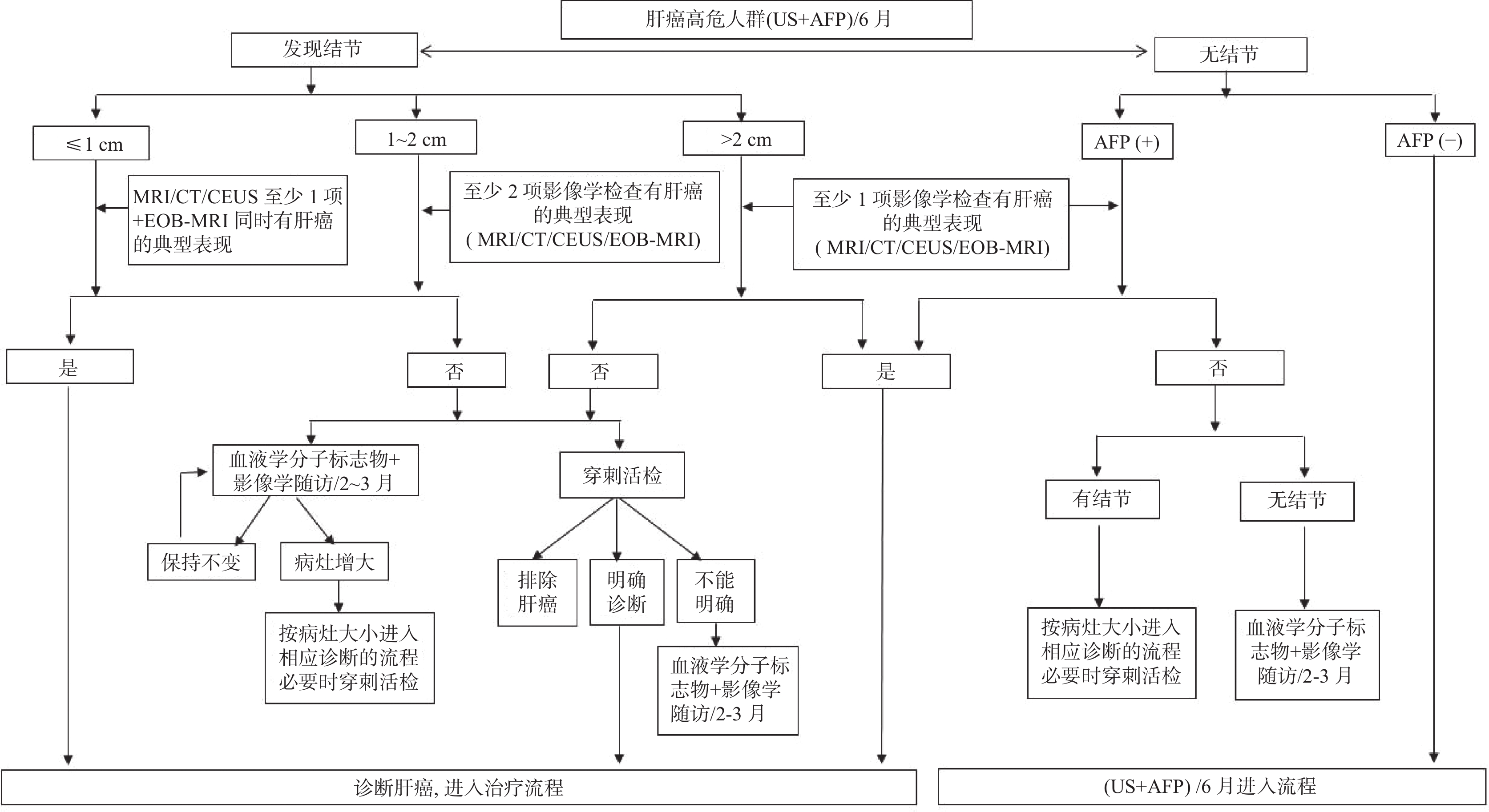
原发性肝癌诊疗指南(2024 年版)
详细信息Standardization for Diagnosis and Treatment of Primary Hepatic Carcinoma (2024 Edition)
-
-
Key words:
- Primary hepatic carcinoma /
- Diagnosis /
- Treatment /
- Standardization
-
0 引言
CRC是全球好发的恶性肿瘤之一,其发病率和死亡率分别占世界恶性肿瘤的第三和第二[1],约35%患者在发现时发生了转移[2]。化疗后的耐药性使得转移及复发性CRC患者治疗效果欠佳,免疫治疗为CRC患者提供了新的思路。
越来越多的研究表明,肿瘤免疫微环境(Tumor immune microenvironment, TME)在CRC的发生发展和侵袭转移中扮演着重要角色[3-5]。通过免疫组织化学对DNA错配修复(Mismatch repair, MMR)蛋白进行定量,可将CRC分成错配修复缺陷(Mismatch repair deficiency, dMMR)或错配修复健全(Proficiency of mismatch repair, pMMR)型CRC[6]。dMMR型CRC缺乏MMR蛋白,无法正确修复遗传错误,称为微卫星高度不稳定(MSI-H)型。该型CRC存在于大约15%的CRC患者中,且仅存在于约5%的转移性CRC中,其突出特点为高肿瘤突变负荷(Tumor mutation burden, TMB)[7],这意味该类型对于常规化疗药物敏感性低,预后较差,但对于免疫治疗的应答性高。探索不同分子分型CRC的免疫治疗方式成为了主流研究方向——开发免疫治疗药物并取得临床获益[8-12]。
本综述将从免疫检查点抑制剂、肿瘤疫苗、过继性细胞治疗等方面探讨结直肠癌目前的免疫治疗现状以及未来可能的发展趋势。
1 非特异性免疫调节治疗
ICIs治疗是近些年来关注度极高的一种治疗方式。PD-1是一种膜受体蛋白,主要存在于免疫细胞表面,可抑制T细胞的炎性反应来调节免疫系统。而PD-L1是PD-1的配体蛋白,是一种跨膜蛋白,主要存在于免疫细胞和某些非免疫细胞的表面,二者结合后,PD-1主要通过酪氨酸磷酸酶(Src homology 2 containing protein tyrosine phosphatase 2, SHP2)来减弱T细胞激活,抑制TME中T淋巴细胞,降低肿瘤的免疫杀伤功能,发生肿瘤免疫逃逸。由于不同类型CRC患者免疫原性不同,pMMR/MSS与dMMR/MSI-H型CRC患者在ICIs治疗方案的探索上也有着差异。
1.1 dMMR/MSI-H型结直肠癌ICIs治疗
dMMR/MSI-H型的CRC更常见于右半结肠,具有分化差的临床特点,且与预后不良的重组B-Raf原癌基因丝氨酸/苏氨酸蛋白激酶(V-raf murine sarcoma viral oncogene homolog B, BRAF)基因突变相关,但许多研究证实该类型CRC对于ICIs治疗敏感[13-14]。相较于MSS型CRC来说,临床上用于MSI-H型的ICIs更常见。
Keynote-177、Checkmate-142试验奠定了ICIs在MSI-H型CRC患者一线治疗的地位。而随着对免疫治疗的进一步了解,ICIs在MSI-H型CRC患者新辅助治疗中的价值凸显。其中最为经典的是NICHE研究,该研究旨在探究术前伊匹木单抗(Ipilimumab)和纳武利尤单抗(Nivolumab)联合或者不联合塞来昔布治疗非转移性CRC患者的安全性、可行性以及免疫相关活性,在入组的32名dMMR型CRC患者中,31名患者实现了病理缓解,其中22名患者达到病理完全缓解,且在随访阶段入组患者均未出现疾病复发[15]。而同时,由中山大学附属第六医院开展的PICC试验[16]、意大利开展的NICOLE试验(NCT04123925)等都显示出单药ICIs在局晚期dMMR/MSI-H型CRC新辅助治疗中可达到良好的肿瘤控制率及疾病缓解率。在观察到单药ICIs治疗效益良好的基础上开展的NICHE2试验,更提示了双免疫治疗在该类型患者新辅助治疗的重要地位(99.1%的患者观察到病理缓解,且未出现复发)。新辅助免疫治疗联合放化疗的临床试验目前正在开展中,其中日本的VOLTAGE-A研究(NCT02948348)通过对比MSS型及MSI-H型CRC患者分别接受纳武利尤单抗(Nivolumab)联合放化疗后发现,联合放化疗组患者更受益(37名MSS型中17名患者达到病理完全缓解,5名MSI-H型中有3名达到病理完全缓解)。新辅助免疫治疗可能会在未来改变肿瘤的治疗模式,甚至会冲击手术的重要地位。
除此之外,该疗法在MSI-H型CRC患者的后线治疗中也占据相当重要的位置。在2015年开展的KEYNOTE-016试验中发现,经标准治疗失败的dMMR/MSI-H型CRC患者使用帕博丽珠单抗(Pembrolizumab)治疗后,客观缓解率(Objective response rate, ORR)高达40%[8],基于此,后期开展的KEYNOTE-177试验中观察到一线使用帕博丽珠单抗相较于标准化疗能显著延长dMMR/MSI-H型CRC患者的无进展生存期(Progression-free survival, PFS)(16.5个月vs. 8.2个月)[17]。因此,FDA于2020年6月批准该药用于dMMR/MSI-H型转移性CRC的一线治疗。而在当下一项评估PD-1免疫检查抑制剂应用于局部晚期直肠癌患者的Ⅱ期临床试验中,仅使用单药PD-1抑制剂就可以让入组的12例Ⅱ/Ⅲ期的dMMR型局部晚期直肠癌患者获得完全缓解(Complete response, CR),而且在随访的阶段(6~25个月)所有患者未报告肿瘤进展或者复发[18]。不止是在免疫单药的使用中获得了很好的治疗效果,在双免联合治疗的应用中也显现出良好的前景。在CheckMate-142研究中,通过PD-L1单抗单用或联合细胞毒性T淋巴细胞相关蛋白4(Cytotoxic T-lymphocyte antigen 4, CTLA-4)单抗治疗MSI-H/dMMR型mCRC,与使用单药抗PD-1单抗相比,联合CTLA-4单抗的双免疫疗法观察到较好的治疗效果(ORR达55%,中位PFS尚未达到,但9个月PFS率达76%,中位OS尚未达到)[19]。虽然疗效得到提高,但是双免疫疗法增加的药物毒性又是亟需解决的难题。
CRC患者中有10%会出现BRAF突变,其中以BRAF V600E突变为常见,该突变大多对于化疗不敏感[20]。美国的一项研究中[21],使用该基因相关通路抑制剂达拉非尼、曲美替尼联合ICIs类药物Spartalizumab治疗CRC,结果显示客观缓解率达24.3%,且该团队指出此两类药物联用可以增加免疫效应。但是其在临床上使用的安全性等相关问题仍需大量的临床试验进一步验证。
即使dMMR/MSI-H型结直肠癌人群被认为是ICI治疗的优势人群,但其客观有效率亦仅为30%~40%,仍有一部分患者对于免疫检查点抑制剂治疗的反应欠佳,后期治疗的探索也应针对此类型患者。
1.2 pMMR/MSS型结直肠癌ICIs治疗
在CRC患者中,pMMR/MSS型是CRC更为常见的类型,该类型患者免疫原性低,对免疫治疗应答效果差。由于此类型CRC患者对于单药ICIs的疗效欠佳,因此联合治疗是其重要探索方向之一。
首先尝试的是在MSI-H群体中曾经取得成功的PD-L1单抗联合CTLA-4单抗的双免疫疗法,此种联用方式在一定程度上增加了效应T细胞的浸润。由加拿大癌症中心开展的一项关于探究PD-L1单抗和CTLA-4单抗能否提高转移性难治性CRC患者生存率的Ⅱ期临床试验[22],其中纳入的98%的患者均为pMMR/MSS型,研究结果显示,双免疫治疗组的中位总生存期达到6.6个月,疾病控制率(Disease control rate, DCR)达到22.6%。而免疫联合靶向治疗也同样展现出良好的治疗效益[23]。尽管双免疫治疗的有效性得到了相关研究验证[24],但仍需进一步实践探索。免疫联合化疗是其探索的方向之一,可以增加免疫原性,并可以抑制耐药性的产生。在Keynote-651[25]中,研究了帕博利珠单抗联合mFOLFOX或者FOLFIRI治疗一线或者二线治疗后晚期转移性MSS型CRC患者的有效性,结果显示前者联合后的ORR为58%,DCR为94%,初步验证联合方案的有效性,但是如何实现方案的最佳联合还需要进一步探索。联合抗血管治疗也可以为此类型患者的治疗带来新的希望。BBCAPX是一项随机、多中心研究[26],旨在探索伴有RAS突变的MSS型转移性CRC中,在标准一线治疗方案CAPEOX+贝伐珠单抗的基础上,联合信迪利单抗能否为一线治疗方案提供新思路,其Ⅰ期临床研究数据显示,ORR达84%,DCR达到100%;随即展开的Ⅱ期试验中指出入组的13名患者接受两个周期的治疗后,其中一名患者获得完全缓解。基于该试验的阳性结果,Ⅲ期临床试验正在进行中。同时,对伴有BRAF突变的MSS型CRC患者来说,靶向药物的联合使用也可为其提供新的治疗方向。REGONIVO研究旨在探讨纳武利尤单抗联合瑞戈非尼对难治性MSS型CRC患者治疗的有效性[27],该试验数据显示,MSS型患者的ORR为33.3%,PFS持续时间为7.9个月,且1年的PFS率为41.8%,OS为68%。然而,免疫治疗联合其他方式的治疗所带来的益处与不良反应之间的平衡仍然存在争议[28],需要进一步的研究和探索。
2 肿瘤疫苗
肿瘤疫苗是一种新兴的免疫疗法,目的在于启动免疫系统,由“冷肿瘤”变为“热肿瘤”。此疗法通过注射肿瘤抗原物质使患者产生免疫反应,从而调节抗原提呈细胞(Antigen presenting cells, APCs)以及T淋巴细胞间的相互作用,以激活肿瘤特异性CD8+细胞毒性T细胞来达到持久的肿瘤消退甚至根除效果。以下将分别介绍其中的DC疫苗、溶瘤病毒载体疫苗以及多肽疫苗等肿瘤疫苗在CRC中的应用现状。
2.1 树突状细胞疫苗
树突状细胞(Dendritic cells, DC)是体内最强的APCs,肿瘤DC疫苗可将肿瘤相关抗原(Tumor-associated antigen, TAA)导入DC中,对抗原进行处理加工后以抗原肽—主要组织相容性复合体(Peptide-major histocompatibility complex, pMHC)的形式提呈给CD8+T细胞,促进T细胞增殖分化为细胞毒性T淋巴细胞,还可以同时激活B淋巴细胞,启动抗体免疫系统达到高效抗肿瘤效果,其次DC可以通过表面共刺激分子激活T细胞,从而找到并杀死肿瘤细胞[29]。直到2010年FDA批准了首个治疗性DC疫苗Sipuleucel-T,用以治疗去势抵抗性前列腺癌[30],才开启了DC疫苗研发的新篇章。
印度生物技术公司在化疗失败的难治性实体瘤患者中开展了一项多中心Ⅱ期临床试验[31-32],验证了DC疫苗APCEDEN的安全性及有效性,疫苗治疗组患者出现的相关不良反应仅为输液时的寒战及轻度发热,且中位无事件生存时间为11个月(对照组5个月)。基于此,2017年4月5日印度食品药品监督管理局批准其上市,用于治疗前列腺癌、卵巢癌、结直肠癌以及小细胞肺癌。
而DC疫苗对于CRC治疗价值的探索仍在继续,在由纳瓦拉大学临床研究中心开展的评估自身裂解DC疫苗治疗CRC肝转移的Ⅱ期临床试验中[33],观察到疫苗组表现为更少及延迟复发,且中位无病生存期明显延长(25.26个月vs. 9.53个月)。在由Español等人开展的一项DC疫苗联合阿维鲁单抗(Avelumab)治疗MSS型转移性CRC的Ⅰ~Ⅱ期临床试验(NCT03152565)中,中位无进展时间3.1个月(2.1~5.3个月),总生存期12.2个月(2.2~23.2个月),且验证了联合使用的安全性(无3~4级毒性反应)[34]。目前相关临床试验仍在接连展开。新加坡癌症中心开展的一项评估DC疫苗联合纳武利尤单抗(Nivolumab)在结直肠癌肝转移患者中临床疗效的Ⅱ期临床试验也仍在进一步招募中(NCT04912765)[35]。国内的相关研究也仍在临床试验阶段,较为突出的是海欣生物技术公司针对治疗CRC的DC疫苗现也正处于Ⅲ期试验招募阶段。据目前在小鼠模型取得的数据来看,相较于单一疗法,DC疫苗联合抗血管治疗和ICIs治疗在控制CRC患者的疾病复发以及转移方面有着更大的治疗价值[36];而且使用一定的佐剂,例如免疫刺激因子粒细胞-巨噬细胞集落刺激因子(Granulocyte macrophage-colony stimulating factor, GM-CSF)可以吸引DC细胞到达注射部位,进一步增强抗肿瘤免疫反应[37]。但是DC疫苗投入临床使用,如何调节肿瘤免疫微环境、如何选择最佳免疫原性疫苗及选择哪条最佳免疫途径[29]等都还需要进一步研究。
2.2 溶瘤病毒载体疫苗
溶瘤病毒疗法是指利用溶瘤病毒(Oncolytic virus, OVs)有选择性或者优先地感染肿瘤细胞后,释放促免疫原性因子,以募集APCs并促进其成熟,从而激活特异性CD4+T细胞和CD8+T细胞,最终产生抗肿瘤免疫反应。截至目前为止,已有四种基于OVs的药物被批准用于癌症的治疗:第一种是2004年在拉脱维亚获批用于黑色素瘤的ECHO-7病毒,称为Riga virus[38];第二种是2005年在中国获批用于头颈部肿瘤的H101腺病毒,称作Oncorine[39];第三种是2015年FDA批准用于转移性黑色素瘤的HSV-1,称作T-VEC[40];第四种是2021年在日本获批用于治疗恶性脑胶质瘤患者的HSV-1,称为Teserpaturev/G47Δ[41]。
在一项由Garcia-carbonero等开展的多中心Ⅰ期临床试验中,通过定向静脉输注新型Ad11p/Ad3嵌合腺病毒Enadenotucirev后,观察到在CRC患者中发生与治疗相关的不良事件为乏力、发冷、1级或2级中性粒细胞减少等[42]。我国中山大学中山医学院通过对难治性CRC肿瘤细胞HCT-116进行定向进化后,得到新型的NGOVM(M1),不仅表现出了强大的溶瘤性,还表现出了高安全性[43],但其在临床上的治疗意义仍需要进一步验证。多项评估重组单纯疱疹病毒疫苗在晚期实体瘤患者中的临床试验(NCT05860374、NCT05886075)[44]目前在进一步招募患者中。结合目前的临床试验数据来看,尽管OVs作为单一疗法不能对肿瘤抑制产生显著效果,但是其联合ICIs可改善肿瘤免疫微环境中T细胞的浸润,促进ICIs的抗肿瘤特性[45]。后续也需面临挑选适合各个瘤种的OVs、最佳的输送方式以及最佳的联合治疗方式等问题。
2.3 肿瘤多肽疫苗
机体接种肿瘤多肽疫苗后,抗原被APCs内吞后迁移到淋巴结,通过抗原提呈系统激活细胞毒性T淋巴细胞从而杀灭肿瘤;也可通过激活B细胞刺激抗体的分泌来达到抗肿瘤效果。自1993年Vander Bruggen首次发现黑色素瘤相关抗原1(Melanoma-associated antigen 1, MAGE-A1)的MZ2-E蛋白可激发肿瘤特异性免疫反应[46],加速了全世界对于其他肽疫苗的进一步探索。
OBERTO-101试验旨在研究新型多肽疫苗PolyPEPI1018,对于一线化疗后的MSS型转移性CRC患者维持治疗的安全性,入组的11名患者未发生与疫苗有关的严重不良反应,且其中有3名患者评估为肿瘤部分缓解,4名患者处于病情稳定状态,2名患者的病灶已缩小至可以行手术治疗状况[47]。霍普金斯大学综合癌症中心正在进一步探究靶向长肽疫苗联合纳武利尤单抗(Nivolumab)和伊匹木单抗(Ipilimumab)在MSS型CRC患者中的治疗价值(NCT04117087)[48]。肽疫苗治疗CRC的相关临床试验仍在进一步展开,其中由安德森癌症中心开展的一项关于个性化肽疫苗治疗晚期结直肠癌患者疗效及安全性的Ⅰ期临床试验处于招募阶段(NCT02600949)[49]。由于不同的给药途径及给药部位会影响多肽疫苗的抗原提呈效率[50],目前临床上暂未对其注射方式进行统一规定,不过肿瘤特异性、简单性以及成本效益是多肽疫苗的优势所在。
3 过继性细胞治疗
过继性细胞治疗是目前极具潜力的肿瘤免疫治疗策略,是指将经过修饰后的免疫效应细胞回输自身体内,起到直接或者间接杀伤肿瘤细胞的作用。嵌合抗原受体T细胞疗法(Chimeric antigen receptor T cell, CAR-T)和自然杀伤(Natural killer, NK)细胞疗法在结直肠癌中的应用较为广泛。
3.1 嵌合抗原受体T细胞疗法
CAR-T疗法是目前的研究热点,指在体外进行基因修饰后将设计好的CAR基因转入到T细胞的基因组中,形成CAR结构,可使得T细胞直接越过主要组织相容性复合体(Major histocompatibility complex, MHC)抗原提呈机制识别肿瘤细胞,同时获得共刺激信号,从而达到抗肿瘤效果的一种疗法。
阿基伦塞注射液是我国第一个获批用于治疗二线及以上复发性或难治性大B细胞淋巴瘤的CD19靶向自体CAR-T细胞疗法药物。在Neelapu等开展的一项多中心Ⅱ期临床试验中,纳入的111名难治性B细胞淋巴瘤患者注射阿基伦塞后,ORR达到了82%,CR达到了54%,且18个月生存率达52%[51]。相较于血液系统肿瘤,由于实体瘤的异质性、缺乏良好的抗原靶点以及肿瘤微环境中免疫抑制细胞的存在[52],CAR-T细胞治疗实体瘤的有效性仍需进一步观察。但2023年10月在ESMO大会上报道的一项关于研究GUCY2C(GCC)CART细胞疗法治疗晚期转移性CRC患者的安全性、疗效以及药代动力学的Ⅰ期临床试验[53]中,入组的患者均未出现免疫效应细胞相关神经毒性综合征(Immune effector cell-associated neurotoxicity syndrome, ICANS)和≥3级的细胞因子释放综合征(Cytokine release syndrome, CRS),且DCR达66.7%,ORR达11.1%。而后续开展的alloSHRINK试验(NCT03692429)[54]旨在进一步验证CAR-T治疗在接受标准化疗后不可切除的转移性CRC患者中的安全性,其结果值得我们期待。CAR-T治疗方式在临床上的应用价值需进一步探索,而抗原逃逸、靶向非肿瘤效应、肿瘤微环境等局限性也是需进一步探索解决的难题[52]。
3.2 自然杀伤细胞疗法
自然杀伤细胞疗法旨在肿瘤部位激活NK细胞,通过直接的细胞毒性作用或通过干扰素-γ(interferon-γ, IFN-γ)分泌以及调节1型树突状细胞(Type 1 conventional dendritic cell, cDC1)来促进适应性免疫的发生,从而达到抗肿瘤效果。
在一项评估CAR-NK治疗CD19阳性淋巴瘤的Ⅰ期和Ⅱ期临床试验中[55],纳入的11名复发或难治性CD19阳性的淋巴瘤患者均未出现严重不良反应,且有7名患者达到了CR。基于此疗法具有耐受性良好、不易发生抑制物抗宿主病、抗原逃逸发生率低的特点,我国研究者将脐带血(Umbilical cord blood, UCB)中的NK细胞通过膜结合白细胞介素(Interleukin, IL)-21进行扩增得到了eUCB-NK细胞,将其输入小鼠体内,观察到该脐带血NK细胞可以抑制结直肠癌小鼠模型中肿瘤的继续生长,并且该试验也证实CAR-NK治疗联合贝伐珠单抗可以在一定程度上增加NK细胞的浸润,提高抗肿瘤活性[56],这可能为中晚期CRC患者带来新的治疗选择。但是这种疗法在杀死癌细胞的同时,也存在着杀死正常细胞,甚至发生NK淋巴瘤的可能[57-58]。
4 结论与展望
ICIs是目前应用于CRC最广泛的免疫治疗方式,2015年美国霍普金斯大学LE等首次发现了dMMR/MSI-H分子表型的转移性CRC患者能从PD-L1单抗帕博利珠单抗(Pembrolizumab)的治疗中显著获益[8],开启了CRC免疫治疗的新篇章,且美国食品和药物管理局和欧洲药品管理局批准将抗PD-1免疫检查点抑制剂用于治疗转移性或无法切除的dMMR/MSI-H CRC[9-10,59]。2019年由美国杰斐逊研究所研发出的Ad5-GUCY2C-PAD2E免疫疫苗,在早期CRC患者中不仅观察到成功激活免疫细胞诱发免疫反应,甚至达到了控制结直肠癌远处转移的效果[11]。此外,美国国立癌症研究所的Rosenberg团队将T细胞转移疗法应用于伴有KRAS G12D基因突变的转移性CRC患者中,经过治疗后观察到患者的肺部转移灶缩小[12],为过继性细胞疗法在CRC的应用提供了新思路。
得益于免疫检查点抑制剂的出现,免疫治疗为许多癌症患者带来了新的方向。不论单独使用还是联合化学治疗和(或)靶向药物,对于实体瘤患者来说,实体瘤细胞异质性对于免疫治疗的影响、肿瘤免疫微环境的改善以及免疫佐剂如何使用等问题,仍需要进一步验证及探索。
对于CRC的患者来说,由于免疫表型的不同,相关免疫治疗的探索也应更加的精准化。区分好免疫分型类型后再行个体化免疫治疗是重要的第一步。目前免疫治疗只在CRC的一部分患者中取得了成功,今后我们还将面临的问题有:免疫药物耐药性及其耐药机制、免疫治疗预测标志物等。目前免疫治疗在CRC上的成功经验,也可以为其他实体瘤进行免疫治疗提供一定的借鉴。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。 -
(临床)问题 步骤1 步骤2 步骤3 步骤4 步骤5 (证据等级1*) (证据等级2*) (证据等级3*) (证据等级4*) (证据等级5*) 这个疾病有多普遍?(患病率) 当地的,当前的随机样本调查(或普查) 与当地情况相匹配调查的系统综述** 当地的,非随机样本调查** 病例系列** N/A 诊断或监测实验是否准确(诊断) 一致地应用了参考标准和盲法的横断面研究的系统综述 一致地应用了参考标准和盲法的横断面研究 非连续病例研究,或研究未能一致地应用参考标准** 病例对照研究,或应用了差的或非独立的参考标准** 基于机制的推理 若不给予这个治疗会发生什么?(预后) 起始队列研究的系统综述 起始队列研究 队列研究或随机研究的对照组* 病例系列或病例对照研究,或低质量预后队列研究** N/A 这个治疗有用吗?(治疗效益) 随机试验或单病例随机对照试验的系统综述 随机试验或具有巨大效果的观察性研究 非随机对照队列/随访研究** 病例系列,病例对照研究,或历史对照研究** 基于机制的推理 这个治疗常见的伤害是什么(治疗伤害) 随机试验的系统综述,巢式病例对照研究的系统综述,针对你所提临床问题患者的n-of-1试验,具有巨大效果的观察性研究 单个随机试验或(特殊地)具有巨大效果的观察性研究 非随机对照队列/随访研究(上市后监测)提供,足够数量来排除常见的伤害(对长期伤害需要足够长的随访时间)** 病例系列,病例对照研究,或历史对照研究** 基于机制的推理 这个治疗少见的伤害是什么?(治疗伤害) 随机试验或n-of-1试验的系统综述 随机试验或(特殊地)具有巨大效果的观察性
研究这个试验(早期发现)值得吗?(筛查) 随机研究的系统综述 随机试验 非随机对照队列/随访研究* 病例系列,病例对照研究,或历史对照研究** 基于机制的推理 注:* :根据研究质量、精确度、间接性,各个研究间不一致,若绝对效应值小,证据等级会被调低;若效应值很大,等级会被上调;
**:系统综述普遍地优于单项研究推荐强度 定义描述 强推荐 非常确信真实值接近效应估计值。基于:高质量研究证据支持净获益(例如,利大于弊);研究结果一致性好,没有或很少有例外;对研究质量轻微或没有疑虑;和/或获得专家组成员的同意。其他基于高质量证据,确信利明显大于弊(包括指南的文献回顾和分析中讨论的内容)也可支持强推荐。 中等程度推荐 对效应估计值有中等程度信心。基于:较好研究证据支持净获益(例如,利大于弊);研究结果一致,有轻微和/或少数例外;对研究质量轻微或少量疑虑;和/或获得专家组成员的同意。其他基于中等质量证据且利大于弊(包括指南的文献回顾和分析中讨论的内容)也可形成中度推荐。 弱推荐 对效应估计值信心有限,该推荐为临床实践提供了目前最好的指导。基于:有限的研究证据支持净获益(例如,利大于弊);研究结果一致,但有重要的例外;研究质量有重要的疑虑;和/或获得专家组成员的同意。其他基于有限的证据(包括指南的文献回顾和分析中讨论的内容)也可导致弱推荐。 注:推荐强度“强推荐、中等程度推荐、弱推荐”正文中分别用“A、B、C”表示 请临床协助填写:
肿瘤部位及术式:肝叶切除/肝段切除/局部切除/其他:
术前治疗:无/有,介入/消融/靶向/免疫检查点抑制剂/其他:肿瘤数量(n=);肿瘤大小:(多结节性肿瘤应尽可能逐一测量 cm× cm× cm)
肿瘤取材方式:“7点”取材;其他:大体类型:
肝细胞癌:单结节型有包膜/单结节型无包膜、多结节型、巨块型、弥漫型、其他:
肝内胆管癌:管周浸润型、肿块型、混合型、其他:
坏死:无/有(具体比例)组织学类型:
肝细胞癌:细梁型、粗梁型、假腺管型、团片型
特殊亚型:双表型、纤维板层型、硬化型、透明细胞型、富脂型、嫌色型、富中性粒细胞型、富淋巴细胞型和未分化型、其他:
肝内胆管癌:大胆管型、小胆管型、细胆管癌、胆管板畸形型
特殊亚型:腺鳞癌、淋巴上皮瘤样型、肉瘤样型、其他:
混合型肝细胞癌-胆管癌(分别描述两种肿瘤成分的比例)分化分级:
肝细胞癌(Ⅰ、Ⅱ、Ⅲ、Ⅳ/高、中、低)
肝内胆管癌(高、中、低)卫星灶:无/有
MVI:无/有
血管内松散悬浮癌细胞:无/有大血管癌栓(巨检/手术所见):无/有
大血管癌栓位置(根据临床信息):大胆管癌栓(巨检/手术所见):无/有
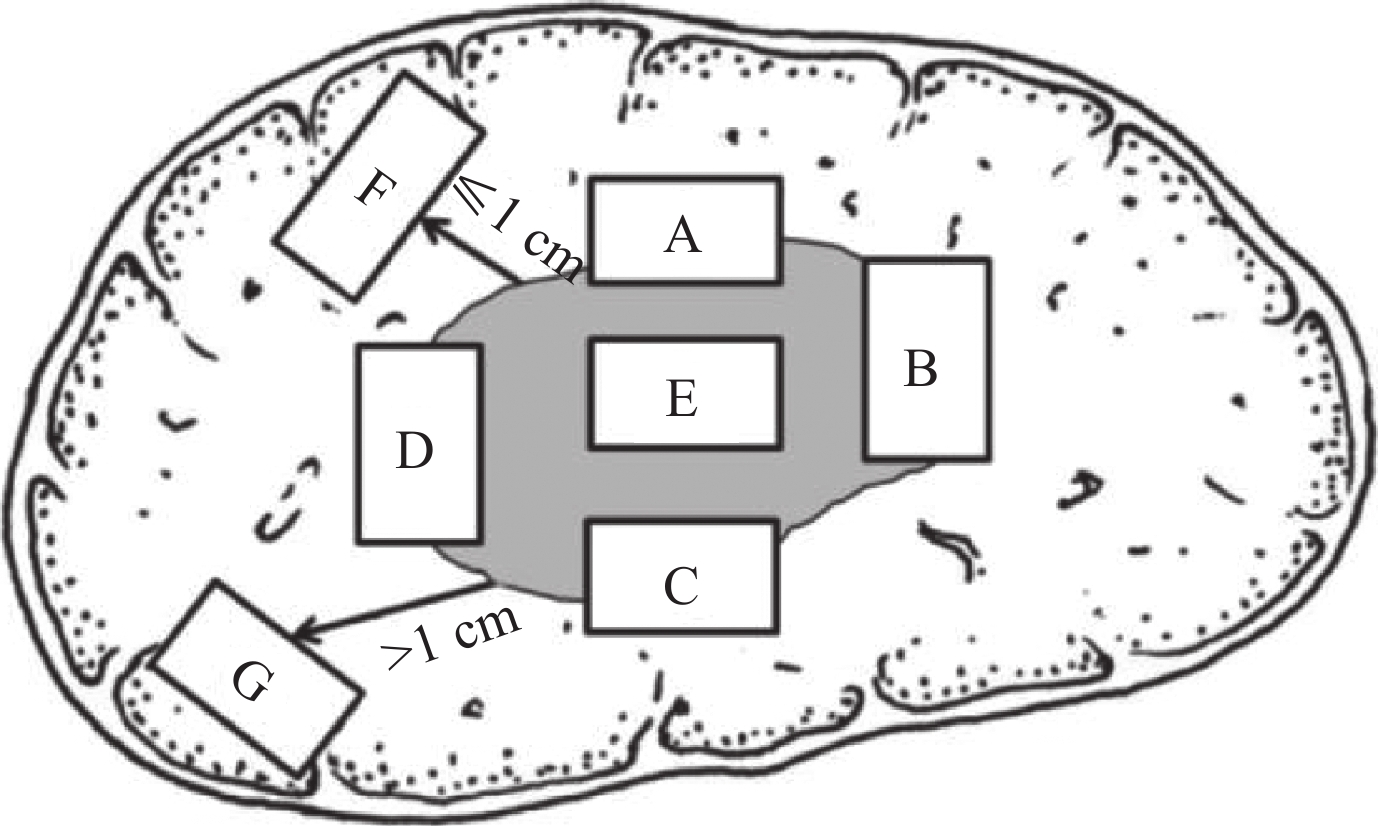
小胆管癌栓(显微镜下所见):无/有MVI病理分级:
M0:未发现MVI;
M1(低危组):≤5个MVI,均发生于近癌旁肝组织(≤1 cm);
M2a(高危组):>5个MVI,均发生于近癌旁肝组织(≤1 cm);
M2b(高危组):MVI发生于远癌旁肝组织(>1 cm)。肝细胞异型增生结节:无/有,低级别/高级别
肝硬化:无/有,小结节/大结节/混合结节型胆管上皮内瘤变:无/有,低级别/高级别
胆管内乳头状肿瘤:无/有,低级别/高级别切缘:无癌,距肿瘤最近距离 cm 肝被膜:未侵犯/侵犯 癌周围肝组织:
肝细胞异型增生:无/肝细胞大、小细胞变
脂肪变程度:无、轻度、中度、重度
肝炎:无/有,肝炎程度G,纤维化分期S周围神经侵犯:无/有
淋巴结/远处转移:无/有,部位:胆囊侵犯:无/有 膈肌侵犯:无/有 转化治疗/新辅助治疗后切除肝癌标本的病理学评估:pCR、MPR百分比: 免疫检查点抑制剂治疗后癌旁肝组织免疫相关肝损伤:无/有,肝细胞损伤、小叶内肝炎、胆管炎 注:MVI为微血管侵犯;pCR为病理学完全缓解;MPR为明显病理学缓解。



 下载:
下载: