Short-term Outcomes and Long-term Survival Outcomes of Elderly Patients (Over 80 Years of Age) with Colorectal Cancer Who Received Laparoscopic Versus Open Surgery
-
摘要:目的
探讨80岁以上高龄结直肠癌患者行腹腔镜与开腹手术的近期疗效与远期预后。
方法纳入行根治性手术的80岁以上313例高龄结直肠癌患者, 其中开腹组143例、腹腔镜组170例。采用倾向得分匹配平衡两组患者基线资料。Kaplan-Meier绘制生存曲线, Log rank法进行预后比较。Cox比例风险模型分析各因素对总体生存率(OS)和无瘤生存率(DFS)的影响。
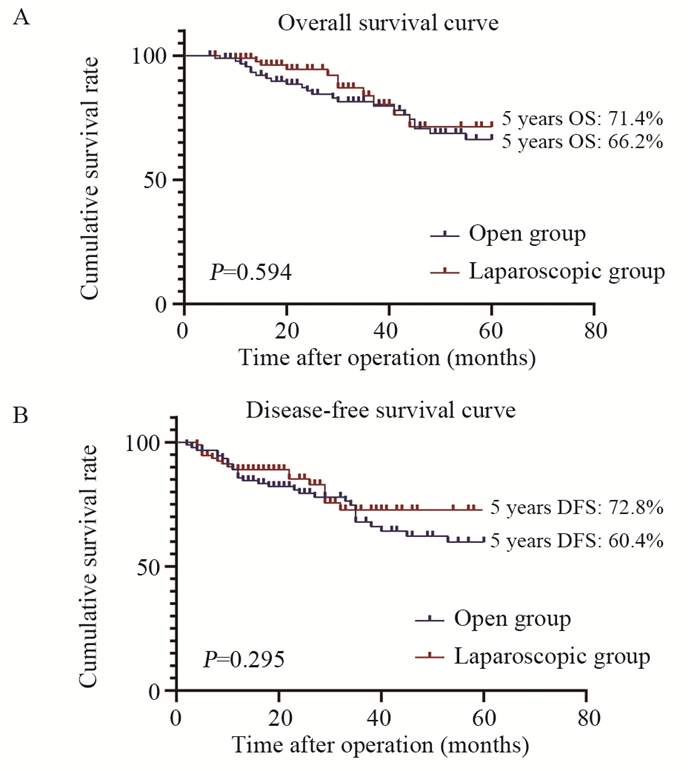
结果匹配后, 两组各纳入93例患者。腹腔镜组患者平均术中出血量、术后总体并发症与Ⅰ~Ⅱ级并发症发生率低于开腹组(均P < 0.05)、术后首次排气时间、经口进食时间与住院时间均明显短于开腹组患者(均P < 0.05)、平均淋巴结清扫数量显著多于开腹组(P=0.030)。两组患者有着相似的5年OS (P=0.594)与DFS (P=0.295)。多因素Cox预后分析结果发现CEA水平 > 5 ng/ml、病理TNM分期Ⅲ期与神经侵犯是影响患者不良OS与DFS的独立危险因素。
结论与开腹手术相比, 腹腔镜手术可以为80岁以上高龄结直肠癌患者提供更好的短期治疗效果与相似的远期预后。
Abstract:ObjectiveTo examine short-term outcomes and long-term survival of elderly patients (aged over 80 years) with colorectal cancer who received laparoscopic versus open surgery.
MethodsA total of 313 patients over 80 years old with colorectal cancer who underwent radical surgery were included.According to the surgical method, all patients were divided into open-surgery group (n=143) and laparoscopic surgery group (n=170).Baseline data were balanced between the two groups by using propensity score matching.Kaplan-Meier was used to draw the survival curve, and survival was compared by Log rank tests.Cox proportional risk model was used to analyze the effects of all factors on overall survival (OS) and disease-free survival (DFS).
ResultsAfter matching, 93 patients were included in each group.The mean intraoperative blood loss, the incidence of overall postoperative complications and gradeⅠ-Ⅱ complications in the laparoscopic surgery group were significantly lower than those in the open surgery group (all P < 0.05).The time to first flatus, the time to oral feeding, and postoperative hospital stays in the laparoscopic surgery group were significantly shorter than those in the open surgery group (all P < 0.05).The mean number of lymph-node dissection was also significantly higher in the laparoscopic surgery group than in the open surgery group (P=0.030).Patients in both groups had similar 5-year OS (P=0.594) and DFS (P=0.295).Multivariate Cox prognostic analysis showed that CEA level > 5 ng/ml, pathological TNM stage Ⅲ, and perineural invasion were independent risk factors for poor OS and DFS.
ConclusionCompared with open surgery, laparoscopic surgery can provide better short-term advantages and similar long-term outcomes for colorectal cancer patients over 80 years of age.
-
Key words:
- Colorectal cancer /
- Open surgery /
- Laparoscopic surgery /
- Short-term outcomes /
- Prognosis /
- Elderly patients
-
0 引言
口腔癌是口腔恶性肿瘤的总称,包括牙龈、舌、软硬腭、颌骨、口底、咽部、涎腺等位置的癌变,以鳞状上皮细胞癌为主。近年我国口腔癌发病率与死亡率呈上升趋势,吸烟、酒精、嚼槟榔以及HPV感染都是口腔癌发生的风险因素[1]。
现代医学在手术技术、放疗和化疗方面均已取得巨大进步,但口腔癌患者的5年生存率近30年来提升缓慢,人种、年龄、性别、生活习惯等多种因素均影响着口腔癌患者的生存时间[2-3]。口腔癌从本质上来说是一种多基因异常改变导致的复杂疾病,从基因的角度探索口腔癌诊疗的新途径具有重要意义。非编码RNA(ncRNAs)是一类低编码蛋白潜能的转录本序列,占人类转录本总数的95%以上,包括小分子RNA(miRNAs)、长链非编码RNA(lncRNAs)、环状RNA(circRNAs)等,是基因表达调控及转录后调控的重要分子。癌症研究领域中非编码RNA越来越受到研究者的关注,探索口腔癌中非编码RNA的功能及其作为口腔癌诊断标志物或治疗靶点的可能性具有重要的意义。
1 miRNA与口腔癌
miRNA是一类长度为20~25个核苷酸的短片段RNA,成熟的miRNA由初级转录物pri-miRNA、前体pre-miRNA逐级加工产生,诱导沉默复合体(RISC)与靶基因位点结合,从而实现翻译抑制及RNA降解,完成基因的转录后调控。人类60%的基因受到miRNAs的调控,涉及细胞增殖、细胞凋亡、组织分化、免疫调控等生理过程。小分子RNA功能的多样性及表达的特异性使其在肿瘤研究领域备受关注,是肿瘤诊断与靶向治疗研究的焦点。
1.1 miRNA对口腔癌生物学功能的影响
miRNA与口腔癌的生物学进程密切相关,Xu等[4]报道口腔癌中miR-340的减少导致葡萄糖转运体-1(Glut1)的异常增加,提升口腔癌细胞葡萄糖摄取率,导致肿瘤细胞生长加快;Zheng等报道[5]口腔癌细胞中miR-92a表达明显增加,使用miR-92a抑制剂后恢复了靶基因KLF4的表达及对Wnt/β-catenin信号通路的负调控,从而减弱了肿瘤细胞的增殖和抗凋亡能力;Wang等报道[6]口腔癌细胞的miR-210-3p经外泌体途径进入内皮细胞后,靶向减少内皮细胞ephrinA3的表达,激活PI3K/AKT信号通路及增强血管形成能力;Liu等[7]发现肿瘤抑制因子miR-150在口腔癌中同样表达降低,伴随靶基因HMGA2的表达升高,口腔癌细胞增殖及转移能力增强。
1.2 miRNA与口腔癌预后
多种miRNA的表达改变与口腔癌患者病情发展密切相关,miRNA具有组织时序表达特异性、结构稳定和体液循环的特点,具有成为理想口腔肿瘤标志物的潜质,是开发口腔癌诊断标志物的重要途径之一。
Lopes等分析发现miR-21可区分口腔癌组织与正常组织(AUC = 0.968; 95%CI: 0.920~1.00)[8],Dioguardi等分析了体液循环系统中miR-21表达的相关研究,认为miR-21是极具开发潜力的口腔癌肿瘤标志物[9];Clague等对比136例口腔癌前病变患者(黏膜白斑病/黏膜红斑病)与136例健康对照者之间血液样本中21个miRNAs基因的SNP位点差异,发现pri-miR-26a-1rs7372209 C > T位点突变(OR=2.09; 95%CI: 1.23~3.56)的患者口腔癌癌前病变的风险增加[10];Langevin等指出miR-137启动子区域的甲基化与口腔癌及部分头颈部肿瘤的发生密切相关(OR=4.80, 95%CI: 1.23~18.82),在口腔癌早期组织中有较好的特异性[11];Manikandan等指出口腔癌组织中miR-1275的表达与口腔癌的局部淋巴转移呈负相关,miR-223的表达则与肿瘤的分期呈负相关[12];MacLellan等分析口腔癌患者血清样本后指出miR-16、let-7b、miR-338-3p、miR-223和miR-29a可组成口腔癌诊断的联合指标[13]。此外口腔癌患者血清中miR-9与口腔癌预后呈正相关[14],miR-150-5p、miR-222-3p和miR-423-5p作为联合诊断指标可有效区分早期口腔癌和癌前病变(AUC=0.917, 95%CI=0.861~0.973)[15];在口腔癌患者的唾液中miR-15a和miR-16-1表达显著减少[16]。以上不同样本来源的miRNA指标都有作为口腔癌早期诊断标志物的应用潜力。
1.3 miRNA与口腔癌的药物研发
小核酸药物将是继化合药物、蛋白质药物之后的第三代药物。目前的小核酸类药物包括反义寡核苷酸(ASO)、小发夹RNA(shRNA)、小干扰RNA(siRNA)等,小核酸药物针对靶基因设计核酸序列大幅减少了药物研发的盲目性,开发流程快耗时短,并可实现个性化治疗方案[17]。
基于miRNA治疗癌症的基本策略主要有两种:一是使用miRNA抑制剂如antagomirs或miRNA竞争物阻止具有促癌作用的miRNA靶向目的基因,亦或使用基因编辑技术消除基因组上该miRNA的表达位点,前文中所提的致癌类miRNAs如miR-340、miR-92a、miR-210-3p等可用此策略;二是miRNA替代疗法,即在体外合成相应miRNA的模拟物,导入生物体后恢复相关功能,前文中所提的抑癌类miRNAs如miR-150等可用此策略。小核酸药物还可辅助增强放化疗或免疫治疗对口腔癌的效果,如沉默miR-218可抑制Wnt通路的激活增强口腔癌细胞的顺铂敏感度[18];miR-29a-3p的模拟物可抑制AMDM12表达增强口腔癌细胞的放疗敏感度[19]。免疫治疗方面,使用miR-197的模拟物可抑制PD-L1表达并减少细胞毒性淋巴细胞的抑制和肿瘤细胞的免疫逃逸[20]。
核酸类药物传递方式主要包括病毒类和非病毒类,其中病毒类包括慢病毒、腺病毒和腺相关病毒(AAV)介导的传递系统,高效但有一定的免疫原性和安全隐患;非病毒类包括脂质体、阳离子聚合物、细胞外囊泡和无机载体,安全性好但效率有待提升。鉴于外泌体核酸传递的高效性,Li等利用γδT细胞来源的细胞外囊泡(γδTDEs)传递miR-138进入口腔癌细胞[21],在传递抗肿瘤核酸药物的同时又刺激了对肿瘤细胞的免疫反应。核酸类药物传递方式的改进将一直伴随此类药物的发展。
鉴于肿瘤分子机制的复杂性,小核酸类药物靶向治疗肿瘤的应用难度将远远大于单基因罕见病治疗,目前大量研究都还处于临床Ⅰ期试验,小核酸类药物开发既是未来的趋势却又充满挑战。
2 长链非编码RNA与口腔癌
长链非编码RNA(lncRNA)是一类长度超过200 nt的RNA转录本,与蛋白或核酸物质结合后发挥其相应的功能,参与了染色质修饰、RNA转录及转录后调控、蛋白质合成等多个生理过程,几乎涉及生物体内全部的生理病理过程[22]。在口腔癌发生发展过程中lncRNA同样发挥关键作用,且大量未知有待研究。
2.1 lncRNA对口腔癌生物学功能的影响
lncRNA通过参与表观遗传调控及转录后修饰影响口腔癌细胞的增殖、迁移及侵袭等生物学进程。Jia等研究发现lncRNA FALEC可与转录抑制因子复合物PRC2的催化亚基EZH2结合,并协助其定位至细胞外基质蛋白ECM1基因的转录起始位点,增加H3K27me3甲基化修饰,使ECM1基因表达降低,从而降低口腔癌细胞的增殖和侵袭转移能力[23]。此外Huang等发现在口腔癌中lncRNA NKILA削弱核转录因子NF-κB的活性从而减少Twist等EMT相关蛋白的表达,抑制口腔癌的迁移和侵袭[24]。Ai等发现LINC00941诱导CAPRIN2基因启动子区域DNA片段发生环化,增强转录因子CTCF与该区域的结合从而加速口腔癌细胞的增殖[25]。此外lncRNA RC3H2通过内源竞争性RNA(ceRNA)机制与miRNA-101-3p结合,导致miRNA-101-3p靶点EZH2基因的表达增加和口腔癌的恶性进展[26]。lncRNA还存在如增强子RNA(eRNA)及短肽翻译等功能[27],但口腔癌中尚无相关报道,有待研究和补充。
2.2 LncRNA与口腔癌预后
LncRNA功能的多样性及表达的特异性使其同样具有作为肿瘤标志物的开发潜力,目前口腔癌相关lncRNA标志物的取材主要来自血液、唾液及口腔组织。Jia等使用基因芯片检测口腔癌患者及健康对照组血浆中lncRNA表达差异,发现ENST00000588803与NR_038323的组合可有效区分口腔癌癌前病变与健康对照(AUC: 0.954, 95%CI: 0.886~1),NR_131012与ENST00000588803的组合可有效区分口腔癌与癌前病变(AUC: 0.924, 95%CI: 0.837~1),此外NR_131012、ENST00000588803、NR_038323三者组合可有效区分早期口腔癌和晚期口腔癌(AUC: 0.926, 95%CI: 0.864~0.987)[28]。Zhang等发现口腔癌Ⅰ期和Ⅱ期患者血浆中lncRNACACS15表达显著高于癌前病变和正常对照组(AUC: 0.88, 95%CI: 0.85~0.95)[29]。Shao等检测口腔癌患者组织和血清样本均发现lncAC007271.3明显高于对照组(AUC: 0.873, 95%CI: 0.815~0.931),具有较好的特异性和敏感度[30]。唾液样本中,Tang等发现HOTAIR在发生转移的口腔癌患者唾液中高表达[31]。Yang等报道口腔癌组织中CASC9的表达量与患者的平均总生存期负相关,认为CASC9能作为口腔癌预后的独立预测因子[32]。
2.3 LncRNA与口腔癌的药物研发
LncRNA数量庞大,涉及生物体内多种功能。随着对lncRNA研究的逐渐深入,有望成为基因治疗药物开发的最大靶点库。基因治疗旨在将外源性的核酸序列引入肿瘤细胞,修正肿瘤细胞中的异常基因,从根本上治疗肿瘤。基因治疗策略主要有四种:基因修正、基因置换、基因失活和基因修饰,CRISPR/CaS系统可便捷地进行基因编辑,表达CaS蛋白和gRNA的核酸药物通过病毒类或非病毒类传递方式进入生物体从而实现基因治疗[33]。
目前lncRNA相关的基因治疗尝试在抑制肿瘤恶性发展和辅助传统治疗方面都取得了一定的研究数据。靶向LINC00460的siRNA有效抑制了LINC00460表达和口腔癌细胞的远端转移能力[34];Wang等使用慢病毒载体表达靶向lnc-p23154的shRNA,显著降低了口腔癌细胞体内外的侵袭与转移能力[35];Liu等在口腔癌细胞小鼠移植瘤部位注射靶向FOXD2-AS1的ASO反义核苷酸药物后显著抑制了肿瘤的生长[36];Chang等利用CRISPR/Cas9靶向消除miR-31宿主基因MIR31HG(miR-31 host gene)序列中miR-31的表达位点,miR-31表达缺失的口腔癌细胞恶性程度显著降低[37]。此外,沉默HOXA11-AS能提高口腔癌耐药细胞的化疗敏感度[38];沉默lncRNA BLACAT1可降低口腔癌细胞的放疗耐受[39]。在免疫治疗方面,增强lncMX1-215[40]和lncRNA CRNDE[41]表达均显著抑制口腔癌细胞的增殖和免疫逃逸。
目前lncRNA靶点的基因治疗临床转化同样面临着如药物精准递送、免疫反应等问题,为实现lncRNA精准治疗Jin等建立了lncRNA功能元件筛选体系,在动物模型中成功实现了骨质疏松的精准靶向基因治疗[42],期待口腔癌lncRNA靶点精准基因治疗的成果早日出现。
3 环状RNA与口腔癌
环状RNA(circRNA)是一类具有闭合环状结构的非编码RNA,广泛存在于真核生物体内,结构稳定且不受RNA外切酶的影响,表达具有组织、细胞和发育阶段的特异性[43]。近年来肿瘤相关circRNA研究非常火热,是肿瘤基因研究和标志物开发的新焦点。
3.1 CircRNA对口腔癌细胞生物学功能的影响
CircRNA机制和功能研究最多的是通过竞争性内源性RNA机制(ceRNA)与miRNA结合,改变miRNA对靶基因表达的影响。He等发现circPVT1竞争性结合miR-125b后导致靶基因STAT3表达增加,从而增强口腔癌细胞的增殖能力[44];circRNA_0000140结合miR-31后抑制Hippo信号通路,削弱口腔癌的增殖和侵袭转移能力[45]。此外circRNA可与蛋白质结合并影响蛋白质功能,如circGSK3β与GSK3β结合后抑制GSK3β对β-catenin蛋白的磷酸化调控,导致口腔癌细胞侵袭转移能力增强[46]。CircRNA中人工引入核糖体进入位点和GFP编码序列后成功表达GFP蛋白质[47],随后发现在生物体内天然存在这一现象,并有RNA N6-甲基腺苷(m6A)修饰介导circRNA的蛋白翻译功能[48]。
3.2 CircRNA对口腔癌预后的影响
CircRNA不仅具备miRNA和lncRNA作为口腔癌诊断和预后标志物的优点,其分子结构更稳定、半衰期更长,经人工修饰后还可实现特定的分子功能,将具有广阔的开发应用前景。
CircRNA的表达与口腔癌病理进程密切相关,hsa_circ_0008309[49]、hsa_circ_000334[50]、hsa_circ_006740[50]在口腔癌组织中表达显著高于正常对照;hsa_circ_009755在口腔癌T1-T2期患者肿瘤组织中表达显著高于T3-T4期肿瘤组织(AUC: 0.782, 95%CI: 0.667~0.854)[51];hsa_circ_0109291[52]和circPVT1[53]与口腔癌患者的预后呈负相关,可作为口腔癌的预后生物标志物。Zhao等发现hsa_circ_0001874和hsa_circ_0001971在口腔癌患者唾液中表达显著增加,而术后的口腔癌患者唾液中两者表达显著降低,hsa_circ_0001874与hsa_circ_0001971的组合可用于口腔癌的早期诊断(AUC: 0.922, 95%CI: 0.883~0.961)[54]。
3.3 CircRNA与口腔癌的药物研发
与其他致癌类基因的处理策略类似,致癌的circRNA依旧可采用小核酸类药物或CRISPR/CaS系统抑制其表达,但在设计circRNA敲降靶点时要避免选择与其线性转录本序列相同的区段,敲降靶点应该落在circRNA的头尾连接处。在口腔癌细胞中,敲低circ_0001971在抑制口腔癌细胞增殖、迁移和侵袭能力的同时增加了口腔癌细胞对顺铂的敏感度[55];敲低circKRT1后口腔癌细胞的增殖和免疫逃逸能力减弱[56]。对于抑癌类circRNA可体外合成circRNA或将表达质粒通过特定的传递方式导入生物体内,如增加口腔癌细胞中circFLNA的表达可显著抑制肿瘤细胞增殖[57];过表达circATRNL1则有效增加口腔癌细胞的放疗敏感度[58]。
目前circRNA影响肿瘤恶性进展的研究大多集中在ceRNA方向,但是circRNA最大的优势还是在于其结构的稳定性和低的免疫原性,基于circRNA靶向抑制蛋白质的功能可设计特异性强、不良反应小的蛋白抑制剂;基于经RNA甲基化修饰后的circRNA可稳定表达蛋白序列的功能,可在生物体内持续表达目的蛋白,用于制造circRNA疫苗及开展基因治疗。这些circRNA新的功能将极大拓展circRNA类核酸药物的应用前景。
4 总结与展望
非编码RNA在口腔癌的发生发展中起着重要的作用,参与了口腔癌大量生物过程。miRNA、lncRNA和circRNA对口腔癌生物学特性的影响、预后及治疗的相关研究内容见表 1。虽然有大量可用于肿瘤分子诊断和基因治疗的基因,但是绝大部分治疗肿瘤的核酸类药物仅处于临床Ⅰ期或Ⅱ期的实验阶段,大多数为miRNA模拟物和miRNA抑制物,基于lncRNA和circRNA的核酸类药物极少。肿瘤相关非编码RNA从基础研究到临床转化还有一段较长的路走,但前景依旧广阔。伴随着测序技术的进步,生物信息会发生爆炸式的增长,病例资料结合基因信息筛选肿瘤相关基因也必将成为研究者关注的重点。近年逐渐成熟的加权基因共表达网络分析可对基因关联模式进行分析,帮助研究者厘清基因表达、生物过程以及疾病之间的关系。随着对口腔癌研究的深入,希望通过基因表达模块与特定性状、表型之间的关联分析发现microRNA、lncRNA、circRNA和mRNA可能存在的规律,为口腔癌的诊断和治疗提供参考,总结出核酸与蛋白质结合的规律和功能位点,从而高效地开发出具有应用前景的口腔癌诊断标志物和治疗靶点。
表 1 口腔癌中非编码RNA概况Table 1 Summary of non-coding RNAs in oral carcinoma Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:毛争强、杜波涛:方案实施、数据收集及论文撰写孙航、周力:数据收集与统计学分析郭得兴:论文指导与修改李新宇、宰守峰:方案设计、论文审校与修改
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:毛争强、杜波涛:方案实施、数据收集及论文撰写孙航、周力:数据收集与统计学分析郭得兴:论文指导与修改李新宇、宰守峰:方案设计、论文审校与修改 -
表 1 匹配前、后开腹组与腹腔镜组老年患者临床病理特征(n(%))
Table 1 Clinicopathological features of elderly patients in the open surgery and laparoscopic surgery groups before and after matching (n(%))

表 2 匹配后开腹组与腹腔镜组老年患者围手术期结局
Table 2 Perioperative outcomes of elderly patients in the open surgery and laparoscopic surgery groups after matching

表 3 匹配后开腹组与腹腔镜组老年患者病理结果(n(%))
Table 3 Pathologic outcomes of elderly patients in the open surgery and laparoscopic surgery groups after matching (n(%))

表 4 匹配后老年患者总体生存率与无瘤生存率的单因素与多因素Cox回归分析
Table 4 Univariate and multivariate Cox regression analyses of overall survival and disease-free survival in elderly patients after matching

-
[1] Rawla P, Sunkara T, Barsouk A. Epidemiology of colorectal cancer: incidence, mortality, survival, and risk factors[J]. Prz Gastroenterol, 2019, 14(2): 89-103.
[2] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. doi: 10.3322/caac.21492
[3] Athanasiou CD, Robinson J, Yiasemidou M, et al. Laparoscopic vs Open approach for transverse colon cancer. A systematic review and meta-analysis of short and long term outcomes[J]. Int J Surg, 2017, 41: 78-85. doi: 10.1016/j.ijsu.2017.03.050
[4] Parker JM, Feldmann TF, Cologne KG. Advances in Laparoscopic Colorectal Surgery[J]. Surg Clin North Am, 2017, 97(3): 547-560. doi: 10.1016/j.suc.2017.01.005
[5] Durak D, Alkurt EG, Turhan VB, et al. Comparison of Short-Term Results of Laparoscopic and Open Surgeries for Colorectal Cancer: A Single-Center Experience[J]. Cureus, 2022, 14(5): e24635.
[6] Hinoi T, Kawaguchi Y, Hattori M, et al. Laparoscopic versus open surgery for colorectal cancer in elderly patients: a multicenter matched case-control study[J]. Ann Surg Oncol, 2015, 22(6): 2040-2050. doi: 10.1245/s10434-014-4172-x
[7] Zhou S, Wang X, Zhao C, et al. Laparoscopic vs. open colorectal cancer surgery in elderly patients: short- and long-term outcomes and predictors for overall and disease-free survival[J]. BMC Surg, 2019, 19(1): 137. doi: 10.1186/s12893-019-0596-3
[8] Fujii S, Ishibe A, Ota M, et al. Long-term results of a randomized study comparing open surgery and laparoscopic surgery in elderly colorectal cancer patients (Eld Lap study)[J]. Surg Endosc, 2021, 35(10): 5686-5697. doi: 10.1007/s00464-020-08026-0
[9] Numata M, Sawazaki S, Morita J, et al. Comparison of Laparoscopic and Open Surgery for Colorectal Cancer in Patients with Severe Comorbidities[J]. Anticancer Res, 2018, 38(2): 963-967.
[10] Luo W, Wu M, Chen Y. Laparoscopic versus open surgery for elderly patients with colorectal cancer: a systematic review and meta-analysis of matched studies[J]. ANZ J Surg, 2022, 92(9): 2003-2017. doi: 10.1111/ans.17972
[11] Chen B, Yu W, Ma Y, et al. Evaluation of the safety and efficacy of perform enterectomy in colorectal cancer patients aged 80 or older. A meta-analysis and a systematic review[J]. Int J Colorectal Dis, 2023, 38(1): 185. doi: 10.1007/s00384-023-04461-2
[12] Son IT, Kim JY, Kim MJ, et al. Clinical and oncologic outcomes of laparoscopic versus open surgery in elderly patients with colorectal cancer: a retrospective multicenter study[J]. Int J Clin Oncol, 2021, 26(12): 2237-2245. doi: 10.1007/s10147-021-02009-4
[13] Ogata T, Yoshida N, Sadakari Y, et al. Colorectal cancer surgery in elderly patients 80 years and older: a comparison with younger age groups[J]. J Gastrointest Oncol, 2022, 13(1): 137-148. doi: 10.21037/jgo-21-627
[14] Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five-year experience[J]. Ann Surg, 2009, 250(2): 187-196. doi: 10.1097/SLA.0b013e3181b13ca2
[15] Zhang X, Wu Q, Gu C, et al. Comparison of short and long-time outcomes between laparoscopic and conventional open multivisceral resection for primary T4b colorectal cancer[J]. Asian J Surg, 2019, 42(1): 401-408. doi: 10.1016/j.asjsur.2018.06.010
[16] Feng B, Zheng MH, Mao ZH, et al. Clinical advantages of laparoscopic colorectal cancer surgery in the elderly[J]. Aging Clin Exp Res, 2006, 18(3): 191-195. doi: 10.1007/BF03324648
[17] She WH, Poon JT, Fan JK, et al. Outcome of laparoscopic colectomy for cancer in elderly patients[J]. Surg Endosc, 2013, 27(1): 308-312. doi: 10.1007/s00464-012-2466-2
[18] Vignali A, Di Palo S, Tamburini A, et al. Laparoscopic vs. open colectomies in octogenarians: a case-matched control study[J]. Dis Colon Rectum, 2005, 48(11): 2070-2075. doi: 10.1007/s10350-005-0147-0
[19] Moon SY, Kim S, Lee SY, et al. Laparoscopic surgery for patients with colorectal cancer produces better short-term outcomes with similar survival outcomes in elderly patients compared to open surgery[J]. Cancer Med, 2016, 5(6): 1047-1054. doi: 10.1002/cam4.671
[20] Hinoi T, Kawaguchi Y, Hattori M, et al. Laparoscopic versus open surgery for colorectal cancer in elderly patients: a multicenter matched case-control study[J]. Ann Surg Oncol, 2015, 22(6): 2040-2050. doi: 10.1245/s10434-014-4172-x
[21] Tsai HL, Cheng KI, Lu CY, et al. Prognostic significance of depth of invasion, vascular invasion and numbers of lymph node retrievals in combination for patients with stage Ⅱ colorectal cancer undergoing radical resection[J]. J Surg Oncol, 2008, 97(5): 383-387. doi: 10.1002/jso.20942
[22] Mehrkhani F, Nasiri S, Donboli K, et al. Prognostic factors in survival of colorectal cancer patients after surgery[J]. Colorectal Dis, 2009, 11(2): 157-161. doi: 10.1111/j.1463-1318.2008.01556.x
[23] Fujita S, Shimoda T, Yoshimura K, et al. Prospective evaluation of prognostic factors in patients with colorectal cancer undergoing curative resection[J]. J Surg Oncol, 2003, 84(3): 127-131. doi: 10.1002/jso.10308
[24] Huh JW, Oh BR, Kim HR, et al. Preoperative carcinoembryonic antigen level as an independent prognostic factor in potentially curative colon cancer[J]. J Surg Oncol, 2010, 101(5): 396-400. doi: 10.1002/jso.21495



 下载:
下载: