Effect of miR-524-5p on Epithelial-mesenchymal Transition in Esophageal Cancer Cells by Regulating HEG1 Expression
-
摘要:目的
探讨miR-524-5p调控HEG1表达对食管癌细胞增殖、上皮间质转化(EMT)的作用机制。
方法qRT-PCR检测食管癌细胞和正常食管上皮细胞中miR-524-5p和HEG1 mRNA表达水平。将KYSE30细胞分为miR-524-5p mimic组、miR-524-5p NC组、miR-524-5p mimic+pcDNA3.1组和miR-524-5p mimic+pcDNA3.1-HEG1组,另设置不转染的细胞为正常对照组(Control组)。CCK-8法检测KYSE30细胞增殖能力;Western blot检测EMT相关蛋白、侵袭迁移相关蛋白和HEG1蛋白表达,划痕实验和Transwell实验检测KYSE30细胞迁移和侵袭能力,双荧光素酶报告基因检测miR-524-5p和HEG1靶向关系。
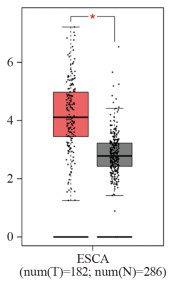
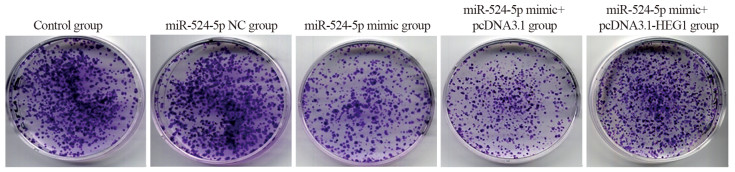
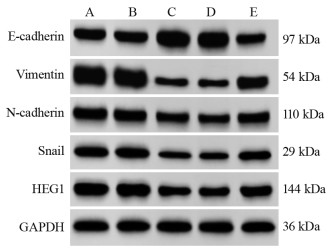
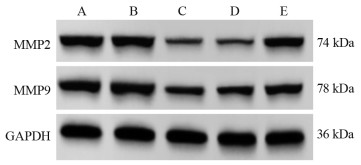
结果miR-524-5p在四种食管癌细胞系TE-1、KYSE30、KYSE150、NEC中均低表达(P < 0.05),选择表达水平最低的KYSE30细胞作为后续实验细胞。HEG1 mRNA在四种食管癌细胞中均高表达(P < 0.05),并且GEPIA数据库显示HEG1在食管癌组织中高表达(P < 0.05)。与miR-524-5p NC组相比,miR-524-5p mimic组KYSE30细胞增殖能力、克隆形成数、间质标志蛋白水平、迁移和侵袭能力显著降低,上皮标志蛋白E-cadherin水平显著上调(P < 0.05);miR-524-5p mimic+pcDNA3.1-HEG1组可以明显逆转过表达miR-524-5p对于KYSE30细胞增殖和上皮间质转化、侵袭转移的抑制作用(P < 0.05)。miR-524-5p mimic组与WT-HEG1共转染组细胞荧光素酶活性显著低于miR-524-5p NC组与WT-HEG1共转染组(P < 0.05)。
结论miR-524-5p在食管癌细胞和组织中低表达,过表达miR-524-5p可以负向调节HEG1在食管癌细胞系KYSE30细胞中的表达,抑制KYSE30细胞的增殖、EMT进程和侵袭迁移能力。
-
关键词:
- miR-524-5p /
- HEG1 /
- 食管癌 /
- 上皮间质转化 /
- 侵袭
Abstract:ObjectiveTo investigate the mechanism and the effect of miR-524-5p regulating HEG1 expression on the proliferation and epithelial-mesenchymal transition of esophageal cancer cells.
MethodsThe expression levels of miR-524-5p and HEG1 mRNA in esophageal cancer cells and normal esophageal epithelial cells were detected by qRT-PCR. KYSE30 cells were divided into miR-524-5p mimic group, miR-524-5p NC group, miR-524-5p mimic+pcDNA3.1 group, and miR-524-5p mimic+pcDNA3.1-HEG1 group. Non-transfected cells were set as the normal control group (group Control). CCK-8 method was applied to detect the proliferation ability of KYSE30 cells. Western blot analysis was conducted to detect the expression of proteins related to EMT, invasion, and migration and the HEG1 protein. Scratch and Transwell assays were applied to detect the migration and invasion abilities of KYSE30 cells. A dual-luciferase reporter gene was used to examine the targeting relationship between miR-524-5p and HEG1.
ResultsmiR-524-5p was lowly expressed in four esophageal cancer cell lines, namely, TE-1, KYSE30, KYSE150, and NEC (P < 0.05). KYSE30 cells with the lowest expression level were selected for subsequent experiments. HEG1 mRNA was highly expressed in four esophageal cancer cell lines (P < 0.05). The GEPIA database showed that HEG1 was highly expressed in esophageal cancer tumor tissues (P < 0.05). KYSE30 cells in the miR-524-5p mimic group had lower proliferation ability, colony formation number, mesenchymal marker protein expression, and migration and invasion abilities and upregulated epithelial marker protein E-cadherin level than cells in the miR-524-5p NC group (P < 0.05). The miR-524-5p mimic+pcDNA3.1-HEG1 group significantly reversed the inhibitory effect of overexpression of miR-524-5p on the proliferation, epithelial–mesenchymal transformation, invasion, and metastasis of KYSE30 cells (P < 0.05). The luciferase activity of cells in the miR-524-5p mimic and WT-HEG1 co-transfection groups was lower than that in the miR-524-5p NC and WT-HEG1 co-transfection groups (P < 0.05).
ConclusionmiR-524-5p is lowly expressed in EC cells and tissues. The overexpression of miR-524-5p can negatively regulate the expression of HEG1 in esophageal cancer cell line (KYSE30 cells) and reduce the proliferation, EMT process, and invasion and migration abilities of KYSE30 cells.
-
Key words:
- miR-524-5p /
- HEG1 protein /
- Esophageal cancer /
- Epithelial-mesenchymal transition /
- Invasion
-
0 引言
目前,全球癌症的发病和死亡人数仍在持续增长,2020年新发肿瘤1 929.3万例、死亡995.8万例,癌症在许多国家的死因顺位上已经超越心血管疾病等高死亡率慢性疾病[1]。沈阳市城区居民全死因中,恶性肿瘤也仅次于心脏病[2],严重危害沈阳人民健康。为了解沈阳市城区居民恶性肿瘤发病及生存情况,并提出防治措施,现对2011—2018年沈阳市城区居民恶性肿瘤发病及生存趋势进行分析。
1 资料与方法
1.1 资料来源
2011—2018年沈阳市城区恶性肿瘤发病和生存资料来源于中国肿瘤登记中心肿瘤随访与登记报告系统。报告范围为具有沈阳市城市国家级监测点(和平区、沈河区、大东区、皇姑区和铁西区)户籍居民发病的全部恶性肿瘤(ICD10编码C00-C97)。人口资料来源于沈阳市公安局提供的每年份性别、年龄别的平均人口数。
1.2 质量评价
根据《中国肿瘤登记工作指导手册》[3]和国际癌症研究中心(IARC)/国际癌症登记协会(IACR)[4-5]对登记质量的有关要求,对数据的可靠性、完整性、有效性进行评估。沈阳市城区肿瘤发病数据从2008年起连续五年被国际五大洲癌症协会收录,连续十年被中国肿瘤登记年报收录。沈阳市城区2011—2018年上报新发肿瘤数据质量评价为病理诊断率(MV%)为66.63%、只有死亡医学证明书比例(DCO%)为2.43%、死亡发病比(M/I)为0.65,均符合质量要求。
1.3 统计学方法
提取2011—2018年沈阳城区恶性肿瘤发病数据,以国际疾病分类法ICD-10进行分类,并用IARCcrgTools软件进行数据审核。利用Excel2007计算粗发病率、标化率(中标率、世标率)、年龄别发病率、累积发病率(0~74岁)、截缩发病率(35~64岁)、前十位肿瘤发病顺位和生存率等指标;利用SPSS23.0统计软件对恶性肿瘤男女发病率及生存率进行χ2检验,检验水准α=0.05;采用寿命表法计算观察生存率,病例随访时间截止至2020-12-31;采用EdererⅡ方法(Ederer and Heise, 1959)计算期望生存率(expected survival rate, ESR)和相对生存率(relative survival rate, RSR);利用美国癌症中心研究所开发的Joinpoint 3.5.3软件计算发病率和生存率年度变化百分比(APC%),检验水准α=0.05。中标率采用2000年全国人口普查,世标率采用Segi's世界标准人口结构进行计算。
2 结果
2.1 总体发病分布
2011—2018年沈阳市上报新发恶性肿瘤109 873例,发病率为364.70/10万,中标率190.00/10万,世标率185.63/10万,0~74岁累积率为21.17%,35~64岁截缩率为311.66/10万。2011—2014年男、女、合计恶性肿瘤发病率及标化率均呈大幅上升趋势(P < 0.01);2015—2018年男、女、合计恶性肿瘤发病率缓慢上升但标化率缓慢下降(P≥0.05),见表 1。
表 1 2011—2018年沈阳市城区居民恶性肿瘤发病率(1/105)Table 1 Malignant tumor incidence of urban residents in Shenyang from 2011 to 2018 (1/105)
2.2 性别分布
2011—2018年沈阳市城区恶性肿瘤男性发病率为380.62/10万,女性发病率为349.42/10万,男、女发病率之比为1.09:1,8年间男性恶性肿瘤发病率高于女性,差异有统计学意义(χ2=201.63, P < 0.05),见表 1。
2.3 年龄分布
多数肿瘤在0~30岁组开始发病,30~40岁组缓慢上升,在40岁以后开始大幅度上升,在80~岁组达到发病高峰,85+岁组发病率略有下降,这可能与85+岁组人口急剧减少有关。男女以50~55岁组为界,发病率呈现X形状,见图 1。
2.4 发病顺位
2011—2018年沈阳市城区男性恶性肿瘤发病前10位的依次是肺癌、结直肠癌、肝癌、胃癌、膀胱癌、食管癌、胰腺癌、前列腺癌、肾癌、甲状腺癌;其中前5位肺癌(28.77%)、结直肠癌(16.40%)、肝癌(9.18%)、胃癌(9.15%)、膀胱癌(4.36%)占男性恶性肿瘤的67.86%。8年间肺癌、结直肠癌、膀胱癌、胰腺癌、前列腺癌、肾癌、甲状腺癌发病率均呈上升趋势(P < 0.05);而肝癌(P=0.00, P=0.05)、胃癌(P=0.02, P=0.07)、食管癌(P=0.08, P=0.24)发病率则先上升后下降,见表 2。
表 2 2011—2018年沈阳市城区男性恶性肿瘤发病顺位(1/105)Table 2 Incidence rank of malignant tumors in male residents in urban areas of Shenyang from 2011 to 2018 (1/105)
女性恶性肿瘤发病率前10位的依次是乳腺癌、肺癌、结直肠癌、宫颈癌、甲状腺癌、胃癌、肝癌、卵巢癌、胰腺癌、子宫体癌;其中前5位乳腺癌(22.63%)、肺癌(18.72%)、结直肠癌(12.84%)、宫颈癌(5.73%)、甲状腺癌(5.71%)占女性恶性肿瘤65.63%;8年间除宫颈癌、胃癌、肝癌、卵巢癌、子宫体癌外,乳腺癌、肺癌、结直肠癌、甲状腺癌、胰腺癌发病率均呈上升趋势(P < 0.05),见表 3。
表 3 2011—2018年沈阳市城区女性恶性肿瘤发病顺位(1/105)Table 3 Incidence rank of malignant tumors in female residents in urban areas of Shenyang from 2011 to 2018 (1/105)
2.5 恶性肿瘤5年生存率
2011—2015年沈阳市城区居民恶性肿瘤5年生存率为40.49%,相对生存率为47.84%。5年间合计观察生存率呈上升趋势,差异有统计学意义(P=0.04),其中男性为31.82%,女性为49.58%,男女观察生存率均呈上升趋势(P=0.04, P=0.03),且女性5年生存率高于男性(χ2=187.62, P < 0.05),见表 4。
表 4 2011—2015年沈阳市城区居民恶性肿瘤5年生存率(%)Table 4 Five-year survival rate of malignant tumors in urban residents in Shenyang from 2011 to 2015 (%)
2.6 发病前十位恶性肿瘤5年生存率顺位
2011—2015年沈阳市城区男性发病前十位的恶性肿瘤5年生存率顺位依次是甲状腺癌(86.25%)、肾癌(64.19%)、膀胱癌(59.43%)、结直肠癌(48.41%)、前列腺癌(47.55%)、胃癌(31.63%)、食管癌(20.56%)、肝癌(17.20%)、肺癌(16.79%)、胰腺癌(8.67%),见表 5。女性依次是甲状腺癌(91.81%)、乳腺癌(76.50%)、子宫体癌(73.17%)、子宫颈癌(65.18%)、结直肠癌(49.04%)、卵巢癌(43.34%)、胃癌(32.47%)、肺癌(21.20%)、肝癌(14.41%)、胰腺癌(10.01%),见表 6。
表 5 2011—2015年沈阳市城区男性发病前十位恶性肿瘤5年生存率(%)Table 5 Five-year survival rate of top ten malignant tumors among males in urban areas of Shenyang from 2011 to 2015 (%) 表 6 2011—2015年沈阳市城区女性发病前十位恶性肿瘤5年生存率(%)Table 6 Five-year survival rate of top ten malignant tumors among females in urban areas of Shenyang from 2011 to 2015 (%)
表 6 2011—2015年沈阳市城区女性发病前十位恶性肿瘤5年生存率(%)Table 6 Five-year survival rate of top ten malignant tumors among females in urban areas of Shenyang from 2011 to 2015 (%)
男女5年生存率最高均为甲状腺癌,最低均为胰腺癌。相同癌种中,肺癌、甲状腺癌5年生存率女性高于男性(χ2=48.29, χ2=9.85, P < 0.01),差异有统计学意义;肝癌男性高于女性(χ2=5.32, P < 0.05),差异有统计学意义;结直肠癌(χ2=0.37, P≥0.05)、胃癌(χ2=0.33, P≥0.05)、胰腺癌(χ2=0.99, P≥0.05)男女5年生存率差异无统计学意义。
2.7 发病前十位恶性肿瘤5年生存率变化趋势
2011—2015年沈阳市男性发病前十位的恶性肿瘤除结直肠癌、前列腺癌、肝癌外,其余七位中,甲状腺癌(APC%=12.97, P=0.03)、肾癌(APC%=7.86, P=0.01)、膀胱癌(APC%=10.04, P=0.00)、胃癌(APC%=6.57, P=0.05)、食管癌(APC%=6.05, P=0.03)、肺癌(APC%=11.81, P=0.04)、胰腺癌(APC%=25.57, P=0.02)5年生存率均呈上升趋势,见表 5。
女性发病前十位的恶性肿瘤除子宫体癌、结直肠癌、胃癌、肺癌外,其余六位的甲状腺癌(APC%=7.93, P=0.01)、乳腺癌(APC%=3.87, P=0.05)、宫颈癌(APC%=4.96, P=0.00)、卵巢癌(APC%=10.75, P=0.03)、肝癌(APC%=20.09, P=0.01)、胰腺癌(APC%=49.75, P=0.01)5年生存率均呈上升趋势,见表 6。
3 讨论
从发病情况看,沈阳市2011—2018年城区居民恶性肿瘤发病率持续上升(P=0.00, P=0.67),发病中标率(190.00/10万)低于2015年中国城市恶性肿瘤发病中标率(193.93/10万)[6]和中国东部恶性肿瘤发病中标率(194.36/10万)[7],高于中部恶性肿瘤发病中标率(183.36/10万)[8],低于2006—2015年辽宁省五城市恶性肿瘤标化发病率(199.15/10万)[9],高于2016年安徽(179.70/10万)[10]和江苏(182.61/10万)[11]、2017年黑龙江(174.27/10万)[12],目前发病率处于全国中等水平。
2011—2018年沈阳市恶性肿瘤发病率男性高于女性(χ2=201.63, P < 0.05),与中国分布相一致[13],且随着年龄的增长呈明显上升趋势,而沈阳市老龄人口亦呈逐年上升趋势,这既反映了人口老龄化进程的加快,也反映了癌症相关危险因素暴露时间的增加[14]是沈阳市癌症高发的重要原因。因此要针对病因和危险因素,致力于通过精准、适度和有效的干预,降低癌症发生风险。
2011—2018年男女恶性肿瘤发病顺位前三位与国家《2018肿瘤登记年报》发布中国城市数据[8]一致。8年间,男性发病前十位除肝癌、胃癌、食管癌发病率先上升后下降,其他癌种均呈上升趋势;女性除了妇科肿瘤和肝癌、胃癌外,其他发病前十的恶性肿瘤发病率均呈上升趋势。研究表明与感染或贫困相关的癌症正逐渐被经济发达国家的常见癌症所取代[15]。而沈阳市由于经济的发展和生活水平的提高,不良生活方式的加剧,不仅原有主要高发癌症尚未有明显下降趋势,西方国家高发的大肠癌、前列腺癌和女性乳腺癌等癌症发病又迅速增加。
从生存情况看,2011—2015年沈阳市城区恶性肿瘤5年观察生存率为40.49%、相对生存率为47.84%,接近于2018年全国公布的全部癌症的5年生存率(40.5%)[16],2019年辽宁省公布的城市癌症5年标化生存率(41.5%)[17],2012—2016年上海市青浦区5年相对生存率为47.41%[18],高于姑苏区2008—2013年癌症患者的5年相对生存率(42.2%)[19]。女性的生存率总体高于男性(χ2=187.62, P < 0.05)。
随着医疗技术水平的提升,沈阳市癌症5年生存率也大幅上升,但仍有部分癌种5年生存率无上升趋势,这与癌症种类构成不同和筛查手段落后造成生存率差异有重要关系。2011—2015年沈阳市城区恶性肿瘤5年生存率最高的癌种为甲状腺癌,其次是女性的乳腺癌(76.50%)、子宫体癌(73.17%)、宫颈癌(65.18%);男女生存率排在后三位是肝癌(17.20%、14.41%)、肺癌(16.79%、21.20%)、胰腺癌(8.67%、10.01%);生存率最低的均为胰腺癌。而这些生存率较高的癌症可以通过早期筛查项目,寻找出高危人群或早期患者,进行早发现、早诊断和早治疗的“二级预防”,是有效提升癌症生存的关键手段;对于生存率较低的癌症我们要依托于生物医学各学科不断发展的各种新技术、新手段,不断探索癌症相关标志物,优化筛查策略,早期发现、规范治疗,以提升患者生存率。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:王娅菲:实验操作、数据整理及文章撰写耿天祥、陈林林:实验操作、数据整理及分析李治国:数据分析李世朋:实验设计及文稿审校 -
表 1 PCR引物序列
Table 1 PCR primer sequences

表 2 miR-524-5p和HEG1在几种食管细胞系中的相对表达量
Table 2 Relative expression of miR-524-5p and HEG1 in several esophageal cell lines

表 3 miR-524-5p对KYSE30细胞增殖能力的影响
Table 3 Effect of miR-524-5p on the proliferative capacity of KYSE30 cells

表 4 不同转染组中EMT相关蛋白和HEG1蛋白表达量
Table 4 EMT-related protein and HEG1 protein expression in different transfection groups

表 5 各组KYSE30细胞中侵袭迁移相关蛋白表达量比较
Table 5 Comparison of expression levels of invasion- and migration-related proteins in KYSE30 cells among all groups

表 6 miR-524-5p靶基因验证
Table 6 Validation of miR-524-5p target gene

-
[1] Watanabe M, Otake R, Kozuki R, et al. Recent progress in multidisciplinary treatment for patients with esophageal cancer[J]. Surg Today, 2020, 50(1): 12-20. doi: 10.1007/s00595-019-01878-7
[2] Uhlenhopp DJ, Then EO, Sunkara T, et al. Epidemiology of esophageal cancer: update in global trends, etiology and risk factors[J]. Clin J Gastroenterol, 2020, 13(6): 1010-1021. doi: 10.1007/s12328-020-01237-x
[3] Yang YM, Hong P, Xu WW, et al. Advances in targeted therapy for esophageal cancer[J]. Signal Transduct Target Ther, 2020, 5(1): 229. doi: 10.1038/s41392-020-00323-3
[4] Zhao Y, Xu L, Wang X, et al. A novel prognostic mRNA/miRNA signature for esophageal cancer and its immune landscape in cancer progression[J]. Mol Oncol, 2021, 15(4): 1088-1109. doi: 10.1002/1878-0261.12902
[5] Bian W, Li Y, Zhu H, et al. miR-493 by regulating of c-Jun targets Wnt5a/PD-L1-inducing esophageal cancer cell development[J]. Thorac Cancer, 2021, 12(10): 1579-1588. doi: 10.1111/1759-7714.13950
[6] Yao W, Jia X, Xu L, et al. MicroRNA-2053 involves in the progression of esophageal cancer by targeting KIF3C[J]. Cell Cycle, 2021, 20(12): 1163-1172. doi: 10.1080/15384101.2021.1929675
[7] Zhao YR, Wang JL, Xu C, et al. HEG1 indicates poor prognosis and promotes hepatocellular carcinoma invasion, metastasis, and EMT by activating Wnt/β-catenin signaling[J]. Clin Sci (Lond), 2019, 133(14): 1645-1662. doi: 10.1042/CS20190225
[8] Dewdney B, Hebbard L. A novel function for HEG1 in promoting metastasis in hepatocellular carcinoma[J]. Clin Sci (Lond), 2019, 133(19): 2019-2022. doi: 10.1042/CS20190704
[9] Song Q, Liu H, Li C, et al. miR-33a-5p inhibits the progression of esophageal cancer through the DKK1-mediated Wnt/β-catenin pathway[J]. Aging (Albany NY), 2021, 13(16): 20481-20494.
[10] Ren S, Tan X, Fu MZ, et al. Downregulation of miR-375 contributes to ERBB2-mediated VEGFA overexpression in esophageal cancer[J]. J Cancer, 2021, 12(23): 7138-7146. doi: 10.7150/jca.63836
[11] Nguyen MT, Lin CH, Liu SM, et al. miR-524-5p reduces the progression of the BRAF inhibitor-resistant melanoma[J]. Neoplasia, 2020, 22(12): 789-799. doi: 10.1016/j.neo.2020.10.009
[12] Li X, Li Z, Zhu Y, et al. miR-524-5p inhibits angiogenesis through targeting WNK1 in colon cancer cells[J]. Am J Physiol Gastrointest Liver Physiol, 2020, 318(4): G827-G839. doi: 10.1152/ajpgi.00369.2019
[13] Jin T, Zhang Y, Zhang T. miR-524-5p Suppresses Migration, Invasion, and EMT Progression in Breast Cancer Cells Through Targeting FSTL1[J]. Cancer Biother Radiopharm, 2020, 35(10): 789-801.
[14] Zhu CY, Meng FQ, Liu J. MicroRNA-524-5p suppresses cell proliferation and promotes cell apoptosis in gastric cancer by regulating CASP3[J]. Eur Rev Med Pharmacol Sci, 2019, 23(18): 7968-7977.
[15] Lüönd F, Sugiyama N, Bill R, et al. Distinct contributions of partial and full EMT to breast cancer malignancy[J]. Dev Cell, 2021, 56(23): 3203-3221. e11. doi: 10.1016/j.devcel.2021.11.006
[16] Na TY, Schecterson L, Mendonsa AM, et al. The functional activity of E-cadherin controls tumor cell metastasis at multiple steps[J]. Proc Natl Acad Sci U S A, 2020, 117(11): 5931-5937. doi: 10.1073/pnas.1918167117
[17] Chen P, Li X, Zhang R, et al. Combinative treatment of β-elemene and cetuximab is sensitive to KRAS mutant colorectal cancer cells by inducing ferroptosis and inhibiting epithelial-mesenchymal transformation[J]. Theranostics, 2020, 10(11): 5107-5119. doi: 10.7150/thno.44705
[18] Pan G, Liu Y, Shang L, et al. EMT-associated microRNAs and their roles in cancer stemness and drug resistance[J]. Cancer Commun (Lond), 2021, 41(3): 199-217. doi: 10.1002/cac2.12138
[19] Nan Y, Guo L, Lu Y, et al. miR-451 suppresses EMT and metastasis in glioma cells[J]. Cell Cycle, 2021, 20(13): 1270-1278. doi: 10.1080/15384101.2021.1933303
[20] Shen D, Zhao HY, Gu AD, et al. miRNA-10a-5p inhibits cell metastasis in hepatocellular carcinoma via targeting SKA1[J]. Kaohsiung J Med Sci, 2021, 37(9): 784-794. doi: 10.1002/kjm2.12392
[21] Wang J, Cai H, Liu Q, et al. Cinobufacini Inhibits Colon Cancer Invasion and Metastasis via Suppressing Wnt/β-Catenin Signaling Pathway and EMT[J]. Am J Chin Med, 2020, 48(3): 703-718. doi: 10.1142/S0192415X20500354
[22] Naso JR, Tsuji S, Churg A. HEG1 is a highly specific and sensitive marker of epithelioid malignant mesothelioma[J]. Am J Surg Pathol, 2020, 44(8): 1143-1148. doi: 10.1097/PAS.0000000000001469
[23] Zou X, Zhang Y, Wang N, et al. HEG1 as a novel potential biomarker for the prognosis of lung adenocarcinoma[J]. Cancer Med, 2023, 12(3): 3288-3298. doi: 10.1002/cam4.5081
-
期刊类型引用(3)
1. 贺明,汤成,梁艳,黄义娟,陶然. 2014-2016年重庆市九龙坡区新发恶性肿瘤生存分析. 社区医学杂志. 2023(03): 115-118+123 .  百度学术
百度学术
2. 李红,徐幽琼,郑婉辉,陆璐. 福州市2018年恶性肿瘤发病与死亡分析. 现代肿瘤医学. 2023(18): 3481-3485 .  百度学术
百度学术
3. 亓琳,张欢欢,沈自芳,杨蕊. 彩色多普勒超声特征对乳腺无症状炎性改变和浸润性导管癌的鉴别诊断价值. 中国医药导报. 2023(28): 164-167 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: