Berberine Promotes Mouse Breast Cancer Metastasis to Lung via Inducing Epithelial–mesenchymal Transition
-
摘要:目的
从上皮-间质转化(EMT)途径探讨盐酸小檗碱(BBR)对小鼠乳腺癌肺转移的作用及机制。
方法CCK-8法检测BBR对乳腺癌4T1细胞增殖的影响; Transwell实验检测BBR对4T1细胞迁移的影响; 采用第4对乳腺脂肪垫注射4T1-Luc细胞法建立小鼠乳腺癌模型, 造模小鼠随机分为Control组和BBR组。BBR组小鼠连续腹腔注射BBR工作液, Control组小鼠连续腹腔注射同体积的用于溶解小檗碱粉末的溶剂。通过小动物活体成像系统检测活体小鼠肺部肿瘤转移情况。给药后第42天进行取材, 通过显微镜观察HE染色小鼠肺转移情况; Western blot检测BBR对EMT相关蛋白(Vimentin、Snail)以及Akt和ERK信号通路表达的影响。
结果BBR促进4T1细胞迁移(P < 0.05);体内实验中, 与Control组相比, BBR组小鼠的肺转移结节数量明显增多(P < 0.05), 镜下观察与HE染色结果一致; BBR上调EMT标志分子Vimentin和Snail及通路相关蛋白p-Akt和p-ERK在肿瘤组织中的表达水平, 与Control组相比差异均有统计学意义(P < 0.05)。
结论BBR可能通过激活p-Akt和p-ERK通路蛋白表达, 促进4T1乳腺癌细胞上皮-间质转化和肺转移。
Abstract:ObjectiveTo study the effect and mechanism of berberine (BBR) on the lung metastasis of mouse breast cancer via epithelial-mesenchymal transition (EMT).
MethodsCCK-8 and Transwell migration assays were utilized to investigate the proliferation and migration properties of breast cancer 4T1 cells after BBR treatment.Mouse 4T1-Luc cells were injected into mice under the fourth mammary fat pad, and the mice were then randomly divided into the control and BBR groups.The mice in the BBR group received daily intraperitoneal injections of BBR working solution and those in the control group were continuously intraperitoneally injected with the same volume of the solvent used to dissolve BBR powder.Tumor metastasis in the lungs of living mice was detected by using an in vivo imaging system.After 42 days of administration, lung metastasis was measured via microscopy and HE staining.Western blot analysis was used to examine the effects of BBR on the expression of EMT-related proteins (Vimentin and Snail) as well as the activation of the Akt and ERK signaling pathways.
ResultsBBR significantly promoted 4T1 cell migration (P < 0.05).In vivo experiments showed that the number of lung metastases in the BBR group had significantly increased compared with that in control group (P < 0.05) as observed under microcopy and histological staining.Compared with the control group, BBR upregulated the expression levels of Vimentin and Snail as well as the phosphorylated levels of p-Akt and p-ERK (P < 0.05).
ConclusionBBR may promote EMT and lung metastasis of breast cancer 4T1 cells by activating the expression of proteins in the p-Akt and p-ERK pathways.
-
Key words:
- Berberine /
- Breast cancer /
- 4T1 cells /
- Metastasis /
- EMT /
- Vimentin /
- Snail
-
0 引言
乳腺癌是女性最常见的恶性肿瘤之一,其发病率逐年上升,现已取代肺癌,成为全球第一大癌症[1]。肿瘤细胞侵袭和转移是导致乳腺癌患者死亡的重要原因[2],而乳腺癌细胞的上皮-间质转化(epithelial-mesenchymal transformation, EMT)是乳腺癌发生侵袭和转移的重要途径之一[3]。研究表明,EMT的发生发展与PI3K/Akt和ERK/MAPK两条信号通路的异常激活密切相关[4]。因此,寻找有效干预EMT的小分子成分以预防乳腺癌转移的发生发展,是当前的研究热点之一。
小檗碱(berberine, BBR)是一种异喹啉类生物碱,可从许多中草药分离获得,如黄连、黄柏等。黄连与黄柏性味与功效相似,味苦、性寒,有清热燥湿、泻火解毒的功效[5]。虽然有研究表明小檗碱具有抑制胃癌、结直肠癌、肺癌等肿瘤增殖和转移的作用[6-8],然而我们前期研究发现,小檗碱可促进乳腺癌4T1细胞转移。基于此,我们进行了一系列体内外实验,明确其对乳腺癌4T1细胞模型的作用,以加强对小檗碱的基础研究。
本研究利用细胞及动物模型,通过现代分子生物学技术研究小檗碱对小鼠乳腺癌肺转移的作用及调控机制,为进一步揭示小檗碱在小鼠乳腺癌肺转移发生发展中的作用提供实验依据。
1 材料与方法
1.1 试剂与仪器
Vimentin(3932)、Snail(3895)、Akt(4685)、ERK(4695)和p-ERK(9101)抗体购自美国Cell Signaling Technology公司;p-Akt(66444-I-Ig)、GAPDH(60004-1-Ig)抗体购自美国Proteintech公司。山羊抗兔IgG二抗(8715)和山羊抗小鼠IgG二抗(6229)购自美国SAB公司。DMEM培养基(南京凯基生物公司);胎牛血清(澳大利亚SERANA公司);二甲基亚砜(上海生工生物公司);青霉素-链霉素溶液(上海源培生物科技股份有限公司);CCK-8试剂盒(上海碧云天公司);Transwell小室(美国Corning公司);BCA蛋白浓度测定试剂盒(武汉博士德生物工程有限公司);HE染色试剂盒(北京索莱宝公司);D-Luciferin荧光素酶(美国PerkinElmer公司);自动细胞计数仪(上海睿钰生物科技有限公司);CO2培养箱(美国Thermo Fisher Scientific公司);IVIS Spectrum CT小动物活体成像系统(美国PerkinElmer公司);Tecan Spark多功能酶标仪(瑞士Tecan公司);SuperKine超敏型ECL发光液(美国Abbkine公司);ChemiDoc MP全能型成像系统(美国Bio-Rad公司);垂直蛋白电泳装置(美国Bio-Rad公司);Aperio Versa智能组织切片分析系统(德国Leica Biosystems公司)。
1.2 细胞株
小鼠乳腺癌4T1细胞株由美国韦恩州立大学F.Miller博士惠赠,4T1-luc细胞是用萤火虫荧光素酶质粒转染4T1细胞后,使用嘌呤霉素筛选后得到的稳定转染细胞株。
1.3 动物
SPF级BALB/c小鼠24只,雌性,体质量20~22 g,6~8周龄,购于上海斯莱克实验动物责任公司,生产许可证号:SCXK(沪)2018-0016。小鼠饲养于福建中医药大学动物中心,许可证号:SYXK(闽)2020-0002。饲养环境为温度23℃~25℃,相对湿度65%~70%,光照周期为12 h: 12 h。该实验已通过福建中医药大学实验动物伦理会审查(No. 2022-233),符合实验动物伦理委员会相关指导原则。
1.4 药物
小檗碱粉末购买自美国MedChemExpress公司,以二甲基亚砜(DMSO)为溶剂溶解成为33.62 mmol/L(12.5 mg/ml)的母液后,分装储存于-80℃冰箱。使用前,以ddH2O为溶剂配制新鲜的小檗碱工作液。
1.5 细胞培养
小鼠乳腺癌4T1细胞和4T1-Luc细胞培养方法一致。用含10%胎牛血清、青霉素和链霉素双抗的高糖DMEM培养液,常规复苏细胞后,置于37℃、5%CO2细胞培养箱中培养,待细胞生长至80%~90%密度时,用0.25%胰蛋白酶消化,进行细胞换液、传代、冻存或用于后续实验。
1.6 CCK-8实验
取处于对数生长期的4T1细胞消化、重悬、进行细胞计数后接种于96孔板中,每孔100 μl新鲜培养液中含9×103个细胞,每组设3个复孔。实验组分别加入终浓度为0、2.5、5、10、20 μmol/L的小檗碱,细胞对照组为4T1细胞加培养液,空白对照组则仅为培养液,边缘孔各加入PBS缓冲液以防止蒸发。将96孔板置于37℃、5%CO2培养箱中培养48 h后,每孔加入10 μl CCK-8溶液,避光继续孵育1.5 h,使用酶标仪检测每孔在450 nm处的吸光度。每个独立实验重复3次。
1.7 Transwell迁移小室实验
将实验分为3组:0 µmol/L BBR组、5 µmol/L BBR组、10 µmol/L BBR组。将Transwell小室放入24孔板中,以无血清培养基重悬,调整细胞密度为2×105个/毫升,取200 μl细胞悬液加入24孔板Transwell小室的上室,分别加入终浓度为5和10 μmol/L的小檗碱或等量DMSO溶剂作为对照,下室中每孔加入500 μl含0.5%胎牛血清的DMEM培养基,常规培养24 h后,用4%多聚甲醛溶液室温固定15 min,随后用结晶紫染色30 min,棉签擦去上室细胞后在显微镜下观察。光学显微镜下拍摄上、中、下、左、右5个不同视野的细胞迁移情况;拍摄每个小室四周及中间共15个视野,取每个视野中穿过膜的平均细胞数目进行计数。
1.8 成瘤模型的制备
24只健康雌性SPF级BALB/c小鼠饲养至9~10周龄,小鼠平均体质量达30 g左右。采用随机数字表法分为Control组和BBR组,每组12只。取处于对数生长期的4T1-Luc细胞,消化离心后弃上清液,细胞沉淀用磷酸盐缓冲液清洗3次后重悬,锥虫蓝对比染色法检测细胞存活率,选取细胞活率大于90%的细胞悬液用于实验,调整细胞浓度为1×107个/毫升,冰上保存。于每只BALB/c雌鼠右侧第4对乳腺脂肪垫注射100 μl浓度为1×107个/毫升的细胞悬液,建立乳腺癌模型,共计24只。
1.9 给药
造模后第2天开始给药,BBR组每只小鼠按每天5 mg/kg的给药剂量(小檗碱工作液)腹腔注射,每天1次,连续注射42天。Control组小鼠腹腔注射200 μl同体积的用于溶解小檗碱粉末的溶剂,每天1次,持续注射42天;
1.10 IVIS Spectrum CT小动物活体成像
通过小动物活体成像系统检测活体小鼠肺部转移瘤荧光信号。配制新鲜的浓度为15 mg/ml的荧光素DPBS溶液,小鼠腹腔注射用量为10 µl/g。检测前,使用异氟烷气体麻醉系统充分麻醉小鼠,确保装置能够持续提供一定含量的氧气与麻醉剂,将小鼠保存仰卧位固定于成像暗箱的平台上。腹腔注射相应体积的荧光素DPBS溶液后,启动活体成像系统并在10~15 min内完成肿瘤荧光信号检测。
1.11 动物取材及标本采集
根据小动物活体成像结果,选取给药后第42天作为小鼠取材时间。使用1%戊巴比妥钠0.01 ml/g剂量对小鼠进行腹腔麻醉,取出肿瘤组织,去除毛发及坏死组织后立即冻存于液氮中,储存于-80℃冰箱中备用。使用在体气管灌注固定法完整剥离、灌注小鼠肺组织,再将小鼠肺组织固定于4%多聚甲醛溶液中。24 h后,乙醇梯度脱水,统计肺部正反面及肺叶间的转移瘤总数,并对小鼠肺组织进行拍照。
1.12 HE染色
肺组织于4%多聚甲醛溶液固定24 h后,常规石蜡包埋、切片(6 μm)。载玻片在二甲苯中脱蜡,用100%、95%、85%、75%乙醇依次脱苯5 min,然后用蒸馏水冲洗2次。载玻片用苏木精溶液染色20 min,然后在流水下缓慢冲洗以除去未染上的蓝色。将载玻片置于分化液中3 min去除细胞质蓝色。自来水下洗涤载玻片5 min,用伊红溶液染色10 min,然后在100%乙醇中脱水;最后,使用中性树胶密封。使用Leica光学显微镜在10倍镜下观察并拍照。
1.13 蛋白印迹法检测蛋白表达
将小鼠肿瘤组织研碎后加RIPA裂解液提取组织总蛋白,BCA试剂盒测定样品蛋白含量。蛋白定量后,分别取蛋白50 μg加入上样缓冲液,100℃变性10 min。电泳,转膜,5%脱脂牛奶封闭后加入一抗(Vimentin、Snail、Akt、p-Akt、ERK、p-ERK、GAPDH),4℃摇床孵育过夜。加入二抗(辣根过氧化酶标记山羊抗兔、辣根过氧化酶标记山羊抗鼠)室温孵育1 h,加入超敏型ECL发光液后用凝胶成像系统拍照成像。使用Image J软件计算蛋白相对表达量。
1.14 统计学方法
采用SPSS22.0统计软件对数据进行统计分析,实验数据以x±s表示,组间比较用单因素方差进行分析,P < 0.05为差异有统计学意义。
2 结果
2.1 CCK-8法检测4T1细胞增殖情况
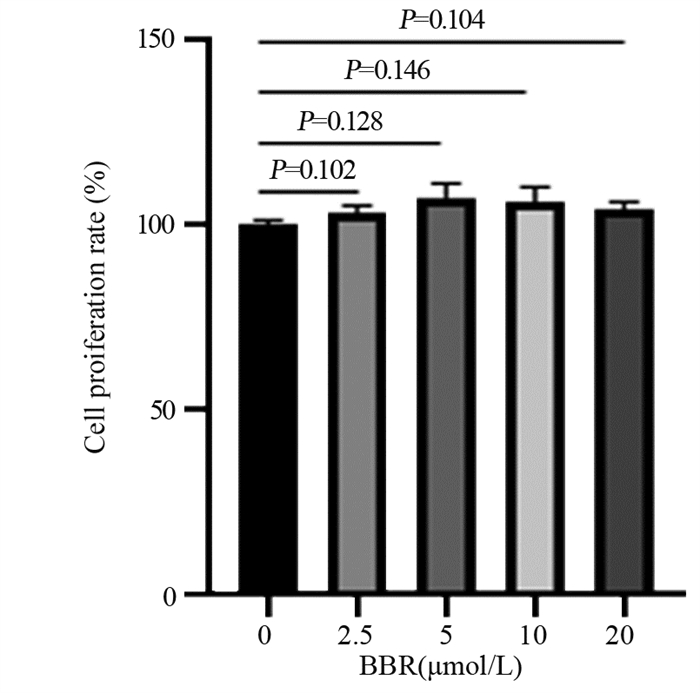
CCK-8实验结果显示,不同浓度BBR干预48 h后,各组细胞增殖率与0 µmol/L BBR组相比差异无统计学意义(P > 0.05),见图 1。因此,依据上述实验结果,拟选择5和10 µmol/L的小檗碱浓度进行后续实验。
2.2 Transwell迁移实验检测小檗碱对4T1细胞迁移的影响
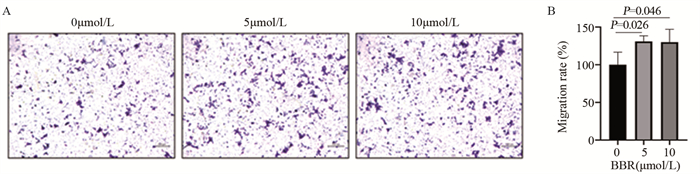
Transwell迁移实验结果显示,BBR作用24 h后,与0 µmol/L组相比,5和10 µmol/L组的4T1细胞迁移率明显提高,差异有统计学意义(P < 0.05),见图 2。
2.3 BBR对小鼠乳腺癌肺转移的影响
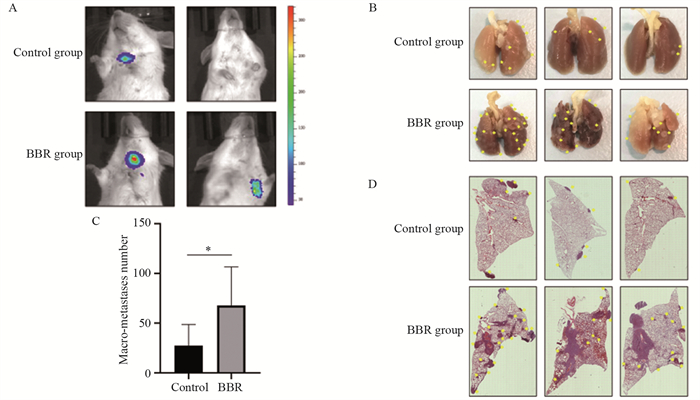
给药第38天,与Control组相比,BBR组的小鼠肺部转移瘤荧光信号明显增强,见图 3A。小鼠肺组织病理标本经过4%多聚甲醛固定液浸泡24 h后,可见清晰的结节状肺转移瘤,呈圆形或类圆形,大小不等,见图 3B。BBR组小鼠的肺组织表面的肿瘤转移结节数量与Control组相比明显增多(P < 0.05),见图 3C。HE染色结果发现,与Control组相比,BBR组的小鼠肺组织被实体肿瘤侵占较多,肺组织结构明显被破坏,正常肺组织减少,肺转移结节数明显多于Control组,见图 3D。以上结果表明,小檗碱促进了乳腺癌小鼠体内4T1细胞的肺转移。
![]() 图 3 BBR对小鼠乳腺癌肺转移的影响Figure 3 Effect of BBR on lung metastasis of breast cancer in mice*: P < 0.05. A: in vivo fluorescence imaging of two mice lung metastases aftter 38 days of BBR administration; B: picture of lungs of three mice (yellow arrow for metastatic lesion); C: macro-metastases number; D: HE staining of mouse lung tissue of three mice (HE×10).
图 3 BBR对小鼠乳腺癌肺转移的影响Figure 3 Effect of BBR on lung metastasis of breast cancer in mice*: P < 0.05. A: in vivo fluorescence imaging of two mice lung metastases aftter 38 days of BBR administration; B: picture of lungs of three mice (yellow arrow for metastatic lesion); C: macro-metastases number; D: HE staining of mouse lung tissue of three mice (HE×10).2.4 BBR通过Akt和ERK信号通路对小鼠乳腺癌EMT相关蛋白的影响
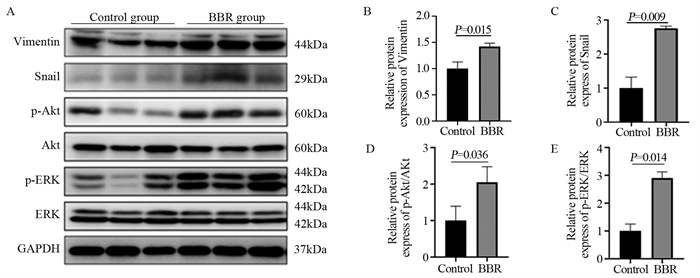
与Control组相比,BBR干预后,间充质标志物Vimentin和转录因子Snail的蛋白相对表达水平均上调,差异具有统计学意义(P < 0.05)。与Control组相比,BBR组Akt和ERK磷酸化蛋白相对表达水平明显上调,差异有统计学意义(P < 0.05),见图 4。
3 讨论
乳腺癌是全世界女性中最常见的癌症,同时也是女性癌症患者死亡的主要原因[1]。复杂的筛查技术和个性化化疗的发展与应用显著降低了乳腺癌患者的死亡率,但被诊断为晚期、高度恶性乳腺癌患者的长期预后仍较差[9]。早期淋巴结转移和远处器官的转移是乳腺癌患者死亡的主要原因,肺是其中仅次于骨转移的第二大转移器官[10]。因此,研究小分子药物对乳腺癌转移相关靶点的调控作用机制,对乳腺癌转移的预防和治疗具有重要意义。
小檗碱是从中草药黄连、黄柏中分离出来的生物碱。值得注意的是,口服小檗碱在我国临床上出现过不同程度的不良反应[11],同时受到口服吸收率低等的影响,小檗碱的临床应用较局限[12]。虽然有研究显示小檗碱对不同肿瘤的生长具有抑制作用[13-15]。然而,也有研究发现,小檗碱单独或与5-Fu联合治疗H460肺癌细胞后,癌症干细胞侧群(SP)部分比例增加,从而增加癌症干细胞的存活率[16]。因此,小檗碱在不同癌症的治疗中应谨慎使用。本研究主要关注小檗碱对小鼠乳腺癌4T1细胞转移的作用及相关机制。既往有研究报道小檗碱可以部分逆转阿霉素加重的乳腺癌转移,并通过小檗碱和化疗药物的组合来抑制TLR4介导的转移增加,从而改善乳腺癌化疗的不良反应。该研究发现小檗碱是通过部分抑制阿霉素激活的TLR4介导的迁移发挥部分抑制作用。然而小檗碱单一成分对4T1细胞本底EMT分子的表达及迁移并无抑制作用[17]。此外,还有研究报道了小檗碱具有类似的协助作用,Refaat等发现小檗碱增强了抗DR5抗体治疗的疗效,对肿瘤生长和肺转移有抑制作用。然而在4T1小鼠体内模型中,该研究结果显示,与对照组相比,单独口服小檗碱组小鼠肺转移灶的数量不仅没有减少,甚至呈现略微增多趋势(差异无统计学意义)[18]。由于同一分子在不同的剂量下确实可对细胞产生双相剂量反应现象[19]。因此,小檗碱单一成分在不同浓度下可能对乳腺癌细胞转移具有不同的干预作用。本研究同样利用来源于自发产生的BALB/c小鼠乳腺肿瘤转移亚群的4T1细胞研究小檗碱单一成分对乳腺癌细胞转移的作用。在4T1细胞中,雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子2(HER-2)表达均为阴性,属于TNBC细胞。TNBC细胞侵袭和转移能力强[20-21],常转移至脑、骨、肺和肝脏[22]。我们采用具有完整免疫系统的BALB/c小鼠造模乳腺癌模型,更好地模拟乳腺癌转移的自然过程,实验结果显示,给予乳腺癌小鼠每天5 mg/kg浓度的小檗碱干预42天后,与模型组相比,小檗碱组小鼠的肺组织转移瘤数量显著增多,证实小檗碱能够促进乳腺癌的肺转移。这一结果提示是否可以将小檗碱作为安全、有效的小分子药物防治小鼠乳腺癌转移。
上皮-间质转化是指上皮细胞在特定生理和病理条件下分化为间充质细胞的现象,被认为是恶性肿瘤细胞转移和侵袭的一个重要过程[3]。肿瘤上皮标志物表达下调、间充质标志物表达上调,导致细胞之间的连接减少、细胞活力增强。我们的研究发现,小檗碱可显著上调乳腺癌小鼠肿瘤组织中Vimentin和Snail两个标志物的表达。Vimentin和Snail是与EMT相关的重要指标蛋白[23]。Vimentin是一种重要的丝状蛋白,为细胞提供结构和功能支持。研究显示,在癌症发展的初始阶段,Vimentin浓度低,然而,当肿瘤开始侵袭周围区域时,Vimentin蛋白表达量明显增加[24]。Naderi等的研究表明,Vimentin存在于乳腺癌和乳腺癌干细胞中,提示EMT和恶性肿瘤之间存在关联[25]。Satelli等研究表明,Vimentin在恶性上皮癌中过度表达,且与不良预后密切相关[26]。Snail是一种锌指转录因子,不仅作为EMT的主要调节因子,而且还作为癌症进展的驱动因子,在细胞侵袭、存活、免疫调节、干细胞特性和代谢调节等过程中起着重要作用[27]。有研究表明,Snail在乳腺癌细胞系中的表达上调导致E-cadherin介导的细胞间黏附丧失,上皮细胞向间质纺锤体形态显著变化,以及迁移和侵袭表型增加[28-29]。EMT相关分子对4T1细胞的转移能力具有重要的调控作用。Shin等研究发现,MnHex处理4T1细胞后,AKT/GSK-3β/Snail信号通路明显被抑制,EMT进程被逆转,从而减少了4T1细胞的迁移和侵袭。体内实验表明,MnHex显著降低Snail蛋白的表达,阻断EMT进程,进而抑制转移[30];Wei等研究发现,TWIST1、SLUG、SNAIL1和ZEB1在BT549和4T1细胞中容易被检测到,并且它们都在虫草素(CD)干预后显著下调,证明CD可以抑制三阴性乳腺癌细胞系BT549和4T1细胞中EMT相关分子的转录[31]。本研究结果显示小檗碱通过上调Vimentin和Snail两个EMT标志分子的表达,增强4T1肿瘤细胞原位侵袭和远处转移能力,促进乳腺癌向远端转移,同时证实了小檗碱促进4T1乳腺癌转移的作用机制,与EMT密切相关。
EMT的发生发展与PI3K/Akt和ERK/MAPK两条信号通路密切相关,Shin等研究表明,MnTnHex-2-PyP 5+与辐射耦合,通过Akt/Snail/EMT通路抑制4T1和MDA-MB-231乳腺癌细胞的转移[30];Bao等研究证实,EPB41L5通过ERK/p38MAPK信号通路促进食管鳞状细胞癌EMT[32]。PI3K/Akt和ERK/MAPK是将细胞外信号传递到细胞核内最重要的两条信号通路,在调控细胞存活、增殖、分化、调亡、代谢等功能中具有关键作用,信号通路异常又是导致细胞发生癌变、促进肿瘤侵袭、转移及产生耐药性的主要原因[33]。为了明确小檗碱促进EMT进展的分子机制,我们检测了Akt和ERK磷酸化蛋白的激活情况。研究结果发现,Akt和ERK的磷酸化蛋白表达被激活,说明小檗碱可能通过激活Akt和ERK的磷酸化蛋白表达而促进上皮间质转化。
综上,我们利用4T1小鼠乳腺癌细胞构建细胞和动物实验模型,发现小檗碱对该乳腺癌动物模型的肿瘤转移具有促进作用并阐述了相关机制,为小檗碱的应用提供了一定的实验依据及新视角。由于不同细胞株具有基因背景差异[34-35],为了更全面地解析小檗碱对乳腺癌的影响及作用机制,后续应进一步拓展小檗碱对其他乳腺癌作用机制的研究。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:袁志莹:数据分析,实验实施,论文撰写马恩:方法研究沃达:数据分析彭军:资料收集朱伟东:资料收集,论文指导任丹妮:项目管理,论文指导及审核 -
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidenceand Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Yousefi M, Nosrati R, Salmaninejad A, et al. Organ-specific metastasis of breast cancer: molecular and cellular mechanisms underlying lung metastasis[J]. Cell Oncol (Dordr), 2018, 41(2): 123-140.
[3] Buyuk B, Jin S, Ye K. Epithelial-to-Mesenchymal Transition Signaling Pathways Responsible for Breast Cancer Metastasis[J]. Cell Mol Bioeng, 2022, 15(1): 1-13. doi: 10.1007/s12195-021-00694-9
[4] De Luca A, Maiello MR, D'Alessio A, et al. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways: role in cancer pathogenesis and implications for therapeutic approaches[J]. Expert Opin Ther Targets, 2012, 16 Suppl 2: S17-S27.
[5] 滕磊, 柴宇琪, 忻耀杰, 等. 基于《长沙药解》探析黄芩、黄连和黄柏的临床效用之别[J]. 上海中医药大学学报, 2018, 32(2): 7-10. https://www.cnki.com.cn/Article/CJFDTOTAL-SHZD201802003.htm Teng L, Chai YQ, Xin YJ, et al. Discussion of differences on clinical efficacy and application among Huangqin (Scutellariae Radix), Huanglian (Coptidis Rhizoma) and Huangbo (Phellodendri Chinensis Cortex) based on Changsha Yaojie (Changsha Drug Analysis)[J]. Shanghai Zhong Yi Yao Da Xue Xue Bao, 2018, 32(2): 7-10. https://www.cnki.com.cn/Article/CJFDTOTAL-SHZD201802003.htm
[6] 王小兰, 幸尚平, 肖建勇, 等. 左金方及其主要成分小檗碱对人胃癌细胞SGC7901上皮间质转化的影响[J]. 中国实验方剂学杂志, 2018, 24(12): 62-67. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201812011.htm Wang XL, Xing SP, Xiao JY, et al. Effect of Zuojinfang and Its Main Ingredient Berberine on Epithelial Mesenchymal Transition of Human Gastric Cancer Cell Line SGC7901[J]. Zhongguo Shi Yan Fang Ji Xue Za Zhi, 2018, 24(12): 62-67. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201812011.htm
[7] 陈宁宁, 蒋义芳, 杨懿, 等. 小檗碱与吴茱萸碱联用对结直肠癌细胞迁移、侵袭能力的影响[J]. 中国实验方剂学杂志, 2022, 28(24): 98-104. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX202224012.htm Chen NN, Jiang YF, Yang Y, et al. Effect of Berberine Combined with Evodiamine on Migration and Invasion of Colorectal Cancer Cells[J]. Zhongguo Shi Yan Fang Ji Xue Za Zhi, 2022, 28(24): 98-104. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX202224012.htm
[8] Zheng F, Li J, Ma C, et al. Novel regulation of miR-34a-5p and HOTAIR by the combination of berberine and gefitinib leading to inhibition of EMT in human lung cancer[J]. J Cell Mol Med, 2020, 24(10): 5578-5592. doi: 10.1111/jcmm.15214
[9] Esteva FJ, Hubbard-Lucey VM, Tang J, et al. Immunotherapy and targeted therapy combinations in metastatic breast cancer[J]. Lancet Oncol, 2019, 20(3): e175-e186. doi: 10.1016/S1470-2045(19)30026-9
[10] Baumann Z, Auf der Maur P, Bentires-Alj M. Feed-forward loops between metastatic cancer cells and their microenvironment-the stage of escalation[J]. EMBO Mol Med, 2022, 14(6): e14283. doi: 10.15252/emmm.202114283
[11] Lee YH, Kim D, Lee MJ, et al. Subchronic toxicity study of Coptidis rhizoma in rats[J]. J Ethnopharmacol, 2014, 152(3): 457-463. doi: 10.1016/j.jep.2014.01.011
[12] Wang J, Wang L, Lou GH, et al. Coptidis Rhizoma: a comprehensive review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. Pharm Biol, 2019, 57(1): 193-225. doi: 10.1080/13880209.2019.1577466
[13] Li SY, Shi CJ, Fu WM, et al. Berberine inhibits tumour growth in vivo and in vitro through suppressing the lincROR-Wnt/beta-catenin regulatory axis in colorectal cancer[J]. J Pharm Pharmacol, 2023, 75(1): 129-138. doi: 10.1093/jpp/rgac067
[14] McCubrey JA, Abrams SL, Steelman LS, et al. APR-246-The Mutant TP53 Reactivator-Increases the Effectiveness of Berberine and Modified Berberines to Inhibit the Proliferation of Pancreatic Cancer Cells[J]. Biomolecules, 2022, 12(2): 276. doi: 10.3390/biom12020276
[15] Xu M, Ren L, Fan J, et al. Berberine inhibits gastric cancer development and progression by regulating the JAK2/STAT3 pathway and downregulating IL-6[J]. Life Sci, 2022, 290: 120266. doi: 10.1016/j.lfs.2021.120266
[16] Sung JH, Kim JB, Park SH, et al. Berberine decreases cell growth but increases the side population fraction of H460 lung cancer cells[J]. J Korean Soc Appl Biol Chem, 2012, 55: 491-495. doi: 10.1007/s13765-012-2119-0
[17] Zheng X, Zhao Y, Jia Y, et al. Biomimetic co-assembled nanodrug of doxorubicin and berberine suppresses chemotherapy-exacerbated breast cancer metastasis[J]. Biomaterials, 2021, 271: 120716. doi: 10.1016/j.biomaterials.2021.120716
[18] Refaat A, Abdelhamed S, Yagita H, et al. Berberine enhances tumor necrosis factor-related apoptosis-inducing ligand-mediated apoptosis in breast cancer[J]. Oncol Lett, 2013, 6(3): 840-844. doi: 10.3892/ol.2013.1434
[19] Calabrese EJ. Hormesis: why it is important to toxicology and toxicologists[J]. Environ Toxicol Chem, 2008, 27(7): 1451-1474. doi: 10.1897/07-541.1
[20] Wei C, Khan MA, Du J, et al. Cordycepin Inhibits Triple-Negative Breast Cancer Cell Migration and Invasion by Regulating EMT-TFs SLUG, TWIST1, SNAIL1, and ZEB1[J]. Front Oncol, 2022, 12: 898583. doi: 10.3389/fonc.2022.898583
[21] Ghalavand M, Dorostkar R, Borna H, et al. MicroRNA-122 Is More Effective than Rapamycin in Inhibition of Epithelial-mesenchymal Transition and mTOR Signaling Pathway in Triple Negative Breast Cancer[J]. Iran J Allergy Asthma Immunol, 2023, 22(1): 46-61.
[22] André F, Zielinski CC. Optimal strategies for the treatment of metastatic triple-negative breast cancer with currently approved agents[J]. Ann Oncol, 2012, 23 Suppl 6: vi46-vi51.
[23] Huber MA, Kraut N, Beug H. Molecular requirements for epithelial-mesenchymal transition during tumor progression[J]. Curr Opin Cell Biol, 2005, 17(5): 548-558.
[24] Usman S, Waseem NH, Nguyen TKN, et al. Vimentin Is at the Heart of Epithelial Mesenchymal Transition (EMT) Mediated Metastasis[J]. Cancers (Basel), 2021, 13(19): 4985.
[25] Naderi R, Gholizadeh-Ghaleh Aziz S, Haghigi-Asl AS. Evaluating the effect of Alantolactone on the expression of N-cadherin and Vimentin genes effective in epithelial-mesenchymal transition (EMT) in breast cancer cell line (MDA-MB-231)[J]. Ann Med Surg (Lond), 2022, 73: 103240.
[26] Satelli A, Li S. Vimentin in cancer and its potential as a molecular target for cancer therapy[J]. Cell Mol Life Sci, 2011, 68(18): 3033-3046.
[27] Dong B, Wu Y. Epigenetic Regulation and Post-Translational Modifications of SNAI1 in Cancer Metastasis[J]. Int J Mol Sci, 2021, 22(20): 11062.
[28] Kielbik M, Szulc-Kielbik I, Klink M. Impact of Selected Signaling Proteins on SNAIL 1 and SNAIL 2 Expression in Ovarian Cancer Cell Lines in Relation to Cells'Cisplatin Resistance and EMT Markers Level[J]. Int J Mol Sci, 2021, 22(2): 980.
[29] Smith BN, Odero-Marah VA. The role of Snail in prostate cancer[J]. Cell Adh Migr, 2012, 6(5): 433-441.
[30] Shin SW, Choi C, Kim H, et al. MnTnHex-2-PyP (5+), Coupled to Radiation, Suppresses Metastasis of 4T1 and MDA-MB-231 Breast Cancer via AKT/Snail/EMT Pathways[J]. Antioxidants (Basel), 2021, 10(11): 1769.
[31] Wei C, Khan MA, Du J, et al. Cordycepin Inhibits Triple-Negative Breast Cancer Cell Migration and Invasion by Regulating EMT-TFs SLUG, TWIST1, SNAIL1, and ZEB1[J]. Front Oncol, 2022, 12: 898583.
[32] Bao S, Ji Z, Shi M, et al. EPB41L5 promotes EMT through the ERK/p38 MAPK signaling pathway in esophageal squamous cell carcinoma[J]. Pathol Res Pract, 2021, 228: 153682.
[33] De Luca A, Maiello MR, D'Alessio A, et al. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways: role in cancer pathogenesis and implications for therapeutic approaches[J]. Expert Opin Ther Targets, 2012, 16 Suppl 2: S17-S27.
[34] 孙宇, 邹燕鹏, 邓素华, 等. 不同分子分型乳腺癌原发灶内CD4+、CD8+ T淋巴细胞的表达差异研究[J]. 中国临床研究, 2016, 29(2): 153-156, 161. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGCK201602004.htm Sun Y, Zou YP, Deng SH, et al. Difference of CD4+ and CD8+ T lymphocytes expressions in primary lesions of different molecular classification breast cancer[J]. Zhongguo Lin Chuang Yan Jiu, 2016, 29(2): 153-156, 161. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGCK201602004.htm
[35] 欧小波, 周密. ADAM15、MMP-2和MMP-9在不同转移能力乳腺癌细胞系中的表达差异[J]. 基础医学与临床, 2016, 36(2): 227-231. https://www.cnki.com.cn/Article/CJFDTOTAL-JCYL201602016.htm Ou XB, Zhou M. The expression of ADAM15, MMP-2 and MMP-9 in different breast cancer cell lines[J]. Ji Chu Yi Xue Yu Lin Chuang, 2016, 36(2): 227-231. https://www.cnki.com.cn/Article/CJFDTOTAL-JCYL201602016.htm
-
期刊类型引用(0)
其他类型引用(1)



 下载:
下载: