Prediction Model of Treatment Effect of Anlotinib on Extensive-stage Small Cell Lung Cancer Based on Combination of Disease and Syndrome Information
-
摘要:目的
构建中医证素参与的安罗替尼治疗既往接受过多线化疗进展的广泛期小细胞肺癌(ES-SCLC)患者预后的列线图预测模型。
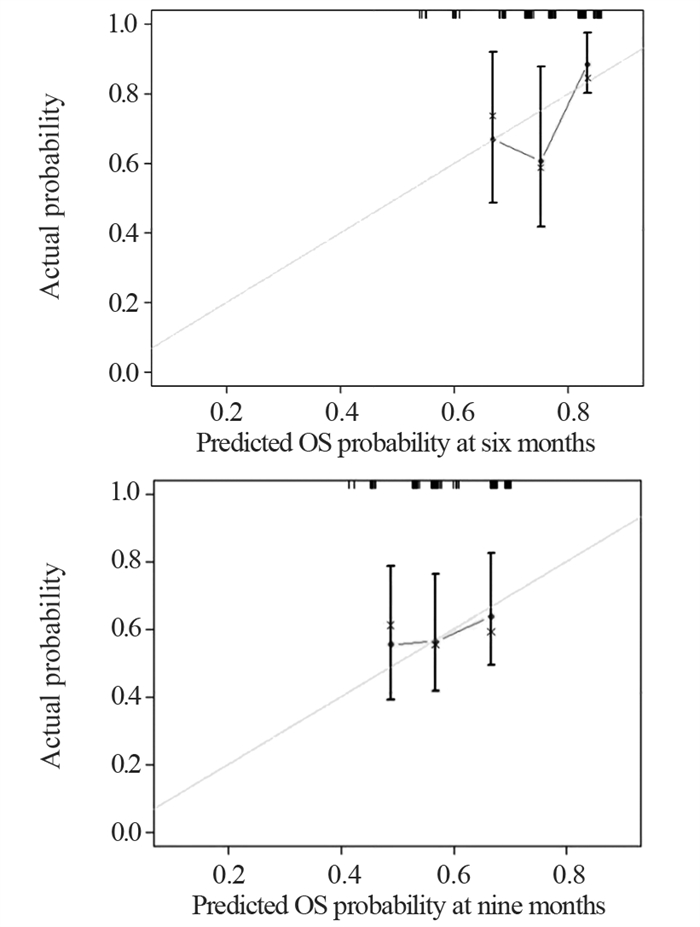
方法回顾性分析至少经过2个周期安罗替尼治疗的127例ES-SCLC患者临床资料。采用Kaplan-Meier法分析各个因素与总生存时间的关系,通过Cox回归分析筛选患者预后的独立影响因素,应用R语言构建列线图预测模型,采用C-index指数对模型进行评估,并以校准曲线来验证模型的准确性。
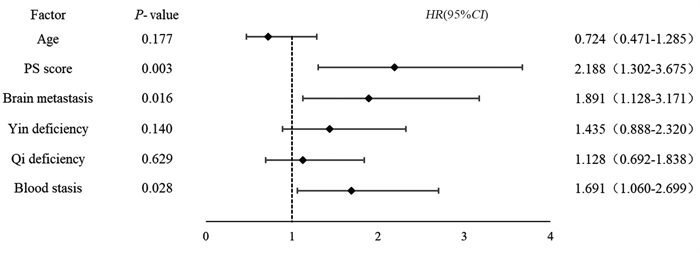
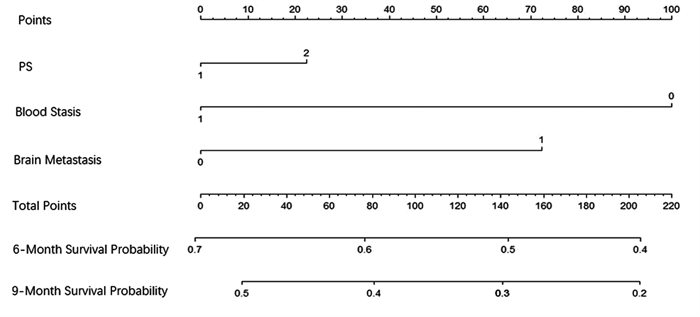
结果K-M法单因素生存分析显示,年龄、PS评分、脑转移、气虚病性证素、阴虚病性证素、血瘀病性证素是安罗替尼治疗ES-SCLC的相关危险因素。多因素Cox回归分析显示,PS评分(HR=2.188, P=0.003)、脑转移(HR=1.891, P=0.016)、血瘀病性证素(HR=1.691, P=0.028)是独立的预后不良因素。基于这三个独立影响因素建立预测安罗替尼治疗ES-SCLC患者预后的列线图模型,预测风险接近实际风险,显示出较高吻合度。
结论以PS评分、血瘀病性证素、脑转移为独立因素建立的列线图模型可以预测安罗替尼二三线治疗ES-SCLC患者的预后。
Abstract:ObjectiveTo construct a nomogram prediction model for the treatment effect of anlotinib with the participation of traditional Chinese medicine syndrome elements on the patients with extensive-stage small cell lung cancer (ES-SCLC) who previously received multiple lines of chemotherapy.
MethodsThe clinical data of 127 patients with ES-SCLC who received at least two cycles of anlotinib treatment were retrospectively studied. Kaplan-Meier method was used to analyze the relationship between each factor and the overall survival time. Cox regression analysis was applied to screen the independent influencing factors of the prognosis of patients with ES-SCLC. R language was employed to build a nomogram prediction model, C-index was used to evaluate the model, and calibration curve was adopted to verify the accuracy of the model.
ResultsAge, PS score, brain metastases, qi deficiency syndrome, yin deficiency syndrome, and blood stasis syndrome were related risk factors for ES-SCLC treated with anlotinib. PS score, brain metastasis, and blood stasis syndrome were independent prognostic factors. On the basis of these three independent influencing factors, a nomogram model was established to predict the prognosis of patients with ES-SCLC treated with anlotinib. The predicted risk was close to the actual risk, showing a high degree of coincidence.
ConclusionThe nomogram model established with PS score, blood stasis syndrome elements, and brain metastasis as independent factors can predict the prognosis of patients with ES-SCLC receiving second- and third-line treatment of anlotinib.
-
0 引言
食管癌是常见的消化道恶性肿瘤,其发病率和死亡率分别居全球恶性肿瘤的第八位和第六位[1]。目前对食管癌的治疗方式主要有手术、放疗和化疗,其5年生存率仍不足20%[2]。人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)和表皮生长因子受体(epidermal growth factor receptor, EGFR)是HER酪氨酸激酶受体家族的主要成员,与细胞的增殖、迁移和侵袭相关[3]。有研究表明在食管癌中EGFR、HER2的共同过表达率高达30%,且与患者的不良预后相关[4-6]。有研究显示,拉帕替尼与临床常用的化疗药物在治疗未接受过化疗的转移性膀胱癌的治疗中发挥协同作用,且拉帕替尼和化疗药物联用,可减少化疗药物的剂量,这是一种潜在的降低毒性的策略[7-8]。多烯紫杉醇,又称紫杉醇,是一种抗微管药物,通过其对微管结构的稳定诱导细胞周期阻滞及凋亡。在临床中单独作用于食管鳞癌的治疗时有效反应率仅为30%左右,故本研究检测拉帕替尼联合紫杉醇在食管癌中是否可以发挥协同抗肿瘤活性及其可能的机制。
1 材料与方法
1.1 细胞及试剂
人食管鳞状细胞系EC109购于中国医学科学院基础医学研究所细胞资源中心。RPMI 1640培养基、胰蛋白酶-EDTA、MTT粉末、结晶紫粉末、青霉素和链霉素购于北京索莱宝科技有限公司;侵袭实验的小室购于美国Corning公司;BCA蛋白定量试剂盒、细胞周期检测试剂盒和细胞凋亡检测试剂盒购于江苏碧云天生物技术研究所;兔抗人EGFE(货号2085)、HER2(货号4290)、AKT(货号2920)、p-AKT(货号13038)、β-actin单克隆抗体及辣根过氧化物酶标记的羊抗鼠(货号3700)、兔IgG抗体(货号4870)购于美国CST公司。拉帕替尼(GW572016, 50 mg)购于美国MedChemExpress公司,将拉帕替尼溶于二甲亚砜(DMSO)中,并以10 mmol/L的浓度储存。紫杉醇注射液(5 mg/ml)购于北京双鹭药业股份有限公司,用PBS溶液稀释。
1.2 细胞培养
EC109细胞用含有体积分数10%胎牛血清、100 g/L链霉素、100 u/ml青霉素的RPMI 1640培养基中培养,在5%CO2、37℃恒温箱中培养。当细胞密度增长至80%~90%融合时,用0.25%胰酶-EDTA将其消化,离心并传代。
1.3 MTT实验检测细胞活性
取对数生长的食管癌细胞EC109,用0.25%胰酶-EDTA消化并计数,按照2 000个/孔的密度接种于96孔板中,培养24 h后,加入拉帕替尼使其终浓度为(1、2、4、8 μmol/L)、加入紫杉醇使其终浓度为(5、10、20、40 μg/L)和联合用药(拉帕替尼1 μmol/L+紫杉醇5 μg/L、拉帕替尼2 μmol/L+紫杉醇10 μg/L、拉帕替尼4 μmol/L+紫杉醇20 μg/L、拉帕替尼8 μmol/L+紫杉醇40 μg/L),每个浓度设置六个平行孔。同时设置无药物处理组及无细胞空白对照组,恒温箱中孵育48 h。每孔加入20 μl MTT溶液(5 mg/ml)继续孵育4 h。弃上清液,每孔加入150 μl DMSO溶液,用酶标仪检测570 nm处的吸光度A值。根据公式计算出不同药物浓度药物处理后细胞的增殖抑制率。
增殖抑制率=(无细胞空白对照组A570值-药物处理组A570值)/(无细胞空白对照组A570值-无药物处理组A570值)×100%。
根据金氏公式计算药物联合指数(q),ABi为两药合用的抑制率,Ai和Bi为两种药单独使用的抑制率,q > 1.15表示两药联合效果强于两药效单纯叠加。联合指数(q)=ABi/[Ai +(1- Ai) × Bi]
1.4 Transwell实验
将24孔板和小室放置恒温箱中预热,在24孔板中加入500 μl含20%血清的培养基,无血清培养基悬浮的EC109细胞,以2×104个/皿的密度接种至小室中,在不同处理组中分别加入紫杉醇10 μg/L、拉帕替尼2 μmol/L和两药同时加入,然后置于恒温箱中孵育48 h。取出小室,用棉签轻轻擦掉小室中未穿过的细胞,然后放入含1 ml多聚甲醛的24孔板中,室温固定10 min。再放入含有0.1%结晶紫染色液的24孔板中,染色30 min。然后用PBS清洗,放置显微镜下拍照,每组从上至下选择5个视野拍照。
1.5 细胞周期检测
EC109细胞以2×104个/皿的密度接种至6孔板中,在恒温箱中孵育24 h后,弃旧培养液,分别单独加入含有拉帕替尼2 μmol/L、紫杉醇10 μg/L的新鲜培养液2 ml,继续培养48 h。胰酶消化收集细胞,PBS溶液洗涤1遍,加入预冷的70%乙醇固定24 h。PBS溶液洗涤1遍,500 μl碘化丙啶(PI)(50 mg/ml)和RNase(100 mg/ml)重悬细胞,37℃避光染色30 min。采用流式细胞仪检测细胞的荧光值,并计算出G1、S、G2/M期细胞的比率。
1.6 细胞凋亡率检测
细胞凋亡试剂盒结合流式细胞术检测拉帕替尼、紫杉醇单独和联用对EC109细胞的凋亡诱导作用。将对数生长期的EC109细胞,以每孔3×105个细胞的密度接种至6孔板中,于恒温箱中孵育24 h后分别加入拉帕替尼2 μmol/L、紫杉醇10 μg/L和联合用药,处理48 h后收集细胞,用PBS洗涤2~3遍。然后每管加入500 μl的Annexin V-FITC结合液重悬细胞,再加入5 μl Annexin V-FITC和10 μl的PI,轻轻混匀后在室温下避光孵育10 min,用流式细胞仪检测。流式凋亡图左上象限(Q1)表示坏死的细胞,右上象限(Q2)表示晚期凋亡细胞,左下象限(Q3)表示正常的细胞,右下象限(Q4)表示早期凋亡细胞,细胞凋亡率为早期凋亡率和晚期凋亡率之和。
1.7 Western blot检测EGFR、HER2及其下游信号通路中关键蛋白的表达
拉帕替尼(2 μmol/L)、紫杉醇(10 μg/L)单独及联用处理EC109细胞48 h后,提取细胞中的总蛋白。用BCA蛋白定量取30 μg的蛋白,并配置5%的浓缩胶、15%的分离胶进行SDS-PAGE电泳,将蛋白湿转至PVDF膜上。用1%BSA室温封闭2 h、经过一抗孵育(1:1 000稀释,4℃孵育过夜)、TBST洗涤3次、二抗孵育(1:4 000稀释,室温孵育1 h)、TBST洗涤3次后,在膜上滴加适量化学发光显色液并置于Amersham Imager 600凝胶成像系统中拍照。
1.8 统计学方法
采用SPSS21.0进行统计分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果
2.1 拉帕替尼、紫杉醇单独及联合使用对EC109细胞的增殖抑制作用
拉帕替尼联合紫杉醇组对细胞的增殖抑制率均高于拉帕替尼组和紫杉醇组,且联合用药指数q值均大于1.15,说明拉帕替尼联合紫杉可协同抑制细胞增殖,见图 1。
2.2 拉帕替尼、紫杉醇单独及联合使用对EC109细胞侵袭的影响
对照组、拉帕替尼2 μmol/L、紫杉醇10 μg/L单独及联合使用时发生侵袭的细胞数分别为214.5±20.5、152.4±16.1、103.6±12.7、62.0±9.5,四组间发生侵袭的细胞数差异有统计学意义(F=57.241, P < 0.001),且拉帕替尼联合紫杉醇组发生侵袭的细胞数少于拉帕替尼组和紫杉醇组,见图 2。
2.3 拉帕替尼、紫杉醇单独及联合使用对EC109细胞周期的影响
对照组、拉帕替尼组、紫杉醇组和联合处理组G2/M期细胞比率分别为(9.6±1.2)%、(20.3±2.5)%、(26.6±2.8)%和(43.4±3.1)%,四组间G2/M期细胞比率差异有统计学意义(F=15.320, P < 0.001),且拉帕替尼联合紫杉醇组G2/M期细胞比率高于拉帕替尼组和紫杉醇组,见图 3。
2.4 拉帕替尼、紫杉醇单独及联合使用对EC109细胞凋亡的影响
对照组、拉帕替尼组、紫杉醇组和联合处理组细胞的凋亡率分别为(5.6±1.2)%、(12.7±2.3)%、(21.4±5.2)%和(47.3±8.4)%。四组之间的凋亡率差异有统计学意义(F=33.612, P < 0.001),且拉帕替尼联合紫杉醇组细胞凋亡率高于拉帕替尼组和紫杉醇组,见图 4。
2.5 拉帕替尼、紫杉醇单独及联合使用对EGFR、HER2及其下游信号通路中关键蛋白AKT表达的影响
拉帕替尼为EGFR、HER2的双靶点药物,可减弱磷酸化EGFR、HER2蛋白的表达,而拉帕替尼联合紫杉醇组,对磷酸化EGFR、HER2蛋白的抑制作用增强,单独药物处理组和联合药物处理组对EGFR、HER2蛋白的表达均没影响。另外拉帕替尼和紫杉醇联合处理组与单独药物处理组相比,可明显抑制磷酸化AKT蛋白的表达,见图 5~6。
3 讨论
食管癌是临床上常见的消化道恶性肿瘤之一,由于患者的早期症状不明显或就诊不及时,确诊时大多处于晚期阶段。对于晚期或者有远处转移的患者常采用化疗,临床上常用的化疗药物有紫杉醇和顺铂。有临床数据表明,晚期食管癌患者在接受以铂类为基础的联合化疗药物治疗后表现出明显的不良反应,然而紫杉醇和埃罗替尼联合放疗却取得了良好的治疗效果[9]。因此,对于晚期肿瘤患者的治疗模式从传统的化疗药物转向化疗药物联合靶向药物治疗。靶向药物治疗是近几年的研究热点,抑制血管内皮生长因子的贝伐单抗,与卡培他滨和顺铂联合使用,一线治疗晚期胃癌患者,临床Ⅲ期实验结果表明接受贝伐单抗和化疗药物联合治疗患者的无进展生存期和总生存率高于其他患者[10]。以HER2为靶点的酪氨酸激酶抑制剂曲妥珠单抗(赫赛丁),用于治疗晚期胃癌患者,与化疗药物的联合使用与化疗药物单独使用相比可显著提高患者的总生存率[11]。
拉帕替尼是以EGFR、HER2为双靶点的酪氨酸激酶抑制剂,首次被批准是和卡培他滨联合治疗HER2阳性的晚期乳腺癌患者。随着对药物作用机制的进一步了解,拉帕替尼在结直肠癌、非小细胞肺癌、胃癌、食管癌的临床治疗中也展开了研究[12-15]。本研究主要比较拉帕替尼联合紫杉醇与二者单独使用时对食管癌EC109细胞的增殖、侵袭、周期和凋亡的影响并进一步探讨二者的联合作用机制。拉帕替尼、紫杉醇单独作用EC109细胞时,对其增殖抑制作用均呈剂量依赖性,而这种增殖抑制作用在联合药物处理中表现更加明显。在不同药物浓度联合处理下,联合作用指数q值均 > 1.15,说明拉帕替尼联合紫杉醇可协同抑制EC109细胞的增殖。拉帕替尼联合紫杉醇与单独药物处理组相比,可显著抑制EC109细胞侵袭。周期检测实验结果显示,拉帕替尼联合紫杉醇与单独药物处理组相比,可显著将细胞周期阻滞于G2/M期。拉帕替尼联合紫杉醇对EC109细胞的凋亡诱导作用强于单独药物处理组。经过对EGFR、HER2及其下游主要信号通路PI3K/AKT中关键蛋白AKT的检测,结果显示拉帕替尼联合紫杉醇可协同抑制p-EGFR、p-HER2蛋白的表达,且可抑制PI3K/AKT信号通路的转导。PI3K/AKT信号通路中活化的AKT可调节大量下游介质,参与细胞的存活和代谢过程[16]。
综上所述,EGFR、HER2双靶向药物拉帕替尼联合化疗药物紫杉醇可协同抑制食管癌细胞EC109的增殖、减弱细胞的侵袭能力、阻滞细胞周期于G2/M期、诱导细胞凋亡,以上作用可能与抑制EGFR、HER2及其下游PI3K/AKT信号通路的转导相关。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:吴 琼:实验实施及论文撰写马军燕:分析、解释数据、撰写文章董量、李春阳:采集、分析、解释数据及技术和材料支持王志武:审阅和指导文章 -
表 1 127例广泛期SCLC患者的一般临床资料
Table 1 General clinical data of 127 patients with ESSCLC

表 2 127例广泛期SCLC患者的中医证素情况
Table 2 Distribution of traditional Chinese medicine syndrome elements in 127 patients with ES-SCLC

表 3 127例广泛期SCLC患者的疗效评价
Table 3 Efficacy evaluation of 127 patients with ES-SCLC

表 4 127例广泛期SCLC患者预后的单因素分析结果
Table 4 Univariate analysis of prognosis of 127 patients with ES-SCLC

-
[1] Poirier JT, George J, Owonikoko TK, et al. New approaches to SCLC therapy: from the laboratory to the clinic[J]. J Thorac Oncol, 2020, 15(4): 520-540. doi: 10.1016/j.jtho.2020.01.016
[2] Dingemans A-M C, Früh M, Ardizzoni A, et al. Small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2021, 32(7): 839-853. doi: 10.1016/j.annonc.2021.03.207
[3] Gözel S, Sumbul A, Sedef AM, et al. Influence of Creatinine Clearance on Survival Parameters in Small Cell Lung Cancer Treated with Cisplatin-Based Chemotherapy Regimen: Topic: Drug Treatment Alone and in Combination with Radiotherapy[J]. J Thoracic Oncol, 2017, 12(1): s701-s702. doi: 10.1016/j.jtho.2016.11.921
[4] Li D, Wei G, Li L, et al. Bronchopleural fistula in squamous cell lung cancer following anlotinib treatment: A case report[J]. Mol Clin Oncol, 2019, 11(6): 595-598. http://www.xueshufan.com/publication/2981329240
[5] 中国医师协会肿瘤医师分会, 中国临床肿瘤学会血管靶向治疗专家委员会, 中国抗癌协会肿瘤靶向治疗专业委员会. 盐酸安罗替尼治疗晚期肺癌中国专家共识(2020版)[J]. 中华肿瘤杂志, 2020, 42(10): 807-816. Oncologist Branch of Chinese Medical Doctor Association, Expert Committee of Vascular Targeted Therapy of Chinese Society of Clinical Oncology, Professional Committee of Targeted Therapy of Cancer of Chinese Anti-Cancer Association. Chinese expert consensus on the treatment of advanced lung cancer by antirotinib hydrochloride (2020 edition)[J]. Zhonghua Zhong Liu Za Zhi, 2020, 42(10): 807-816.
[6] Zhang Y, Jia B, Li J, et al. Anlotinib in treatment of an elderly patient with recurrent advanced SCLC[J]. Tumori, 2020, 106(6): NP36-NP40. doi: 10.1177/0300891619900673
[7] 张国伟, 程瑞瑞, 牛媛媛, 等. 安罗替尼单药治疗89例老年广泛期小细胞肺癌的疗效和安全性分析[J]. 肿瘤学杂志, 2022, 28(6): 479-484. https://www.cnki.com.cn/Article/CJFDTOTAL-XHON202206007.htm Zhang GW, Cheng RR, Niu YY, et al. Efficacy and Safety of antirotinib in the treatment of 89 elderly patients with extensive small cell lung cancer[J]. Zhong Liu Xue Za Zhi, 2002, 28(6): 479-484. https://www.cnki.com.cn/Article/CJFDTOTAL-XHON202206007.htm
[8] 王静怡, 董量, 付浩宇, 等. 安罗替尼二三线治疗的广泛期小细胞肺癌患者预后分析[J]. 中国临床医生杂志, 2021, 49(1): 38-41. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLYS202101012.htm Wang JY, Dong L, Fu HY, et al. Prognosis analysis of patients with extensive small cell lung cancer treated with second or third line antirotinib[J]. Zhongguo Lin Chuang Yi Sheng Za Zhi, 2021, 49(1): 38-41. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLYS202101012.htm
[9] 卢美君, 赵燕仪, 康马飞. 影响安罗替尼临床疗效和预后的多因素分析[J]. 现代肿瘤医学, 2022, 30(10): 1831-1835. doi: 10.3969/j.issn.1672-4992.2022.10.023 Lu MJ, Zhao YY, Kang MF. Analysis of the factors influencing the clinical efficacy and prognosis of androtinib[J]. Xian Dai Zhong Liu Yi Xue, 2022, 30(10): 1831-1835. doi: 10.3969/j.issn.1672-4992.2022.10.023
[10] Li H, Liu Y, Liu X, et al. A novel multi-target tyrosine kinase inhibitor anlotinib combined with irinotecan has in-vitro anti-tumor activity against human small-cell lung cancer[J]. Anti-Cancer Drugs, 2020, 31(10): 1057-1064. doi: 10.1097/CAD.0000000000000969
[11] 中华人民共和国国家卫生健康委员会. 原发性肺癌诊疗指南(2022年版)[J]. 中国合理用药探索, 2022, 19(9): 1-28. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYS202209001.htm National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of primary lung cancer (2022 edition)[J]. Zhongguo He Li Yong Yao Tan Suo, 2022, 19(9): 1-28. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYS202209001.htm
[12] 朱文锋. 证素辨证学[M]. 第1版. 北京: 人民卫生出版社, 2008: 88-90. Zhu WF. Syndrome element Differentiation[M]. 1st Ed. Beijing: People's Medical Publishing House, 2008: 88-90.
[13] 王蓉, 申洹浣, 谢书阳, 等. 不同年龄组小细胞肺癌的临床特征与预后影响因素分析[J]. 中国医院统计, 2022, 29(4): 246-252, 256. https://www.cnki.com.cn/Article/CJFDTOTAL-JTYY202204002.htm Wang R, Shen HH, Xie SY, et al. Analysis of clinical features and prognostic factors of small cell lung cancer in different age groups[J]. Zhongguo Yi Yuan Tong Ji, 2022, 29(4): 246-252, 256. https://www.cnki.com.cn/Article/CJFDTOTAL-JTYY202204002.htm
[14] 中华人民共和国卫生部. 中药新药临床研究指导原则(试行)[M]. 北京: 中国医药科技出版社, 2002: 216-224. Ministry of Health of the People's Republic of China. Guidelines for clinical research of New Chinese Medicine (Trial)[M]. Beijing: China Medical Science and Technology Press, 2002: 216-224.
[15] 王晶, 李凯. 小细胞肺癌治疗中的抗血管生成药物研究进展[J]. 中华肿瘤杂志, 2020, 42(8): 624-628. https://www.cnki.com.cn/Article/CJFDTOTAL-FAIZ202101012.htm Wang J, Li K. Research progress of anti-angiogenic drugs in the treatment of small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2020, 42(8): 624-628. https://www.cnki.com.cn/Article/CJFDTOTAL-FAIZ202101012.htm
[16] Montanino A, Manzo A, Carillio G, et al. Angiogenesis inhibitors in small cell lung cancer[J]. Front Oncol, 2021, 11: 655316.
[17] Xu Q, Gu J, Lv Y, et al. Angiogenesis for tumor vascular normalization of Endostar on hepatoma 22 tumor-bearing mice is involved in the immune response[J]. Oncol Lett, 2018, 15(3): 3437-3446. doi: 10.3892/ol.2018.7734/download
[18] Rodríguez-Remírez M, del Puerto-Nevado L, Fernández-Aceñero MJ, et al. Targeting galectin-1 by aflibercept strongly enhances its antitumor effect in neuroendocrine carcinomas[J]. Neuroendocrinology, 2021, 111(1-2): 146-157. http://pubmed.ncbi.nlm.nih.gov/31991407/
[19] Gao X, Peng L, Zhang L, et al. Real-world efficacy and safety of anlotinib as third- or further-line treatment in refractory small cell lung cancer[J]. J Cancer Res Clin Oncol, 2022, 148(10): 2661-2671. doi: 10.1007/s00432-021-03848-4
[20] 肖琳, 王志武, 宣立功, 等. 晚期非小细胞肺癌安罗替尼治疗后中医证型与近期疗效相关性因素的分析[J]. 辽宁中医杂志, 2022, 49(9): 74-78. https://www.cnki.com.cn/Article/CJFDTOTAL-LNZY202209021.htm Xiao L, Wang ZW, Xuan LG, et al. Analysis of correlation factors between TCM syndrome type and short-term curative effect after treatment of advanced non-small cell lung cancer with antirotinib[J]. Liaoning Zhong Yi Za Zhi, 2022, 49(9): 74-78. https://www.cnki.com.cn/Article/CJFDTOTAL-LNZY202209021.htm
[21] 周卫东, 袁庆, 艾瑛, 等. 不同中医证型肺鳞癌患者的化疗疗效及其中医干预疗效[J]. 实用医学杂志, 2020, 36(5): 677-681. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYZ202005028.htm Zhou WD, Yuan Q, Ai Y, et al. Therapeutic effect of chemotherapy and TCM intervention in patients with lung squamous cell carcinoma with different TCM syndroms[J]. Shi Yong Yi Xue Za Zhi, 2020, 36(5): 677-681. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYZ202005028.htm
[22] 芦希艳, 姚家久, 赵宁侠. 中医辨证辅助化疗治疗非小细胞肺癌的临床疗效及对患者免疫功能和预后的影响[J]. 癌症进展, 2022, 20(8): 797-799, 804. https://www.cnki.com.cn/Article/CJFDTOTAL-AZJZ202208005.htm Lu XY, Yao JJ, Zhao NX. Clinical efficacy of TCM syndrome differentiation and adjuvant chemotherapy in the treatment of non-small cell lung cancer[J]. Ai Zheng Jin Zhan, 2002, 20(8): 797-799, 804. https://www.cnki.com.cn/Article/CJFDTOTAL-AZJZ202208005.htm
[23] Chen T, Tang M, Xu X, et al. Inflammation-based prognostic scoring system for predicting the prognosis of advanced small cell lung cancer patients receiving anlotinib monotherapy[J]. J Clin Lab Anal, 2022, 36(12): e24772.
[24] Wu D, Nie J, Hu W, et al. A phaseⅡ study of anlotinib in 45 patients with relapsed small cell lung cancer[J]. Int J Cancer, 2020, 147(12): 3453-3460. http://pubmed.ncbi.nlm.nih.gov/32557583/
-
期刊类型引用(1)
1. 贾蕊,郭雪君,乔晓芳. TENM3在胃癌组织中的表达及与其预后的相关性研究. 实用癌症杂志. 2024(10): 1588-1591 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: