LncRNA SBF2-AS1 Regulates Invasion and Proliferation of Hepatocellular Carcinoma Cells Through miR-372-3p/CDK6 Axis
-
摘要:目的
探讨长链非编码RNA SET结合因子2反义RNA1(lncRNA SBF2-AS1)调控miR-372-3p/细胞分裂蛋白激酶6(CDK6)轴对肝癌细胞侵袭及增殖的影响。
方法以Bel7402和SK-hep1细胞为研究对象,上调或下调SBF2-AS1、miR-372-3p及CDK6表达水平,实时荧光定量PCR及Western blot检测细胞中miR-372-3p及CDK6表达水平。双荧光素酶报告基因实验分别验证SBF2-AS1和miR-372-3p、miR-372-3p和CDK6靶向关系。CCK-8、集落形成实验、Transwell、细胞周期实验及流式细胞术分析细胞增殖、集落形成、迁移/侵袭能力、细胞周期活动及凋亡。
结果SBF2-AS1在肝癌细胞中高表达(P<0.05)。敲降SBF2-AS1后,Bel7402和SK-hep1细胞侵袭、增殖能力降低(P<0.05)。敲降miR-372-3p后,Bel7402细胞侵袭、增殖能力升高,同时敲降SBF2-AS1后,可反转上述效应(P<0.05)。miR-372-3p靶向CDK6并抑制后者的表达,过表达SFB2-AS1,可反转上述效应(P<0.05)。过表达CDK6,可以逆转过表达miR-372-3p对Bel7402细胞侵袭及增殖的抑制。
结论lncRNA SBF2-AS1通过miR-372-3p正向调控CDK6的表达,改变肝癌细胞的周期活动,影响肝癌细胞的增殖、侵袭能力。
-
关键词:
- 长链非编码RNA SET结合因子2反义RNA1 /
- miR-372-3p /
- 细胞分裂蛋白激酶6 /
- 肝癌
Abstract:ObjectiveTo investigate the effects of lncRNA SBF2-AS1 on the proliferation and invasion of hepatoma cells by regulating the miR-372-3p/CDK6 pathway.
MethodsBel7402 and SK-hep1 cells were selected as research objects. The expression levels of SBF2-AS1, miR-372-3p, and CDK6 were up- or down-regulated according to different experimental stages, while the expression levels of miR-372-3p and CDK6 in cells were detected by real-time fluorescence quantitative PCR and Western blot. Dual luciferase reporter assay verified the targeting relationships between SBF2-AS1 and miR-372-3p as well as miR-372-3p and CDK6, respectively. CCK-8, colony formation assay, Transwell, cell cycle assay, and flow cytometry were used to analyze cell proliferation, colony formation, migration/invasion ability, cell cycle activity, and apoptosis.
ResultsSBF2-AS1 was highly expressed in hepatocellular carcinoma cells (P<0.05). SBF2-AS1 knockdown resulted in decreased proliferation and invasion of Bel7402 and SK-hep1 cells (P<0.05). After miR-372-3p knockdown, the proliferation capacity and invasion number of Bel7402 cells were significantly increased. However, the above results were reversed after SBF2-AS1 knockdown (P<0.05). In addition, miR-372-3p targeted CDK6 and inhibited its expression, although over-expressing SFB2-AS1 could reverse the above results (P<0.05). Over-expressing CDK6 could reverse the inhibition of over-expressing miR-372-3p on the proliferation and invasion of Bel7402 cells.
ConclusionLncRNA SBF2-AS1 can positively regulate the expression of CDK6 through miR-372-3p. It can also influence the distribution of cell cycle and affect the proliferation and invasion abilities of hepatocellular carcinoma cells.
-
Key words:
- SBF2-AS1 /
- miR-372-3p /
- CDK6 /
- Liver cancer
-
0 引言
原发性肝癌是全球发病率第五、死亡率第三的恶性肿瘤[1],中国肝癌的发病率及病死率远高于世界平均水平。据统计,全球新发病例和死亡病例,有一半在中国[2]。肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌的主要类型,占原发性肝癌的75%~85%[3]。尽管近几十年来,HCC的治疗得到了较大发展,但由于HCC具有发病隐匿、易转移、易复发以及对化疗和放疗不敏感等特点[4],致使HCC患者总体治疗效果未得到明显改善。HCC是多基因、多因素变化所致的疾病,其发生发展包括关键生长调节基因的遗传和表观遗传转化等复杂过程[5]。为此,从基因调控角度探究HCC的发生发展机制,对该领域的基础研究及临床应用具有重要价值[6]。
长链非编码RNA(long non-coding RNA, lncRNA)和微小RNA(microRNA, miRNA)是两类小分子非编码RNA,均参与调控细胞的增殖、凋亡、分化等生命过程[7-8]。lncRNA作为内源性竞争性RNA与miRNA相互作用,调控靶基因的表达,从而影响肿瘤的发生发展[9]。研究表明,lncRNA对染色质结构、基因表达和翻译的调控至关重要[10-11],lncRNA可能在转录、转录后和表观遗传水平上调节关键的癌症途径[12]。
SET结合因子2反义RNA1(SET binding factor 2 antisense RNA 1, SBF2-AS1)是近年来新发现的一种lncRNA,在多种肿瘤中高表达[13],参与调控肿瘤的发生发展、放化疗敏感度及预后等,是肿瘤生物标志物和治疗的潜在分子靶点[14-16]。SBF2-AS1在HCC细胞中的表达及其对HCC的调控机制尚不明确。本研究以miR-372-3p/CDK6轴为切入点,探讨SBF2-AS1对HCC细胞增殖、凋亡及侵袭等活动的影响及机制,以期为HCC的诊断及分子治疗提供依据。
1 材料与方法
1.1 细胞系
正常人肝细胞系HL-7702和HCC细胞系HepG2、Hep3B、SMMC-7721、Bel7402及SK-hep1均购自中国科学院上海细胞库。
1.2 主要试剂
DMEM培养基购自武汉益普生物科技有限公司;胎牛血清(FBS)购自广州蕊特生物科技有限公司;细胞计数试剂盒8(CCK-8)购自碧云天生物技术公司,LipofectamineTM 2000试剂盒购自上海恒斐生物科技有限公司;SYBR Premix Ex Taq购自北京智杰方远科技有限公司;FITC-Annexin Ⅴ细胞凋亡试剂盒及双荧光素酶活性试剂盒购自北京索莱宝科技有限公司;cycle TEST PLUS DNA试剂盒购自美科美(北京)生物医学科技中心;Transwell小室购自美国Corning公司;TRIzol试剂、反转录试剂盒和聚合酶链反应(PCR)试剂盒购自深圳晶美生物工程有限公司;SBF2-AS1小干扰RNA(si-SBF2-AS1)、乱序无意义阴性序列(si-NC)、miR-372-3p模拟物(miR-372-3p mimics)、模拟对照序列(mimics-NC)、miR-372-3p抑制剂(miR-372-3p inhibitor)、抑制剂对照序列(inhibitor-NC)、SBF2-AS1过表达载体(pcDNA3.1-SBF2-AS1)、CDK6过表达载体(pcDNA3.1-CDK6)及阴性对照(pcDNA3.1)、双荧光酶素载体均购自上海吉玛制药技术有限公司;兔源CDK6、β-actin一抗及辣根过氧化物酶标记的羊抗鼠二抗均购自美国Abcam公司;PCR引物由武汉华联科生物技术有限公司设计并合成。
1.3 实验方法
1.3.1 细胞培养
HL-7702细胞、HepG2、Hep3B、SMMC-7721、Bel7402及SK-hep1细胞均用含10%FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基,在恒温箱(37℃、5%CO2)内持续培养。取对数生长期的Bel7402及SK-hep1细胞,根据不同实验阶段,分为si-NC组、si-SBF2-AS1组、mimics-NC组、miR-372-3P mimics组、inhibitor-NC+si-NC组、inhibitor-NC+si-SBF2-AS1组、miR-372-3P inhibitor+si-NC组、miR-372-3P inhibitor+si-SBF2-AS1组、mimics-NC+pcDNA3.1组、mimics-NC+pcDNA3.1-CDK6组、miR-372-3P mimics+pcDNA3.1组、miR-372-3p mimics+pcDNA3.1-CDK6组。LipofectamineTM 2000转染试剂进行转染,转染48 h后,收集细胞进行后续实验。
1.3.2 qPCR检测相关分组细胞中SBF2-AS1、miR-372-3p的表达
TRIzol试剂法从转染后的细胞中提取总RNA,反转录合成cDNA,根据SYBR Premix Ex Taq说明书进行qPCR,通过2-△△Ct方法计算SBF2-AS1、miR-372-3p的相对表达量。
1.3.3 CCK-8法检测Bel7402及SK-hep1细胞的增殖能力
将转染后的细胞以5×103个/孔接种在96孔板中,在37℃、5%CO2含10%胎牛血清的DMEM培养基中培养48 h。向每孔加入10 μl CCK-8溶液,继续培养1 h。酶标仪在450 nm波长处测量各吸光度(OD)值。
1.3.4 集落形成实验
将各组细胞接种于6孔板(500个/孔),于37℃、5%CO2培养箱中培养14天,弃培养基,用预冷的PBS洗涤后加入500 μl甲醇固定20 min(–20℃),加入400 μl 1%结晶紫染色液染色15 min(37℃),随后显微镜(200倍)对其进行观察,记录L>0.1 mm(L为细胞的直径)的细胞克隆形成数。
1.3.5 Transwell实验检测Bel7402及SK-hep1细胞的侵袭及迁移能力
迁移实验:收集转染及处理后的各组细胞,将细胞加入上室(每孔200 μl),下室加入600 μl的10%胎牛血清培养液,培养24 h。培养完毕后取出上室,于37℃使用4%多聚甲醛固定20 min,0.1%结晶紫染色10 min,PBS清洗后,在电子显微镜下观察并拍照,计算迁移细胞数。侵袭实验:具体步骤与迁移实验相同,但在加入细胞前,预先在上室表面铺满基底胶。
1.3.6 细胞周期实验
Cycle TEST PLUS DNA试剂盒对细胞进行碘化丙啶染色后,流式细胞仪进行细胞周期检测,FACScan软件进行分析。
1.3.7 流式细胞仪检测细胞凋亡
胰蛋白酶法获取细胞。FITC-Annexin Ⅴ和碘化丙啶双重染色后,使用FITC-Annexin Ⅴ凋亡检测试剂盒、流式细胞仪进行细胞凋亡检测。
1.3.8 双荧光素酶报告基因实验验证SBF2-AS1与miR-372-3p及miR-372-3p与CDK6的靶向关系
分别构建SBF2-AS1野生型质粒(SBF2-AS1-WT)和突变型质粒(SBF2-AS1-MUT),LipofectamineTM2000转染试剂盒将SBF2-AS1-WT和SBF2-AS1-MUT分别与mimics-NC及miR-372-3p mimics转染Bel7402细胞,转染48 h后,双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
分别构建CDK6野生型质粒(CDK6-WT)和突变型质粒(CDK6-MUT),LipofectamineTM2000转染试剂盒将CDK6-WT和CDK6-MUT分别与mimics-NC及miR-372-3p mimics转染Bel7402细胞,转染48 h后,双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.3.9 Western blot检测Bel7402细胞系中CDK6的表达
利用RIPA裂解缓冲液裂解转染后的细胞并提取总蛋白,经电泳、转膜、封闭后,加入一抗CDK6(1:1 000)、β-actin(1:1 000)抗体在4℃下处理过夜。TBST洗涤3次,加入二抗(羊抗鼠IgG-HRP抗体,1:3 000)室温处理1 h。TBST洗涤后,化学发光法进行显影,Image J软件量化蛋白条带灰度值并计算CDK6相对表达量。
1.4 统计学方法
以上所有试验均独立重复三遍,用SPSS21.0软件进行统计学分析,GraphPad8.0软件进行绘图。所有数据均以(x±s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 SBF2-AS1在肝癌各细胞系中的表达
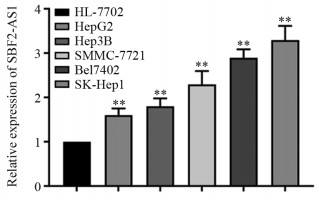
qPCR检测结果显示,与正常肝细胞HL-7702相比,HCC细胞HepG2、Hep3B、SMMC-7721、Bel7402及SK-hep1中SBF2-AS1呈高表达,其中以Bel7402和SK-hep1细胞中表达最高(P=0.000, P=0.000),见图 1。因此,后续以Bel7402和SK-hep1细胞为研究对象。
2.2 敲降SBF2-AS1后细胞侵袭、增殖情况
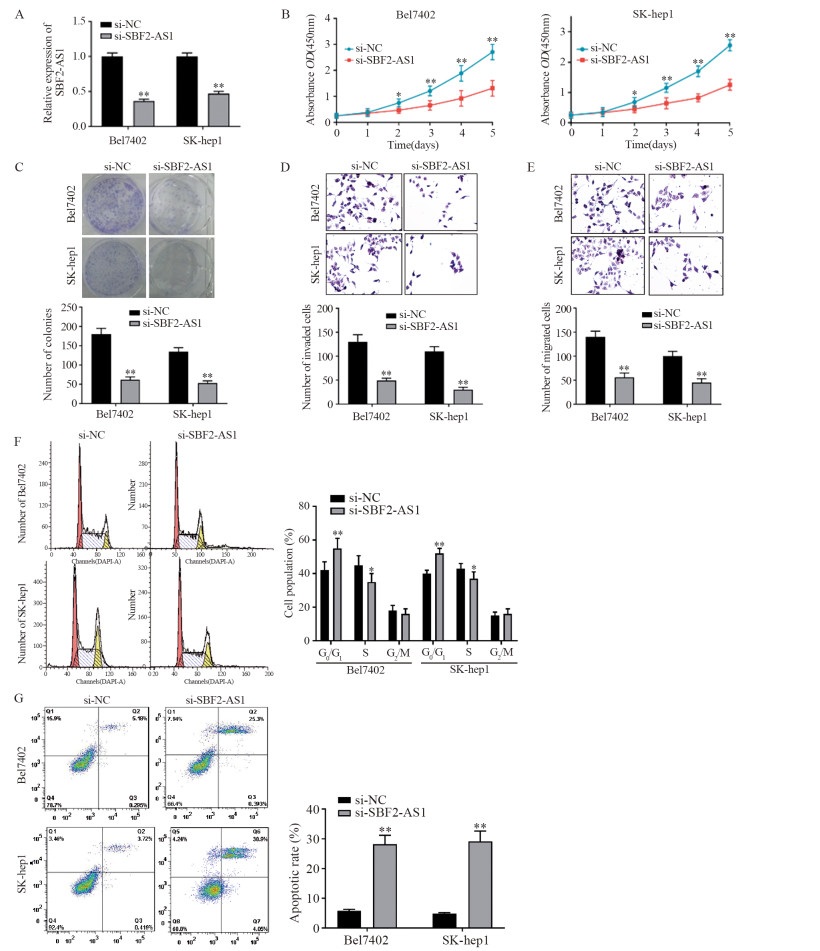
结果显示,si-SBF2-AS1组细胞增殖能力、集落形成数、迁移及侵袭细胞数均低于si-NC组;si-SBF2-AS1组细胞相较si-NC组,滞留于G0/G1期细胞比例增加,且细胞凋亡增高(均P<0.05),见图 2。
![]() 图 2 敲降SBF2-AS1后对Bel7402及SK-hep1细胞的影响Figure 2 Effect of SBF2-AS1 knockdown on Bel7402 and SK-hep1 cells*: P<0.05, **: P=0.000, compared with si-NC group. A: knockdown efficiency of SBF2-AS1 in Bel7402 and SK-hep1 cells; B: comparison of cell proliferation ability after decreasing SBF2-AS1 expression in Bel7402 and SK-hep1 cells; C: comparison of cell colony formation after inhibiting SBF2-AS1 expression in Bel7402 and SK-hep1 cells; D-E: effects of SBF2-AS1 knockdown on the invasion (D) and migration (E) of Bel7402 and SK-hep1 cells detected by Transwell assay; F: effects of inhibiting SBF2-AS1 expression on the cell cycles of Bel7402 and SK-hep1 cells; G: effects of inhibiting SBF2-AS1 expression on the apoptosis of Bel7402 and SK-hep1 cells.
图 2 敲降SBF2-AS1后对Bel7402及SK-hep1细胞的影响Figure 2 Effect of SBF2-AS1 knockdown on Bel7402 and SK-hep1 cells*: P<0.05, **: P=0.000, compared with si-NC group. A: knockdown efficiency of SBF2-AS1 in Bel7402 and SK-hep1 cells; B: comparison of cell proliferation ability after decreasing SBF2-AS1 expression in Bel7402 and SK-hep1 cells; C: comparison of cell colony formation after inhibiting SBF2-AS1 expression in Bel7402 and SK-hep1 cells; D-E: effects of SBF2-AS1 knockdown on the invasion (D) and migration (E) of Bel7402 and SK-hep1 cells detected by Transwell assay; F: effects of inhibiting SBF2-AS1 expression on the cell cycles of Bel7402 and SK-hep1 cells; G: effects of inhibiting SBF2-AS1 expression on the apoptosis of Bel7402 and SK-hep1 cells.2.3 LncBase Predicted v.2预测lncRNA SBF2-AS1与miR-372-3p之间的靶向关系
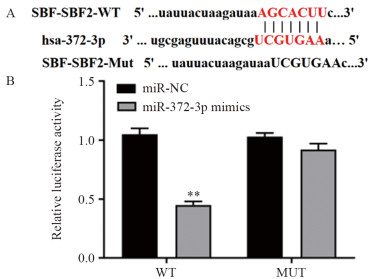
lncRNA SBF2-AS1与miR-372-3p之间存在结合位点,见图 3。双荧光素酶报告基因检测结果显示,WT中,与miR-NC组相比,miR-372-3p mimics组的荧光素酶活性显著降低(P=0.000);MUT中,miR-372-3p mimics组与miR-NC组比较,荧光素酶活性差异无统计学意义(P>0.05),说明SBF2-AS1的3'UTR存在miR-372-3p的结合位点。
2.4 lncRNA SBF2-AS1与miR-372-3p的调控关系
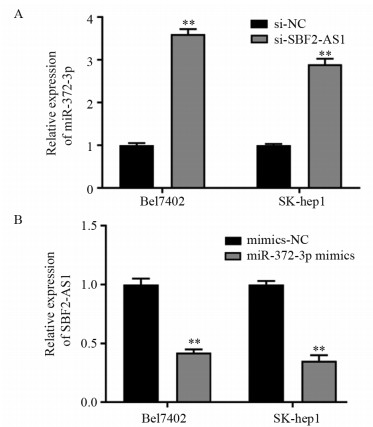
qPCR法结果显示,与si-NC组相比,si-SBF2-AS1组中Bel7402和SK-hep1细胞中miR-372-3p表达量明显增高(均P=0.000);与mimics-NC组对比,miR-372-3p mimics组中Bel7402和SK-hep1细胞中SBF2-AS1的表达量明显降低(均P=0.000),见图 4。结果提示二者在Bel7402和SK-hep1细胞系中呈负相关,SBF2-AS1可以靶向负调控miR-372-3p的表达,miR-372-3p也可以负调控SBF2-AS1的表达。
![]() 图 4 Bel7402和SK-hep1细胞中lncRNA SBF2-AS1负向调控miR-372-3p表达Figure 4 LncRNA SBF2-AS1 negatively regulated miR-372-3p expression in Bel7402 and SK-hep1 cells**: P=0.000, compared with si-NC or mimics-NC group; A: expressions of miR-372-3p in Bel7402 and SK-hep1 cells after SBF2-AS1 knockdown; B: expressions of SBF2-AS1 in Bel7402 and SK-hep1 cells after over-expressing miR-372-3p.
图 4 Bel7402和SK-hep1细胞中lncRNA SBF2-AS1负向调控miR-372-3p表达Figure 4 LncRNA SBF2-AS1 negatively regulated miR-372-3p expression in Bel7402 and SK-hep1 cells**: P=0.000, compared with si-NC or mimics-NC group; A: expressions of miR-372-3p in Bel7402 and SK-hep1 cells after SBF2-AS1 knockdown; B: expressions of SBF2-AS1 in Bel7402 and SK-hep1 cells after over-expressing miR-372-3p.2.5 敲降miR-372-3p后Bel7402细胞侵袭、增殖情况
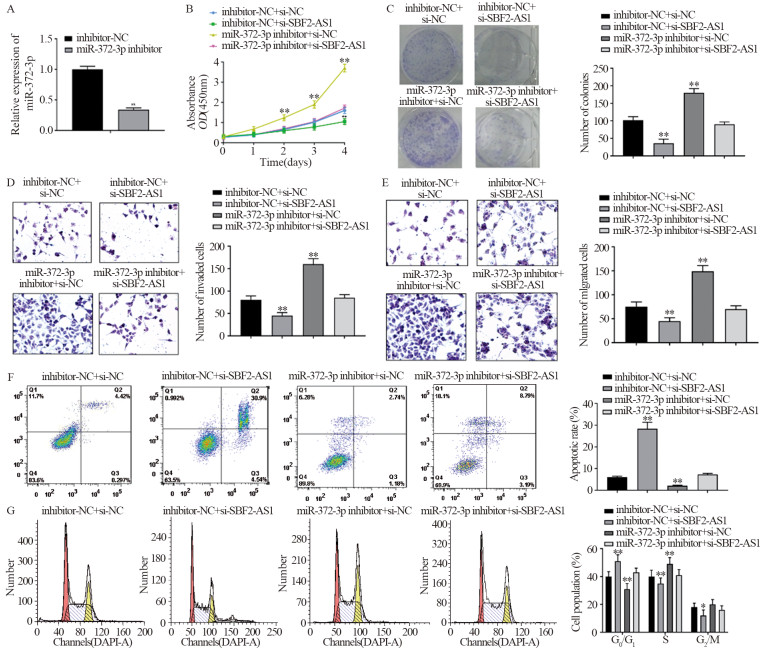
结果显示,miR-372-3p inhibitor组miR-372-3p表达明显降低(P<0.001),见图 5。与inhibitor-NC+si-NC组对比,miR-372-3p inhibitor+si-NC组细胞增殖能力、集落形成数、迁移及侵袭细胞数均明显增高,滞留于G0/G1期比例减少,且细胞凋亡降低,而同时敲降SBF2-AS1后,可反转上述结果。inhibitor-NC+si-SBF2-AS1组相较于inhibitor-NC+si-NC组,前者细胞增殖能力、集落形成数、迁移及侵袭细胞数均明显减少,滞留于G0/G1期细胞比例增加,且细胞凋亡增加,而同时敲降miR-372-3p后,可以反转上述结果(均P<0.05),见图 5。
![]() 图 5 敲降miR-372-3p表达后对Bel7402细胞的影响Figure 5 Effect of miR-372-3p knockdown on Bel7402 cells*: P<0.01, **: P=0.000, compared with inhibitor-NC+si-NC group. A: efficiency of miR-372-3p inhibitor knocking down miR-372-3p in Bel7402 cells; B: comparison of proliferation ability of Bel7402 cells; C: comparison of cell colony formation of Bel7402 cells; D-E: effects of miR-372-3p inhibitor knockdown on the invasion (D) and migration (E) of Bel7402 cells detected by Transwell assay; F: effect of miR-372-3P inhibitor and si-SBF2-AS1 on the cell cycle of Bel7402 cells; G: effect of miR-372-3P inhibitor and si-SBF2-AS1 on the apoptosis of Bel7402 cells.
图 5 敲降miR-372-3p表达后对Bel7402细胞的影响Figure 5 Effect of miR-372-3p knockdown on Bel7402 cells*: P<0.01, **: P=0.000, compared with inhibitor-NC+si-NC group. A: efficiency of miR-372-3p inhibitor knocking down miR-372-3p in Bel7402 cells; B: comparison of proliferation ability of Bel7402 cells; C: comparison of cell colony formation of Bel7402 cells; D-E: effects of miR-372-3p inhibitor knockdown on the invasion (D) and migration (E) of Bel7402 cells detected by Transwell assay; F: effect of miR-372-3P inhibitor and si-SBF2-AS1 on the cell cycle of Bel7402 cells; G: effect of miR-372-3P inhibitor and si-SBF2-AS1 on the apoptosis of Bel7402 cells.2.6 miR-372-3p和CDK6有靶定位点
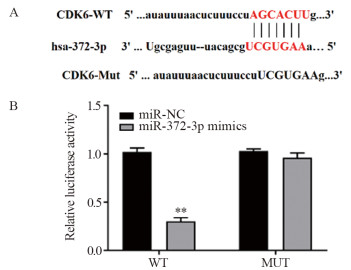
Starbase网预测发现,miR-372-3p与CDK6存在结合位点,见图 6。双荧光素酶报告基因检测结果显示,WT中,与miR-NC组相比,miR-372-3p mimics组的荧光素酶活性显著降低(P=0.000);MUT中,miR-372-3p mimics组与miR-NC组比较,荧光素酶活性差异无统计学意义(P>0.05),说明CKD6的3'UTR存在miR-372-3p的结合位点。
2.7 miR-372-3p负向调控CDK6 mRNA
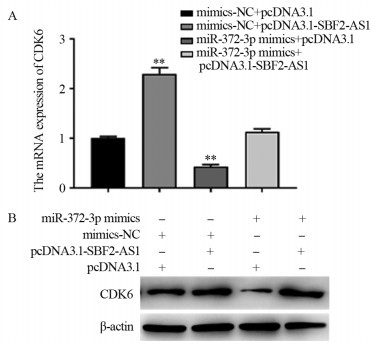
结果显示,与mimics-NC+pcDNA3.1组相比,miR-372-3p mimics+pcDNA3.1组细胞CDK6表达量明显降低(P=0.000),而miR-372-3p mimics+ pcDNA3.1-SFB2-AS1组细胞CDK6表达量高于前两组(P=0.020),见图 7。结果提示miR-372-3p和CDK6在Bel7402细胞中可能呈一种负相关关系,且SBF2-AS1过表达后,可以缓解过表达miR-372-3p对CDK6的效应。
2.8 过表达miR-372-3p后Bel7402细胞侵袭、增殖情况
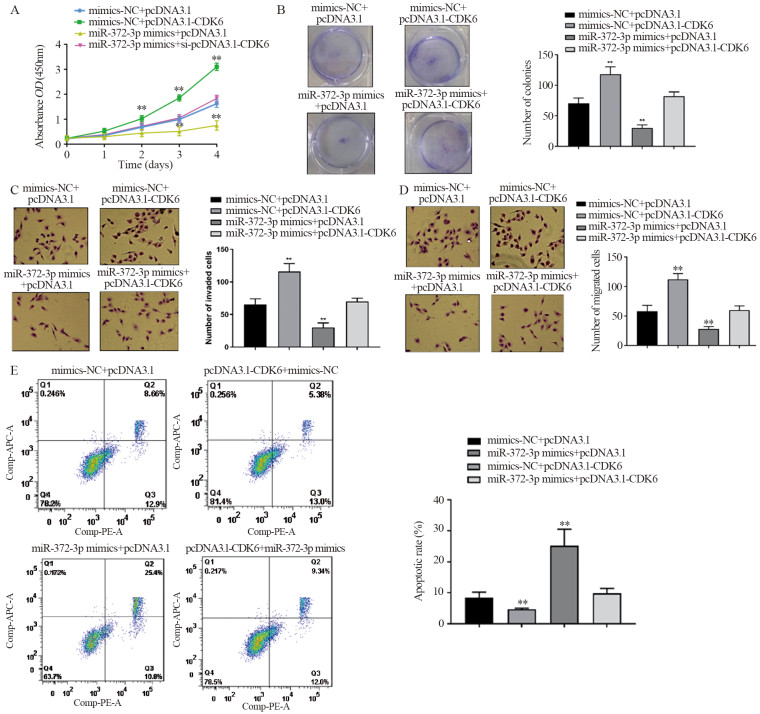
与mimics-NC+pcDNA3.1组对比,miR-372-3p mimics+pcDNA3.1组细胞增殖能力、集落形成数、迁移及侵袭细胞数均明显降低,且细胞凋亡增高;而miR-372-3p mimics+pcDNA3.1-CDK6组细胞增殖能力、集落形成数、迁移及侵袭细胞数均高于miR-372-3p mimics+pcDNA3.1组,细胞凋亡低于miR-372-3p mimics+pcDNA3.1组(P=0.000、0.000、0.000、0.000、0.000),见图 8。与mimics-NC+pcDNA3.1组比较,mimics-NC+pcDNA3.1-CDK6组细胞增殖能力、集落形成数、迁移及侵袭细胞数均明显增高,细胞凋亡减低;而miR-372-3p mimics+pcDNA3.1-CDK6组细胞增殖能力、集落形成数、迁移及侵袭细胞数均低于mimics-NC+pcDNA3.1-CDK6组,细胞凋亡高于mimics-NC+pcDNA3.1-CDK6组(P=0.000、0.000、0.000、0.000、0.004),见图 8。
![]() 图 8 过表达miR-372-3p对Bel7402细胞的影响Figure 8 Effect of over-expressing miR-372-3p on Bel7402 cells**: P<0.01, compared with mimics-NC+pcDNA3.1 group. A: comparison of cell proliferation of Bel7402 cells; B: comparison of cell colony formation of Bel7402 cells; C-D: effects of miR-372-3p mimics and pcDNA3.1-CDK6 on the invasion (C) and migration (D) of Bel7402 cells detected by Transwell assay; E: effects of miR-372-3p mimics and pcDNA3.1-CDK6 on the apoptosis of Bel7402 cells.
图 8 过表达miR-372-3p对Bel7402细胞的影响Figure 8 Effect of over-expressing miR-372-3p on Bel7402 cells**: P<0.01, compared with mimics-NC+pcDNA3.1 group. A: comparison of cell proliferation of Bel7402 cells; B: comparison of cell colony formation of Bel7402 cells; C-D: effects of miR-372-3p mimics and pcDNA3.1-CDK6 on the invasion (C) and migration (D) of Bel7402 cells detected by Transwell assay; E: effects of miR-372-3p mimics and pcDNA3.1-CDK6 on the apoptosis of Bel7402 cells.3 讨论
近年来,诸多lncRNA被证实在肝癌的发生发展过程中起着重要作用[17]。Lee等[18]在一项前瞻性研究中发现,肝癌患者外周血lncRNA-ATB水平与肝癌TNM分期、门静脉血栓形成等因素相关,是病死率及疾病进展的独立预测因子。张锦等[19]研究表明,lncRNA PCAT6可能与肝癌患者的Edmondson分级、TNM分级及淋巴结转移相关,并证实lncRNA PCAT6是潜在的预后预测因子。
lncRNA SBF2-AS1是一种近年来新发现的lncRNA,位于染色体11p15.1位点,是SBF2的一个2708nt的反义RNA[20]。目前认为,SBF2-AS1参与调控了多个肿瘤的生物过程。研究[21]表明,SBF2-AS1在结直肠癌细胞中的表达上调,抑制了miR⁃619-5p的活性并导致HDAC3过表达,促进结直肠癌细胞增殖、侵袭和迁移。Dai等[22]发现SBF2-AS1可通过竞争性抑制miR-30a来靶向调节叉头框蛋白家族成员A1表达,促进骨肉瘤增殖、侵袭和迁移,发挥促癌作用。Chen等[15]发现,SBF2-AS1在食管鳞癌细胞Eca109中高表达,沉默SBF2-AS1后,细胞增殖、集落形成、侵袭和迁移能力均显著受到抑制。目前,SBF2-AS1对HCC细胞调控的影响尚不明确。本研究证实SBF2-AS1在HCC细胞中高表达,说明SBF2-AS1参与调控HCC细胞的发生发展,可能是HCC诊断及治疗潜在的分子靶点。
LncRNA作为内源性竞争性RNA,可通过海绵吸附作用抑制miRNA调控基因表达,进而调控肿瘤的生物过程[23]。如lncRNA OIP5-AS1可通过miR-372-3p/USP7轴影响肝癌细胞EMT及侵袭迁移[24]。Wu等[25]研究表明,lncRNA SUMO1P3可通过靶向结合miR-320a而活化Wnt/β-catenin信号通路,进而促进HCC细胞的增殖与侵袭。本研究通过生物信息学软件预测显示,lncRNA SBF2-AS1与miR-372-3p的核苷酸序列存在结合位点。双荧光素酶活性报告基因实验证实,SBF2-AS1可能与miR-372-3p靶向结合。在HCC细胞中,过表达miR-372-3p可以抑制SBF2-AS1的表达,而敲降SBF2-AS1后,则可以使miR-372-3p的表达增高,提示二者存在一种负向调控的关系。
研究[26]表明,miR-372可调节许多肿瘤的细胞周期、凋亡、侵袭和增殖。另有研究表明,miR-372可能在非小细胞肺癌患者中转录后下调大肿瘤抑制基因2,从而导致肿瘤发生和增殖[27]。此外,miR-372-3p在肺鳞状细胞癌、乳腺癌等恶性肿瘤中高表达,可显著促进肿瘤细胞的生长和转移[28-29]。本研究结果提示miR-372-3p作为抑癌基因参与HCC的调控。敲降miR-372-3p后的各项结果,可同时被敲降SBF2-AS1所反转,提示SBF2-AS1通过负向调控miR-372-3p的表达,参与调控HCC细胞的发生发展。
本研究结果提示,在Bel7402细胞系中,miR-372-3p表达上调后,CDK6表达降低,提示miR-372-3p靶向并负向调控CDK6的表达。进一步研究证实,在Bel7402细胞中,过表达SBF2-AS1可以缓解因miR-372-3p表达上调所致的CDK6表达降低,提示SBF2-AS1可以通过对miR-372-3p的海绵吸附作用,调控CDK6的表达。
细胞分裂蛋白激酶6(CDK6)是细胞周期蛋白D蛋白和细胞周期蛋白依赖性激酶抑制蛋白,属于CDC2相关激酶家族中一员,具有丝/苏氨酸激酶活性,是关键的细胞周期调控因子,其与CDK4发挥协同作用,促进细胞周期由G1期向S期转变[30]。相关研究表明,CDK6在大多数肿瘤中呈高表达,具有抑制肿瘤细胞凋亡、促进肿瘤血管生成等作用,与肿瘤的发生发展相关[31-32]。Li等[33]研究表明,DDX11-AS1可以通过增加CDK6的表达,从而促进膀胱癌的进展。He等[34]通过体内外试验证实,NEAT1通过miR-495-3p/CDK6轴促进结肠癌进展。细胞周期调节失控是人类癌症的共同特征,本研究中lncRNA SBF2-AS1和miR-372-3p结合位点与miR-372-3p和CDK6结合位点一致,提示lncRNA SBF2-AS1通过对miR-372-3p的海绵吸附作用,调控CDK6的表达,从而影响Bel7402细胞的周期活动,导致细胞的增殖、集落形成、迁移、侵袭及凋亡的改变。
本研究结果提示,lncRNA SBF2-AS1的表达量高于人正常肝细胞。受实验条件所限,本研究仅选取lncRNA SBF2-AS1表达量增高最为明显的细胞系行进一步研究,故SBF2-AS1是否通过miR-372-3p/CDK6轴影响肝炎相关肝癌细胞系的生物活性,还有待于进一步的研究。
综上所述,本研究推断lncRNA SBF2-AS1海绵吸附miR-372-3p上调CDK6的表达,通过影响细胞周期活动,促进HCC细胞增殖、迁移及侵袭等。本研究可能为新的肝癌诊断及靶向治疗提供实验依据。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:宋巍:课题设计、实验操作、文章撰写及修改徐蓉:实验指导、文献汇总分析李玉鹏、李智德、王锦国、马超:文献检索及筛查孟塬:课题指导陈雄:确定研究方向、文章修改指导 -
-
[1] 曹毛毛, 陈万青. GLOBOCAN 2020全球癌症统计数据解读[J]. 中国医学前沿杂志(电子版), 2021, 13(3): 63-69. https://www.cnki.com.cn/Article/CJFDTOTAL-YXQY202103010.htm Cao MM, Chen WQ. Interpretation on the global cancer statistics of GLOBOCAN 2020[J]. Zhongguo Yi Xue Qian Yan Za Zhi (Dian Zi Ban), 2021, 13(3): 63-69. https://www.cnki.com.cn/Article/CJFDTOTAL-YXQY202103010.htm
[2] 刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-13. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLZD202102001.htm Liu ZC, Li ZX, Zhang Y, et al. Interpretation on the report of Global Cancer Statistics 2020[J]. Zhong Liu Zong He Zhi Liao Dian Zi Za Zhi, 2021, 7(2): 1-13. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLZD202102001.htm
[3] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. doi: 10.3322/caac.21492
[4] Hartke J, Johnson M, Ghabril M. The diagnosis and treatment of hepatocellular carcinoma[J]. Semin Diagn Pathol, 2017, 34(2): 153-159. doi: 10.1053/j.semdp.2016.12.011
[5] Forner A, Reig M, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-1314. doi: 10.1016/S0140-6736(18)30010-2
[6] Luo Q, Wang CQ, Yang LY, et al. FOXQ1/NDRG1 axis exacerbates hepatocellular carcinoma initiation via enhancing crosstalk between fibroblasts and tumor cells[J]. Cancer Lett, 2018, 417: 21-34. doi: 10.1016/j.canlet.2017.12.021
[7] Shen Y, Xu J, Pan X, et al. LncRNA KCNQ1OT1 sponges miR-34c-5p to promote osteosarcoma growth via ALDOA enhanced aerobic glycolysis[J]. Cell Death Dis, 2020, 11(4): 278. doi: 10.1038/s41419-020-2485-1
[8] Feng J, Guo J, Wang JP, et al. MiR-129-5p inhibits proliferation of gastric cancer cells through targeted inhibition on HMGB1 expression[J]. Eur Rev Med Pharmacol Sci, 2020, 24(7): 3665-3673.
[9] Wang SY, Wang X, Zhang CY. LncRNA SNHG7 enhances chemoresistance in neuroblastoma through cisplatin-induced autophagy by regulating miR-329-3p/MYO10 axis[J]. Eur Rev Med Pharmacol Sci, 2020, 24(7): 3805-3817.
[10] Zhang X, Gejman R, Mahta A, et al. Maternally expressed gene 3, an imprinted noncoding RNA gene, is associated with meningioma pathogenesis and progression[J]. Cancer Res, 2010, 70(6): 2350-2358. doi: 10.1158/0008-5472.CAN-09-3885
[11] Gutschner T, Diederichs S. The hallmarks of cancer: a long non-coding RNA point of view[J]. RNA Biol, 2012, 9(6): 703-719. doi: 10.4161/rna.20481
[12] Su K, Wang N, Shao Q, et al. The role of a ceRNA regulatory network based on lncRNA MALAT1 site in cancer progression[J]. Biomed Pharmacother, 2021, 137: 111389. doi: 10.1016/j.biopha.2021.111389
[13] 李晓敏, 查文娟, 铁小伟, 等. LncRNA SBF2-AS1在恶性肿瘤中的作用及其机制[J]. 现代肿瘤医学, 2021, 29(18): 3290-3294. https://www.cnki.com.cn/Article/CJFDTOTAL-SXZL202118034.htm Li XM, Zha WJ, Tie XW, et al. The role of LncRNA SBF2-AS1 in malignant tumor and its mechanism[J]. Xian Dai Zhong Liu Yi Xue, 2021, 29(18): 3290-3294. https://www.cnki.com.cn/Article/CJFDTOTAL-SXZL202118034.htm
[14] Zhang Q, Pan X, You D. Overexpression of long non-coding RNA SBF2-AS1 promotes cell progression in esophageal squamous cell carcinoma (ESCC) by repressing miR-494 to up-regulate PFN2 expression[J]. Biol Open, 2020, Online ahead of print.
[15] Chen R, Xia W, Wang X, et al. Upregulated long non-coding RNA SBF2-AS1 promotes proliferation in esophageal squamous cell carcinoma[J]. Oncol Lett, 2018, 15(4): 5071-5080.
[16] Gao F, Feng J, Yao H, et al. LncRNA SBF2-AS1 promotes the progression of cervical cancer by regulating miR-361-5p/FOXM1 axis[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 776-782. doi: 10.1080/21691401.2019.1577883
[17] 李菠, 吕明, 周帅. 长链非编码RNA HOXA11-AS在肝癌组织中的表达及临床意义[J]. 肿瘤防治研究, 2020, 47(8): 607-610. doi: 10.3971/j.issn.1000-8578.2020.19.1503 Li B, Lyu M, Zhou S. Expression and Clinical Significance of lnc RNA HOXA11-AS in Hepatocellular Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(8): 607-610. doi: 10.3971/j.issn.1000-8578.2020.19.1503
[18] Lee YR, Kim G, Tak WY, et al. Circulating exosomal noncoding RNAs as prognostic biomarkers in human hepatocellular carcinoma[J]. Int J Cancer, 2019, 144(6): 1444-1452. doi: 10.1002/ijc.31931
[19] 张锦, 李艳, 谢元元. lncRNA PCAT6在肝癌组织中的表达及其预后价值[J]. 解剖学研究, 2022, 44(3): 213-217. https://www.cnki.com.cn/Article/CJFDTOTAL-GDJP202203005.htm Zhang J, Li Y, Xie YY. Expression of lncRNA PCAT6 in liver cancer and its prognostic value[J]. Jie Pou Xue Yan Jiu, 2022, 44(3): 213-217. https://www.cnki.com.cn/Article/CJFDTOTAL-GDJP202203005.htm
[20] Lv J, Qiu M, Xia W, et al. High expression of long non-coding RNA SBF2-AS1 promotes proliferation in non-small cell lung cancer[J]. J Exp Cancer Res, 2016, 35: 75. doi: 10.1186/s13046-016-0352-9
[21] Chen G, Gu Y, Han P, et al. Long noncoding RNA SBF2-AS1 promotes colorectal cancer proliferation and invasion by inhibiting miR-619-5p activity and facilitating HDAC3 expression[J]. J Cell Physiol, 2019, 234(10): 18688-18696. doi: 10.1002/jcp.28509
[22] Dai JH, Huang WZ, Li C, et al. Silencing of long noncoding RNA SBF2-AS1 inhibits proliferation, migration and invasion and contributes to apoptosis in osteosarcoma cells by upregulating microRNA-30a to suppress FOXA1 expression[J]. Cell Cycle, 2019, 18(20): 2727-2741. doi: 10.1080/15384101.2019.1656478
[23] Liu Z, Wang Y, Wang L, et al. Long non-coding RNA AGAP2-AS1, functioning as a competitive endogenous RNA, upregulates ANXA11 expression by sponging miR-16-5p and promotes proliferation and metastasis in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2019, 38(1): 194. doi: 10.1186/s13046-019-1188-x
[24] 刘星, 刘小梯, 符秋红, 等. 下调lncRNA OIP5-AS1可通过miR-217/USP7轴抑制肝癌细胞EMT及侵袭迁移[J]. 邵阳学院学报(自然科学版), 2022, 19(3): 94-103. https://www.cnki.com.cn/Article/CJFDTOTAL-SYXZ202203013.htm Liu X, Liu XT, Fu QH, et al. Down-regulating of lncRNA OIP5-AS1 can inhibit EMT, invasion and migration of hepatoma cells through miR-217/USP7 axis[J]. Shaoyang Xue Yuan Xue Bao (Zi Ran Ke Xue Ban), 2022, 19(3): 94-103. https://www.cnki.com.cn/Article/CJFDTOTAL-SYXZ202203013.htm
[25] Wu S, Chen S, Lin N, et al. Long non-coding RNA SUMO1P3 promotes hepatocellular carcinoma progression through activating Wnt/β-catenin signalling pathway by targeting miR-320a[J]. J Cell Mol Med, 2020, 24(5): 3108-3116. doi: 10.1111/jcmm.14977
[26] Voorhoeve PM, le Sage C, Schrier M, et al. A genetic screen implicates miRNA-372 and miRNA-373 as oncogenes in testicular germ cell tumors[J]. Adv Exp Med Biol, 2007, 604: 17-46.
[27] Peng H, Pan X, Su Q, et al. MiR-372-3p promotes tumor progression by targeting LATS2 in colorectal cancer[J]. Eur Rev Med Pharmacol Sci, 2019, 23(19): 8332-8344.
[28] Fan X, Huang X, Li Z, et al. MicroRNA-372-3p promotes the epithelial-mesenchymal transition in breast carcinoma by activating the Wnt pathway[J]. J BUON, 2018, 23(5): 1309-1315.
[29] Wang Q, Liu S, Zhao X, et al. MiR-372-3p promotes cell growth and metastasis by targeting FGF9 in lung squamous cell carcinoma[J]. Cancer Med, 2017, 6(6): 1323-1330. doi: 10.1002/cam4.1026
[30] Bronner SM, Merrick KA, Murray J, et al. Design of a brain-penetrant CDK4/6 inhibitor for glioblastoma[J]. Bioorg Med Chem Lett, 2019, 29(16): 2294-2301. doi: 10.1016/j.bmcl.2019.06.021
[31] Nebenfuehr S, Kollmann K, Sexl V. The role of CDK6 in cancer[J]. Int J Cancer, 2020, 147(11): 2988-2995. doi: 10.1002/ijc.33054
[32] Kollmann K, Briand C, Bellutti F, et al. The interplay of CDK4 and CDK6 in melanoma[J]. Oncotarget, 2019, 10(14): 1346-1359. doi: 10.18632/oncotarget.26515
[33] Li Q, Wang S, Wu Z, et al. DDX11-AS1exacerbates bladder cancer progression by enhancing CDK6 expression via suppressing miR-499b-5p[J]. Biomed Pharmacother, 2020, 127: 110164. doi: 10.1016/j.biopha.2020.110164
[34] He Z, Dang J, Song A, et al. NEAT1 promotes colon cancer progression through sponging miR-495-3p and activating CDK6 in vitro and in vivo[J]. J Cell Physiol, 2019, 234(11): 19582-19591. doi: 10.1002/jcp.28557



 下载:
下载: