Effect of LncRNA PTENP1 on TGF-β-induced Epithelial-mesenchymal Transition in Esophageal Squamous Cell Carcinoma
-
摘要:目的
探讨lncRNA PTENP1在转化生长因子-β(TGF-β)诱导的食管鳞状细胞癌(ESCC)上皮间质转化(EMT)中的作用。
方法用TGF-β1处理ESCC Eca109和TE-1细胞,采用qRT-PCR检测细胞处理前后PTENP1表达的变化。在Eca109和TE-1细胞中构建PTENP1 3'UTR稳定过表达细胞株,Transwell小室实验、CCK-8实验、Western blot法检测过表达PTENP1对TGF-β1诱导的Eca109和TE-1细胞迁移、增殖及EMT相关蛋白表达的影响。
结果TGF-β1处理后,Eca109和TE-1细胞中PTENP1的表达明显下降(P < 0.05)。过表达PTENP1后,Eca109和TE-1细胞的迁移能力显著降低(P < 0.05),Eca109和TE-1细胞的增殖能力受到显著抑制(P < 0.05),EMT标志物E-cadherin表达显著增加,而N-cadherin和Vimentin的表达明显下降(P < 0.05),TGF-β1对Eca109和TE-1细胞迁移能力受到削弱,并部分逆转TGF-β1诱导的EMT过程(P < 0.05)。
结论PTENP1在TGF-β诱导的ESCC细胞EMT过程中发挥重要作用。
-
关键词:
- 食管鳞状细胞癌 /
- LncRNA PTENP1 /
- 转化生长因子-β /
- 迁移 /
- EMT
Abstract:ObjectiveTo investigate the role of lncRNA PTENP1 in regulating TGF-β-induced epithelial-mesenchymal transition (EMT) in esophageal squamous cell carcinoma (ESCC).
MethodsEca109 and TE-1 cells were treated with TGF-β1, and the expression of PTENP1 was detected by qRT-PCR before and after treatment. PTENP1-overexpressing stably transfected cell lines were constructed in Eca109 and TE-1 cells. The effects of overexpression of PTENP1 on TGF-β1-induced migration, proliferation and EMT-related proteins expression in Eca109 and TE-1 cells were detected by Transwell assay, CCK-8 test and Western blot, respectively.
ResultsThe expression of PTENP1 was significantly decreased in Eca109 and TE-1 cells treated with TGF-β1 (P < 0.05). Overexpression of PTENP1 significantly prevented cell migration, decreased the cell vitality, upregulated the E-cadherin expression, and downregulated the expression of N-cadherin and vimentin in Eca109 and TE-1 cells (P < 0.05). Furthermore, PTENP1 overexpression attenuated TGF-β-induced migration of Eca109 and TE-1 cells. PTENP1 overexpression partially reversed TGF-β-induced EMT (P < 0.05).
ConclusionPTENP1 plays an important role in TGF-β-induced EMT in ESCC cells.
-
0 引言
食管癌是我国最常见的恶性消化道肿瘤之一,居恶性肿瘤发病率第六位,死亡率第四位,其中食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)约占所有食管癌的90%[1-2]。由于食管癌早期临床症状隐匿,且患者缺乏肿瘤预防、筛查理念,导致大部分患者在确诊时已是中晚期。食管癌的5年生存率约为15%~25%,肿瘤局部复发和远处转移是导致治疗失败的主要原因[3]。上皮间质转化(epithelial-mesenchymal transition, EMT)是肿瘤发生迁移和侵袭的关键过程。转化生长因子-β(transforming growth factor-β, TGF-β)信号通路对肿瘤的生长转移起到促进作用,是启动EMT的重要通路之一[4-6]。长链非编码RNA(long noncoding RNA, lncRNA)是指超过200个核苷酸的非编码RNA,研究表明许多lncRNA参与调控恶性肿瘤的发生发展。值得注意的是,一些lncRNA已被证实参与TGF-β诱导的EMT[7-9]。TGF-β通过SMAD2/3上调lnc-UTGF表达,反过来lnc-UTGF可进一步激活TGF-β/SMAD通路,形成TGF-β/SMAD/lnc-UTGF正反馈环路,从而促进肝癌的侵袭和转移[10]。哺乳动物中存在三种TGF-β亚型,包括TGF-β1、TGF-β2、TGF-β3。TGF-β1是恶性肿瘤中表达最多的亚型,与TGF-β信号激活最密切相关。Liu等发现TGF-β1通过上调lncRNA MALAT1表达进而诱导ESCC细胞的EMT、转移和侵袭[11]。
PTEN假基因lncRNA PTENP1位于人染色体9p13.3,为高度保守的非编码序列,与PTEN高度同源,是一种在恶性肿瘤中缺失或高度甲基化的抑癌基因[12]。前期研究发现PTENP1在ESCC组织中相对低表达,并与ESCC患者预后不良相关[13]。同时,有报道表明PTENP1可通过竞争性结合miR-160b使PTEN表达上调,从而抑制宫颈癌细胞增殖和EMT[14]。但是,PTENP1是否参与TGF-β诱导的食管鳞癌EMT过程尚未见研究报道。本研究旨在探讨PTENP1在TGF-β1介导EMT过程中的作用,明确PTENP1调控ESCC转移的机制。
1 材料与方法
1.1 材料
人ESCC细胞株Eca109和TE-1细胞购自中国科学院典型培养物保藏委员会细胞库。DMEM高糖培养基和RPMI 1640培养基购自美国HyClone公司;胎牛血清购自杭州天杭生物科技有限公司;CCK-8试剂盒购自日本Dojindo公司;Transwell小室购自美国Corning公司;E-cadherin、N-cadherin、Vimentin、GAPDH抗体均购自美国CST公司。TGF-β1细胞因子购自美国Peprotech公司,另TGF-β1处理组经人重组TGF-β1(10 ng/ml)细胞因子处理48 h。
1.2 方法
1.2.1 细胞培养
Eca109细胞用含10%胎牛血清的DMEM培养基培养,TE-1细胞用含10%胎牛血清的RPMI 1640培养基培养,置于5%CO2、37℃培养箱内,待细胞生长至80%~90%时,用0.25%胰蛋白酶进行消化传代。
1.2.2 PTENP1
3'UTR过表达稳转细胞株的构建取对数生长期的Eca109和TE-1细胞,接种于培养皿中,5%CO2、37℃条件下培养24 h,待细胞覆盖率为70%左右时,进行转染。用含8 μg/ml Polybrene的新鲜培养基按适合的MOI值稀释病毒液,弃掉培养皿中原有的培养基,分为对照组和处理组,将慢病毒对照稀释液加至对照组中,将PTENP1 3'UTR过表达慢病毒稀释液加至处理组中。48 h后更换成普通培养液,并添加嘌呤霉素筛选,存活的细胞即为表达PTENP1 3'UTR或阴性对照的细胞。为获得稳定转染的单克隆细胞株,将100个用嘌呤霉素筛选培养的细胞接种于培养皿中,3周后分别挑选各个抗嘌呤霉素克隆接种于96孔板中,继续用嘌呤霉素培养,5周后可获得稳定转染的细胞株。
1.2.3 CCK-8实验
取对数生长期的细胞,胰酶消化离心制备细胞悬液,按每孔3 000个细胞种植于96孔板,每组设置3个复孔。分别培养24、48、72、96 h后,取出培养板,每孔加入10 μl CCK-8溶液,继续孵育3 h,用酶标仪测定每孔在450 nm处的吸光度值。
1.2.4 Transwell迁移实验
取对数生长期的细胞,用胰酶消化离心后,用无血清培养基重悬成单细胞悬液。将600 μl含有20%血清的培养基加至24孔板,将150 μl含有2×105个细胞悬液加至上室,放至培养箱中继续培养24 h。取出小室,弃掉上室液体,每孔加入600 μl甲醇固定20~30 min,1%结晶紫染色30 min,PBS充分清洗干净,室温晾干小室,显微镜下拍摄照片,随机取5个视野计数,统计结果。
1.2.5 qRT-PCR实验
TRIzol法提取细胞中的总RNA,反转录PCR获得cDNA,GAPDH作为定量的内参对照,扩增条件为:95℃预变性30 s。95℃ 5 s,60℃ 30 s,72℃ 30 s,共40个循环。采用Bio-Rad CFX Manager软件采集数据,并用ΔΔCt法计算目的基因的相对表达量。每个样本独立重复实验3次。引物序列如下:GAPDH-F: 5’-GTCTCCTCTGACTTCAACAGCG-3’, GAPDH-R: 5’-ACCACCCTGTTGCTGTAGCCAA-3’;PTENP1-F: 5’-TCAGAACATGGCATACACCAA-3’, PTENP1-R: 5’-TGATGACGTCCGATTTTTCA-3’。
1.2.6 Western blot实验
取对数生长期的细胞,加入150 μl裂解混合液,冰上裂解20 min后收集细胞裂解物,4℃ 12 000 r/min离心20 min,吸取上清液,BCA法检测蛋白浓度。取蛋白样品进行SDS-PAGE凝胶电泳,转至PVDF膜上。5%脱脂奶粉室温封闭1.5 h,加入一抗4℃孵育过夜,二抗室温孵育1.5 h。均匀滴加适量ECL化学发光液至PVDF膜上,然后将膜置于Bio-Rad显像仪中,采用Image J软件进行图像采集。
1.3 统计学方法
采用GraphPad软件进行统计学分析,所有定量结果表示为至少3次独立实验的平均值±标准偏差(x±s)。使用Student t检验、ANOVA单因素方差分析组间差异,P < 0.05为差异有统计学意义。
2 结果
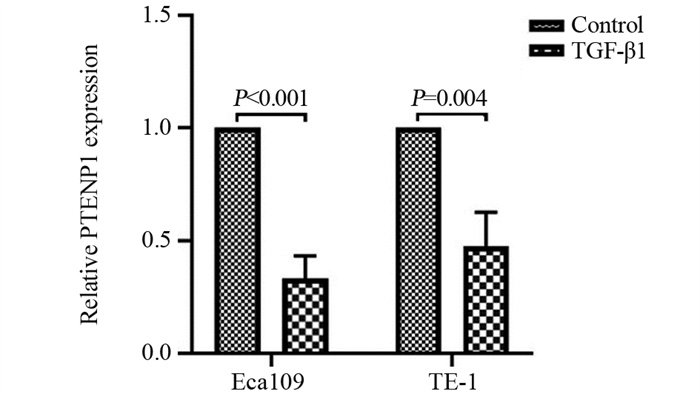
2.1 TGF-β抑制ESCC细胞PTENP1的表达
采用qRT-PCR检测TGF-β1处理前后ESCC细胞PTENP1的表达水平。结果显示,与对照组相比,Eca109和TE-1细胞经TGF-β1处理48 h后,PTENP1的表达水平显著降低(P < 0.05),见图 1,表明TGF-β抑制PTENP1的表达。
2.2 过表达PTENP1 3’UTR慢病毒载体转染验证
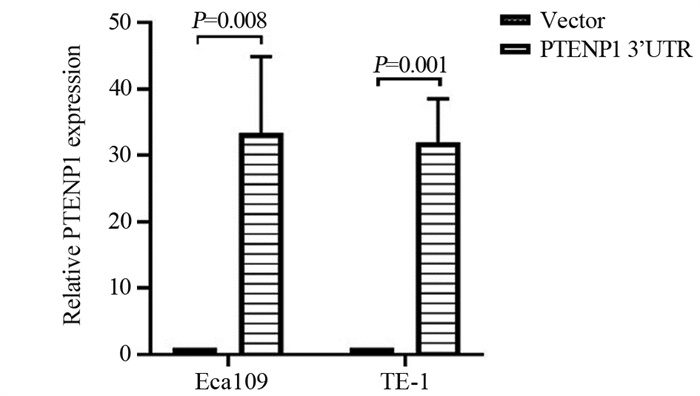
为进一步证实PTENP1对ESCC细胞生物学行为的影响及PTENP1是否参与TGF-β诱导的EMT过程,我们构建了PTENP1 3’UTR过表达慢病毒载体,转染Eca109、TE-1细胞,经嘌呤霉素筛选后通过qRT-PCR检测,结果显示,与对照组相比,转染PTENP1 3’UTR后PTENP1的表达显著增加(P < 0.05),见图 2,表明PTENP1过表达稳转细胞株构建成功。
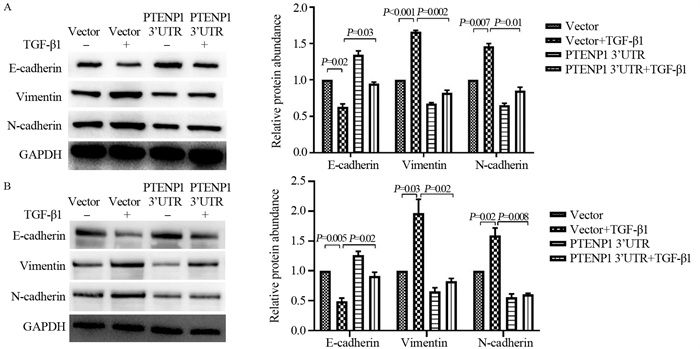
2.3 过表达PTENP1抑制ESCC细胞的EMT
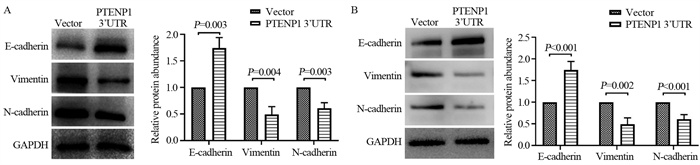
Western blot检测过表达PTENP1 3’UTR后Eca109和TE-1细胞中EMT标志物蛋白表达的水平。结果显示(P < 0.05),过表达PTENP1 3’UTR Eca109、TE-1细胞的E-cadherin表达水平明显高于对照组,而N-cadherin和Vimentin的表达水平显著下降,见图 3。表明过表达PTENP1可以抑制食管鳞癌细胞的EMT。
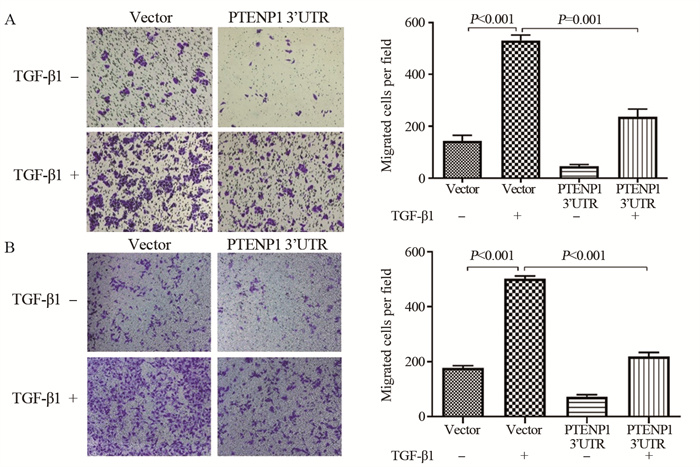
2.4 过表达PTENP1抑制ESCC细胞增殖和迁移
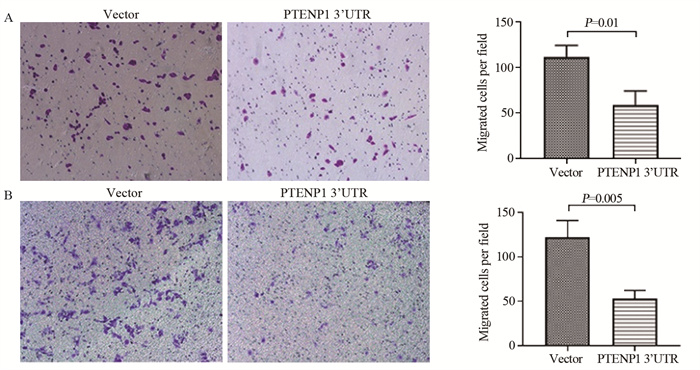
Transwell实验检测过表达PTENP1 3’UTR对Eca109和TE-1细胞迁移能力的影响。分别将相同数量过表达PTENP1 3’UTR和对照组细胞接种至Transwell小室中,观察24 h后穿过小室的细胞数,结果显示,PTENP1过表达后,Eca109和TE-1细胞的迁移能力显著下降(P < 0.05),见图 4。
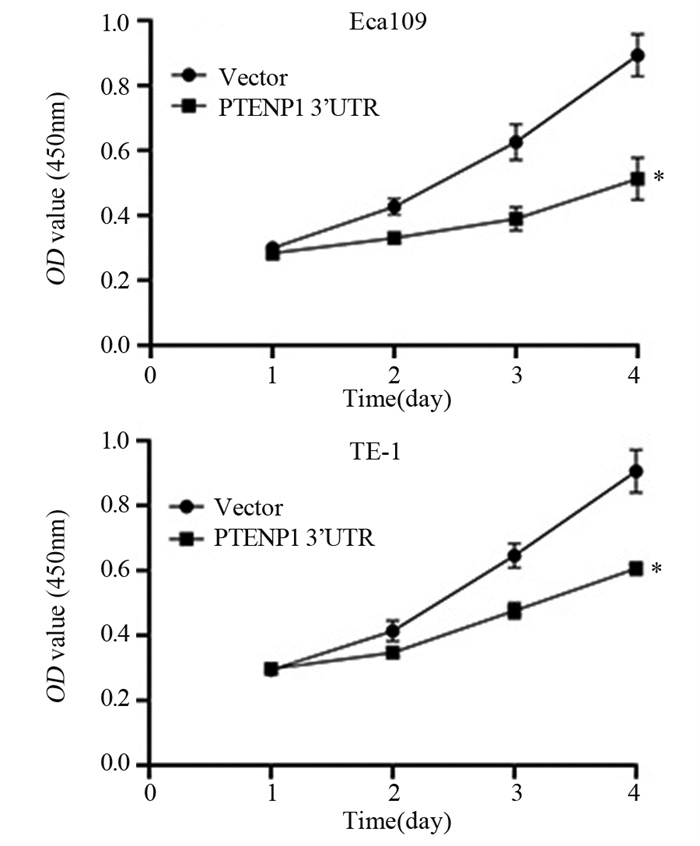
通过CCK-8实验分析过表达PTENP1对ESCC细胞增殖的影响,结果发现,与对照组相比,过表达PTENP1显著抑制了Eca109和TE-1细胞的增殖能力(P < 0.05),见图 5。
2.5 过表达PTENP1部分逆转TGF-β诱导的EMT过程
Western blot检测发现,Eca109和TE-1细胞经TGF-β1诱导后,E-cadherin的表达水平降低,同时N-cadherin和Vimentin表达上调,证实了TGF-β可促进ESCC细胞发生EMT。而过表达PTENP1抑制了TGF-β1诱导的E-cadherin表达减少和N-cadherin、Vimentin表达升高(均P < 0.05),见图 6。Transwell迁移实验结果显示,Eca109和TE-1细胞经TGF-β1诱导48 h后,迁移能力明显增强;而过表达PTENP1可削弱TGF-β1对Eca109细胞迁移能力的促进作用(均P < 0.05),见图 7。这些结果说明,PTENP1过表达可部分逆转TGF-β1诱导的EMT过程。
3 讨论
食管癌是我国常见的消化道恶性肿瘤之一,局部复发和转移是导致食管癌患者预后差的主要原因。因此,探索食管癌转移的分子机制,具有重要的临床意义。食管癌的转移是多分子参与、相互调控的复杂生物学过程,多种基因和信号通路参与其中。TGF-β在细胞生长、分化、凋亡、侵袭等过程中发挥重要作用,TGF-β通路介导的EMT是肿瘤发生侵袭、迁移的重要机制之一。前期研究发现PTENP1在ESCC组织中低表达,与患者TNM分期、肿瘤浸润深度和淋巴结转移及预后不良相关[13]。而PTENP1是否与ESCC的侵袭、迁移能力有关,其是否参与调控TGF-β介导的EMT尚未见研究报道。本研究结果发现,TGF-β可抑制食管鳞癌细胞PTENP1的表达,过表达PTENP1可抑制食管鳞癌细胞增殖和迁移,并部分逆转TGF-β诱导的EMT过程。
TGF-β信号通路通过调节多种mRNA及其编码蛋白,影响肿瘤EMT、浸润转移、免疫微环境、治疗抵抗等生物学过程。但是TGF-β信号通路在肿瘤发生发展中的作用具有双重性,在肿瘤发生发展的早期,TGF-β可以抑制肿瘤生长,阻止肿瘤的发展。而在肿瘤进展期,随着肿瘤表观遗传改变,TGF-β则对肿瘤的生长和转移起到促进作用[15-17]。因此阐明TGF-β调控肿瘤进展的分子机制,对开发潜在的肿瘤治疗靶点具有重要意义。近年来随着对非编码RNA与肿瘤发生发展关系的研究深入,学者发现lncRNA可作为TGF-β信号转导的效应因子影响肿瘤的EMT和侵袭转移[7]。TGF-β可上调lncRNA-ATB表达促进肝癌细胞EMT过程,其下游机制为lncRNA-ATB可通过竞争性结合miR-200,从而使miR-200靶基因ZEB1/2表达升高[18]。在肺癌细胞中,TGF-β/SMAD3通路可抑制LINC01186的表达,从而促进肿瘤的侵袭、迁移和EMT过程[19]。PTENP1作为内源性RNA,其转录本主要通过竞争性结合相关miRNA,在转录后水平调节PTEN的表达,从而影响肿瘤细胞增殖、凋亡、侵袭和转移。Qian等发现过表达PTENP1通过吸附miR-193a-3p调控PTEN/Akt信号通路,从而抑制肝癌细胞的侵袭和转移[20]。Fan等发现PTENP1通过竞争性结合miR-106b调控PTEN表达,抑制宫颈癌细胞增殖和EMT[14]。然而,PTENP1是否参与TGF-β介导的食管鳞癌细胞EMT和侵袭转移尚未可知。本研究通过qRT-PCR比较TGF-β1处理前后食管鳞癌Eca109细胞中PTENP1表达的变化,发现经TGF-β1处理后,lncRNA PTENP1的表达明显下降。进一步构建了PTENP1 3’UTR过表达慢病毒载体,体外功能实验结果发现,过表达PTENP1可抑制食管鳞癌细胞的迁移和增殖能力。表明PTENP1在ESCC的肿瘤侵袭转移中发挥潜在作用。过表达PTENP1 3’UTR后,Eca109和TE-1细胞中EMT标志物E-cadherin表达增加,而N-cadherin和Vimentin表达下降,提示PTENP1可通过调控EMT过程抑制食管癌迁移能力。进一步的挽救实验表明,过表达PTENP1可以部分削弱TGF-β1对Eca109和TE-1细胞迁移能力的影响。同时,过表达PTENP1 3’UTR抑制了TGF-β1诱导的E-cadherin降低及N-cadherin和Vimentin升高,证实PTENP1参与调控TGF-β1诱导的食管鳞癌EMT过程。
但是TGF-β抑制PTENP1表达的具体机制,以及PTENP1如何调控EMT相关标志物表达的分子机制尚未完全清楚。Smad通路是TGF-β信号下游最经典和直接的通路,研究发现,在TGF-β刺激下,Smad2/3通过结合至lncRNA SMASR启动子区,抑制SMASR转录和表达,从而促进肺癌的EMT和迁移侵袭[21]。此外,Li等研究表明,TGF-β1通过将HDAC3富集于lncRNA ANCR启动子区,降低ANCR启动子的乙酰化水平,使其表达下调,从而促进乳腺癌的侵袭和转移[22]。回顾文献发现,在多种肿瘤中,PTENP1的基因启动子区域存在甲基化位点,并且PTENP1甲基化水平与自身表达水平呈负相关。Cao等发现,miR-21通过作用下游靶蛋白TETs,提高PTENP1启动子甲基化水平,从而影响PTENP1的表达,促进肝癌发生发展[23]。PTENP1在肾癌细胞系和组织中表达较低,且其启动子区高度甲基化[24]。基于这些事实,推测ESCC中PTENP1的表达水平受其基因启动子区甲基化位点调控,而TGF-β/Smad通路是否可能通过与PTENP1启动子结合来调控其表达,需要后续进一步研究证实。此外,研究发现,lncRNA主要通过竞争性结合相关miRNA如miR-200家族,在转录后水平调节EMT相关转录因子的表达[18-25]。PTENP1作为竞争性内源RNA,主要通过竞争性结合相关miRNA,包括miR-20a、miR-19b、miR-21、miR-26a、miR-17和miR-214等在转录后水平调节PTEN或其他基因如SOCS6的表达,从而影响肿瘤的发生、发展、浸润和转移[12]。那么,PTENP1是否通过调控某些miRNA影响ESCC的EMT过程?我们后续会开展进一步的研究,阐明TGF-β信号通路调控PTENP1的具体分子机制以及PTENP1调控EMT的下游分子机制。
综上,PTENP1在TGF-β诱导的食管鳞癌EMT过程发挥重要作用,这一发现将为食管癌的诊疗提供新策略和新靶点。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:付神波:实验设计与实施、数据分析及论文撰写龚拓拓:实验设计指导郭俊俊:论文指导 -
-
[1] Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9. doi: 10.1016/j.jncc.2022.02.002
[2] He F, Wang J, Liu L, et al. Esophageal cancer: trends in incidence and mortality in China from 2005 to 2015[J]. Cancer Med, 2021, 10(5): 1839-1847. doi: 10.1002/cam4.3647
[3] Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567. doi: 10.1016/S2214-109X(18)30127-X
[4] Hao Y, Baker D, Ten Dijke P. TGF-beta-Mediated Epithelial-Mesenchymal Transition and Cancer Metastasis[J]. Int J Mol Sci, 2019, 20(11): 2767. doi: 10.3390/ijms20112767
[5] Ganesh K, Massagué J. Targeting metastatic cancer[J]. Nat Med, 2021, 27(1): 34-44. doi: 10.1038/s41591-020-01195-4
[6] Su J, Morgani SM, David CJ, et al. TGF-beta orchestrates fibrogenic and developmental EMTs via the RAS effector RREB1[J]. Nature, 2020, 577(7791): 566-571. doi: 10.1038/s41586-019-1897-5
[7] Papoutsoglou P, Moustakas A. Long non-coding RNAs and TGF-beta signaling in cancer[J]. Cancer Sci, 2020, 111(8): 2672-2681. doi: 10.1111/cas.14509
[8] Hu YZ, Hu ZL, Liao TY, et al. LncRNA SND1-IT1 facilitates TGF-beta1-induced epithelial-to-mesenchymal transition via miR-124/COL4A1 axis in gastric cancer[J]. Cell Death Discov, 2022, 8(1): 73. doi: 10.1038/s41420-021-00793-6
[9] Lai XN, Li J, Tang LB, et al. MiRNAs and LncRNAs: Dual Roles in TGF-beta Signaling-Regulated Metastasis in Lung Cancer[J]. Int J Mol Sci, 2020, 21(4): 1193. doi: 10.3390/ijms21041193
[10] Wu MZ, Yuan YC, Huang BY, et al. Identification of a TGF-beta/SMAD/lnc-UTGF positive feedback loop and its role in hepatoma metastasis[J]. Signal Transduct Target Ther, 2021, 6(1): 395. doi: 10.1038/s41392-021-00781-3
[11] Liu Q, Zheng S, Chen Y, et al. TGF-beta1-Induced Upregulation of MALAT1 Promotes Kazakh's Esophageal Squamous Cell Carcinoma Invasion by EMT[J]. J Cancer, 2020, 11(23): 6892-6901. doi: 10.7150/jca.48426
[12] Ghafouri-Fard S, Khoshbakht T, Hussen BM, et al. A review on the role of PTENP1 in human disorders with an especial focus on tumor suppressor role of this lncRNA[J]. Cancer Cell Int, 2022, 22(1): 207. doi: 10.1186/s12935-022-02625-8
[13] Gong T, Zheng S, Huang S, et al. PTENP1 inhibits the growth of esophageal squamous cell carcinoma by regulating SOCS6 expression and correlates with disease prognosis[J]. Mol Carcinog, 2017, 56(12): 2610-2619. doi: 10.1002/mc.22705
[14] Fan Y, Sheng W, Meng Y, et al. LncRNA PTENP1 inhibits cervical cancer progression by suppressing miR-106b[J]. Artif Cells Nanomed Biotechnol, 2020, 48(1): 393-407. doi: 10.1080/21691401.2019.1709852
[15] Batlle E, Massagué J. Transforming Growth Factor-beta Signaling in Immunity and Cancer[J]. Immunity, 2019, 50(4): 924-940. doi: 10.1016/j.immuni.2019.03.024
[16] David CJ, Massagué J. Contextual determinants of TGFbeta action in development, immunity and cancer[J]. Nat Rev Mol Cell Biol, 2018, 19(7): 419-435.
[17] Tu S, Huang W, Huang C, et al. Contextual Regulation of TGF-beta Signaling in Liver Cancer[J]. Cells, 2019, 8(10): 1235. doi: 10.3390/cells8101235
[18] Lin H, Yang L, Tian F, et al. Up-regulated LncRNA-ATB regulates the growth and metastasis of cholangiocarcinoma via miR-200c signals[J]. Onco Targets Ther, 2019, 12: 7561-7571. doi: 10.2147/OTT.S217676
[19] Hao Y, Yang X, Zhang D, et al. Long noncoding RNA LINC01186, regulated by TGF-beta/SMAD3, inhibits migration and invasion through Epithelial-Mesenchymal-Transition in lung cancer[J]. Gene, 2017, 608: 1-12. doi: 10.1016/j.gene.2017.01.023
[20] Qian YY, Li K, Liu QY, et al. Long non-coding RNA PTENP1 interacts with miR-193a-3p to suppress cell migration and invasion through the PTEN pathway in hepatocellular carcinoma[J]. Oncotarget, 2017, 8(64): 107859-107869. doi: 10.18632/oncotarget.22305
[21] Xu L, Liu W, Li T, et al. Long non-coding RNA SMASR inhibits the EMT by negatively regulating TGF-beta/Smad signaling pathway in lung cancer[J]. Oncogene, 2021, 40(20): 3578-3592. doi: 10.1038/s41388-021-01760-2
[22] Li Z, Dong M, Fan D, et al. LncRNA ANCR down-regulation promotes TGF-beta-induced EMT and metastasis in breast cancer[J]. Oncotarget, 2017, 8(40): 67329-67343. doi: 10.18632/oncotarget.18622
[23] Cao LQ, Yang XW, Chen YB, et al. Exosomal miR-21 regulates the TETs/PTENp1/PTEN pathway to promote hepatocellular carcinoma growth[J]. Mol Cancer, 2019, 18(1): 148. doi: 10.1186/s12943-019-1075-2
[24] Yu G, Yao W, Gumireddy K, et al. Pseudogene PTENP1 functions as a competing endogenous RNA to suppress clear-cell renal cell carcinoma progression[J]. Mol Cancer Ther, 2014, 13(12): 3086-3097. doi: 10.1158/1535-7163.MCT-14-0245
[25] Li RH, Chen M, Liu J, et al. Long noncoding RNA ATB promotes the epithelial-mesenchymal transition by upregulating the miR-200c/Twist1 axe and predicts poor prognosis in breast cancer[J]. Cell Death Dis, 2018, 9(12): 1171. doi: 10.1038/s41419-018-1210-9
-
期刊类型引用(3)
1. 彭清琴. 沙利度胺联合同步放化疗对食管癌患者血管生成相关因子的影响. 吉林医学. 2025(06): 1430-1433 .  百度学术
百度学术
2. 刘艳春,贾儒渊,樊志慧,王朝凤,苏海燕,曹文娟,徐丹丹. 表皮生长因子受体在食管鳞状细胞癌组织中的表达及其临床意义. 临床误诊误治. 2024(10): 35-38+43 .  百度学术
百度学术
3. 许杨,袁红平,李晓全,范耀东,李得意,马雪艳. SERINC2通过激活TGF-β/Smad3信号通路促进脑胶质瘤细胞的迁移和侵袭. 中国现代医药杂志. 2024(11): 33-38 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: