Construction and Validation of A Risk Model for Predicting Prognosis and Immunotherapy Response of Bladder Cancer Based on Cellular Senescence-related Genes
-
摘要:目的
通过构建细胞衰老相关标志(SRS)风险评分模型评估膀胱癌的预后和对免疫治疗的反应,探讨SRS在膀胱癌中的临床应用价值。
方法从TCGA-BLCA筛选出细胞衰老基因,根据LASSO回归筛选出其中的细胞衰老相关标志基因。基于衰老标志基因构建膀胱癌风险评分模型分析TCGA-BLCA高、低风险组的生存差异和模型拟合度,单因素、多因素Cox回归分析膀胱癌预后危险因素。分析GEO-BLCA、IMvigor210数据库中高、低风险组的总体生存差异和免疫治疗反应。根据膀胱癌组织和正常癌旁组织中β-gal显色反应,明确膀胱癌组织中是否存在细胞衰老。
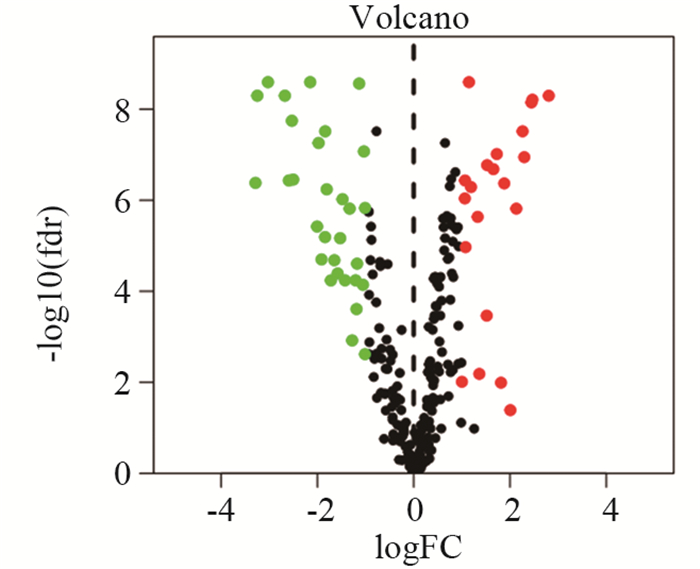
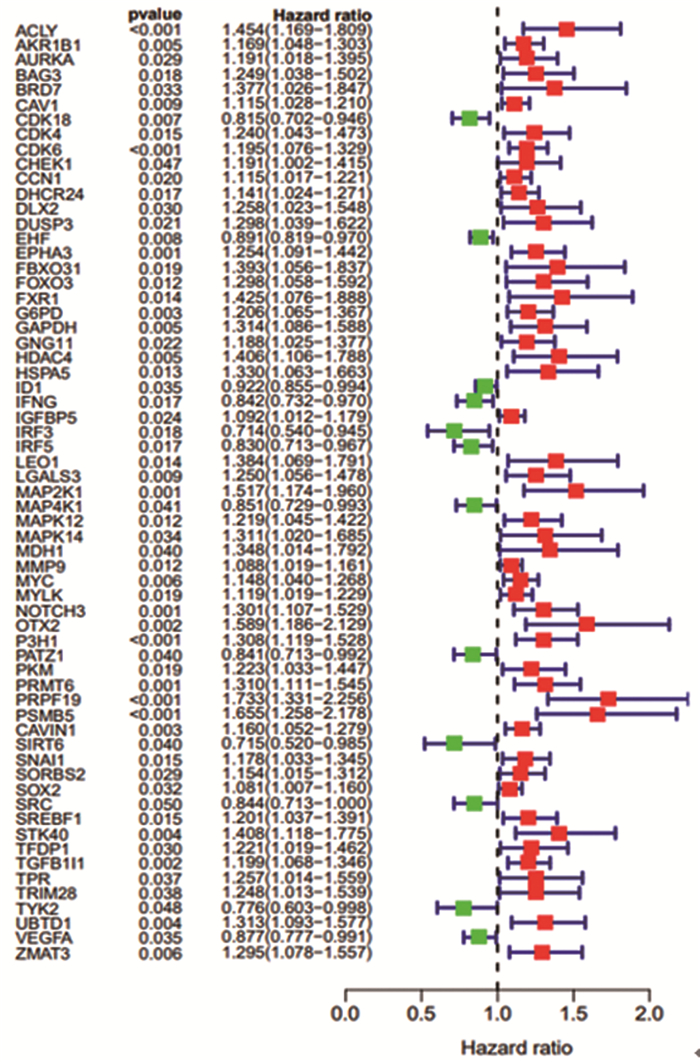
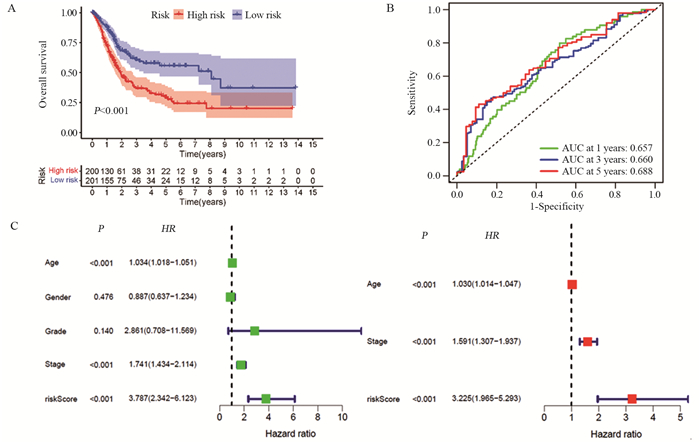
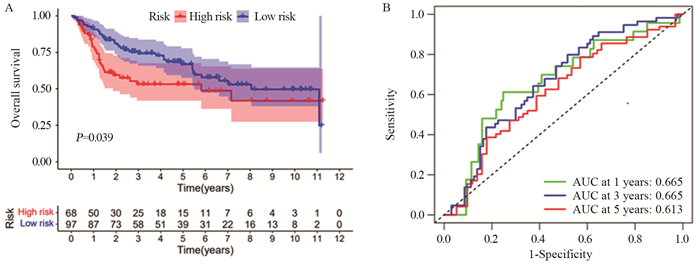
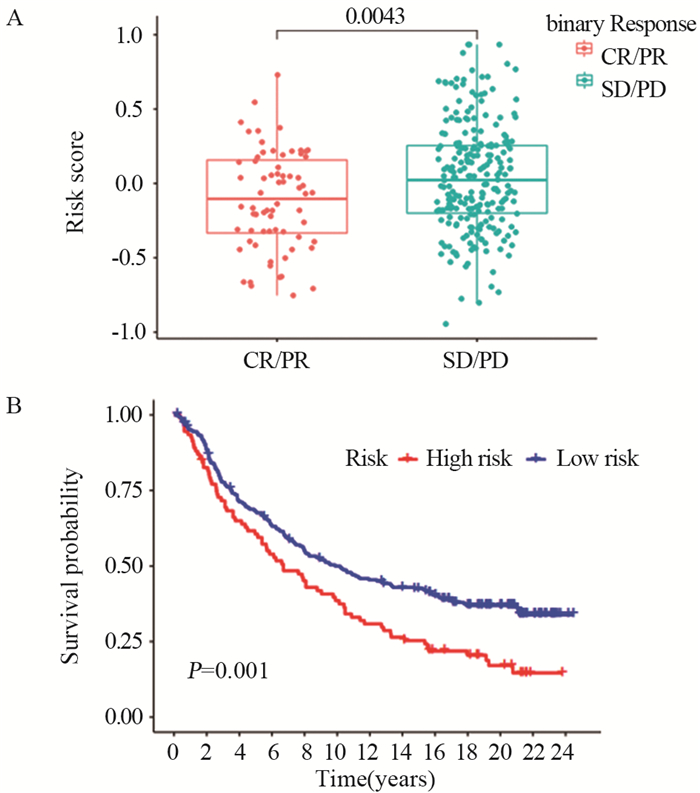
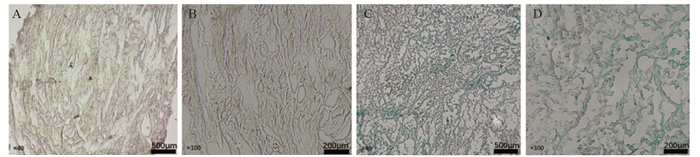
结果共筛选出8个细胞衰老标志基因,根据标志基因构建的风险评分中位数将患者分为高、低风险组。高风险组患者的5年生存率低于低风险组患者(训练集及验证集P < 0.05),TCGA-BLCA和GSE13507患者1、3、5年OS的ROC曲线下面积分别为0.657、0.660、0.688和0.665、0.665、0.613。SRS风险评分可作为膀胱癌患者预后的独立危险因素,膀胱癌免疫治疗中反应组较非反应组的SRS风险评分更低(P < 0.05)。膀胱癌组织β-gal染色阳性,癌旁正常组织β-gal染色阴性。
结论膀胱癌组织中存在细胞衰老现象,SRS风险评分可以预测膀胱癌患者的临床预后,评分较低的患者可以从免疫治疗中获益。SRS是膀胱癌预后和免疫治疗反应的一个可靠的生物标志物。
Abstract:ObjectiveTo evaluate the prognosis and immunotherapy response of patients with bladder cancer by constructing a risk-score model of cellular senescence-related signature (SRS), as well as to explore the clinical application value of SRS in bladder cancer.
MethodsSenescence genes were screened from TCGA-BLCA, and cellular SRS genes were screened according to LASSO regression. A bladder cancer risk-score model was constructed based on the SRS genes to analyze the survival difference and model-fit degree of TCGA-BLCA high- and low-risk groups. Univariable and multivariable Cox regression was used to analyze the prognostic risk factors of bladder cancer. Overall survival differences of high- and low-risk groups in GEO-BLCA database were verified, and variations in immunotherapy responses were analyzed in IMvigor210 databases. According to the result of β-gal chromogenic reaction in bladder cancer and normal paracancer tissues, the existence of cell senescence was determined.
ResultsEight marker genes were screened, and patients were divided into high- and low-risk groups according to the median risk score constructed by the marker genes. The 5-year survival rate of high risk group was lower than that of low risk group (training and validation sets P < 0.05). The area under the ROC curve of TCGA-BLCA in 1-, 3-, and 5-year were 0.657, 0.660, and 0.688, and those for GSE13507 were 0.665, 0.665, and 0.613, respectively. SRS risk score can be used as an independent risk factor for the prognosis of patients with bladder cancer. The SRS risk score in the response group was lower than that in the non-response group during bladder cancer immunotherapy (P < 0.05). The β-gal staining of bladder cancer tissue was positive, but the β-gal staining of adjacent normal tissue was negative.
ConclusionCell senescence occurs in bladder cancer tissues. SRS risk score can predict the clinical prognosis of patients with bladder cancer, and patients with low score can benefit from immunotherapy. SRS is a reliable biomarker for the prognosis and immunotherapy response of bladder cancer.
-
0 引言
恶性肿瘤的治疗依然是世界性难题,根据GLOBOCAN 2020数据库显示,2020年全球新发癌症19 292 789例,9 958 133例癌症患者死亡,较2018年统计数据均有所上升,乳腺癌、肺癌、结直肠癌的发病率位列前三[1]。近年来,肿瘤免疫治疗技术逐步提高,包括单克隆抗体、双特异性抗体、肿瘤疫苗、免疫检查点的抑制、CAR-T细胞治疗等,为肿瘤患者带来了新的曙光。CAR-T细胞通过对T细胞的基因改造,表达特异性识别肿瘤的融合性受体,并发挥强大的抗肿瘤功能,然而CAR-T在实际应用过程中存在诸多副作用及肿瘤复发问题。为了提高CAR-T的敏感度和抗肿瘤能力,融合基因的表达模式也逐渐由单靶点过渡到双靶点或多靶点模式。本文将系统介绍多靶点CAR-T的发展及应用前景。
1 CAR-T疗法
CAR-T是一种过继细胞免疫疗法,该方法是从患者血液中提取T淋巴细胞,在体外进行基因改造及扩增,再回输给患者,进而发挥靶向杀伤肿瘤的作用。改造后的T细胞表达独特的融合性受体,该受体胞外结构域一般由能够特异性地识别肿瘤相关抗原(tumor-associated antigen, TAA)的单链片段(single-chain variable fragment, scFv)组成,往往决定了CAR-T细胞的肿瘤靶向性。CAR-T细胞的胞内区为免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAMs),发挥信号转导和细胞激活功能,加上共刺激分子的作用,激活的T细胞大量释放穿孔素和颗粒酶对肿瘤细胞产生直接溶解作用,同时分泌干扰素γ(interferon-gamma, IFN-γ)等细胞因子介导靶细胞的杀伤。CAR-T较普通的T细胞更具有靶向性、杀伤性,而且不受主要组织相容性复合体(MHC)限制[2],成为了抗肿瘤的一大利器。
2 CAR-T治疗肿瘤的现状
在一系列临床研究中,发现CAR-T对血液相关肿瘤有显著的疗效。2013年全球首例CD19的CAR-T免疫疗法治疗1名急性淋巴细胞白血病患儿,病情获得完全缓解(complete response, CR)[3]。随后以CD19为靶点的CAR-T在治疗血液系统肿瘤中得到了广泛应用,有效率高达60%~80%。然而强大的杀伤力也带来了细胞因子风暴(cytokine release syndrome, CRS)、脱靶效应等不良反应。同时,抗原的丢失可能使CAR-T逐渐失效,肿瘤复发或难治成为了新的难题,据统计:CAR-T细胞治疗复发性/难治性急性B细胞淋巴细胞白血病,1年累积复发率约50%~60%[4]。在实体肿瘤中,由于异质性高,靶点特异性不强,脱靶效应更加显著,CAR-T在攻击肿瘤细胞时也攻击了正常细胞,造成不必要的器官损害,加之复杂的抑制性肿瘤微环境,导致CAR-T治疗实体肿瘤效能低下,整体有效率只有9%左右[5]。近年来一些代表性的临床试验结果见表 1。
表 1 CAR-T治疗肿瘤临床数据Table 1 Clinical data of CAR-T cell therapy for tumor
3 多靶点的嵌合抗原受体T细胞的开发
抗原逃逸是逃避免疫治疗的主要潜在机制,单靶点的CAR-T治疗后不可避免地面临着复发快、复发率高等问题,当肿瘤出现复发后往往更难治疗,多靶点CAR-T细胞可能是解决这一问题的有效方法。多靶点的嵌合抗原受体工程T细胞是指T细胞上同时表达2个或2个以上的受体,两者各自发挥功能或协同发挥功能,而且在一定程度上提高了抗原覆盖率,克服抗原逃逸,提高靶抗原的特异性和持久性,当一种抗原丢失后仍能保持肿瘤的杀伤能力。目前最常见的多靶点CAR-T是双靶点CAR-T,主要的几种形式为:联合CAR-T疗法;Dual CAR;双靶点串联CAR-T;三靶点CAR-T。
3.1 联合CAR-T疗法
这是一种混合式或鸡尾酒式疗法,即两个不同靶点的CAR-T细胞系混合或序贯治疗,每种细胞表达不同的抗原特异性CAR;例如:Ruella等研究发现,患有B-ALL的儿童经过CD19-CAR-T治疗后出现复发,这些患儿检测表型为CD19+、CD123+,随后给予CD123-CAR-T,能够很好地根除疾病[19]。Wang等报道了一项序贯CD19和CD22-CAR-T细胞治疗难治/复发性B细胞恶性肿瘤的疗效和安全性,纳入的89例患者,51例B-ALL患者的微小残留(MRD)阴性反应率为96.0%;38例非霍奇金淋巴瘤(NHL)患者总反应率为72.2%,CR为50.0%,表明序贯输注CD19/22CAR-T细胞治疗B细胞肿瘤是有效的[20]。值得注意的是,使用两种CAR-T细胞系可能导致细胞群体的不平衡,对肿瘤细胞产生强烈的免疫压力,这也可能导致两种抗原同时逃逸[21]。在一项实验中向胰腺导管癌(PDAC)患者注入CD19-CAR-T和Meso-CAR-T后,发现两种CAR-T表现出不同的扩张能力,在纳入本研究的三例患者中观察到CD19-CAR-T细胞与Meso-CAR-T细胞联合时并没有提高Meso-CAR-T细胞的持久性[22]。另一项研究中,1例对放化疗不敏感的晚期转移性胆管癌(CAA)患者采取了CAR-T鸡尾酒疗法,从CART-EGFR治疗中获得了8.5月的部分缓解(PR),随后从CART133治疗中获得了持续4.5月的PR,几次CAR-T的注射都引起了相关急性不良反应,比如寒颤、发热、肌痛、呕吐、皮疹等,甚至需要临床干预[23]。目前仍需更多的临床研究来优化联合CAR-T细胞治疗方案,尽可能减轻不良反应,避免复发。
3.2 Dual CAR
Dual CAR是通过共转染等方式,使单个T细胞共同表达两个独立的CAR结构,传递独立的两种信号。由于肿瘤异质性,没有单一的特异性肿瘤抗原,这种组合的多抗原靶向策略可能抵消潜在的抗原逃逸机制。研究表明,Dual CAR-T与单靶点的CAR-T或者联合两个单靶点CAR-T细胞群相比,能够更有效地防止抗原逃逸,增强抗肿瘤效果,而且当Dual CAR-T细胞遇到两种抗原共同存在时,可表现出最大的下游信号转导。Ruella等[19]建立的CD19和CD123的Dual CAR-T细胞,证实了具有较好的抗肿瘤作用和较长的持久性,在异种移植模型中防止了因CD19抗原丢失引起的复发。同样,在实体肿瘤中应用Dual CAR-T也有类似的效果,一种双靶点CAR-T分别靶向前列腺特异性膜抗原(PSMA)和前列腺干细胞抗原(PSCA)。在小鼠前列腺癌模型中证实,双靶点CAR-T细胞能够根除PSCA+ PSMA+的小鼠肿瘤,而PSCA+PSMA-的小鼠肿瘤对治疗反应差[24]。虽然Dual CAR-T能够高度激活T细胞,但也容易引起细胞因子风暴,并对低表达靶抗原的正常细胞过度杀伤,因此需要在结构设计和功能上进一步的优化,在确保安全的情况下有效发挥肿瘤杀伤作用。
3.3 双靶点串联CAR-T
该形式是两个不同的抗原结合结构域串联表达在同一个工程化T细胞上,可引起不同的应答,不论识别哪种抗原,都可以保留细胞溶解能力。基于此种设计,研究人员构建了一种人源化的CD37-CD19 CAR-T细胞,能够特异的靶向CD37阳性或CD19阳性细胞,杀伤效果和分泌IFN-γ情况均优于CD19单靶点的CAR-T[25]。最近,一项Ⅰ期临床试验首次使用抗CD20、抗CD19双特异性CAR T细胞来治疗复发难治性B细胞恶性肿瘤,22例患者输入双特异性抗体后,第28天的总体反应率为82%,其中14例患者获得完全缓解,4例部分缓解,在治疗中显示出低毒性和高疗效,值得注意的是,在复发或经历治疗失败的患者中未观察到CD19的丢失,表明双特异性CAR可以通过减轻靶抗原下调作为复发机制来改善临床反应[26]。在实体瘤的研究中,与共表达BCMA和CS1的Dual CAR-T细胞相比,BCMA/CS1双靶点串联CAR-T细胞表现出出众的CAR表达率和更加优越的功能[27]。可见,这种双靶点串联的CAR-T有着广泛的研究前景。由于实体肿瘤微环境中抑制性受体的存在,尤其是T细胞表面存在程序性死亡因子1(programmed death factor 1, PD-1),使得CAR-T细胞注入后容易出现衰竭,因此研究人员也青睐于引入PD-L1作为CAR-T的另一靶点,提高CAR-T的存活力和持久力。比如Li等构建的PD-L1/MUC16双靶点CAR-T,在体内外均显示出对卵巢癌细胞的强大杀伤能力,存活时间方面,双特异性CAR-T细胞的功效比单特异性CAR-T细胞高2~4倍[28]。此外,还有Trop 2、C-MET等与PD-1或PD-L1为组合设计的双靶点CAR-T[29-31],与单靶CAR-T细胞相比,双靶点CAR-T细胞显示出较低的抑制性受体表达和较低的分化特性,从而在PD-L1高表达的肿瘤异种移植模型中产生了强大的抗肿瘤作用,并延长了生存期。
3.4 三靶点CAR-T
为了进一步解决肿瘤抗原逃逸,克服耐药性问题,目前也积极在开发三靶点的CAR-T。该类型CAR-T细胞是由三个靶向有效抗原的CAR组成的单一工程T细胞。Miltenyi Biotec公司的一个科学家团队报道了CD19-CD20-CD22三靶点CAR-T细胞研究成果,他们表明,在体外和B-ALL小鼠模型中,CD19-CD20-CD22 CAR-T细胞能够有效控制CD19抗原逃逸的肿瘤,可用于顽固性疾病患者的抢救或一线CAR治疗[32]。在胶质母细胞瘤的治疗中,虽然双特异性CAR-T带来一些希望,但因患者肿瘤表面抗原表达的差异性,双特异性CAR-T仍不能提供足够的抗原覆盖。Bielamowicz[33]团队设计了同时串联靶向HER2、IL13Rα2和EphA2的三靶点CAR-T细胞用以克服患者之间的变异性,这些细胞实现了GBM肿瘤细胞近100%的捕获率并发挥强大的抗肿瘤作用。他们表明,三靶点CAR-T细胞的功能增强可能是由增强的T细胞激活信号,广泛的肿瘤抗原覆盖范围和强大的免疫突触形成而引起的。此外,贝勒医学院的研究人员还开发出了一种新型CAR-T(Smar T),可独立识别前列腺干细胞抗原(PSCA)和TGF-β、IL-4,传递独立的信号包括:抗原识别,共刺激和细胞因子分泌,当三种关键信号被识别并传递给T细胞后,T细胞就会被激活并在肿瘤部位扩增,同时抵抗肿瘤环境的抑制作用,确保其持续的长期生存和效应功能[34]。这种新型CAR-T有望成为多靶点CAR-T的发展方向。未来需要更多的优化靶点设计,更合理的逻辑门控系统来增加CAR-T细胞的治疗智能化。
4 多靶点CAR-T的未来发展方向
4.1 提高安全性能
提高安全性的最好办法是寻找特异性好的靶点,目前一些常用的靶点如:间皮素(mesothelin, MSLN)、神经节苷脂2(GD2)、人类表皮生长因子受体2(human epidermal growth factor receptor 2, Her-2)、癌胚抗原(carcinoembryonic antigen, CEA)、前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)等,但这些靶点虽然在肿瘤中高表达,在正常组织中也有少量表达,因此都只能称为肿瘤相关性抗原(TAA)。除了寻找特异性更高的靶点外,另一种策略是引入自杀基因,即在CAR-T产生不良毒性作用的时候终止CAR-T。单纯疱疹病毒-胸苷激酶(Herpes simplex vires-derived enzyme thymidine kinase, HSV-TK)是一种高度免疫原性的病毒衍生蛋白,能将前体药物更昔洛韦(ganciclovir, GCV)转化为GCV-三磷酸,通过阻断DNA合成导致细胞死亡。将HSV-TK基因插入至CAR-T,使其对抗病毒药物GCV敏感,以此控制CAR-T的存活[35]。另一种是诱导型半胱氨酸蛋白酶9(inducible caspase 9, iCasp9)系统,iCasp9的诱导依赖于小分子二聚体药物AP1903,二聚能快速诱导转染细胞凋亡,优先杀死表达高水平转基因的活化细胞。Klopp等[36]观察到注射iC9二聚体后1~6 h,血液和脾脏中的CAR-T细胞减少了90%以上,肝脏中的CAR-T细胞减少了99%以上,从而限制了肝毒性并阻止了细胞因子的分泌。
4.2 提高CAR-T归巢
在实体肿瘤中,肿瘤血管屏障、细胞外基质、肿瘤微环境的抑制因子等因素,共同阻碍了静注药物的疗效。CAR-T细胞在注射后往往不能有效到达肿瘤深处发挥作用,甚至过早衰竭,因此如何提高CAR-T的归巢是其发挥作用的前提。最直接的方法是将CAR-T细胞局部作用于肿瘤部位,比如在胸膜内注射靶向间皮素抗原的CAR-T[37]、颅内注射IL-13Rα2-CAR-T细胞等[38],都能够使患者的生存期显著延长。另一种想法是增强CAR-T趋化性,Wang等[39]设计了一种特异性针对肿瘤抗原间皮素(MSLN-CAR)的CAR与细胞趋化因子受体CCR2b或CCR4共表达,显著增强了其迁移和浸润到肿瘤组织中的地方。
4.3 CAR-T联合其他抗肿瘤方案
联合疗法往往能产生协同作用,可能增加CAR-T功效。放化疗是最常见的临床肿瘤治疗方案,放疗可以促进肿瘤相关抗原和压力信号的释放,引发非放疗部位肿瘤的消退,这种效应被称为“远隔效应”。此外低剂量化疗可清除负性调节免疫细胞,重塑免疫微环境,提高CAR-T细胞的增殖和免疫活性。在一项报道中,42例复发或难治性(R/R)侵袭性B细胞淋巴瘤患者在经过大剂量化疗后的自体干细胞移植(HDT-ASCT)后,输注了CD19/22 CAR-T细胞,总体缓解率达到90.5%,持续完全缓解(CR)患者中,分别有97.1%和68.6%在3个月时持续检测到CD19和CD22CAR基因表达,说明CAR-T的持久性在化疗后得到了延长[40]。
新兴的光热疗法也有较好的前景[41],光热治疗肿瘤是将光热转换材料注射入生物体内部或肿瘤,在特定的外部光源照射下将光能转化为热能,达到“烧死”肿瘤的目的。肿瘤的轻度热疗可降低其致密结构和组织间液压力,增加血液灌注,释放抗原,促进内源性免疫细胞的招募。Chen等[42]运用了装载吲哚菁绿(ICG)的聚乳酸-乙醇酸(PLGA)纳米颗粒,通过红外照射造成局部升温,增加了血液灌注,改变了肿瘤局部微环境,能够提高CAR-T在肿瘤局部的浸润。
此外,由于程序性死亡受体(PD-1)介导的T细胞抑制作用是肿瘤细胞逃逸的关键机制之一,联合PD-1或PD-L1抗体或阻断剂能够有效避免免疫抑制。Zah联合了BCMA-CD319的双靶点CAR-T与PD-1阻断剂治疗,加速了体内肿瘤的初始清除率,获得治疗的持久性[43]。这种强强联合的策略,可能成为一种有效克服肿瘤进展和转移的策略。
5 结语与展望
总之,CAR-T细胞治疗恶性肿瘤还有着广阔的研究空间,虽然在血液肿瘤中的应用较为成功,但仍需解决的问题是:如何提高CAR-T治疗效力,维持CAR-T在体内的有效增殖,减少耗竭,不仅在于CAR-T的自身设计,也与肿瘤类型和免疫微环境状态息息相关。从单靶点到多靶点的演变,逐渐克服CAR-T治疗的安全性、有效性和可行性等问题,在加强自身武器的同时,通过对肿瘤微环境的调节可促进CAR-T更有效地发挥功能。随着人们对肿瘤的逐渐认知,个性化、智能化地改造T细胞,使其具有更高的靶向杀伤功能,这无疑是攻克肿瘤的有力武器。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:张鹏:实验实施,论文撰写杨倩:实验数据分析易东风:实验设计及论文审校 -
-
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Lobo N, Mount C, Omar K, et al. Landmarks in the treatment of muscle-invasive bladder cancer[J]. Nat Rev Urol, 2017, 14(9): 565-574. doi: 10.1038/nrurol.2017.82
[3] Felsenstein KM, Theodorescu D. Precision medicine for urothelial bladder cancer: update on tumour genomics and immunotherapy[J]. Nat Rev Urol, 2018, 15(2): 92-111. doi: 10.1038/nrurol.2017.179
[4] Alifrangis C, Mcgovern U, Freeman A, et al. Molecular and histopathology directed therapy for advanced bladder cancer[J]. Nat Rev Urol, 2019, 16(8): 465-483. doi: 10.1038/s41585-019-0208-0
[5] Nadal R, Bellmunt J. Management of metastatic bladder cancer[J]. Cancer Treat Rev, 2019, 76: 10-21. doi: 10.1016/j.ctrv.2019.04.002
[6] Gorgoulis V, Adams PD, Alimonti A, et al. Cellular Senescence: Defining a Path Forward[J]. Cell, 2019, 179(4): 813-827. doi: 10.1016/j.cell.2019.10.005
[7] Baker DJ, Childs BG, Durik M, et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan[J]. Nature, 2016, 530(7589): 184-189. doi: 10.1038/nature16932
[8] Wang B, Kohli J, Demaria M. Senescent Cells in Cancer Therapy: Friends or Foes?[J]. Trends Cancer, 2020, 6(10): 838-857. doi: 10.1016/j.trecan.2020.05.004
[9] Cuollo L, Antonangeli F, Santoni A, et al. The Senescence-Associated Secretory Phenotype (SASP) in the Challenging Future of Cancer Therapy and Age-Related Diseases[J]. Biology (Basel), 2020, 9(12): 485.
[10] Lin W, Wang X, Wang Z, et al. Comprehensive Analysis Uncovers Prognostic and Immunogenic Characteristics of Cellular Senescence for Lung Adenocarcinoma[J]. Front Cell Dev Biol, 2021, 9: 780461. doi: 10.3389/fcell.2021.780461
[11] Kim WJ, Kim EJ, Kim SK, et al. Predictive value of progression-related gene classifier in primary non-muscle invasive bladder cancer[J]. Mol Cancer, 2010, 9: 3. doi: 10.1186/1476-4598-9-3
[12] Mariathasan S, Turley SJ, Nickles D, et al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells[J]. Nature, 2018, 554(7693): 544-548. doi: 10.1038/nature25501
[13] Avelar RA, Ortega JG, Tacutu R, et al. A multidimensional systems biology analysis of cellular senescence in aging and disease[J]. Genome Biol, 2020, 21(1): 91. doi: 10.1186/s13059-020-01990-9
[14] Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of Cellular Senescence[J]. Trends Cell Biol, 2018, 28(6): 436-453. doi: 10.1016/j.tcb.2018.02.001
[15] Hanahan D. Hallmarks of Cancer: New Dimensions[J]. Cancer Discov, 2022, 12(1): 31-46. doi: 10.1158/2159-8290.CD-21-1059
[16] Birch J, Gil J. Senescence and the SASP: many therapeutic avenues[J]. Genes Dev, 2020, 34(23-24): 1565-1576. doi: 10.1101/gad.343129.120
[17] van Deursen JM. Senolytic therapies for healthy longevity[J]. Science, 2019, 364(6441): 636-637. doi: 10.1126/science.aaw1299
[18] Dimri GP, Lee X, Basile G. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proc Natl Acad Sci U S A, 1995, 92(20): 9363-9367. doi: 10.1073/pnas.92.20.9363
[19] Qi W, Cooke LS, Liu X, et al. Aurora inhibitor MLN8237 in combination with docetaxel enhances apoptosis and anti-tumor activity in mantle cell lymphoma[J]. Biochem Pharmacol, 2011, 81(7): 881-890. doi: 10.1016/j.bcp.2011.01.017
[20] Massó-Vallés D, Soucek L. Blocking Myc to Treat Cancer: Reflecting on Two Decades of Omomyc[J]. Cells, 2020, 9(4): 883. doi: 10.3390/cells9040883
[21] Vail ME, Murone C, Tan A, et al. Targeting EphA3 inhibits cancer growth by disrupting the tumor stromal microenvironment[J]. Cancer Res, 2014, 74(16): 4470-4481. doi: 10.1158/0008-5472.CAN-14-0218
[22] Swords RT, Greenberg PL, Wei AH, et al. KB004, a first in class monoclonal antibody targeting the receptor tyrosine kinase EphA3, in patients with advanced hematologic malignancies: Results from a phase 1 study[J]. Leuk Res, 2016, 50: 123-131. doi: 10.1016/j.leukres.2016.09.012
-
期刊类型引用(11)
1. 鲁朝霞,马骥雄,马菊红,周红,薛娟娟,丁高恒,王引弟,吕珍,刘玉琴,王犇,陈莉莉. 2010-2019年甘肃省肿瘤登记地区肺癌发病的流行病学特征分析. 中国肺癌杂志. 2024(02): 88-95 .  百度学术
百度学术
2. 石安霞,许慧琳,李为希,程颖玲,周洁,李俊. 2013—2019年上海市闵行区肺癌流行特征趋势分析. 中国肿瘤. 2024(03): 223-231 .  百度学术
百度学术
3. 袁茹,陆颍,史江,石孝净. 基于计划外再入院风险模型的早期预见性干预在老年非小细胞肺癌手术患者中的应用. 中华现代护理杂志. 2024(08): 1100-1104 .  百度学术
百度学术
4. 陆恩宁,高田静,朱云峰,江涛. 2009—2020年浙江省海宁市肺癌发病与死亡分析. 中国肿瘤. 2024(04): 294-301 .  百度学术
百度学术
5. 王飞,郭赜铭,李纪宾,曹巍,董学思,王晨冉,李霓. 中国肺癌高发现场研究进展. 肿瘤综合治疗电子杂志. 2024(04): 14-19 .  百度学术
百度学术
6. 古扎努尔·尼牙孜,袁浩冉,丁高恒,王宏宗,马琴,夏小军,刘玉琴. 2018年甘肃省肿瘤登记地区肺癌流行特征及2010—2018年变化趋势. 中国肿瘤. 2023(02): 111-117 .  百度学术
百度学术
7. 吕艺,张馨予,聂慧芳,赵雪,李恂. 2011~2018年沈阳市城区居民肺癌发病及死亡趋势分析. 肿瘤预防与治疗. 2023(02): 117-124 .  百度学术
百度学术
8. 王永亮,许龙,李吉尧,臧其威. 低剂量螺旋CT结合血浆DAPK、MGMT甲基化检测在肺癌早期筛查诊断中的应用价值. 中国肿瘤外科杂志. 2023(05): 459-463 .  百度学术
百度学术
9. 周子寒,李秋林,余家华,容敏华,曹骥,葛莲英,唐卫中,余红平. 2017年广西肿瘤登记地区恶性肿瘤流行特征及疾病负担分析. 中国癌症防治杂志. 2022(03): 264-273 .  百度学术
百度学术
10. 王芳,周秋云,鲁涛. 亚胺培南西司他丁钠或美罗培南治疗早期肺癌合并重症肺部感染. 中国临床研究. 2022(09): 1305-1309 .  百度学术
百度学术
11. 王艳平,武萌,刘蓉,邱琳. 2013—2017年陕西省肿瘤登记地区肺癌发病与死亡趋势分析. 中国肿瘤. 2022(11): 878-884 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载: