Construction and Validation of A Risk Model for Predicting Prognosis and Immunotherapy Response of Bladder Cancer Based on Cellular Senescence-related Genes
-
摘要:目的
通过构建细胞衰老相关标志(SRS)风险评分模型评估膀胱癌的预后和对免疫治疗的反应,探讨SRS在膀胱癌中的临床应用价值。
方法从TCGA-BLCA筛选出细胞衰老基因,根据LASSO回归筛选出其中的细胞衰老相关标志基因。基于衰老标志基因构建膀胱癌风险评分模型分析TCGA-BLCA高、低风险组的生存差异和模型拟合度,单因素、多因素Cox回归分析膀胱癌预后危险因素。分析GEO-BLCA、IMvigor210数据库中高、低风险组的总体生存差异和免疫治疗反应。根据膀胱癌组织和正常癌旁组织中β-gal显色反应,明确膀胱癌组织中是否存在细胞衰老。
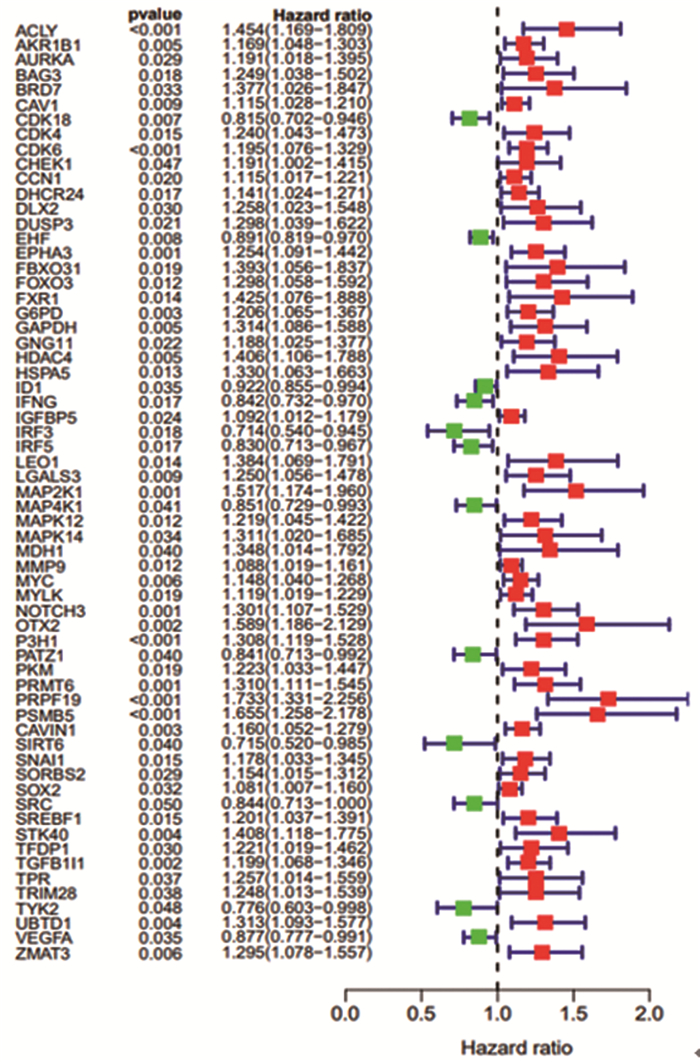
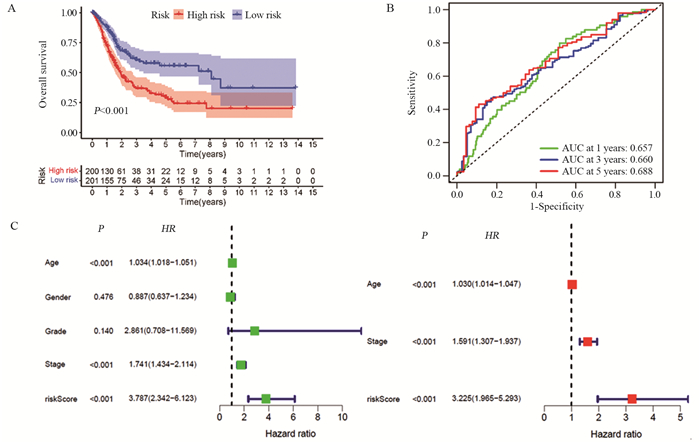
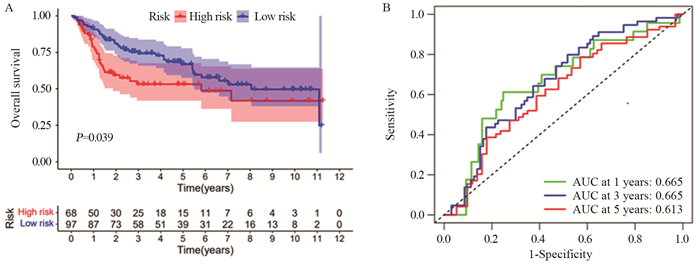
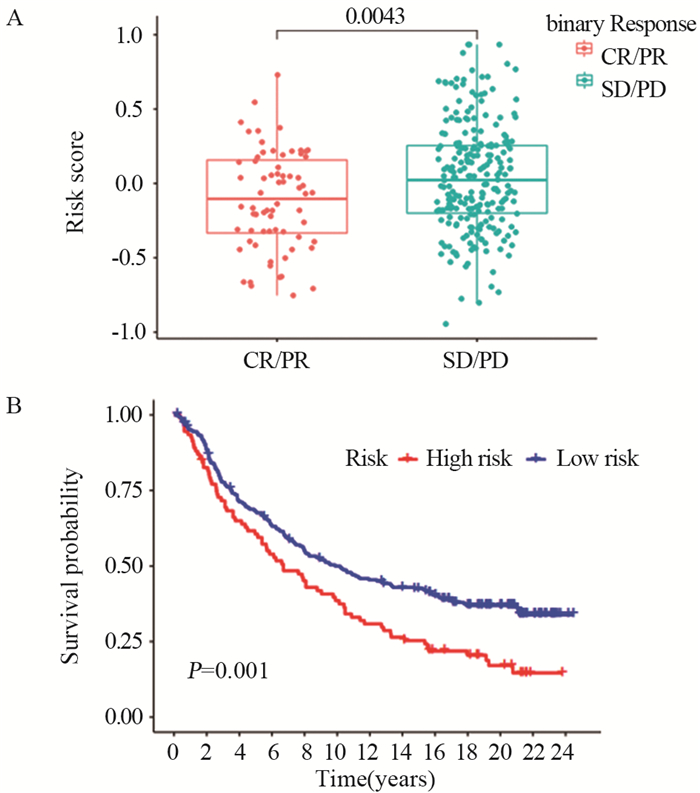
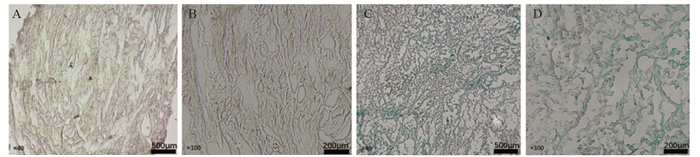
结果共筛选出8个细胞衰老标志基因,根据标志基因构建的风险评分中位数将患者分为高、低风险组。高风险组患者的5年生存率低于低风险组患者(训练集及验证集P < 0.05),TCGA-BLCA和GSE13507患者1、3、5年OS的ROC曲线下面积分别为0.657、0.660、0.688和0.665、0.665、0.613。SRS风险评分可作为膀胱癌患者预后的独立危险因素,膀胱癌免疫治疗中反应组较非反应组的SRS风险评分更低(P < 0.05)。膀胱癌组织β-gal染色阳性,癌旁正常组织β-gal染色阴性。
结论膀胱癌组织中存在细胞衰老现象,SRS风险评分可以预测膀胱癌患者的临床预后,评分较低的患者可以从免疫治疗中获益。SRS是膀胱癌预后和免疫治疗反应的一个可靠的生物标志物。
Abstract:ObjectiveTo evaluate the prognosis and immunotherapy response of patients with bladder cancer by constructing a risk-score model of cellular senescence-related signature (SRS), as well as to explore the clinical application value of SRS in bladder cancer.
MethodsSenescence genes were screened from TCGA-BLCA, and cellular SRS genes were screened according to LASSO regression. A bladder cancer risk-score model was constructed based on the SRS genes to analyze the survival difference and model-fit degree of TCGA-BLCA high- and low-risk groups. Univariable and multivariable Cox regression was used to analyze the prognostic risk factors of bladder cancer. Overall survival differences of high- and low-risk groups in GEO-BLCA database were verified, and variations in immunotherapy responses were analyzed in IMvigor210 databases. According to the result of β-gal chromogenic reaction in bladder cancer and normal paracancer tissues, the existence of cell senescence was determined.
ResultsEight marker genes were screened, and patients were divided into high- and low-risk groups according to the median risk score constructed by the marker genes. The 5-year survival rate of high risk group was lower than that of low risk group (training and validation sets P < 0.05). The area under the ROC curve of TCGA-BLCA in 1-, 3-, and 5-year were 0.657, 0.660, and 0.688, and those for GSE13507 were 0.665, 0.665, and 0.613, respectively. SRS risk score can be used as an independent risk factor for the prognosis of patients with bladder cancer. The SRS risk score in the response group was lower than that in the non-response group during bladder cancer immunotherapy (P < 0.05). The β-gal staining of bladder cancer tissue was positive, but the β-gal staining of adjacent normal tissue was negative.
ConclusionCell senescence occurs in bladder cancer tissues. SRS risk score can predict the clinical prognosis of patients with bladder cancer, and patients with low score can benefit from immunotherapy. SRS is a reliable biomarker for the prognosis and immunotherapy response of bladder cancer.
-
0 引言
根据国际癌症研究机构发布的数据,肺癌是全球第二大常见癌症,约占所有确诊癌症的11.4%[1]。对于非小细胞肺癌(NSCLC),40%的患者会有脑转移瘤(brain metastases, BM),其中约10%的患者在诊断时就已有BM,约30%的患者在病程中会发生BM。腺癌是最具脑转移倾向的病理类型,也是最常见的NSCLC病理类型,约占肺癌的40%[2]。BM患者中,60%~75%的患者有神经系统症状,常见如癫痫、局灶性神经障碍、恶心呕吐、嗜睡等。未经治疗的BM会导致患者病情迅速恶化,因颅内压升高而在4~8周内死亡,初诊NSCLC-BM后经治疗的患者中位生存期仅为4~6个月[3]。绝大多数NSCLC-BM患者在确诊时便已不再适合手术治疗。化疗如抗叶酸制剂联合铂类仍然是目前晚期NSCLC的基石。由于血脑屏障的阻碍,绝大多数化疗药物及靶向TKI类药物对BM的疗效有限。第三代TKI类药物不仅具有较强的抗肿瘤活性,而且对血脑屏障通过率高,往往疗效较好,但是这类药物仅适用于部分常见经典驱动基因突变的症状不明显的患者[2]。目前放射治疗(radiotherapy, RT)仍然是NSCLC-BM重要的无创局部治疗手段,尤其针对有症状、驱动基因阴性、寡转移或是复发脑转移患者。脑部放疗手段主要包括全脑放疗(whole brain radiotherapy, WBRT)、部分脑放疗、立体定向放疗(stereotactic radiotherapy, SRT)及立体定向放射外科(stereotactic radiosurgery, SRS)。有研究发现硬脑膜窦中功能性淋巴管[4],证明免疫治疗对NSCLC-BM具有不可低估的疗效。放疗与免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)联合治疗可通过多种机制发挥协同抗癌效应,是目前NSCLC-BM最有前景的联合治疗手段之一,本文就放疗联合免疫治疗在NSCLC-BM中的应用展开综述。
1 放疗联合免疫治疗治疗NSCLC-BM的理论基础
1.1 放疗增加血脑屏障的通透性
血脑屏障主要由毛细血管内皮间紧密连接、完整基膜、星形胶质细胞膜等组成,可阻止血浆蛋白结合型药物以及免疫性抗体等大分子进入脑内。约100%的大分子和98%的小分子药物会被血脑屏障阻挡[5]。而放疗作为目前用于破坏血脑屏障的三种手段之一,可以在对颅脑病灶进行照射治疗时,进一步增加药物对颅脑病灶的疗效[6]。无论低、中、高剂量的照射,都可对血脑屏障产生有效且可逆的破坏作用。在一项临床前研究中[7],成年小鼠分别接受0.1、2、10 Gy的局部颅脑照射后,各组小鼠的血脑屏障通透性在1周内都增加了约2倍,并在26周时恢复至基线水平。相关临床研究也从血脑屏障的角度探索了可能存在的最佳放疗剂量以及时机。一项对14例脑肿瘤患者的观察性研究结果显示[8],当肿瘤区照射剂量达到20~30 Gy时,其血脑屏障通透性平均增加了24.7%,并且在8个月后逐步恢复至正常水平,研究过程中没有患者出现严重不良反应或长期并发症。另一项基于30例脑转移瘤患者、共计64处脑病灶的前瞻性研究[9]表明,脑转移瘤可根据血脑屏障通透性分为高渗性病灶和低渗性病灶,低渗性病灶在接受放疗1月后,血脑屏障通透性显著升高(P=0.01),而高渗性病灶在接受放疗1月后血脑屏障通透性没有显著变化(P > 0.05)。由于血脑屏障的检测手段如定量DCE-MRI的临床应用仍然不够成熟,故而该研究表明,应该在放疗后2~4周开始系统性药物治疗,从而确保药物能透过血脑屏障发挥颅内作用。因此,对于NSCLC-BM患者,在放疗总剂量达到20~30 Gy后2~4周开始给药,或许是用来提高药物颅内生物利用度的最佳方式。
1.2 脑部放疗与免疫治疗的协同作用
电离射线除通过损伤细胞DNA从而杀伤肿瘤外,它还具有一定的免疫调节作用。放射治疗可通过诱导免疫原性细胞死亡,增加肿瘤抗原的释放和肿瘤细胞上MHC-Ⅰ类分子的表达,从而激活抗原提呈细胞、CD8+T细胞等启动宿主免疫,募集细胞因子、趋化因子来吸引这些免疫细胞进入辐射微环境,诱导钙质网蛋白的释放以及损伤相关分子模式,最终提高受照射肿瘤对免疫治疗的敏感度[10]。一项基于小鼠模型的研究表明[11],接受脑部放疗联合PD-1抑制剂后可促进局部的T淋巴细胞浸润,从而延缓肿瘤进展。放疗的远隔效应与ICI也具有协同效应,其主要机制是延长细胞毒性T细胞和自然杀伤细胞的诱导,以及抑制骨髓来源抑制细胞、M2型巨噬细胞和调节性T细胞等促瘤细胞的生长[12],并且这种远隔效应可能跨越血脑屏障[13]。ICI药物也具有良好的放疗增敏作用。一项体外研究表明[14],放疗可通过PI3K/AKT信号转导和转录激活蛋白-3通路来上调PD-L1的表达,从而导致免疫耐受,PD-L1可通过刺激细胞迁移,促进上皮-间充质转化过程,从而导致辐射抵抗,而PD-1/PD-L1抑制剂可解除这种放疗所引起的免疫耐受和PD-L1上调所引起的放疗抵抗。一项纳入了32篇临床前研究以及9篇临床研究的Meta分析提示[15],ICI的辐射增强效应(REF)为0.4~80,是传统放疗增敏剂顺铂的4~800倍,在同步给药时具有更好的放疗增敏效果。可见,ICI药物具有良好的放疗增敏效果,并且可通过多种机制与脑部放射治疗相互协同,增强抗肿瘤效应。
2 放疗联合免疫治疗治疗NSCLC-BM的临床疗效及安全性
2.1 全脑放疗联合免疫治疗
WBRT作为针对BM的传统放疗方式,与PD-1抑制剂联合治疗NSCLC-BM具有较大前景。Liao等[16]回顾性分析了70例NSCLC-BM患者,结果表明,PD-1抑制剂联合WBRT较单纯WBRT显著提高了中位生存期(mOS)(27 vs. 20月,P=0.035),同时不增加不良反应(OR=0.94, P=0.879),但两组间中位无进展生存期(mPFS)差异无统计学意义(12 vs. 7月, P=0.247)。而Khan等[17]回顾性研究则发现,WBRT联合PD-1抑制剂较单独WBRT显著延长了NSCLC-BM患者的PFS(11 vs. 3月, P=0.016),但联合组的OS改善却无统计学意义(24 vs. 13月, P=0.107),该研究样本量太小故没有进行安全性分析。Hubbeling等[18]回顾性地对163例NSCLC-BM患者的安全性分析表明,与单独放疗相比,放疗(WBRT/部分脑放疗/SRS)联合ICI治疗NSCLC-BM是安全的,最常见的不良事件(adverse events, AE)为乏力(76%)、放射性皮炎(48%)、WBRT相关认知障碍(41%)和SRS相关头痛(26%),其中绝大多数都是1~2级AE。由此可见,WBRT联合PD-1抑制剂对于NSCLC-BM患者是安全的,并且可能延长患者的OS或PFS,但仍需要高质量的临床研究来进一步证实。此外,目前无WBRT联合PD-1抑制剂提高颅内病灶控制率的结果报道,可能是因为WBRT较SRS肿瘤区生物剂量受限而未能提高局部控制率。
2.2 SRS联合免疫治疗
随着精准放疗技术的快速发展,立体定向放射外科治疗在临床诊疗中得到了广泛应用。在治疗BM方面,SRS最初仅用于治疗孤立性病灶,但目前已有研究表明,SRS对于≤20个颅内病灶患者的疗效都要优于WBRT,同时SRS可避免电离射线对大脑重要区域(如海马回)的损伤,明显减少或延缓患者出现神经认知和学习功能障碍[19-20]。SRS具有靶区剂量高、周围组织受量小、仅需单次或超低分割照射即可完成治疗的优点,临床上SRS与ICI联合应用的间隔时间往往较短。已有较多研究表明SRS联合ICI能改善BM患者的预后或局部控制,Shepard等[21]回顾性匹配队列研究显示,与单独ICI相比,SRS联合ICI显著提高了NSCLC-BM患者的颅内完全缓解率(8/16 vs. 5/32, P=0.012)以及缩短了脑部病灶的中位消退时间(2.5 vs. 3.1月,P < 0.0001),而且联合治疗组的放射性坏死或瘤内出血风险(P=0.99)、瘤周水肿进展率(P=0.162)都没有显著增加。这表明SRS联合ICI不仅能更有效地促进NSCLC-BM病灶的消退,并且具有良好的安全性。但是从长远来看,该研究中联合治疗组的OS(HR=0.99, P=0.99)和颅内PFS(P=0.42)却没有显著改善。而在Enright等[22]对77例NSCLC-BM患者的回顾性分析中,接受SRS-ICI联合治疗较单纯SRS预示着更好的OS(HR=0.46, P=0.03)及更好的安全性。然而,Martin等[23]研究却发现SRS-ICI联合治疗较单纯SRS与放射性坏死(radionecrosis, RN)显著相关(HR=2.56, P=0.004),但这项研究混杂了较多黑色素瘤和肾细胞癌来源BM的患者。可见,SRS联合ICI可更快速、更有效地局部控制NSCLC-BM病灶,并且可能改善患者的预后,同时也可能增加RN风险,这值得警惕,但考虑到SRS较WBRT的优势,SRS联合ICI对于NSCLC-BM的临床应用前景仍然值得期待。
总之,目前已有较多回顾性研究证明放疗联合ICI在改善预后或局部控制方面优于单纯放疗,但也可能增加放射性不良反应的风险,并且缺乏随机对照研究进一步验证。
2.3 不同免疫治疗类型联合放疗
在ICI药物方面,ICI类型也可能影响这种联合治疗对于NSCLC-BM的安全性。一项纳入19项临床试验的Meta分析[24]表明,PD-1抑制剂治疗NSCLC时的肺炎发生率显著高于PD-L1抑制剂(3.6% vs. 1.3%, P=0.001),这是因为与PD-L1抑制剂相比,PD-1抑制剂可打破巨噬细胞PD-L2稳态从而降低免疫耐受,导致免疫性肺炎。对于放疗联合ICI治疗NSCLC-BM,目前没有研究报道PD-L1抑制剂与PD-1抑制剂之间的安全性差异,可能因为这些研究中使用PD-L1抑制剂的NSCLC-BM患者太少。未来随着PD-L1抑制剂在临床上更广泛地应用,这一问题在放疗联合ICI治疗NSCLC-BM的临床实践及研究中值得注意。
此外,已有较多研究表明CTLA-4抑制剂联合放疗对于BM患者可显著改善OS或颅内控制,但是目前CTLA-4抑制剂仅限用于黑色素瘤来源的BM患者[25]。对于NSCLC-BM,目前CTLA-4抑制剂极少应用,Formenti等[26]进行的一项放疗联合伊匹单抗(阻断NSCLC患者CTLA-4信号的抑制剂,ipilimumab)治疗转移性NSCLC(至少有1处远处转移的NSCLC患者)的前瞻性研究中,有高达41%的患者在研究开始时就有预先通过放疗或手术控制的脑转移。这项研究的结果是完成4周期ipilimumab者(n=21, mOS=13月)较未完成者(n=18, mOS=3月)具有显著的生存优势(P < 0.001),并且放疗不会增加ipilimumab的不良反应。这或许可为放疗联合CTLA-4抑制剂在NSCLC-BM的应用提供参考,目前该临床试验(NCT02221739)下一阶段的研究结果尚未公布,值得期待。
3 放疗联合ICI治疗NSCLC-BM的时机
3.1 同步治疗vs.序贯治疗
在联合时机方面,目前大多数关于NSCLC-BM的回顾性研究都支持同步RT-ICI优于单纯放疗或放疗序贯RT-ICI,但对于“同步RT-ICI治疗”定义中的RT-ICI间隔时间缺乏统一意见,较为常见的间隔时间为2周、4周、3月。Yang等[27]纳入了19项RT联合ICI治疗NSCLC-BM回顾性研究的Meta分析提出,以最常用的定义即“启动放疗之前或之后4周开始ICI”作为“同步RT-ICI治疗”的标准,进一步证明了同步RT-ICI治疗较单纯放疗(HR=0.77, P < 0.001)和序贯治疗(HR=0.39, P=0.043)的生存优势,同时不增加神经AE风险(RR=1.44, P=0.34)。
3.2 同步治疗下的最佳时间及顺序
在同步治疗的前提下,RT-ICI之间的间隔时间以及RT-ICI的顺序也可能会影响NSCLC-BM的疗效。
在时间方面,Scoccianti等[28]对100例接受间隔时间4周内同步SRT-ICI治疗的NSCLC-BM患者进行了更深入的亚组分析,发现接受SRT-ICI间隔时间为1~4周的同步治疗亚组与接受SRT-ICI间隔时间≤1周的同步治疗亚组相比,表现出更短的OS(经倾向性评分调整后HR=6.97, P=0.008),并且两亚组间RN发生率差异无统计学意义(P=0.68)。可见更短SRT-ICI间隔时间的同步治疗可能使NSCLC-BM患者有更好的生存获益。然而在Lee等[29]研究中,SRS-ICI间隔时间≤14天同步治疗组(n=24)的中位OS却低于SRS-ICI间隔时间 > 14天的联合治疗组(n=27)(22.5 vs. 42.1月)。但是Lee等研究纳入的病例数较少,且没有报道统计学检验结果,因此Scoccianti等的研究结论似乎更具说服力。
在顺序方面,Scoccianti等[28]研究表明,先SRT后ICI(SRT→ICI)较先ICI后SRT(ICI→SRT)可能具有OS优势(经倾向性评分调整后HR=0.74, P=0.574),尤其对已有颅内外进展的患者OS优势具有统计学意义(经倾向性评分调整后P=0.037),但研究中没有描述SRT→ICI亚组与ICI→SRT亚组之间的安全性差异。而Hubbeling等研究中[18],RT与ICI的顺序不会影响NSCLC-BM的总体AE以及≥3级AE发生率,但该研究中RT→ICI亚组、ICI→RT亚组的定义间隔时间较长。Cabanie等[30]研究将接受同步SRT-ICI治疗(放疗之前或之后30天内接受ICI治疗)的59例BM患者共103个颅内病灶按照SRT-ICI的间隔时间分为A组(≤7天)、B组(8~14天)、C组(15~30天),其研究结果表明,SRT与ICI的间隔时间及顺序都不是影响颅内RN及≥3级AE发生率的显著预后因素,但是该研究纳入的病例中仅60%的BM病灶是来源于NSCLC,另外40%为黑色素瘤。
总的来说,更短SRT-ICI间隔时间即≤1周的同步治疗以及SRT→ICI的治疗顺序可能对NSCLC-BM疗效最佳,但缺乏更多的研究来支持这一观点。
3.3 根据ICI药物半衰期调整同步治疗中RT-ICI的间隔时间
目前,包括Scoccianti等[28]研究在内的绝大多数研究中所涉及的ICI药物几乎仅限于nivolumab、pembrolizumab、atezolizumab,它们在体内的半衰期(t1/2)相近且都接近4周,分别为25.2天、25天、27天,这或许也是大多数研究将同步治疗中RT-ICI的间隔时间设为4周的原因之一。而durvalumab、Avelumab等ICI药物的t1/2明显更短,分别为18天、6.1天。如果按统一的RT-ICI间隔时间来定义“同步治疗”,那么研究中涉及不同ICI药物的半衰期差异可能会对研究结果产生偏倚。而Kotecha等[31]的大型回顾性队列研究以t1/2来定义同步治疗,将同步SRS-ICI队列定义为“SRS之前或之后5倍t1/2内接受该ICI治疗”,在同步SRS-ICI队列中设置立即SRS-ICI亚队列即“SRS之前或之后t1/2内接受该ICI治疗”,结果虽然同步SRS-ICI队列的局部最佳总体反应率(-67% vs. -57%, P=0.014)、完全缓解率(42% vs. 33%, P < 0.05)、12个月持续缓解率(86% vs. 72%, P=0.005)显著优于单纯放疗队列,但是立即SRS-ICI亚队列局部最佳总体反应率(−100%)、完全缓解率(50%)、12个月持续缓解率(94%)的优势更加显著,并且联合治疗时机不会增加治疗相关不良反应的风险。这也表明更短SRT-ICI间隔时间的同步治疗更能使NSCLC-BM患者获益,但是这项研究与Scoccianti等研究中对于更短SRT-ICI间隔时间的定义不同。未来的大型回顾性研究以及前瞻性研究或许可借鉴这两项研究的亚组设置,以进一步确定放疗联合ICI治疗NSCLC-BM的最佳时机。
4 总结与展望
放疗联合ICI可通过多种机制对NSCLC-BM产生协同作用,并且这种联合治疗手段对于NSCLC-BM的疗效及安全性已经被较多的回顾性研究认可,但存在可能增加放射性不良反应风险等问题。在时机方面,更短RT-ICI间隔时间的同步治疗以及在放疗后再给予ICI可能是最佳的联合治疗方式,然而缺乏更多的研究结果来支持这一观点。
放疗联合ICI是对NSCLC-BM最有前景的治疗手段之一,未来的研究应注重根据患者全身状态、颅内病灶数量、病理类型等个体化地决定脑部放疗方式、放疗剂量、ICI类型、调整联合治疗时机、增加联合治疗手段等。相信随着相关Ⅲ期临床研究(NCT05111197、NCT04787185等)的完成,将进一步阐释放疗联合ICI治疗NSCLC-BM的临床疗效和安全性,以及最佳的联合治疗时机。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:张鹏:实验实施,论文撰写杨倩:实验数据分析易东风:实验设计及论文审校 -
-
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Lobo N, Mount C, Omar K, et al. Landmarks in the treatment of muscle-invasive bladder cancer[J]. Nat Rev Urol, 2017, 14(9): 565-574. doi: 10.1038/nrurol.2017.82
[3] Felsenstein KM, Theodorescu D. Precision medicine for urothelial bladder cancer: update on tumour genomics and immunotherapy[J]. Nat Rev Urol, 2018, 15(2): 92-111. doi: 10.1038/nrurol.2017.179
[4] Alifrangis C, Mcgovern U, Freeman A, et al. Molecular and histopathology directed therapy for advanced bladder cancer[J]. Nat Rev Urol, 2019, 16(8): 465-483. doi: 10.1038/s41585-019-0208-0
[5] Nadal R, Bellmunt J. Management of metastatic bladder cancer[J]. Cancer Treat Rev, 2019, 76: 10-21. doi: 10.1016/j.ctrv.2019.04.002
[6] Gorgoulis V, Adams PD, Alimonti A, et al. Cellular Senescence: Defining a Path Forward[J]. Cell, 2019, 179(4): 813-827. doi: 10.1016/j.cell.2019.10.005
[7] Baker DJ, Childs BG, Durik M, et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan[J]. Nature, 2016, 530(7589): 184-189. doi: 10.1038/nature16932
[8] Wang B, Kohli J, Demaria M. Senescent Cells in Cancer Therapy: Friends or Foes?[J]. Trends Cancer, 2020, 6(10): 838-857. doi: 10.1016/j.trecan.2020.05.004
[9] Cuollo L, Antonangeli F, Santoni A, et al. The Senescence-Associated Secretory Phenotype (SASP) in the Challenging Future of Cancer Therapy and Age-Related Diseases[J]. Biology (Basel), 2020, 9(12): 485.
[10] Lin W, Wang X, Wang Z, et al. Comprehensive Analysis Uncovers Prognostic and Immunogenic Characteristics of Cellular Senescence for Lung Adenocarcinoma[J]. Front Cell Dev Biol, 2021, 9: 780461. doi: 10.3389/fcell.2021.780461
[11] Kim WJ, Kim EJ, Kim SK, et al. Predictive value of progression-related gene classifier in primary non-muscle invasive bladder cancer[J]. Mol Cancer, 2010, 9: 3. doi: 10.1186/1476-4598-9-3
[12] Mariathasan S, Turley SJ, Nickles D, et al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells[J]. Nature, 2018, 554(7693): 544-548. doi: 10.1038/nature25501
[13] Avelar RA, Ortega JG, Tacutu R, et al. A multidimensional systems biology analysis of cellular senescence in aging and disease[J]. Genome Biol, 2020, 21(1): 91. doi: 10.1186/s13059-020-01990-9
[14] Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of Cellular Senescence[J]. Trends Cell Biol, 2018, 28(6): 436-453. doi: 10.1016/j.tcb.2018.02.001
[15] Hanahan D. Hallmarks of Cancer: New Dimensions[J]. Cancer Discov, 2022, 12(1): 31-46. doi: 10.1158/2159-8290.CD-21-1059
[16] Birch J, Gil J. Senescence and the SASP: many therapeutic avenues[J]. Genes Dev, 2020, 34(23-24): 1565-1576. doi: 10.1101/gad.343129.120
[17] van Deursen JM. Senolytic therapies for healthy longevity[J]. Science, 2019, 364(6441): 636-637. doi: 10.1126/science.aaw1299
[18] Dimri GP, Lee X, Basile G. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proc Natl Acad Sci U S A, 1995, 92(20): 9363-9367. doi: 10.1073/pnas.92.20.9363
[19] Qi W, Cooke LS, Liu X, et al. Aurora inhibitor MLN8237 in combination with docetaxel enhances apoptosis and anti-tumor activity in mantle cell lymphoma[J]. Biochem Pharmacol, 2011, 81(7): 881-890. doi: 10.1016/j.bcp.2011.01.017
[20] Massó-Vallés D, Soucek L. Blocking Myc to Treat Cancer: Reflecting on Two Decades of Omomyc[J]. Cells, 2020, 9(4): 883. doi: 10.3390/cells9040883
[21] Vail ME, Murone C, Tan A, et al. Targeting EphA3 inhibits cancer growth by disrupting the tumor stromal microenvironment[J]. Cancer Res, 2014, 74(16): 4470-4481. doi: 10.1158/0008-5472.CAN-14-0218
[22] Swords RT, Greenberg PL, Wei AH, et al. KB004, a first in class monoclonal antibody targeting the receptor tyrosine kinase EphA3, in patients with advanced hematologic malignancies: Results from a phase 1 study[J]. Leuk Res, 2016, 50: 123-131. doi: 10.1016/j.leukres.2016.09.012
-
期刊类型引用(1)
1. 张群,周士祥,时雪玲,余定玥,周莹,于佳琪,李多杰. 驱动基因阴性非小细胞肺癌脑转移免疫治疗联合放疗疗效分析. 中华全科医学. 2025(01): 17-20+64 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: