-
摘要:目的
探讨光动力治疗对胆道恶性梗阻的疗效和安全性。
方法回顾性分析我中心接受经皮光动力治疗的胆管恶性梗阻患者临床资料,根据是否联合介入、靶向或免疫治疗分为光动力组和联合组。观察治疗后肝功能变化、胆道通畅时间及术后1月内并发症。
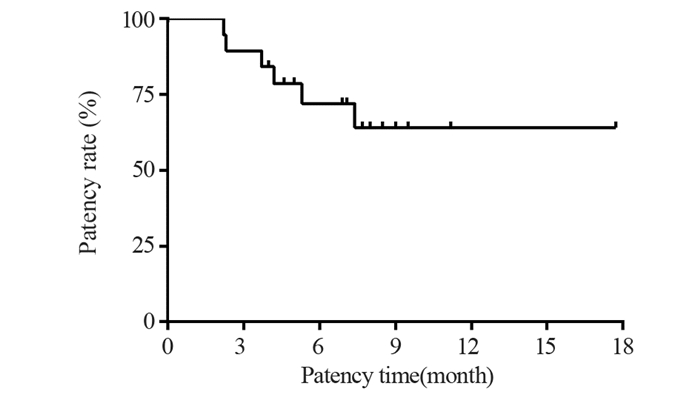
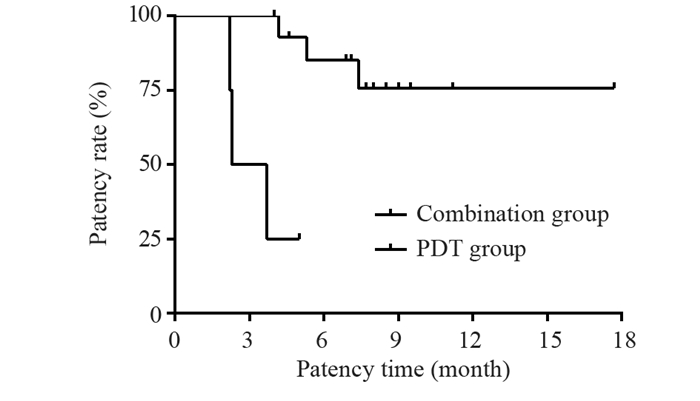
结果共入组19位患者,光动力治疗成功率达100%。术后1月未观察到肝功能下降。最长随访时间17.7月,术后1、3、6和12月胆道通畅率分别为100%、89.5%、72%和64%,平均胆道通畅时间约6.9±0.8月(95%CI: 5.2~8.7月)。Bismuth Ⅲ型胆道通畅时间7.5±1.1月,Bismuth Ⅳ型胆道通畅时间6.1±1.3月。单纯光动力治疗组胆道通畅时间约3.3±0.7月,联合治疗组患者胆道通畅时间约7.9±0.9月,两组差异具有统计学意义(P=0.017)。
结论光动力治疗Bismuth Ⅲ-Ⅳ型胆道恶性梗阻安全有效,联合全身治疗可使胆道通畅时间显著延长。
Abstract:ObjectiveTo investigate the safety and efficacy of photodynamic therapy (PDT) for malignant obstruction of the biliary tract.
MethodsWe retrospectively analyzed the clinical data of patients with malignant biliary obstruction treated by PDT in our medical center. On the basis of different treatment plans, the patients were categorized into the photodynamic only group and the combined treatment group, in which additional interventional operations, targeted therapy, or immunotherapy were arranged. The alterations in liver function, duration of biliary patency, and postoperative complications that occurred within one month were closely monitored in both groups.
ResultsA total number of 19 patients were enrolled in this study. The technical success rate of PDT was 100%. The deterioration of liver function was not observed in any patients within one month after PDT. Within a maximum of 17.7 months follow-up, the patency rates of the biliary tract were 100.0%, 89.5%, 72%, and 64% at 1, 3, 6, and 12 months after the procedure, respectively. The mean biliary patency time was 6.9±0.8 months (95%CI: 5.2-8.7 months). Specifically, the biliary patency times for Bismuth type Ⅲ and Ⅳ were 7.5±1.1 and 6.1±1.3 months, respectively. The biliary patency time was around 3.3±0.7 months in the photodynamic only group and 7.9±0.9 months in the combined treatment group (P=0.017).
ConclusionPDT for Bismuth Ⅲ-Ⅳ malignant biliary obstruction is safe and effective. Moreover, the period of biliary patency is greatly extended when PDT is combined with systemic therapy.
-
0 引言
在我国,女性乳腺癌的发病率和死亡率已分别上升到女性癌症的第一位和第六位[1]。女性肺癌的发病率在女性恶性肿瘤中居第二位。乳腺癌的发病率虽逐年升高,但其预后相对较好,患者生存期的延长会潜在地增加发生第二原发肿瘤的风险[2-3]。近些年来临床上乳腺癌患者发生原发性肺癌的患者越来越多,易被误诊为乳腺癌合并肺转移,从而影响后续临床治疗和管理。而且当第二原发癌为肺癌时,第一原发癌以乳腺癌最多见[4],因此乳腺癌和肺癌的发生发展可能有着密切关系,本文将对以乳腺癌为首发癌的双原发乳腺癌和肺癌的流行病学、临床病理特征、诊疗等方面的研究进展作一综述,以期为临床实践及研究提供参考。
1 复合癌概念
复合癌又称多原发癌(multiple primary cancer, MPC)、多原发肿瘤(multiple primary malignant tumors,MPMTs)。目前对复合癌广泛采用的定义标准是1932年Warren和Gates提出的:(1)独立起源的恶性肿瘤,排除转移可能; (2)各种癌部位之间具有一定的距离,间隔最少2 cm以上; (3)两种癌治疗周期间隔1年以内为同时性复合癌,间隔1年以上叫异时性复合癌[5-6]。
随着现代肿瘤诊治的进展,MPC发病率呈上升趋势,逐渐成为临床研究的热点。有研究表明一种癌症的发生会增加发现另一种癌症的概率[7-8]。国外报道了MPC的发病率为2%~17%[9],而国内报道为0.84%~1.31%[10]。有文献资料显示,乳腺癌患者将来发生原发性肺癌的概率增高,其患第二原发癌的概率较正常人群高17%,而且第二原发癌的部位和恶性程度是影响预后的主要因素[11-13]。
2 乳腺癌首发的双原发乳腺癌和肺癌流行病学特征
多原发癌是比较罕见的,其中大多数属于异时性多原发癌,同时发生的多原发癌实属少见[14]。2000年1月至2015年12月天津肿瘤医院手术和临床病理诊断为乳腺癌合并肺癌128例双原发癌患者资料发现,乳腺癌作为第一原发癌合并肺癌113例(88.28%),肺癌作为第一原发癌合并乳腺癌15例(11.72%),提示乳腺癌首发的双原发乳腺癌和肺癌的发生率远比肺癌首发的双原发肺癌和乳腺癌的发生率要高[15]。有临床研究表明,乳腺癌发病后出现第二原发癌的中位年龄在55岁左右,其中位间隔时间为48月左右[15-17]。根据一项包含多中心临床研究数据结果表明,乳腺癌发病后继发肺癌的中位年龄为50~59岁,中位间隔时间为43~60月[18],与上述数据一致,提示包括肺癌在内的第二原发癌多出现在首发乳腺癌之后的第4年左右。Shoji等[19]对1 066例乳腺癌手术切除患者和666例肺癌手术切除患者进行了调查研究,发现肺癌倾向于在乳腺癌手术后3年内被发现。因此乳腺癌术后的随访有助于早期肺癌的检测,尤其在乳腺癌术后3~4年,一定要严格监测肺部情况。
研究表明,有肿瘤家族史、吸烟史及放射暴露史的患者,会增加MPC的发生[20-22]。贾玉峰[23]对202例乳腺癌合并肺癌患者进行临床特征比较研究,发现乳腺癌肺癌双原发癌的患者比乳腺癌肺内转移患者的年龄偏大、肿瘤偏小、放疗比例更多。贺科文等[24]在乳腺癌合并原发性肺癌与乳腺癌肺转移患者的临床病理特征分析中也提示,乳腺癌患者的发病年龄偏大和有放疗史是原发肺癌的危险因素。以上可说明,乳腺癌患者的年龄、放疗史、吸烟史、家族肿瘤史及乳腺肿瘤大小均对包括肺癌在内第二原发癌有一定的影响。因此,乳腺癌患者如具有上述危险因素中的一项或多项,则再发肺癌时更倾向于原发肿瘤。
3 乳腺癌首发的双原发乳腺癌和肺癌患者的临床病理特征
有文献[24-27]提示,患者的年龄较大(>50岁),肺部CT征象:磨玻璃影、毛刺征、支气管征、空泡征、胸膜凹陷症时倾向于原发性肺癌; 乳腺癌术后1~3年,肺部CT征象:两肺多发实性结节、分布在肺外周、其他实质脏器检查发现多发结节病灶倾向于肺转移癌。临床上乳腺原发肿瘤大小、腋窝淋巴结是否阳性、临床分期、分子分型、激素受体、Ki-67、P53、手术方式、化疗、是否内分泌治疗、CA125、CA153、CEA为乳腺癌肺转移的危险因素。研究[24, 28]指出,在乳腺癌首发的MPC患者中,第一原发乳腺癌的TNM分期(以Ⅱ期为主)及Luminal B型患者易再发其他恶性肿瘤,而且多原发肿瘤的乳腺癌患者预后取决于第二原发肿瘤的类型及恶性程度。王子祥[29]回顾性研究分析20 909例乳腺癌再发第二肿瘤患者的临床病理特征提示,TNM分期为Ⅱ期的乳腺癌患者,第二肿瘤发生风险高于Ⅲ期和Ⅳ期的患者。何蕴藉等[18]对乳腺癌继发肺癌的流行病学与临床病理特征分析也提示,临床分期为Ⅱ期的乳腺癌患者易发生肺癌,在乳腺癌、肺癌的双原发癌中,乳腺癌分子分型Luminal B型占比最高,而且乳腺癌发病后继发同侧原发性肺癌的比例高达60%左右,肺癌病理类型主要以腺癌为主,因此,提示在诊断为乳腺癌后随访的过程中,需密切关注乳腺癌同侧出现的肺部结节。Liu等[30]报道了一例52岁的乳腺癌女性患者术前查胸部CT时,发现右肺上叶尖段结节,直径约2.1 cm,患者接受了右乳房切除,然后在胸腔镜下楔形切除了右肺结节,最后病理证实为肺腺癌。Takahashi等[31]报道了一例75岁的乳腺癌肺癌同期双原发患者,病变均位于右侧。还有研究报道一例65岁的女性患者为乳腺、肺、甲状腺同时性三原发癌,其中乳腺和肺的病变均位于左侧[32]。
庄竣皓[15]研究中的128例乳腺、肺双原发癌(包含15例以肺癌首发)病理结果显示: 乳腺浸润性导管癌121例(占比高达94.5%),其中合并肺腺癌105例,合并其他类型癌依次为肺鳞癌、非小细胞肺癌及肺癌肉瘤; 乳腺导管内癌4例合并肺腺癌; 乳腺黏液癌伴印戒细胞分化合并肺浸润性腺癌3例,提示乳腺、肺双原发癌时乳腺浸润性导管癌并发肺腺癌占比较高。Liu等[30]报道的1例52岁乳腺癌女性患者,术前查胸部CT发现同侧肺结节,先后行右乳房切除及肺结节楔形切除术,病理证实右乳腺浸润性导管癌及右肺上叶原发性肺腺癌的发生。因此当患者首发乳腺癌病理结果为乳腺浸润性导管癌时,一定要密切关注第二原发癌肺腺癌出现的可能。
4 乳腺癌首发的双原发乳腺癌和肺癌的诊断
当乳腺癌患者发现肺部病变时,定性诊断对患者治疗和预后至关重要,而在乳腺癌首发的患者中,第二原发肺癌以腺癌最多见,其形态与乳腺癌肺转移极为相似,因此对其鉴别难度较大。从上述流行病学的角度出发,可初步预测肺部病变为原发还是来源于乳腺癌转移。有文献从影像学的角度分析,对肺部病变的来源也有一定的判断价值,王升平等[25]回顾性研究116例乳腺癌患者肺内孤立性结节的CT征象,提示实性成份体积比<24%、有毛刺征和支气管充气征等征象时多为原发性肺癌。郭斯明[26]利用高分辨率CT回顾性分析95例乳腺癌伴有孤立性肺部病变患者的胸部图像,发现伴有磨玻璃影、毛刺征、支气管充气征、空泡征、密度不均及胸膜凹陷征时更倾向于原发性肺癌。而对于两肺多发实性结节、分布在肺外周、其他实质脏器检查发现多发结节病灶倾向于肺转移癌。
梁春燕[27]对1 370例乳腺癌患者术后追踪研究发现,有112例发生肺转移,多发生在术后1~3年,利用单因素分析和多因素Logistic回归分析发现原发乳腺癌肿瘤直径 > 2 cm、腋窝淋巴结阳性、Ki-67高表达、P53阳性、血清CA153和CA125升高的患者发生肺转移概率明显增加。蒋雪梅等[33]对140例原发肺腺癌及48例乳腺癌肺转移患者标本采用免疫组织化学法检测发现,在肺原发腺癌中天冬氨酸蛋白酶(Napsin A)、肺泡表面活性蛋白(SP-A)呈强阳性表达而在乳腺癌肺转移患者中呈阴性表达。雌激素受体(ER)和孕激素受体(PR)在乳腺癌肺转移患者中的表达显著高于肺原发性腺癌患者,因此Napsin A、SP-A、ER和PR有助于鉴别转移性乳腺癌和肺原发性腺癌。此外,气管镜检查、影像诊断联合穿刺活检、胸腔镜微创活检和手术对肺部占位的定性诊断以及判断原发性肺癌或转移性肺癌有着极高的临床价值; 对于任何类型的肿瘤,在临床工作中,病理结果才是确诊的金标准,一般新发肿瘤常规病理与第一原发乳腺癌病理作对照,即可明确诊断,还有一部分需进一步加做免疫组织化学及肿瘤标志物检查后才能明确诊断。从病理分子学免疫组织化学水平来讲,表皮生长因子受体(EGFR)在乳腺癌中突变十分罕见[34],TTF-1是一种调节甲状腺和肺特异基因表达的蛋白,主要表达于甲状腺和肺上皮细胞中,在脑组织也有部分表达,乳腺癌组织中不表达[35]。因此,若患者发生EGFR突变或(和)TTF-1表达阳性时,该患者肺癌可被判断为原发性肺癌。
有文献报道1例66岁女性患者,发现右乳肿块后行胸部X线提示右肺中叶结节,多科会诊后,先后行右侧腋窝前哨淋巴结活检、右侧乳腺癌改良根治术、胸腔镜右中上肺楔形切除术等,右乳肿块术后病理检查结果示乳腺浸润性导管癌Ⅱ级; 右肺中叶结节术后病理检查结果示右肺腺癌,免疫组织化学结果示EGFR(+),提示乳腺癌肺癌双原发[36]。娄成等[37]报道了1例45岁女性患者,双侧乳腺占位伴胀痛,行手术治疗,病理提示左乳浸润性导管癌Ⅱ级,未见脉管侵犯。半年后行胸部CT提示:右上肺不规则结节,伴空洞及点状钙化。因PET-CT提示右肺结节、右肺门及纵隔淋巴结高代谢,考虑患者肺部肿瘤分期较晚,遂行肺部肿块穿刺活检,病理提示:右肺浸润性腺癌,免疫组织化学检测:TTF-1(+)、EGFR第21外显子L858R突变,提示均为原发性肿瘤。Jin等[38]报道了一例57岁女性患者,其乳腺癌和两侧肺腺癌均行手术切除。乳腺癌肿瘤组织的EGFR基因分析未发现突变。双肺下叶肺腺癌均存在EGFR基因突变:左侧病变L858R点突变位于第21外显子,右侧病变缺失突变位于第19外显子,EGFR突变提示该患者乳腺癌肺癌为双原发癌。庞丽俊等[39]报道了一例52岁女性患者,行乳腺癌根治术,术后行放化疗,时隔10年后,发现肺门、纵隔及胸膜等多发占位性病变。行多处肺穿刺活检,结果显示一处为EGFR第19外显子突变型,另一处为野生型,提示肺部为原发性肿瘤。以上说明EGFR及TTF-1基因可作为评估肺原发癌的依据,同时从后两个报道的案例中提示患者不仅存在双原发肿瘤,而且肺癌也存在肿瘤异质性(EGFR基因突变类型不同),因此临床实际治疗中应该注意此类问题,以便对患者制订个体化治疗方案。
5 乳腺癌首发的双原发乳腺癌和肺癌的治疗
文献报道乳腺癌首发的乳腺、肺双原发癌患者较肺癌首发的双原发癌患者预后好,异时性双原发癌患者发生率较同时性双原发癌患者高且预后好[15]。目前,在多原发癌治疗方案的选择方面尚无统一标准,多数文献较为一致的是,无论是同时性多原发癌还是异时性多原发癌患者,一般来说,先处理对患者生命威胁大、恶性程度高的肿瘤,尽可能地同时或先后完整地切除病灶,若病灶无法切除,则可以考虑应用免疫治疗、化疗、靶向治疗等综合手段治疗[10, 40]。
因此,对于乳腺、肺双原发癌的治疗,应综合考虑生长部位、肿瘤类型、进展情况及患者的一般情况,若患者身体能耐受,建议同时行乳腺癌和肺癌手术治疗,患者不能完全耐受,可先取病理证实,优先切除恶性程度高、对患者生命威胁大的一方,再根据患者身体情况择期行另一部位手术切除; 患者完全不能耐受,需结合实际情况进行多学科综合诊疗,确定最佳方案。对于乳腺癌首发的异时性乳腺、肺双原发癌患者的治疗,则第二原发肺癌治疗的关键在于其是否能够早期发现并及时制定合理的治疗方案。若患者全身状态能够耐受手术,参照肺癌NCCN指南,均首选根治性手术切除(楔形切除、段及亚段切除、叶切除)肺部病变及清扫或采样相应的淋巴结,若肿瘤已广泛转移或患者全身状态较差,则应考虑姑息手术治疗或非手术疗法为主。此外,放化疗、靶向治疗、免疫治疗及中医治疗等对肿瘤复发均具有一定的抑制作用[41]。值得一提的是在前面提到的肺癌EGFR突变,亚裔人群NSCLC患者EGFR基因突变的阳性率约40%,而我国的肺腺癌EGFR基因突变的阳性率高达50%左右[42-44]。在NSCLC患者中,最常见的EGFR基因突变是外显子19缺失突变19DEL和外显子21点突变(L858R突变),这两种突变都可以激活酪氨酸激酶域,且均与EGFR-TKIs的敏感度有关,肺癌的靶向药物如吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)、达克替尼(Dacomitinib)、阿法替尼(Afatinib)和奥西替尼(Osimertinib)等有很好的疗效[45]。
6 小结与展望
新冠疫情下CT筛查的广泛应用,使许多肺结节被发现,应按照肺结节诊治共识[46]处理,尤其对于已经确诊的乳腺癌及术后患者,当发现肺结节时,首先考虑是肺转移癌还是原发性肺癌、肺良性非肿瘤性疾病,要避免遗漏肺转移癌和原发早期肺癌,也不要过度诊断、过度应用胸腔镜肺结节活检,从而减少患者创伤和经济负担。
乳腺癌首发的乳腺、肺双原发癌的发病与多种因素相关,应做到对疾病的一级预防,即病因预防,如及早戒烟、养成并保持良好的生活习惯; 同时也应加强并重视二级预防,即对于有肿瘤家族病史的患者,更应该意识到体检的重要性,既要做到早发现、早诊断、早治疗,更要注意乳腺癌术后原发性肺癌易因检查不完善而误诊为转移癌,从而延误治疗的最佳时机。当乳腺癌术后患者检查发现肺部结节时,考虑肺部病变可能是转移癌、原发性肺癌或肺良性非肿瘤性疾病,首先应注意患者的年龄、家族肿瘤史、既往有无放疗史及吸烟史等,还要注意肺部病变与原发乳腺癌的位置关系以及结合影像学特点和包括肿瘤标志物在内的实验室检查,这些因素虽然不能确定新发肿瘤是否为原发,但至少在确诊前有一个更好的预测倾向,此外需追踪患者的原发乳腺癌的病理结果(注重TNM分期及Luminal分型),选取合适的手段(气管镜检查、穿刺活检、胸腔镜或纵隔镜手术等)获取肺部病变的标本,注重常规病理与第一原发癌病理对照,如不能加以区分,还应进一步行免疫组织化学染色(基因组比较分析),尤其注重EGFR基因的特殊地位,EGFR基因突变分析不仅能为原发性肺癌的诊断提供可靠的重要信息,同时也为原发性肺癌的治疗提供强有力的依据。原发性肺癌的处理原则及预后与转移癌是截然不同的,一旦确定为原发性肺癌就应积极进行多学科领域共同会诊,及时为患者制订出具体的个体化针对性治疗方案,才能让患者获得最有效的治疗及预后。乳腺癌术后合并原发性肺癌以腺癌为主,提示乳腺癌与原发性肺癌之间存在某种克隆进化的联系,但是具体机制不明,需要进一步进行高通量测序,以寻找到关键分子标志,从而进一步揭示乳腺癌合并原发性肺癌的分子机制。随着对乳腺癌和肺癌双原发癌研究的深入,期待有更明确的诊疗指南,从而制定早期干预策略,提高乳腺癌和肺癌双原发癌患者的生活质量,延长生存期。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:尉建安:数据收集与统计分析、图表制作及论文撰写苏天昊、金龙:参与手术,指导论文撰写及数据分析栗荐、杨思维:数据收集及图表制作魏建:参与手术,随访患者 -
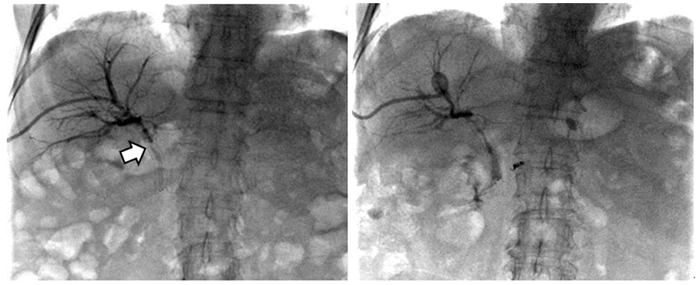
图 1 患者老年女性,胆道恶性肿瘤合并胆道狭窄,支架后再次出现皮肤巩膜黄染,PDT术前胆道造影见支架内充盈缺损(箭头处),对比剂无法顺利通过(左图);PDT治疗1月后再次造影见支架恢复通畅,对比剂可顺利通过并进入肠道内(右图)
Figure 1 An elderly female patient with biliary malignancy complicated with biliary stricture, presented with yellow staining of skin and sclera after stenting. Biliary angiography before photodynamic therapy (PDT) showed a filling defect in the stent (arrow), and the contrast agent could not pass smoothly (left). One month after PDT, the stent was unobstructed again and the contrast agent could pass through and enter the intestine smoothly (right)
-
[1] Xiang S, Lau WY, Chen XP, et al. Hilar cholangiocarcinoma: Controversies on the extent of surgical resection aiming at cure[J]. Int J Colorectal Dis, 2015, 30(2): 159-171. doi: 10.1007/s00384-014-2063-z
[2] Wang HW, Li XJ, Li SJ, et al. Biliary stent combined with iodine-125 seed strand implantation in malignant obstructive jaundice[J]. World J Clin Cases, 2021, 9(4): 801-811. doi: 10.12998/wjcc.v9.i4.801
[3] Zhang X, Mo R, Zhao H, et al. WITHDRAWN: A comparative effectiveness meta-analysis of photodynamic therapy and stent drainage for unresectable cholangiocarcinoma[J]. Photodiagnosis Photodyn Ther, 2018, S1572-1000(18)30085-1. Online ahead of print.
[4] Dolak W, Schwaighofer H, Hellmich B, et al. Photodynamic therapy with polyhematoporphyrin for malignant biliary obstruction: A nationwide retrospective study of 150 consecutive applications[J]. United European Gastroenterol J, 2017, 5(1): 104-110. doi: 10.1177/2050640616654037
[5] 丁瑜, 李伟, 李彬, 等. 光动力疗法与食管支架置入术改善中晚期食管癌所致吞咽困难的对比分析[J]. 中华医学杂志, 2020, 100(5): 378-381. Ding Y, Li W, Li B, et al. Comparison between photodynamic therapy and interventional esophageal stent implantation in dysphagia caused by advanced esophageal cancer[J]. Zhonghua Yi Xue Za Zhi, 2020, 100(5): 378-381.
[6] 陈士明, 娄玥, 方煊, 等. 光动力疗法联合支架引流与单独支架引流治疗不可切除胆管癌疗效的Meta分析[J]. 中华肝胆外科杂志, 2018, 24(9): 616-621. Chen SM, Lou Y, Fang X, et al. Photodynamic therapy plus biliary stenting versus biliary stenting alone to treat nonresectable ductal cholangiocarcinoma: a Meta-analysis[J]. Zhonghua Gan Dan Wai Ke Za Zhi, 2018, 24(9): 616-621.
[7] Moole H, Tathireddy H, Dharmapuri S, et al. Success of photodynamic therapy in palliating patients with nonresectable cholangiocarcinoma: A systematic review and meta-analysis[J]. World J Gastroenterol, 2017, 23(7): 1278-1288. doi: 10.3748/wjg.v23.i7.1278
[8] Blechacz B. Cholangiocarcinoma: Current Knowledge and New Developments[J]. Gut Liver, 2017, 11(1): 13-26. doi: 10.5009/gnl15568
[9] Olek M, Machorowska-Pieniążek A, Olek K, et al. Photodynamic therapy in the treatment of oral squamous cell carcinoma-The state of the art in preclinical research on the animal model[J]. Photodiagnosis Photodyn Ther, 2021, 34: 102236. doi: 10.1016/j.pdpdt.2021.102236
[10] Galiardi-Campoy AEB, Machado FC, Carvalho T, et al. Effects of photodynamic therapy mediated by emodin in cervical carcinoma cells[J]. Photodiagnosis Photodyn Ther, 2021, 35: 102394. doi: 10.1016/j.pdpdt.2021.102394
[11] Floriano BF, Carvalho T, Lopes TZ, et al. Effect of berberine nanoemulsion Photodynamic therapy on cervical carcinoma cell line[J]. Photodiagnosis Photodyn Ther, 2021, 33: 102174. doi: 10.1016/j.pdpdt.2020.102174
[12] Beltrán Hernández I, Yu Y, Ossendorp F, et al. Preclinical and Clinical Evidence of Immune Responses Triggered in Oncologic Photodynamic Therapy: Clinical Recommendations[J]. J Clin Med, 2020, 9(2): 333. doi: 10.3390/jcm9020333
[13] Mohan BP, Chandan S, Khan SR, et al. Photodynamic Therapy (PDT), Radiofrequency Ablation (RFA) With Biliary Stents in Palliative Treatment of Unresectable Extrahepatic Cholangiocarcinoma: A Systematic Review and Meta-analysis[J]. J Clin Gastroenterol, 2022, 56(2): e153-e160. doi: 10.1097/MCG.0000000000001524
[14] Chen P, Yang T, Shi P, et al. Benefits and safety of photodynamic therapy in patients with hilar cholangiocarcinoma: A meta-analysis[J]. Photodiagnosis Photodyn Ther, 2022, 37: 102712. doi: 10.1016/j.pdpdt.2022.102712
[15] Li Z, Jiang X, Xiao H, et al. Long-term results of ERCP- or PTCS-directed photodynamic therapy for unresectable hilar cholangiocarcinoma[J]. Surg Endosc, 2021, 35(10): 5655-5664. doi: 10.1007/s00464-020-08095-1
[16] Tan EK, Taner T, Heimbach JK, et al. Liver Transplantation for Peri-hilar Cholangiocarcinoma[J]. J Gastrointest Surg, 2020, 24(11): 2679-2685. doi: 10.1007/s11605-020-04721-4
[17] Inchingolo R, Acquafredda F, Ferraro V, et al. Non-surgical treatment of hilar cholangiocarcinoma[J]. World J Gastrointest Oncol, 2021, 13(11): 1696-1708. doi: 10.4251/wjgo.v13.i11.1696
[18] Inchingolo R, Acquafredda F, Ferraro V, et al. Non-surgical treatment of hilar cholangiocarcinoma[J]. World J Gastrointest Oncol, 2021, 13(11): 1696-1708. doi: 10.4251/wjgo.v13.i11.1696
[19] Shin DW, Kim MJ, Lee JC, et al. Gemcitabine Plus Cisplatin Chemotherapy Prolongs the Survival in Advanced Hilar Cholangiocarcinoma: A Large Multicenter Study[J]. Am J Clin Oncol, 2020, 43(6): 422-427. doi: 10.1097/COC.0000000000000682
[20] Zeng FL, Chen JF. Application of Immune Checkpoint Inhibitors in the Treatment of Cholangiocarcinoma[J]. Technol Cancer Res Treat, 2021, 20: 15330338211039952.
[21] Gonzalez-Carmona MA, Bolch M, Jansen C, et al. Combined photodynamic therapy with systemic chemotherapy for unresectable cholangiocarcinoma[J]. Aliment Pharmacol Ther, 2019, 49(4): 437-447. doi: 10.1111/apt.15050
[22] 刘朝莲, 吴宏磊, 徐可. 光动力疗法与抗肿瘤免疫治疗在肿瘤治疗中的应用[J]. 中国肿瘤临床, 2021, 48(1): 35-39. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZL202101012.htm Liu CL, WU HL, Xu K. Photodynamic therapy and the application of anti-tumor immunotherapy for tumor treatment[J]. Zhongguo Zhong Liu Lin Chuang, 2021, 48(1): 35-39. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZL202101012.htm
[23] Lobo ACS, Gomes-da-Silva LC, Rodrigues-Santos P, et al. Immune Responses after Vascular Photodynamic Therapy with Redaporfin[J]. J Clin Med, 2019, 9(1): 104. doi: 10.3390/jcm9010104
[24] Luz AFS, Pucelik B, Pereira MM, et al. Translating phototherapeutic indices from in vitro to in vivo photodynamic therapy with bacteriochlorins[J]. Lasers Surg Med, 2018, 50(5): 451-459. doi: 10.1002/lsm.22931
-
期刊类型引用(2)
1. 程轩,孟璠璐,孙海凤,蒋喆,姚俊涛. 合并肺癌的多原发恶性肿瘤70例临床病理特征分析. 现代肿瘤医学. 2022(23): 4365-4369 .  百度学术
百度学术
2. 吕佰瑞,尹培,张晓慧,赵剑平,刘春海,霍红旗. 转录调节因子c-Myb通过炎症因子Ccl2抑制乳腺癌肺转移的实验研究. 现代肿瘤医学. 2021(19): 3347-3350 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: