Clinical Efficiency and Safety of Hypofractionated Thoracic Radiotherapy Combined with EP Chemotherapy on Patients with Limited-stage Small-cell Lung Cancer
-
摘要:目的
探讨大分割放疗模式联合EP方案化疗治疗局限期小细胞肺癌(LS-SCLC)的疗效及安全性。
方法以117例LS-SCLC患者为研究对象,随机分为试验组(59例)和对照组(58例)。试验组患者给予大分割放疗联用EP方案化疗,对照组给予超分割放疗方案联用EP方案化疗。比较两组患者近期客观缓解率(ORR)、2年总生存率(OS)、2年无进展生存期(PFS)和免疫细胞水平;比较两组患者不良反应发生率。
结果治疗后试验组患者近期ORR高于对照组,但差异无统计学意义(P > 0.05);平均OS、PFS显著长于对照组(均P < 0.05);CD3+、CD4+、CD4+/CD8+以及NK细胞水平显著高于对照组,CD8+水平显著低于对照组(P < 0.05);放射性肺炎、放射性食管炎、重度皮炎发生率明显低于对照组(P < 0.05)。
结论大分割放疗联合EP化疗可提高局限期小细胞肺癌疗效,提高患者生存期,降低机体免疫功能损害,减轻放疗不良反应。
Abstract:ObjectiveTo investigate the efficacy and safety of hypofractionated thoracic radiotherapy combined with EP chemotherapy in the treatment of limited-stage small-cell lung cancer (LS-SCLC).
MethodsA total of 117 patients with LS-SCLC were enrolled and randomly divided into test group (n=59) and control group (n=58). Patients in the experiment group were given hypofractionated thoracic radiotherapy combined with EP chemotherapy, while patients in the control group were given hyperfractionation radiotherapy combined with EP chemotherapy. Objective response rate (ORR), 2-year overall survival (OS), 2-year progression free survival (PFS), and immune cell level were used to evaluate clinical efficacy. We compared the incidence of side effects between the two groups.
ResultsAfter the treatment, the ORR of patients in the test group was higher than that in the control group (P > 0.05). The mean OS and PFS of patients in the test group were significantly longer than those in the control group (P < 0.05). The levels of CD3+, CD4+, CD4+/CD8+, and NK cells in the test group were significantly higher, whereas the levels of CD8+ were significantly lower than those in the control group (P < 0.05). The incidence of radiation pneumonitis, radiation esophagitis, and severe dermatitis in the test group was significantly lower than that in the control group (P < 0.05).
ConclusionHypofractionated radiotherapy combined with EP chemotherapy for treatment of LS-SCLC can effectively improve the anticancer efficacy and patient survival, reduce the damage to the body's immune function, and alleviate adverse reaction of radiotherapy.
-
0 引言
小细胞肺癌(SCLC)约占肺癌所有分型的15%[1],其确诊时,约有30%处于局限期[2]。该类型癌症恶性程度高,具有高侵袭性、高致死性、高转移性的特点[3],因对放化疗敏感,故目前局限期小细胞肺癌(limited-stage small-cell lung cancer, LS-SCLC)一线治疗以同步放化疗为主[4]。尽管对于LS-SCLC的治疗已进行了诸多尝试,但该疾病的治愈率仍较低,大多数患者病情最终恶化,发生复发和转移[5-7]。当前新型化疗药物的研发进程缓慢[8],抗体类药物虽有较好的应用前景,但尚未广泛投入临床使用[9],不同分割照射剂量的放射治疗仍存在争议,已逐渐成为局限期小细胞肺癌的研究热点[10]。超分割放射剂量在前期研究中表现出优于常规分割剂量的临床疗效[11],目前大分割疗法研究规模较小,研究设计也存在一定不足,因此本研究根据实际治疗经验,利用大分割放疗模式联合EP方案化疗治疗LS-SCLC,探讨其疗效及安全性。
1 资料与方法
1.1 一般资料
选择2018年7月—2020年6月在安徽医科大学附属安庆第一人民医院肿瘤科接受治疗的117例LS-SCLC患者为试验对象。纳入标准:(1)患者符合《中国原发性肺癌诊疗规范2015》[12]诊断标准,且经病理活检和影像学检查确诊为LS-SCLC,TNM分期为Ⅰ~Ⅲb期;(2)患者年龄为18~70岁;(3)无其他类型癌症、无远端转移;(4)功能状态评分(PS)0~1分。排除标准:(1)患严重心脑血管疾病、免疫疾病或器官衰竭者;(2)精神异常者;(3)不同意治疗方案者。随机分为试验组59例和对照组58例。两组患者一般资料差异均无统计学意义(P > 0.05),具有可比性,见表 1。所有入组患者及家属知晓试验内容,并签署知情同意书。本研究经医院伦理委员会审核通过。
表 1 试验组和对照组患者一般资料对比Table 1 Comparison of general information between test and control groups
1.2 治疗方法
化学疗法:两组均采用EP方案化疗,根据我院实际治疗经验,诱导化疗以21天为1周期,同步放化疗以28天为1周期,放疗结束后序贯化疗,共治疗6周期。依托泊苷(齐鲁制药有限公司,国药准字H32025583,5 ml : 0.1 g)80 mg/(m2·d),d1~d4静脉滴注,顺铂(齐鲁制药有限公司,国药准字H37021357,10 mg)30 mg/(m2·d),d1~d3静脉滴注。
放射疗法:放疗在化疗第3周期d1进行同步治疗,采用调强适形放疗。患者仰卧,上肢交叉抱肘置于前额,真空袋固定,4D-CT定位,增强CT扫描范围:上界环甲软骨,下界肝下缘,层距3 mm。大体肿瘤靶区(GTV)包括肿瘤区(GTV-T)和淋巴结区(GTV-N),GTV-T根据化疗后肿瘤区域勾画,GTV-N根据化疗前所有受累淋巴结区域勾画。临床肿瘤靶区(CTV-T)为GTV-T外扩8 mm,CTV-N为GTV-N外扩5 mm,计划靶区(PTV)为CTV-T/CTV-N外扩5 mm。危及器官:肺V20 < 28%,肺V5 < 60%,脊髓 < 40 Gy,心脏V40 < 30%,平均 < 26 Gy,食管V35 < 50%。试验组采用大分割放射剂量,即55 Gy/22 Fx、1次/天;对照组采用超分割放射剂量,即45 Gy/30 Fx、2次/天,两次照射间隔为8 h。两组均每周照射5 d。
1.3 评估标准
1.3.1 临床疗效
缓解率(ORR):治疗结束后3个月,参照RECIST 1.1标准[13],对患者进行近期疗效评估,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),ORR=CR+PR。
总生存率(OS):从患者治疗结束后至死亡或末次随访的时间,以率(%)表示,定期随访2年,每月电话或复查随访一次,失去联系或放弃本院治疗即视为失访。
无疾病进展生存率(PFS):从患者治疗结束后至病情进展或末次随访的时间,以率(%)表示,定期随访2年,每月电话或复查随访一次,失去联系或放弃本院治疗即视为失访。
免疫功能指标:治疗结束后3个月,检测患者CD3+、CD4+、CD4+/CD8+、CD8+及NK细胞水平,评估治疗对患者免疫系统的影响。
1.3.2 安全性
结束治疗后1周,记录并比较两组患者治疗后出现重度皮炎、骨髓抑制、肝功能受损、放射性肺炎、放射性食管炎等治疗相关不良反应发生情况,以率(%)表示。
1.3.3 随访
所有病例随访截止2022年6月。
1.4 统计学方法
使用SPSS20.0软件进行实验数据分析,计量资料以平均数±标准差(x±s)描述,组间对比采用独立样本t检验;计数资料以率(%)描述,两组对比采用χ2检验;采用Kaplan-Meiers绘制生存曲线,并进行Log rank单因素检验。P < 0.05为差异具有统计学意义。
2 结果
2.1 临床疗效比较
观察组ORR为91.53%,对照组为87.93%,差异无统计学意义(P > 0.05),见表 2。
表 2 两组患者近期疗效比较(n(%))Table 2 Comparison of short-term clinical effect between the two groups (n(%))
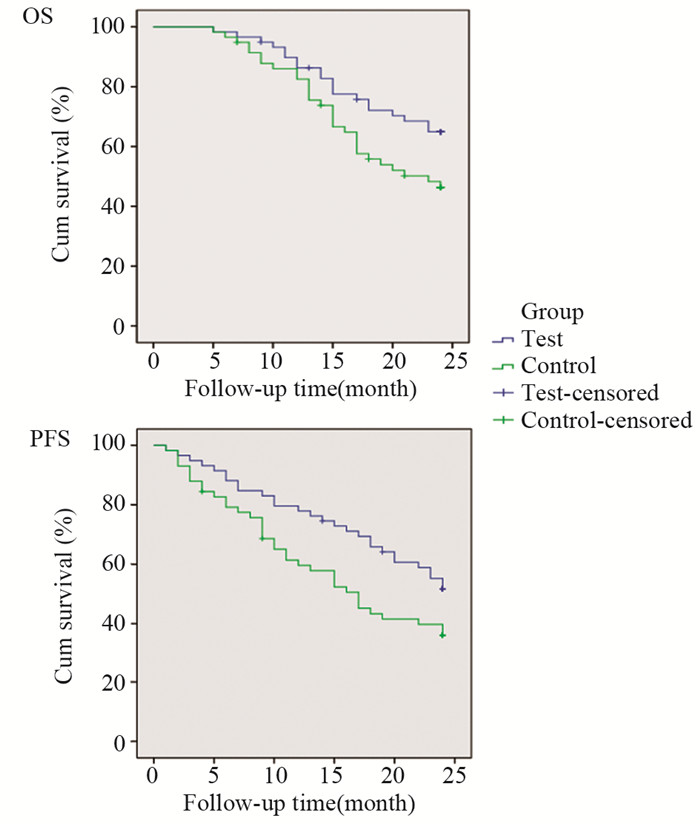
随访从治疗结束后第1个月开始,试验组3例失访,对照组4例失访,失访者OS和PFS按照末次随访时刻计算。因随访结束时仍未达到中位OS和PFS,故采用平均OS和PFS进行比较。试验组和对照组平均OS分别为(20.70±0.703)月和(18.72±0.817)月,两组差异有统计学意义(χ2=4.005, P=0.045);平均PFS分别为(18.821±0.974)月和(15.447±1.109)月,两组差异有统计学意义(χ2=4.047, P=0.044),见图 1。
2.2 免疫功能指标比较
治疗后,两组患者CD3+、CD4+、CD4+/CD8+以及NK细胞水平较治疗前显著增加,而CD8+较治疗前显著降低,差异均具有统计学意义(均P < 0.05);治疗前,两组患者CD3+、CD4+、CD4+/CD8+、CD8+和NK细胞水平无显著差异(P > 0.05);治疗后,试验组患者CD3+、CD4+、CD4+/CD8+以及NK细胞百分率显著高于对照组,而CD8+显著低于对照组,组间比较差异具有统计学意义(P < 0.05),见表 3。
表 3 两组患者治疗前后免疫细胞水平比较Table 3 Comparison of the levels of immune cells between the two groups
2.3 不良反应
试验组放射性食管炎、放射性肺炎和重度皮炎发生率显著低于对照组,差异具有统计学意义(P < 0.05);两组患者肝功能损伤及骨髓抑制发生率差异无统计学意义(P > 0.05),见表 4。
表 4 两组治疗相关不良反应发生率比较(n(%))Table 4 Comparison of treatment-related complication rate between the two groups (n(%))
3 讨论
SCLC生长迅速、侵袭能力强、转移率高,且发病较为隐蔽,直接危害患者生命健康[14-16]。局限期给予及时有效的医疗干预对防止病情恶化意义重大,但整体治疗效果仍然偏低,长期存活率在30%以下,且当前治疗不良反应大,严重影响患者生活质量[16]。因此阻止疾病进展,延长患者预期寿命,减少治疗相关不良反应是该领域的研究热点。目前因LS-SCLC肿瘤病灶对放疗和化疗敏感,故为临床治疗首选方案[17]。就放疗领域而言,不同分割照射剂量仍有较大争议[18]。研究表明[19],超分割剂量相对常规分割模式有更高的临床疗效,但治疗频率高,患者耐受差,不良反应明显,临床应用受到限制。大分割放疗是在超分割基础上提出的新型分割模式,但临床研究规模小、维度少,研究有待优化,本研究在EP方案化疗基础上,采用大分割放疗模式治疗LS-SCLC,探讨其对疗效及安全性的影响。
在既往的二十年中,关于治疗LS-SCLC的放射剂量和频率一直在不断探索。Hasan等[20]研究表明放疗剂量在45 Gy以上有较好疗效。在尤静等[21]研究中,50 Gy/30 F放射剂量表现出最佳疗效。在Zhang[22]和Xia等[23]临床研究中,CTV 55 Gy/22 F的大分割剂量相对于常规分割剂量和超分割剂量均表现出更好的有效性和可接受的毒性。基于“缩短时间跨度,提高分割剂量以改善疗效”的思想,本研究采取55 Gy/22 F,每天一次的大分割方式开展研究。
本研究中,试验组患者2年平均OS、平均PFS均显著高于对照组,患者生存期及无进展生存期显著延长,可能因为放射治疗的效果和放射剂量呈正相关,大分割放疗单次放射剂量大于超分割剂量,可在单位时间内将更大剂量的治疗射线给予靶区照射,获得更高的照射效率,迅速灭活肿瘤细胞,破坏肿瘤血管网,降低其增殖、侵袭能力,减少了癌细胞对免疫细胞的抑制,避免了肿瘤细胞对放射治疗产生抗性,强化了治疗效果;另一方面,超分割单日总照射剂量大,且1日2次对患者进行照射,照射相对频繁,患者常难以耐受。大分割治疗模式间隔时间长,给予正常组织器官和免疫系统较小的恢复压力,相对于超分割模式,对正常组织器官和免疫系统损害更小,对肿瘤细胞死亡后的抗肿瘤免疫反应不良反应小,保证免疫系统对肿瘤的杀伤效果。
本研究中,试验组患者放射性食管炎、放射性肺炎及重度皮炎的发病率显著低于对照组,试验组肝功能受损和骨髓抑制发病率与对照组差异无统计学意义,试验组患者免疫能力显著高于对照组,提示大分割放射剂量安全性高于超分割放射剂量。采用放疗和化疗治疗癌症时,由于药物和射线对正常组织、器官的杀伤作用,因而产生一系列治疗相关不良反应,且不良反应发生情况和剂量呈正相关。大分割放射疗法的照射剂量低于超分割组,对临近靶区的食管、正常肺组织、靶区皮肤和免疫细胞的杀伤作用较小,引发的不良反应相对较小,免疫系统在放化疗结束后恢复较快;虽放疗对肝功能受损和骨髓抑制也有一定影响,但射线照射并非主要因素,化疗所用的顺铂和依托泊苷主导了此类不良反应,故两组差异无统计学意义。
本研究仍存在以下不足:(1)受制于客观因素,本研究并未探讨更长时间的患者治疗效果;(2)本次纳入研究患者的家庭收入情况有所差距,治疗结束后患者在营养、护理、生活等方面客观存在差异,本研究未能排除此影响;(3)本次纳入样本量相对较少,大分割放疗的适用性有待进一步研究。
综上所述,对于LS-SCLC,使用大分割放疗模式联用EP方案化疗可提高抗癌疗效,有效提高患者生存期,降低机体免疫功能损害,同时,在减轻放疗不良反应方面有所提高。
Competing interests: The authors declare that they have no competing interests.作者贡献:何宜生、鲍亮亮:课题设计、资料分析、论文撰写与修改余嘉文、吕杨:数据收集、论文指导 -
表 1 试验组和对照组患者一般资料对比
Table 1 Comparison of general information between test and control groups

表 2 两组患者近期疗效比较(n(%))
Table 2 Comparison of short-term clinical effect between the two groups (n(%))

表 3 两组患者治疗前后免疫细胞水平比较
Table 3 Comparison of the levels of immune cells between the two groups

表 4 两组治疗相关不良反应发生率比较(n(%))
Table 4 Comparison of treatment-related complication rate between the two groups (n(%))

-
[1] 李靖康, 徐爱晖. 1107例肺癌患者临床特征分析[J]. 临床肺科杂志, 2018, 23(5): 905-908. doi: 10.3969/j.issn.1009-6663.2018.05.036 Li JK, Xu AH. An analysis of clinical characteristics of 1107 cases of lung cancer[J]. Lin Chuang Fei Ke Za Zhi, 2018, 23(5): 905-908. doi: 10.3969/j.issn.1009-6663.2018.05.036
[2] Yu H, Zhang J, Zhang Z, et al. One Cycle of Concurrent Chemotherapy vs. Two Cycles of Concurrent Chemotherapy With Radiation Therapy in Patients With Limited-Stage Small Cell Lung Cancer[J]. Front Oncol, 2022, 11: 785022. doi: 10.3389/fonc.2021.785022
[3] Atci MM, Sakin A, Uysal E, et al. Survival and Prognostic Factors in Limited-stage Small-cell Lung Cancer[J]. J Coll Physicians Surg Pak, 2021, 31(12): 1433-1437. doi: 10.29271/jcpsp.2021.12.1433
[4] Wang S, Zimmermann S, Parikh K, et al. Current Diagnosis and Management of Small-Cell Lung Cancer[J]. Mayo Clin Proc, 2019, 94(8): 1599-1622. doi: 10.1016/j.mayocp.2019.01.034
[5] Tomassen ML, Aarts MJ, Peters M, et al. Prophylactic cranial irradiation in patients with small cell lung cancer in The Netherlands: A population-based study[J]. Clin Transl Radiat Oncol, 2021, 27: 157-163. doi: 10.1016/j.ctro.2021.02.001
[6] Feng J, Wang Y, Yao W, et al. Comprehensive analysis of prognostic predictors for patients with limited-stage small-cell lung cancer who underwent resection followed by adjuvant chemotherapy[J]. Ann Transl Med, 2021, 9(14): 1169. doi: 10.21037/atm-21-3353
[7] Higgins KA, Gorgens S, Sudmeier LJ, et al. Recent developments in limited stage small cell lung cancer[J]. Transl Lung Cancer Res, 2019, 8(Suppl 2): S147-S152.
[8] 何娇雪, 乐晓燕. 小细胞肺癌综合治疗的研究进展[J]. 癌症进展, 2020, 18(21): 2169-2172, 2190. https://www.cnki.com.cn/Article/CJFDTOTAL-AZJZ202021003.htm He JX, Le XY. Research progress of comprehensive treatment of small cell lung cancer[J]. Ai Zeng Jin Zhan, 2020, 18(21): 2169-2172, 2190. https://www.cnki.com.cn/Article/CJFDTOTAL-AZJZ202021003.htm
[9] 张惠秋, 李西阳, 李西川, 等. 免疫检查点抑制剂在小细胞肺癌治疗中的应用与临床试验进展[J]. 中国肺癌杂志, 2021, 24(11): 790-795. doi: 10.3779/j.issn.1009-3419.2021.102.41 Zhang HQ, Li XY, Li XC, et al. Clinical trial progress and Application of immune checkpoint inhibitors in the treatment of small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2021, 24 (11): 790-795. doi: 10.3779/j.issn.1009-3419.2021.102.41
[10] 占天佑, 周宗玫. 局限期小细胞肺癌胸部放疗剂量分割现状[J]. 中华放射肿瘤学杂志, 2022, 31(3): 284-287. Zhan TY, Zhou ZM. Thoracic radiotherapy of limited-stage small cell lung cancer: current situation of dose fractionation[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2022, 31(3): 284-287.
[11] Simone CB 2nd, Bogart JA, Cabrera AR, et al. Radiation Therapy for Small Cell Lung Cancer: An ASTRO Clinical Practice Guideline[J]. Pract Radiat Oncol, 2020, 10(3): 158-173. doi: 10.1016/j.prro.2020.02.009
[12] 支修益, 石远凯, 于金明. 中国原发性肺癌诊疗规范(2015年版)[J]. 中华肿瘤杂志, 2015, 37(1): 67-78. https://www.cnki.com.cn/Article/CJFDTOTAL-GWHH201607001.htm Zhi XY, Shi YK, Yu JM. Standards for the diagnosis and treatment of Primary Lung Cancer (2015 version) in China[J]. Zhonghua Zhong Liu Za Zhi, 2015, 37(1): 67-78. https://www.cnki.com.cn/Article/CJFDTOTAL-GWHH201607001.htm
[13] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1. 1)[J]. Eur J Cancer, 2009, 45(2): 228-247. doi: 10.1016/j.ejca.2008.10.026
[14] Tjong MC, Mak DY, Shahi J, et al. Current Management and Progress in Radiotherapy for Small Cell Lung Cancer[J]. Front Oncol, 2020, 10: 1146. doi: 10.3389/fonc.2020.01146
[15] Levy A, Hendriks LEL, Le Péchoux C, et al. Current management of limited-stage SCLC and CONVERT trial impact: Results of the EORTC Lung Cancer Group survey[J]. Lung Cancer, 2019, 136: 145-147. doi: 10.1016/j.lungcan.2019.08.007
[16] 张爽, 程颖. 小细胞肺癌治疗新进展[J]. 中国肿瘤临床, 2021, 48(10): 501-505. doi: 10.3969/j.issn.1000-8179.2021.10.048 Zhang S, Cheng Y. Advances in the treatment of small-cell lung cancer[J]. Zhongguo Zhong Liu Lin Chuang, 2021, 48 (10): 501-505. doi: 10.3969/j.issn.1000-8179.2021.10.048
[17] 刘家兵, 林桂, 倪渊, 等. 基于文献挖掘局限期小细胞肺癌放疗热点的研究[J]. 中华肿瘤防治杂志, 2021, 28(21): 1660-1665. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202121010.htm Liu JB, Lin G, Ni Y, et al. Hot topic analysis of radiotherapy for limited-stage small-cell lung cancer based on text mining[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2021, 28(21): 1660-1665. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202121010.htm
[18] Ciammella P, Timon G, Bruni A, et al. Radiation therapy in small cell lung cancer: a national Italian survey[J]. Radiol Med, 2018, 123(7): 554-560. doi: 10.1007/s11547-018-0868-5
[19] Chen Y, Jin Y, Hu X, et al. Effect of chemoradiotherapy on the proportion of circulating lymphocyte subsets in patients with limited-stage small cell lung cancer[J]. Cancer Immunol Immunother, 2021, 70(10): 2867-2876. doi: 10.1007/s00262-021-02902-x
[20] Hasan S, Renz P, Turrisi A, et al. Dose escalation and associated predictors of survival with consolidative thoracic radiotherapy in extensive stage small cell lung cancer (SCLC): A National Cancer Database (NCDB) propensity-matched analysis[J]. Lung Cancer, 2018, 124: 283-290.
[21] 尤静, 于会明, 宋马小薇, 等. 局限期小细胞肺癌同步推量调强放疗的Ⅰ期/Ⅱ期临床研究[J]. 中国肺癌杂志, 2017, 20(1): 28-34. https://www.cnki.com.cn/Article/CJFDTOTAL-FAIZ201701005.htm You J, Yu HM, Song MXW, et al. A PhaseⅠ/Ⅱ Study of Chemotherapy Concurrent with Twice-daily Radiotherapy Schedules by Intensity Modulated Radiation Therapy Using Simultaneous Integrated Boost for Limited-stage Small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2017, 20(1): 28-34. https://www.cnki.com.cn/Article/CJFDTOTAL-FAIZ201701005.htm
[22] Zhang J, Fan M, Liu D, et al. Hypo- or conventionally fractionated radiotherapy combined with chemotherapy in patients with limited stage small cell lung cancer[J]. Radiat Oncol, 2017, 12(1): 51.
[23] Xia B, Hong LZ, Cai XW, et al. Phase 2 study of accelerated hypofractionated thoracic radiation therapy and concurrent chemotherapy in patients with limited-stage small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2015, 91(3): 517-523.
-
期刊类型引用(1)
1. 柯楠,刘凯,陈娇,李晶. 改良PI-RADS评分联合血清AGR2、sTim-3水平对前列腺癌的诊断价值. 中国性科学. 2025(01): 40-44 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: