OASL Expression in Pancreatic Cancer and Its Effect on Proliferation and Migration of Pancreatic Cancer Cells
-
摘要:目的
探讨OASL的表达对胰腺癌细胞增殖和迁移能力的影响。
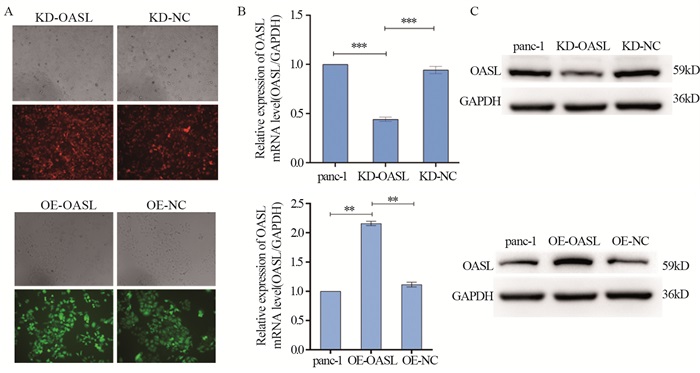
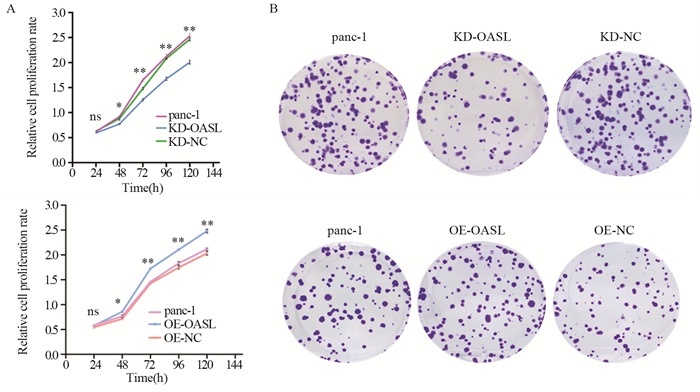
方法GEPIA数据库分析OASL在胰腺癌组织和正常胰腺组织中的表达差异。TIMER数据库分析OASL表达与患者生存期的关系。TCGA数据库分析OASL表达与胰腺癌临床病理参数的相关性。shRNA技术敲减胰腺癌panc-1细胞中OASL基因的表达。慢病毒用于过表达胰腺癌panc-1细胞中OASL基因。MTT实验检测胰腺癌panc-1细胞的增殖能力,划痕实验及Transwell实验检测panc-1细胞的迁移能力,Western blot实验检测与肿瘤增殖、迁移、侵袭相关蛋白的表达。
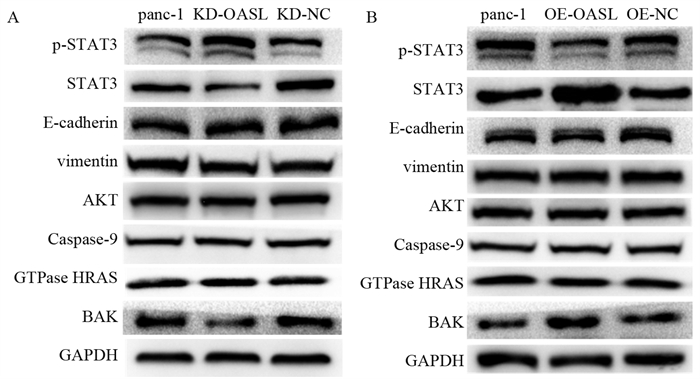
结果胰腺癌组中的OASL表达量显著高于正常胰腺组织(P < 0.05),且胰腺癌患者中OASL高表达患者与低表达患者相比具有较差的总生存期(P < 0.05)。敲减OASL基因后,panc-1细胞的增殖和迁移能力均被抑制,而过表达OASL基因促进了panc-1细胞的增殖和迁移能力。敲减OASL后,p-STAT3蛋白表达增高,STAT3和BAK蛋白表达降低;过表达OASL后,p-STAT3蛋白表达降低,STAT3和BAK蛋白表达增高。
结论OASL可能通过STAT3信号通路影响胰腺癌细胞增殖和迁移能力以及BAK表达来诱导细胞凋亡。
Abstract:ObjectiveTo explore the effect of OASL expression on the proliferation and migration of pancreatic cancer cells.
MethodsThe GEPIA database was used to analyze the differences in OASL expression in pancreatic cancer tissues and normal pancreatic tissues. The TIMER database was used to analyze the relationship between OASL expression and patient survival. The TCGA database was used to analyze the correlation of OASL expression with the clinicopathological parameters of pancreatic cancer. shRNA was used to knock down the expression of OASL gene in pancreatic cancer panc-1 cells. Lentiviruses were used to overexpress the OASL gene in pancreatic cancer cells. MTT assay was used to evaluate their proliferation ability, and scratch and Transwell experiments were used to evaluate their migration ability. Western blot experiments were used to detect changes in proteins related to tumor proliferation, migration, and invasion.
ResultsOASL expression in the pancreatic cancer group was significantly higher than that in normal pancreatic tissue (P < 0.05), and patients with high OASL expression in pancreatic cancer patients had worse OS than patients with low expression (P < 0.05). After OASL gene knockdown, the proliferation and migration abilities of panc-1 cells were inhibited, whereas the overexpression of OASL gene promoted the proliferation and migration ability of panc-1 cells. Western blot experiments showed that after OASL knockdown, p-STAT3 protein expression increased, whereas STAT3 and BAK protein expressions decreased. After OASL overexpression, p-STAT3 protein expression decreased, and STAT3 and BAK protein expression increased.
ConclusionOASL may affect the proliferation and migration of pancreatic cancer cells through the STAT3 signaling pathway while affecting BAK expression to induce cell death.
-
Key words:
- Pancreatic cancer /
- OASL /
- Bioinformatics
-
0 引言
结肠癌是全球最常见的恶性肿瘤之一,手术切除是目前治疗结肠癌的首选方法,但仍有50%~60%的根治性术后患者会出现复发或远处转移[1],预后差,复发率高是结肠癌恶性度高的主要原因。因此寻找结肠癌远期预后的特异性指标显得尤为重要。近年来,错配修复基因(mismatch repair gene, MMR)成为肿瘤研究热点,由于DNA错配修复基因种系突变可导致区域内体细胞突变高累积,故又称为高度微卫星不稳定(MSI-H),目前公认两者等同(下文统称deficient mismatch repair, dMMR)[2]。dMMR在Ⅱ/Ⅲ期结肠癌中被证明具有明显的预后优势,是结肠癌治疗中重要的生物标志物及预后因子[3]。另外中性粒细胞/淋巴细胞比率(neutrophil lymphocyte ratio, NLR)作为全身炎性反应状态的有用指标,被认为可反映促肿瘤炎性反应和抗肿瘤免疫功能之间的平衡,其预后意义已在结肠癌等多种实体瘤中得到广泛证实[4]。研究表明dMMR结肠癌表现出更高水平的肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)及良好的肿瘤微环境,这可能是其预后良好的主要机制[5]。但是鲜有研究在MMR的背景下研究机体全身炎性反应状态,dMMR状态下的局部炎性反应浸润与全身的炎性反应状态的联系尚无确切的定论。因此通过挖掘MMR与NLR的相关性,或许可以进一步阐述dMMR结肠癌的预后机制。
1 资料与方法
1.1 临床资料
回顾性收集2015年4月1日—2017年4月1日期间在福建医科大学附属第二医院和厦门大学附属第一医院接受左/右半结肠癌根治术、术后病理确诊为结肠癌的125名患者资料,其中优先纳入免疫组织化学证实为dMMR状态结肠癌55例,并按标准随机纳入70例错配修复基因正常(proficient mismatch repair, pMMR)状态结肠癌用作对比。纳入标准:(1)结肠癌得到病理证实,术后病理进行错配修复蛋白免疫组织化学分析;(2)术前均完善了血常规、生化、肿瘤标志物检查;(3)术前未接受新辅助放化疗及其他辅助治疗。排除标准:(1)伴有第2种原发性恶性肿瘤;(2)术前明确合并急性、慢性感染或自身免疫性疾病等;(3)随访期间因其他疾病或事件死亡。临床资料包括年龄、性别、肿瘤病理特征(大小、部位、大体类型、组织学类型、分化程度、浸润深度、淋巴结转移、分期)、CEA、乳酸脱氢酶、术前NLR、术后接受化疗情况。本研究均经所有患者知情同意并获得授权签字(伦理号:[2019]福医附二伦理审字第(116号))。
1.2 免疫组织化学结果判定
免疫组织化学法检测肿瘤组织中错配修复基因表达情况。术后病理报告经高年资病理科医师审核确认。错配修复蛋白MLH1、PMS2、MSH2、MSH6中出现1个及以上表达缺失即判定为dMMR状态,未出现错配修复蛋白缺失即判定为pMMR状态。
1.3 NLR值
结肠癌根治术前3天内所有患者静脉采血进行血常规检查。NLR为中性粒细胞绝对值和淋巴细胞绝对值的比值。确保所有患者术前无明显的感染症状。
1.4 观察指标
复发标准为:本院或外院影像学检查(B型超声、CT、MRI、胸片、肠镜等)发现病灶或者直接确诊的病理证据。主要研究指标是无复发生存期(recurrence-free survival, RFS)。
1.5 随访情况
所有患者均通过门诊、电话、微信方式进行随访,随访终点为患者结肠癌复发。数据收集截至2020年4月1日,过程中失访及未复发患者作为结尾数据处理。
1.6 统计学方法
采用SPSS23.0软件作统计学数据分析。ROC曲线确定NLR最佳阈值。计数资料采用卡方检验。Kaplan-Meier法计算不同MMR状态及NLR组别术后无病生存率和累计生存率,Log rank检验比较各组别生存时间的差异。P < 0.05为差异有统计学意义。
2 结果
2.1 结肠癌患者的一般资料
共125例患者纳入研究,其中男性65例,女性60例。中位年龄63岁(33~90岁)。按患者MMR状态分为dMMR组(55例),pMMR组(70例)。
2.2 不同MMR状态组临床病理特征分析
相比pMMR组,dMMR组结肠癌发病年龄较低,肿瘤体积更大,分化程度更低,多发于右半结肠,更多见神经侵犯(均P < 0.05)。在性别、大体类型、组织类型、浸润深度、淋巴结转移、病理分期、CEA、乳酸脱氢酶上两组间差异无统计学意义(均P > 0.05),见表 1。
表 1 结肠癌患者临床资料(n(%))Table 1 Clinical data of colon cancer patients (n(%))
2.3 MMR状态与术前NLR相关性及预后价值分析
根据术前NLR值和患者肿瘤复发情况建立ROC曲线,患者NLR值ROC曲线下面积为0.644。根据兼顾敏感度和特异性的原则,最终确定NLR=3作为截断值,见图 1。将NLR < 3定义为低NLR值,NLR≥3定义为高NLR值。最终结果显示,dMMR组(n=55)中低NLR值40例,高NLR值15例(72.7% vs. 27.3%);pMMR组(n=70)中低NLR值30例,高NLR值40例(42.9% vs. 57.1%)。两组差异有统计学意义(P < 0.05)。
125例患者随访36月。术后根据NCCN指南,共77例患者接受术后辅助化疗,dMMR组36例,pMMR组41例(65.5% vs. 58.6%)(P > 0.05)。随访过程中9例患者未能获得完整的随访资料,将其纳入结尾数据分析。结果3年总复发率31.2%。按MMR状态和NLR高低,将患者分为四组(分别为dMMR并低NLR组,dMMR并高NLR组,pMMR并低NLR组,pMMR并高NLR组),四组患者数量,3年无复发生存率比较,见表 2。组间进行卡方检验,结果显示,四组中,dMMR并低NLR组3年无复发生存率明显较高(P < 0.05)。Kaplan-Meier生存分析,结果见图 2,组间采用Log rank检验,结果见表 3。对比pMMR并高NLR组,dMMR并低NLR组存在明显的生存优势(P < 0.05);而dMMR并高NLR组、pMMR并低NLR组两组接近(P > 0.05)。
表 2 不同MMR状态和NLR水平组的3年无复发生存率情况比较(n(%))Table 2 Comparison of 3-year relapse-free survival rates among groups with different MMR status and NLR level (n(%)) 表 3 不同MMR状态和NLR水平组的Log rank检验结果Table 3 Log rank statistics result of different MMR status and NLR level groups
表 3 不同MMR状态和NLR水平组的Log rank检验结果Table 3 Log rank statistics result of different MMR status and NLR level groups
3 讨论
DNA错配修复基因系统主要包括4个蛋白(MLH1,PMS2,MSH2,MSH6), 出现1个及以上表达缺失即判定为dMMR。在亚洲人群中,dMMR结肠癌占全部结直肠癌的5.5%~7.3%[2, 6]。近年来,许多的研究皆证实了dMMR结肠癌独特的预后优势,一项Meta分析评估了1 277例Ⅰ~Ⅳ期dMMR结肠癌患者,发现无论早期还是进展期疾病,dMMR复发率明显低于pMMR肿瘤,减少死亡风险35%[7]。在对其机制的探索中,研究发现了dMMR结肠癌独特的病理学特征。例如对比pMMR结肠癌,dMMR患者年龄偏低,肿瘤好发于右半结肠,癌灶病理分化程度差,多见黏液分泌[8]。这本应决定较差的预后结果,逆转的关键在于dMMR结肠癌在宿主-肿瘤相互作用上有更明显的肿瘤浸润特征,如淋巴反应,克罗恩样淋巴结节,包括更多的生发中心和上皮内淋巴细胞浸润[9],这决定了良好的肿瘤浸润微环境,患者表现更长的总生存期(overall survival, OS)、无复发生存期(recurrence-free survival, RFS)[10]。中性粒细胞/淋巴细胞比值(NLR)作为一种反映机体炎性反应程度和免疫状态的有用指标,被发现与结直肠癌等肿瘤的复发和预后关系密切[3]。但据我们所知,很少有研究同时考虑肿瘤的局部和全身炎性反应,进一步评估其预后价值。有一项胃癌研究表明肿瘤基质中高密度的CD4+T细胞与低NLR相关,但遗憾的是该研究并没有表明MMR状态[11]。
本研究结果显示,MMR状态与患病年龄、肿瘤发生部位、肿瘤大小、肿瘤分化程度、癌灶神经侵犯相关。相比pMMR组,dMMR组患者患病年龄低,肿瘤多发生于右半结肠,且体积大,肿瘤分化程度低,伴随神经侵犯,这与国内赵喜连等[12]研究结果相同,区别在于本研究未能显示淋巴结转移、肿瘤浸润深度方面的相关性。但不管如何,两者均体现出dMMR结肠癌具有区别于pMMR的临床病理特征,表明对具有该病理特征的结肠癌更应进行MMR检测,以便提高dMMR筛查的敏感度和特异性,对指导患者的治疗具有重要意义。在对不同状态的术前NLR值分析后发现,dMMR与术前NLR明显相关,dMMR组低NLR的患者(72.7%)比例明显高于pMMR组(42.9%)。既往研究发现中性粒细胞衍生的细胞因子和趋化因子有利于肿瘤增殖,局部浸润和血管形成,中性粒细胞增加可加速局部肿瘤的侵袭和远处转移的形成,增加的肿瘤内淋巴细胞浓度可放大至宿主全身性炎性反应,可能与积极的临床结果相关,低NLR明显更有利于肿瘤预后[4, 13]。在本研究中,对MMR和NLR状态分组后进行复发率的随访,我们发现dMMR并低NLR组3年无复发生存率明显高于其他三组,生存分析显示相比pMMR高NLR组具有明显的术后生存优势。这提示dMMR低NLR是结肠癌的良好预后因素。关于dMMR状态和NLR的联系,我们猜测有以下两点:一是低NLR可能是良好肿瘤浸润微环境的全身性体现,两者互为因果,共同提示结肠癌的预后;二是可能存在更复杂的机制同时调控两者状态。这需要未来更多的研究来证实。
MMR状态和NLR对结肠癌的发生、发展具有重要意义,但数据中仍存在许多不足之处需加以解决。首先,目前关于NLR的界值尚没有明确定论,代表全身炎性反应状态的程度没有确切说法,既往研究也都是经验性的指标。根据最近的评论[14],该临界值介于2到5之间,其在不同的研究、不同的种族都可能有所不同,因此关于NLR的临床应用,这可能是一个关键限制。另外,本研究为回顾性研究,术前缺少NLR的基线值,研究群体样本量不足,多数为适合接受手术的非进展期患者,缺乏代表性,且术后随访复查视患者依从性而定,部分患者真实复发时间可能延后于随访所得时间,这些均是造成研究结果偏倚的重要因素;其次,关于全身炎性反应状态的指标有很多,包括C-反应蛋白(CRP)、IL家族细胞因子、预后营养指数(PNI),均有相关的文献支持其在肿瘤中的应用[15],但因为并不作为常规检测,因此并没有被纳入本研究,期待未来开展大型的前瞻性研究进一步弥补这些短板;最后,重要的一点是我们应认识到随着放化疗、靶向治疗、免疫治疗等多种新兴治疗手段的出现,结肠癌的预后模型构建也变得更加的复杂和困难,未来还有很长的路要走,需要我们共同努力。
综上,dMMR结肠癌具有独特的临床病理特征,联合NLR值可用于评估患者术后复发风险。根据其影响,应注意督促患者复查随访,及时采取干预手段,降低结肠癌死亡率,提高患者生存质量。
Competing interests: The authors declare that they have no competing interests.作者贡献:张人丹:实验操作、结果整理及文章撰写赵春艳:课题思路指导姚佳欣、胡先华:实验材料准备母波:论文指导 -
表 1 TCGA中胰腺癌患者OASL表达与临床病理参数的相关性(n(%))
Table 1 Association between OASL expression and clinicopathological parameters in patients with pancreatic cancer in TCGA database (n(%))

-
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. doi: 10.3322/caac.21708
[2] Mizrahi JD, Surana R, Valle JW, et al. Pancreatic cancer[J]. Lancet, 2020, 395(10242): 2008-2020. doi: 10.1016/S0140-6736(20)30974-0
[3] Lv J, Wang L, Shen H, et al. Regulatory roles of OASL in lung cancer cell sensitivity to Actinidia chinensis Planch root extract (acRoots)[J]. Cell Biol Toxicol, 2018, 34(3): 207-218. doi: 10.1007/s10565-018-9422-4
[4] Gu X, Zhou W, Han J. Factors Affecting the Readmission of Patients with Pancreatic Cancer after Surgery[J]. Appl Bionics Biomech, 2022, 2022: 6106914.
[5] Wu C, Li M, Meng H, et al. Analysis of status and countermeasures of cancer incidence and mortality in China[J]. Sci China Life Sci, 2019, 62(5): 640-647. doi: 10.1007/s11427-018-9461-5
[6] Alessandro P, Patrick H, William H, et al. Characteristics of 10-Year Survivors of Pancreatic Ductal Adenocarcinoma[J]. JAMA Surg, 2015, 150(8): 701-710. doi: 10.1001/jamasurg.2015.0668
[7] Kamisawa T, Wood LD, Itoi T, et al. Pancreatic cancer[J]. Lancet, 2016, 388(10039): 73-85. doi: 10.1016/S0140-6736(16)00141-0
[8] Brown ZJ, Cloyd JM. Trends in the utilization of neoadjuvant therapy for pancreatic ductal adenocarcinoma[J]. J Surg Oncol, 2021, 123(6): 1432-1440. doi: 10.1002/jso.26384
[9] Shukla A, Maiti P. Nanomedicine and versatile therapies for cancer treatment[J]. MedComm (2020), 2022, 3(3): e163.
[10] He Q, Yan R, Hou WT, et al. A pH-Responsive Zwitterionic Polyurethane Prodrug as Drug Delivery System for Enhanced Cancer Therapy[J]. Molecules, 2021, 26(17): 5274. doi: 10.3390/molecules26175274
[11] Zhang C, Zou Y, Zhu Y, et al. Three Immune-Related Prognostic mRNAs as Therapeutic Targets for Pancreatic Cancer[J]. Front Med(Lausanne), 2021, 8: 649326.
[12] Sturm N, Ettrich TJ, Perkhofer L. The Impact of Biomarkers in Pancreatic Ductal Adenocarcinoma on Diagnosis, Surveillance and Therapy[J]. Cancers (Basel), 2022, 14(1): 217. doi: 10.3390/cancers14010217
[13] Zheng B, Qu J, Ohuchida K, et al. LAMA4 upregulation is associated with high liver metastasis potential and poor survival outcome of Pancreatic Cancer[J]. Theranostics, 2020, 10(22): 10274-10289. doi: 10.7150/thno.47001
[14] Lundy J, Harris M, Zalcberg J, et al. EUS-FNA Biopsies to Guide Precision Medicine in Pancreatic Cancer: Results of a Pilot Study to Identify KRAS Wild-Type Tumours for Targeted Therapy[J]. Front Oncol, 2021, 11: 770022. doi: 10.3389/fonc.2021.770022
[15] Khan MA, Azim S, Zubair H, et al. Molecular Drivers of Pancreatic Cancer Pathogenesis: Looking Inward to Move Forward[J]. Int J Mol Sci, 2017, 18(4): 779. doi: 10.3390/ijms18040779
[16] Ogawa S, Fukuda A, Matsumoto Y, et al. SETDB1 Inhibits p53-Mediated Apoptosis and Is Required for Formation of Pancreatic Ductal Adenocarcinomas in Mice[J]. Gastroenterology, 2020, 159(2): 682-696. doi: 10.1053/j.gastro.2020.04.047
[17] Wang X, Liao X, Yu T, et al. Analysis of clinical significance and prospective molecular mechanism of main elements of the JAK/STAT pathway in hepatocellular carcinoma[J]. Int J Oncol, 2019, 55(4): 805-822.
[18] Shiah JV, Grandis JR, Johnson DE. Targeting STAT3 with Proteolysis Targeting Chimeras and Next-Generation Antisense Oligonucleotides[J]. Mol Cancer Ther, 2021, 20(2): 219-228. doi: 10.1158/1535-7163.MCT-20-0599
[19] Du YE, Tu G, Yang G, et al. MiR-205/YAPI in Activated Fibroblasts of Breast Tumor Promotes VEGF-independent Angiogenesis through STAT3 Signaling[J]. Theranostics, 2017, 7(16): 3972-3988. doi: 10.7150/thno.18990
[20] Laudisi F, Cherubini E, Monteleone G, et al. STAT3 Interactors as Potential Therapeutic Targets for Cancer Treatment[J]. Int J Mol Sci, 2018, 19(6): 1787. doi: 10.3390/ijms19061787
[21] Zundler S, Neurath MF. Integrating Immunologic Signaling Networks: The JAK/STAT Pathway in Colitis and Colitis-Associated Cancer[J]. Vaccines (Basel), 2016, 4(1): 5. doi: 10.3390/vaccines4010005
[22] Walensky LD. Targeting BAX to drug death directly[J]. Nat Chem Biol, 2019, 15(7): 657-665. doi: 10.1038/s41589-019-0306-6
[23] Zhang G, Ma F, Li L, et al. Palbociclib triggers apoptosis in bladder cancer cells by Cdk2-induced Rad9-mediated reorganization of the Bak. Bcl-xl complex[J]. Biochem Pharmacol, 2019, 163: 133-141. doi: 10.1016/j.bcp.2019.02.017
[24] Xin Z, Wu X, Ji T, et al. Bakuchiol: A newly discovered warrior against organ damage[J]. Pharmacol Res, 2019, 141: 208-213. doi: 10.1016/j.phrs.2019.01.001
[25] Kuriyama S, Tsuji T, Sakuma T, et al. PLEKHN1 promotes apoptosis by enhancing Bax-Bak hetro-oligomerization through interaction with Bid in human colon cancer[J]. Cell Death Discov, 2018, 4: 11.
-
期刊类型引用(0)
其他类型引用(1)



 下载:
下载: