Correlation Between Peripheral Blood Biomarkers and Immune Checkpoint Inhibitors in Treatment of Advanced Esophageal Cancer
-
摘要:目的
探讨外周血标志物对于接受免疫检查点抑制剂(ICIs)治疗的晚期食管癌患者疗效和预后的影响。
方法收集61例满足纳入标准的晚期食管癌患者资料,包括临床指标、外周血标志物,观察其客观缓解率(ORR)和无进展生存期(PFS)。
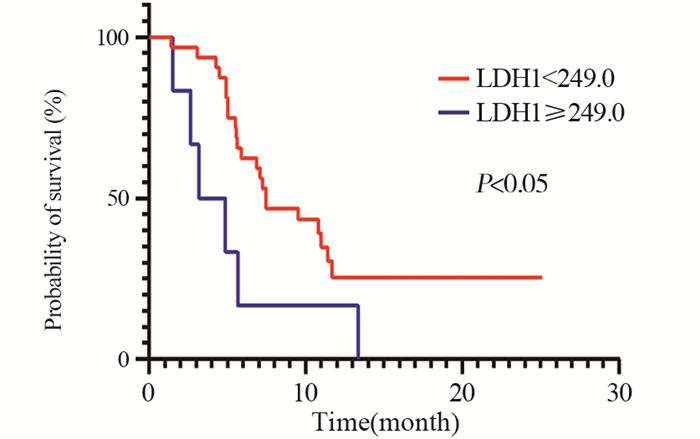
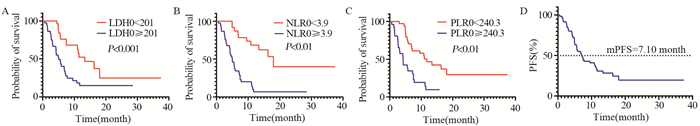
结果纳入患者中位PFS为7.10个月(95%CI: 5.12~9.07)。基线乳酸脱氢酶(LDH) < 201患者的ORR优于LDH≥201患者(P < 0.05)。单因素分析显示基线LDH0 < 201、中性粒细胞淋巴细胞比值(NLR) < 3.9、血小板淋巴细胞比值(PLR) < 240.3及接受ICIs治疗后2周LDH1 < 249.0与PFS明显改善显著相关(P < 0.05)。多因素分析基线NLR0 < 3.9患者的PFS更长(P < 0.05)。
结论LDH0 < 201、NLR0 < 3.9、PLR0 < 240.3、LDH1 < 249.0与接受ICIs治疗晚期食管癌患者的预后呈正相关。
Abstract:ObjectiveTo explore the effect of peripheral blood markers on the efficacy and prognosis of patients with advanced esophageal cancer treated with immune checkpoint inhibitors (ICIs).
MethodsThe case data of 61 patients with advanced esophageal cancer who met the inclusion criteria were collected. Data on clinical indicators and peripheral blood markers as well as objective response rate (ORR) and progression-free-survival (PFS) were obtained.
ResultsThe median PFS of the included patients was 7.10 months (95%CI: 5.12-9.07). The ORR of patients with baseline lactate dehydrogenase (LDH) < 201 was better than that of patients with LDH≥201 (P < 0.05). Univariate analysis showed that baseline LDH0 < 201, neutrophil to lymphocyte ratio (NLR) < 3.9, platelet-to-lymphocyte ratio (PLR) < 240.3, and LDH1 < 249.0 two weeks after ICI treatment were significantly associated with significant improvement in PFS (P < 0.05). In multivariate analysis, patients with NLR0 < 3.9 had longer PFS (P < 0.05).
ConclusionLDH0 < 201, NLR0 < 3.9, PLR0 < 240.3, and LDH1 < 249.0 are positively correlated with the prognosis of patients with advanced esophageal cancer treated with ICIs.
-
Key words:
- Peripheral blood biomarkers /
- Esophageal cancer /
- Immune checkpoint inhibitors /
- Prediction /
- Efficacy
-
0 引言
肺癌是人类最常见的肿瘤之一,2012年肺癌在男性中的发病率为34.2/100 000,女性中的发病率为13.6/100 000[1]。肺癌已成为全球肿瘤相关死亡率最高的肿瘤,五年生存率仅为15%左右[2],其好发年龄为65~70岁,在低龄人群中的发生率低[3]。近来许多研究表明,低龄肺癌人群与高龄肺癌人群在性别比例、吸烟史、病理类型、预后及基因突变情况等方面存在差异。但是也有许多类似研究却得出了相反的结果。因此本综述的目的在于对目前已有的关于低龄肺癌研究进行归纳分析,探讨低龄肺癌患者临床流行病学特征、病理类型、预后及基因突变情况。
本研究检索数据库包括:中国知网、维普数据库、Web of Science和PubMed。检索时间从1990年1月到2016年11月。检索关键词为“肺癌”或者“肺部恶性肿瘤”或者“支气管肿瘤”和“低龄”。文献的语言必须是中文或者英语。纳入文献必须包含低龄肺癌人群的性别比例、病理类型、肿瘤分期,或者基因突变情况。检索出来的文献由两名研究人员独立筛选,最后再将筛选的文献进行综合,存在差异时,由两人商议决定。去除重复,排除缺乏相关完整数据的文献,最后纳入研究文献共48篇。
1 低龄肺癌的流行病学
目前对于低龄肺癌并没有明确定义,其在肺癌人群中的比例也局限于各个研究中,并没有统一的数据。我们通过对1990—2016年期间关于低龄肺癌的研究进行统计分析发现,对于低龄肺癌的年龄界定主要为≤40岁[4-15]、45岁[3, 16-24]或50岁[25-33]这几个年龄段。
以≤40岁来界定低龄肺癌时,低龄肺癌所占比例仅为2.2%~2.7%[5, 9, 10]。其中比例最低的为Maruyama等[11]研究的1.9%。比例最高的为Catania等[8]研究的3.5%。当低龄的界限划为45岁时,低龄肺癌所占比例猛增为7.7%~18.8%[17-19]。其中比例最低的为Hsu等[3]研究的5%。然而将低龄肺癌的年龄界限提高到50岁时,低龄肺癌在肺癌中所占比例为6%~12.5%,与界限为45岁时比较,比例并没有明显升高[26-27, 29-30]。总的来说,>40岁以后肺癌的发生率明显升高。
非小细胞肺癌约占肺癌的86.3%[31]。在针对非小细胞肺癌的研究中,以40、45和50岁为界限的低龄非小细胞肺癌患者占总NSCLC的比例分别为1.2%~2.1%[12-13]、3.2%~6%[22-23]和5.6%[31],也符合所有肺癌在40岁以上突然增加的规律。
2 低龄肺癌的临床特征
2.1 性别比
在所有肺癌患者中男性远多于女性,比例为2.20:1,且近两年有上升趋势[34]。然而在低龄肺癌患者中女性的比例明显升高。在≤40岁的低龄肺癌患者中男性所占比例为43%~60.4%,而相对高龄肺癌患者中男性所占比例为71.8%~75.9%,差异均有统计学意义[8, 10-11]。Ye等[4]研究发现,男女比例在低龄肺癌与高龄肺癌患者中没有统计学差异,但其纳入研究对象仅123例,并且高龄肺癌组男性比例高于低龄组。由于纳入研究对象例数过少,且男女比例不匹配可能导致其研究结果存在偏倚。Hsu等[3]研究发现,当以45岁为分界时,低龄肺癌患者中男性比例为51.2%低于高龄肺癌患者中的61.8%,且差异有统计学意义。在Cornere等[16]研究中,≤45岁肺癌患者中女性比例为67%远高于>45岁的32%,且差异有统计学意义。Gadgeel等[27]研究中,≤50岁肺癌患者中男性比例与>50岁肺癌患者中男性比例比较差异无统计学意义,Inoue等[26]针对手术患者的研究也得到了相似的结论。Prasad等研究也表明男女比例在低龄与高龄肺癌中比较差异并无统计学意义[17-20, 30]。
在针对非小细胞肺癌的研究中,无论将低龄的界限定为40、45还是50岁,都得到了相似的结论:低龄肺癌组中女性所占比例为42%~52.5%,大于高龄肺癌组中女性所占比例的13%~47.2%,且差异有统计学意义。只有Mauri等的研究发现,男女比例在>45岁与≤45岁的肺癌患者中差异无统计学意义,但低龄肺癌组中女性比例为18.3%,仍高于高龄肺癌组的12.5%[22]。这表明随着年龄的增长,肺癌患者中男性比例可能逐渐增加。
2.2 吸烟史
大多数关于肺癌患者吸烟情况的研究发现,低龄肺癌人群的吸烟率要低于高龄肺癌人群。只有一篇将低龄定义为≤45岁和两篇将低龄定义为≤50岁的研究表明低龄肺癌人群与高龄肺癌人群比较吸烟率差异无统计学意义[22, 27-28]。低龄肺癌患者吸烟情况在不同国家的研究中差异很大。其中低龄肺癌患者吸烟率最低的为中国,吸烟率为12.2%~51.3%[4, 6, 18, 35-36],且在≤30岁肺癌人群中,吸烟率仅为12.2%~17.2%[6, 35-36]。在日本低龄肺癌患者吸烟率为47.4%~66%[10, 25-26, 28, 30]。在美国低龄肺癌患者吸烟率为80%~93%[5, 7, 19, 27]。
2.3 家族史
目前对于低龄肺癌肿瘤家族史的研究较少,但是总的来说低龄肺癌的发生可能与肿瘤家族史相关。Abbasowa等[37]研究显示低龄肺癌患者中有肿瘤家族史的占44.8%,有肺癌家族史的占27.6%,在高龄肺癌患者中肿瘤家族史占36%,肺癌家族史占11.3%,且差异均有统计学意义(P值分别为0.028和0.0026)。Jiang等研究显示低龄与高龄肺癌患者有无肺癌家族史差异虽并无统计学意义,但比例却较高,分别为10.5%和8.3%[18]。Ramalingam等的研究也有类似发现,低龄与高龄组有肺癌家族史的分别为9.9%和7%[33]。Bourke等研究显示低龄组(46%)与高龄组(44%)有肿瘤家族史的比例最高,但两者比较差异也无统计学意义[19]。
2.4 组织类型
除了Bryant等的研究[38],其余研究均表明腺癌所占比例在低龄肺癌患者中高于高龄肺癌患者。同时除了Dell’Amore等关于经手术治疗非小细胞肺癌的研究表明低龄肺癌患者与高龄肺癌患者鳞癌比例无明显差异外[32],其余研究均发现鳞癌在低龄肺癌患者中比例低于高龄肺癌组。除了1999年两篇美国的研究发现大细胞癌在肺癌组织类型中排第二位[5, 27],其余美国、日本、意大利和土耳其等国家的研究中,腺癌和鳞癌都在肺癌的病理类型中排前两位[7-8, 11, 19-20, 25-26, 28]。然而在中国的研究中,低龄肺癌患者中肺腺癌占比最大,而小细胞肺癌却超过鳞癌排第二位[6, 18, 36, 39]。
2.5 分期
许多研究表明[3, 5, 7-8, 11, 16, 18-19, 21, 24, 35, 37, 39-41],低龄肺癌患者中早期肺癌所占比例为15%~30%。在Inoue等[26]研究中,低龄肺癌患者组早期肺癌患者比例高达76.4%。而在Mauri等[22]研究中低龄肺癌患者组早期肺癌患者比例仅为1.8%。在以经手术治疗肺癌患者为研究对象的研究中,低龄肺癌组早期肺癌患者所占比例均大于50%[4, 20, 30, 32]。大多数研究表明,低龄肺癌组早期肺癌所占比例低于高龄肺癌组。仅有一篇将低龄定义为 < 45岁和一篇将低龄定义为≤50岁的研究表明,低龄肺癌组早期肺癌比例高于高龄肺癌组[16, 32]。还有两篇研究发现将低龄定义为≤45或50岁时,低龄与高龄肺癌组中早期肺癌比例无差异[3, 30]。
3 低龄肺癌的诊断
许多关于肺癌患者症状的研究发现,咳嗽与胸痛在低龄或者高龄肺癌组中都是最常见的症状,有咳嗽症状的低龄肺癌患者占30%~58%,有胸痛症状的低龄患者占22%~58%[5, 7, 9, 11, 13, 19, 36, 42]。Kuo等研究表明,胸痛在低龄非小细胞肺癌患者中的发生率高于高龄非小细胞肺癌(P=0.04)[13]。Icard等研究表明约33%低龄肺癌患者无症状[9],且Mauri等发现无症状的低龄(≤45岁)非小细胞肺癌患者多于高龄(>45岁)非小细胞肺癌(分别为61.7%和47.6%, P=0.004)[22]。Bourke及Bryant等研究表明,肺癌在低龄(≤45岁)患者中相较于高龄(>45岁)患者更容易延误诊断[19, 38]。对转移情况进行分析发现,低龄与高龄肺癌组并无明显差异,最常见的为肺内、脑、骨和肝转移[6, 15, 35, 42]。但是杨鹭等研究发现在晚期非小细胞肺癌患者中,低龄肺癌较高龄肺癌更容易发生脑转移[24]。
4 低龄肺癌的治疗现状
总的来说,低龄肺癌患者由于全身基础条件较好,其所接受的治疗也更积极一些。除了Jiang等的研究表明低龄肺癌组接受姑息治疗的比例高于高龄肺癌组(分别为15.3%和13.4%)外,其余有关肺癌治疗的研究都表明,低龄肺癌患者所接受的治疗更积极。低龄肺癌患者接受化疗的比例高于高龄肺癌[11, 19, 37],且低龄肺癌患者更多接受联合化疗,而高龄肺癌患者更多接受单药化疗[27, 37]。低龄肺癌患者接受手术治疗的比例也大于高龄肺癌患者[13, 17]。Arnold等研究表明,低龄肺癌患者往往在确诊了以后更早开始治疗[41]。
5 低龄肺癌的预后
关于低龄肺癌与高龄肺癌预后的研究,不同的研究得出的结论并不一致。有两篇关于肺癌的研究显示[18-19],低龄肺癌患者的预后较高龄肺癌患者差;另两篇日本的研究表明低龄肺癌患者预后好于高龄肺癌患者[26, 30];其余研究均表明低龄肺癌与高龄肺癌预后并无差异。而在针对NSCLC的研究中,只有一项改良的队列病例对照研究显示,一期的低龄肺癌较高龄肺癌预后差(分别为59%和67%, P<0.001),其余三期并无差异[38];希腊的一项研究表明低龄与高龄肺癌组预后差异无统计学意义[22];其余研究均表明低龄肺癌组较高龄肺癌组具有更好的预后。但是关于生存率的研究显示,不同的研究得到的结果差异非常大。在大数量人群的研究中低龄肺癌的一年总生存率集中在50%~60%,五年总生存率集中在10%~23%[11, 18, 21, 31]。
6 低龄肺癌的基因突变情况
近几年关于低龄肺癌患者基因突变情况的研究逐渐增多。而且这些研究多针对肺癌驱动基因EGFR和ALK基因。EGFR基因突变与女性、腺癌、非吸烟的相关性较强[43-45]。Hsu等研究表明老年、非吸烟女性患者更有可能产生EGFR基因突变,在所有患者中低龄肺癌组与高龄肺癌组EGFR阳性突变率分别为52.5%和60.6%,而在非吸烟腺癌患者中低龄与高龄肺癌组EGFR阳性突变率分别为56.5%和68.4%[3]。而ALK基因重排往往较EGFR突变发生年龄更小[46-48],有ALK基因重排的患者较EGFR突变患者约年轻11岁[3]。在EGFR突变阴性的腺癌患者中,ALK基因突变率为9.8%,并且低龄肺癌组中比例(14%)高于高龄肺癌组(3.4%)[42]。Catania等研究发现,在低龄肺癌患者中ALK基因的突变率高于EGFR突变[8, 35, 49]。
7 结语
目前对低龄肺癌并没有明确的定义,且低龄与高龄肺癌组在临床流行病学特征、病理类型、预后及基因突变情况等方面的差异没有统一的结论。但是将低龄定义为≤40岁时,所有研究表明肺癌患者中女性比例在低龄肺癌中高于高龄肺癌。低龄肺癌与高龄肺癌组相比,腺癌比例大,吸烟率低有较统一的结论。EGFR突变在女性、非吸烟和腺癌中发生率较高。少量研究发现ALK基因只与年龄相关。而预后情况各研究得出的结论差异较大。未来需要更多的大样本研究来探讨预后及基因突变情况等在低龄肺癌患者中的特征。
Competing interests: The authors declare that they have no competing interests.作者贡献:王培伟:设计研究方案、收集与统计数据、撰写及修改论文翁一鸣:指导研究方案设计崔雪:收集及整理数据彭敏:指导研究方案设计及修改论文 -
表 1 61例晚期食管癌患者临床特征
Table 1 Clinical characteristics of 61 patients with advanced esophageal cancer

表 2 不同生物截断值亚组的短期疗效评价(n(%))
Table 2 Short-term efficacy evaluation in different subgroups (n(%))

表 3 无进展时间的单因素和多因素分析
Table 3 Univariate and multivariate analyses of progression-free survival

-
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Allaire JC, Balk M, Azmi S, et al. Use of PD-1 and PD-L1 inhibitors after first-line therapy in esophageal cancer patients in the US[J]. Curr Med Res Opin, 2021, 37(8): 1403-1407. doi: 10.1080/03007995.2021.1929134
[3] Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40. doi: 10.1016/S0140-6736(21)00797-2
[4] Magbanua MJM, Swigart LB, Wu HT, et al. Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival[J]. Ann Oncol, 2021, 32(2): 229-239. doi: 10.1016/j.annonc.2020.11.007
[5] Bartlett EK, Flynn JR, Panageas KS, et al. High neutrophil-to-lymphocyte ratio (NLR) is associated with treatment failure and death in patients who have melanoma treated with PD-1 inhibitor monotherapy[J]. Cancer, 2020, 126(1): 76-85. doi: 10.1002/cncr.32506
[6] Russo A, Russano M, Franchina T, et al. Neutrophil-to-Lymphocyte Ratio (NLR), Platelet-to-Lymphocyte Ratio (PLR), and Outcomes with Nivolumab in Pretreated Non-Small Cell Lung Cancer (NSCLC): A Large Retrospective Multicenter Study[J]. Adv Ther, 2020, 37(3): 1145-1155. doi: 10.1007/s12325-020-01229-w
[7] 柯萍, 江波, 何文杰, 等. 外周血生物标志物与PD-1/PD-L1抑制剂治疗肺癌疗效的相关性[J]. 肿瘤防治研究, 2021, 48(11): 1006-1011. doi: 10.3971/j.issn.1000-8578.2021.21.0357 Ke P, Jiang B, He WJ, et al. Correlation Between Peripheral Blood Biomarkers and Efficacy of PD-1/PD-L1 Inhibitors Treatment on Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(11): 1006-1011. doi: 10.3971/j.issn.1000-8578.2021.21.0357
[8] Simonaggio A, Elaidi R, Fournier L, et al. Variation in neutrophil to lymphocyte ratio (NLR) as predictor of outcomes in metastatic renal cell carcinoma (mRCC) and non-small cell lung cancer (mNSCLC) patients treated with nivolumab[J]. Cancer Immunol Immunother, 2020, 69(12): 2513-2522. doi: 10.1007/s00262-020-02637-1
[9] Kim H, Kwon HJ, Park SY, et al. Clinicopathological analysis and prognostic significance of programmed cell death-ligand 1 protein and mRNA expression in non-small cell lung cancer[J]. PLoS One, 2018, 13(6): e0198634. doi: 10.1371/journal.pone.0198634
[10] Moretto R, Elliott A, Zhang J, et al. Homologous Recombination Deficiency Alterations in Colorectal Cancer: Clinical, Molecular, and Prognostic Implications[J]. J Natl Cancer Inst, 2022, 114(2): 271-279. doi: 10.1093/jnci/djab169
[11] Diem S, Schmid S, Krapf M, et al. Neutrophil-to-Lymphocyte ratio (NLR) and Platelet-to-Lymphocyte ratio (PLR) as prognostic markers in patients with non-small cell lung cancer (NSCLC) treated with nivolumab[J]. Lung Cancer, 2017, 111: 176-181. doi: 10.1016/j.lungcan.2017.07.024
[12] Murakami Y, Saito H, Shimizu S, et al. Neutrophil-to-Lymphocyte Ratio as a Prognostic Indicator in Patients With Unresectable Gastric Cancer[J]. Anticancer Res, 2019, 39(5): 2583-2589. doi: 10.21873/anticanres.13381
[13] Hernando-Calvo A, García-Alvarez A, Villacampa G, et al. Dynamics of clinical biomarkers as predictors of immunotherapy benefit in metastatic melanoma patients[J]. Clin Transl Oncol, 2021, 23(2): 311-317. doi: 10.1007/s12094-020-02420-9
[14] Pu D, Xu Q, Zhou LY, et al. Inflammation-nutritional markers of peripheral blood could predict survival in advanced non-small-cell lung cancer patients treated with PD-1 inhibitors[J]. Thorac Cancer, 2021, 12(21): 2914-2923. doi: 10.1111/1759-7714.14152
[15] Galdiero MR, Marone G, Mantovani A. Cancer Inflammation and Cytokines[J]. Cold Spring Harb Perspect Biol, 2018, 10(8): a028662. doi: 10.1101/cshperspect.a028662
[16] Teijeira A, Garasa S, Ochoa MC, et al. IL8, Neutrophils, and NETs in a Collusion against Cancer Immunity and Immunotherapy[J]. Clin Cancer Res, 2021, 27(9): 2383-2393. doi: 10.1158/1078-0432.CCR-20-1319
[17] Swierczak A, Mouchemore KA, Hamilton JA, et al. Neutrophils: important contributors to tumor progression and metastasis[J]. Cancer Metastasis Rev, 2015, 34(4): 735-751. doi: 10.1007/s10555-015-9594-9
[18] Hagerling C, Werb Z. Neutrophils: Critical components in experimental animal models of cancer[J]. Semin Immunol, 2016, 28(2): 197-204. doi: 10.1016/j.smim.2016.02.003
[19] Suzuki R, Wei X, Allen PK, et al. Prognostic Significance of Total Lymphocyte Count, Neutrophil-to-lymphocyte Ratio, and Platelet-to-lymphocyte Ratio in Limited-stage Small-cell Lung Cancer[J]. Clin Lung Cancer, 2019, 20(2): 117-123. doi: 10.1016/j.cllc.2018.11.013
[20] Wang H, Zhao J, Zhang M, et al. The combination of plasma fibrinogen and neutrophil lymphocyte ratio (F-NLR) is a predictive factor in patients with resectable non small cell lung cancer[J]. J Cell Physiol, 2018, 233(5): 4216-4224. doi: 10.1002/jcp.26239
[21] Schlesinger M. Role of platelets and platelet receptors in cancer metastasis[J]. J Hematol Oncol, 2018, 11(1): 125.
[22] Palacios-Acedo AL, Mège D, Crescence L, et al. Platelets, Thrombo-Inflammation, and Cancer: Collaborating With the Enemy[J]. Front Immunol, 2019, 10: 1805. doi: 10.3389/fimmu.2019.01805
[23] Manerba M, Di Ianni L, Govoni M, et al. LDH inhibition impacts on heat shock response and induces senescence of hepatocellular carcinoma cells[J]. Eur J Pharm Sci, 2017, 105: 91-98.
[24] Egenvall M, Karlsson E, Nygren-Bonnier M, et al. Associations between a composite score of hemoglobin, CRP and albumin and physical performance in older patients undergoing gastrointestinal cancer surgery[J]. Clin Nutr ESPEN, 2021, 46: 330-335.
[25] Yamamoto T, Kawada K, Hida K, et al. Combination of lymphocyte count and albumin concentration as a new prognostic biomarker for rectal cancer[J]. Sci Rep, 2021, 11(1): 5027.
[26] Ouyang X, Dang Y, Zhang F, et al. Low Serum Albumin Correlates with Poor Survival in Gastric Cancer Patients[J]. Clin Lab, 2018, 64(3): 239-245.



 下载:
下载: