Expression of PD-L1 in Primary Colorectal Cancer and Its Predictive Value for Recurrence After Microwave Ablation of Liver Metastases
-
摘要:目的
探讨程序性死亡配体1(PD-L1)在结直肠癌(CRC)肝转移患者原发灶肿瘤细胞(TC)和肿瘤浸润免疫细胞(TIC)中的表达情况,及其对肝转移微波消融(MWA)术后复发的预测价值。
方法回顾性收集28例CRC肝转移患者原发灶的石蜡包埋标本,采用免疫组织化学法检测其中PD-L1表达水平,分析其与临床特征的关系。Kaplan-Meier法和Log rank检验进行无复发生存(RFS)分析,Cox比例风险回归模型进行影响复发的多因素分析。
结果PD-L1在CRC原发灶TC和TIC中的阳性率分别为14.3%(4/28)和46.4%(13/28)。CRC肝转移患者原发灶TIC的PD-L1表达与肝转移瘤最大径有显著关联(P < 0.05),与肝转移MWA术后更差的RFS相关(P < 0.05)。CRC肝转移患者原发灶TIC的PD-L1表达、肝转移瘤最大径 > 3 cm是影响肝转移MWA术后复发的危险因素(P < 0.05)。
结论CRC肝转移患者原发灶TIC的PD-L1表达可能会增加肝转移MWA术后复发的风险。
Abstract:ObjectiveTo investigate the expression of programmed death ligand 1(PD-L1) in primary tumor cells(TCs) and tumor-infiltrating immune cells(TICs) in patients with liver metastases from colorectal cancer(CRC) and determine its predictive value for recurrence after microwave ablation(MWA) of liver metastases.
MethodsThe paraffin-embedded specimens of 28 patients with CRC liver metastasis were collected retrospectively. The expression of PD-L1 in the primary lesions was detected by immunohistochemistry, and the relationship between PD-L1 and clinical features was analyzed. Recurrence-free survival(RFS) was analyzed by Kaplan-Meier method and Log rank test. Cox proportional hazards regression model was used to analyze the factors influencing recurrence.
ResultsThe positive rates of PD-L1 in TCs and TICs in primary CRC were 14.3%(4/28) and 46.4%(13/28), respectively. PD-L1 expression in primary TICs of CRC patients with liver metastases was significantly correlated with the largest hepatic tumor diameter (P < 0.05). PD-L1 expression in primary TICs of CRC patients with liver metastasis was correlated with poor RFS after MWA (P < 0.05). PD-L1 expression in primary TICs and the largest hepatic tumor diameter > 3 cm in CRC patients with liver metastases were the risk factors for recurrence after MWA (P < 0.05).
ConclusionPD-L1 expression in primary TICs of CRC patients with liver metastasis may increase the risk of recurrence after MWA for liver metastasis.
-
Key words:
- PD-L1 /
- Colorectal cancer /
- Liver metastases /
- Microwave ablation /
- Recurrence
-
0 引言
结直肠癌(colorectal cancer, CRC)发病率和死亡率目前居全球癌症谱第三位和第二位,并呈平行增长势态,加剧了全球疾病负担[1]。其中高达50%患者合并肝转移,且转移灶大多不能一线手术切除[2-3],我国CRC肝转移的主要治疗理念是积极化疗、积极手术,包括新辅助治疗和转化治疗的目的都是获取适宜的手术机会,但化疗药物的毒副作用、耐药性及手术难度大等问题一直困扰着我们[4]。随着肿瘤免疫疗法的不断突破,越来越多的证据表明,局部热消融与免疫检查点阻断治疗相结合的癌症治疗方法前景广阔[5]。程序性死亡配体1(PD-L1)是重要的免疫检查点,PD-L1的抗体阻断可以激活抗肿瘤免疫反应,从而使部分癌症患者获得缓解[6]。微波消融(microwave ablation, MWA)作为一种自身优势明显的热消融方式,近年来在CRC肝转移治疗中演变迅速,尤其对≤3 cm的病灶能提供与手术相仿的效果[7-8]。尽管热消融治疗存在一定优势,但总体而言较高的复发率仍是一个治疗难题[9]。研究显示[10],PD-L1表达与CRC肝转移患者的预后相关,但具体治疗选择的预后价值还需进一步研究。本研究通过检测PD-L1在CRC原发灶中的表达水平,分析其与临床特征的关系,以及对肝转移MWA术后复发的预测价值,为CRC肝转移患者的治疗提供参考。
1 资料与方法
1.1 一般资料
回顾性收集2019年4月—2021年3月于甘肃省人民医院超声科行MWA治疗的CRC肝转移患者28例作为研究对象。其中男20例,女8例;年龄29~72岁,中位年龄58岁;原发灶位置:直肠19例,结肠9例;肝转移出现时间(同时、异时[4]):异时22例,同时6例;肝转移瘤数目:单发15例,多发13例;肝转移瘤最大径:≤3 cm 19例, > 3 cm 9例。纳入标准:(1)术前未接受放疗和化疗;(2)原发病灶行根治性手术切除,术后经病理确诊为CRC;(3)无论同时或异时肝转移都符合《中国结直肠癌肝转移诊断和综合治疗指南(2020版)》,且肝功能Child-Pugh分级为A或B级。排除标准:(1)患有其他肿瘤;(2)临床病理及随访资料不完整者。本研究经甘肃省人民医院伦理委员会批准。
1.2 研究方法
1.2.1 PD-L1蛋白免疫组织化学检测及判读标准
试剂:PD-L1(SP263)抗体试剂及DAB染色液均购自西安元鼎体外诊断试剂有限公司。检测方法:使用CRC石蜡包埋标本,4 μm厚度切片,在罗氏全自动免疫组织化学染色仪上进行染色,步骤严格按照试剂盒说明书执行,染色结束后清洗、封片,显微镜观察。
检测PD-L1在肿瘤细胞(TC)和肿瘤浸润免疫细胞中(TIC)的表达情况,PD-L1蛋白定位于细胞膜和(或)细胞质,当所观察指标部位出现棕黄色颗粒为阳性细胞。分别计算PD-L1染色阳性TC/TIC在整张片的TC/TIC总数中所占的百分比,≥5%定义为阳性表达, < 5%为阴性表达[11]。
1.2.2 CRC肝转移病灶MWA治疗及术后随访
仪器:超声诊断仪LOGIQ E9(美国GE公司),造影剂为声诺维(上海Bracco公司),微波消融仪(南京维京九洲医疗器械研发中心)。本研究病例MWA操作由介入超声科经验丰富的高年资医师完成,常规使用超声定位并引导消融,术后行超声造影,确认病灶是否消融完全,必要时行补充消融。
术后通过电子病例、门诊记录及电话等方式,每3个月对患者复发情况进行随访,并记录患者术后无复发生存期(RFS),末次随访时间为2021年12月31日。复发的定义:增强影像学检查提示靶病灶最大径至少增加20%或出现新病灶。
1.3 统计学方法
采用SPSS25.0软件进行统计学分析。用χ2或Fisher精确检验分析不同PD-L1表达与临床参数的关系,Kaplan-Meier计算累积无复发生存率及绘制曲线,Log rank检验进行不同PD-L1表达的无复发生存分析。Cox回归分析CRC肝转移患者MWA术后复发的独立危险因素。P < 0.05为差异有统计学意义。
2 结果
2.1 PD-L1在CRC原发灶TC和TIC中的表达
CRC肝转移患者原发灶中,PD-L1在TC中的阳性表达为14.3%(4/28),在TIC中为46.4%(13/28),且主要表达在淋巴细胞和巨噬细胞,见图 1。
2.2 不同PD-L1蛋白表达与CRC肝转移患者临床特征的关系
CRC肝转移患者中,原发灶TIC中PD-L1表达在肝转移瘤最大径间差异有统计学意义(P < 0.05),在年龄、性别、原发灶位置、肝转移出现时间、转移瘤数目间差异均无统计学意义(P > 0.05);原发灶TC中的PD-L1表达在年龄、性别、原发灶位置、肝转移出现时间、转移瘤数目、转移瘤最大径间差异均无统计学意义(P > 0.05),见表 1。
表 1 CRC肝转移患者原发灶TC和TIC中PD-L1的表达与临床特征的关系(n=28)Table 1 Relation between PD-L1 expression in TCs and TICs of primary loci and clinical features of patients with CRC liver metastasis (n=28)
2.3 不同PD-L1表达对CRC肝转移患者MWA术后复发的影响
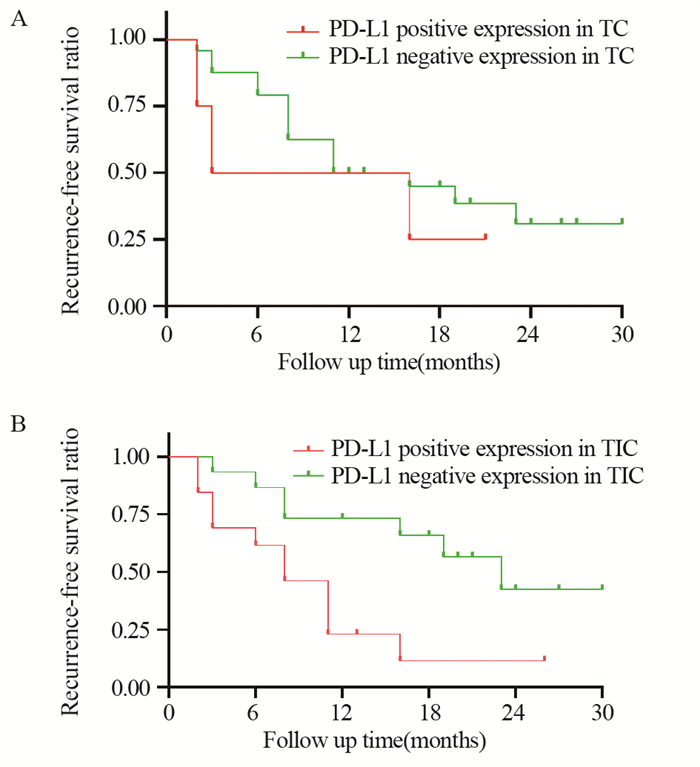
28例患者均得以有效随访,随访时间2~30个月,中位随访12个月,随访过程中18例患者出现消融后复发。CRC原发灶TC中的PD-L1阳性表达患者中位无复发生存时间为10个月,阴性表达患者为12个月,差异无统计学意义(P > 0.05),见图 2A。CRC原发灶TIC中的PD-L1阳性表达患者中位无复发生存时间为8个月,阴性表达患者为18个月,差异有统计学意义(P < 0.05),见图 2B。
2.4 Cox回归分析影响CRC肝转移患者MWA术后复发的危险因素
单因素分析显示,原发灶TIC中PD-L1表达、肝转移瘤最大径均是影响CRC肝转移患者MWA术后复发的危险因素(P < 0.05),多因素分析显示,原发灶TC中PD-L1、原发灶TIC中PD-L1、肝转移瘤最大径均不是MWA术后复发的独立危险因素(P > 0.05),见表 2。
表 2 影响CRC肝转移患者MWA术后复发的多因素分析Table 2 Multivariate analysis of recurrence after MWA in patients with CRC liver
3 讨论
CRC的发生、发展涉及十分复杂的生物学过程,其机制尚未完全明确,研究[12]显示,肿瘤免疫微环境从中扮演着重要角色,在所有阶段都暗示了肿瘤细胞与免疫系统之间复杂而动态的相互作用,预先存在的免疫参数可能与患者的生存相关。PD-1/PD-L1信号通路是肿瘤免疫检查点阻断治疗的热门靶点,CRC肝转移部分患者已从中获益[13]。热消融治疗不仅可以杀死癌细胞,还能诱发特异性抗肿瘤免疫反应,已广泛应用于治疗原发性和转移性肝恶性肿瘤。目前局部热消融联合免疫检查点阻断治疗是一个非常活跃的肿瘤研究领域,意在发挥两者的免疫协同作用,且相继显露出一定的潜力[14]。一项关于CRC肝转移的临床试验表明[15],热消融治疗诱导的免疫反应非常频繁,且单一手段还不足以阻止肿瘤进展。因此,本研究探索PD-L1免疫靶点和局部热消融之间的联系,为今后其在CRC肝转移的临床应用提供更多理论依据。
PD-L1是B7家族共刺激/共抑制分子的成员,可表达于包括肿瘤细胞在内的多种细胞类型,肿瘤细胞表面PD-L1可与效应T细胞上的受体PD-1结合,从而抑制效应T细胞活性,使得肿瘤细胞逃避免疫攻击得以生存发展[16]。目前关于PD-L1的免疫检测结果的判读尚无统一标准。本研究CRC原发灶TC和TIC的PD-L1阳性率与部分相关研究[17-18]结果大致相同,且表现出一定的临床意义。
研究发现[19],CRC中PD-L1的阳性表达与良好的预后相关。但在本研究中CRC肝转移患者TC的PD-L1阳性率仅为14.3%,不仅提示着患者预后不良,而且针对PD-L1靶点的免疫治疗方法将严重受阻。研究显示[18, 20],CRC肝转移灶PD-L1表达水平高于原发灶,肝转移灶的微环境可能存在更强的免疫抑制。本研究由于条件限制,未能检测肝转移灶的PD-L1表达,但发现了原发灶TIC的PD-L1表达与肝转移瘤最大径相关,分析可能是肝转移灶TC和TIC的PD-L1存在较高的表达,使免疫微环境形成了较强的抑制,从而间接影响了肝转移灶的生长状况。CRC原发灶TIC的PD-L1表达可能间接影响肝转移灶的生长状况。
局部热消融术,对于无法获得根治性切除的肝恶性肿瘤已成为安全有效的替代疗法[21],主要包括微波消融(MWA)和射频消融(RFA)。与RFA相比,MWA具有消融面积大、瘤内温度高、手术时间短、“热沉”效应低等优势[22]。超声技术是临床常用的热消融引导方式,Qin等[23]关于超声引导下MWA治疗CRC肝转移经验回顾,总共治疗411个病灶,99.27%的病灶完全消融,表明是一种安全有效的方法。另有研究显示[24],不充分局部热消融会造成残留病灶加速生长及越早复发。肿瘤大小已被证明是影响热消融术后复发的危险因素[25],在本研究同样有所体现,肝转移瘤最大径成为CRC肝转移MWA术后复发的危险因素。尽管我们在MWA术后即可行超声造影确认消融是否完全,但不同术者水平存在差异,尤其对于体径较大的肝转移瘤,很难做到微观意义的完全消融。故CRC肝转移瘤体径较大者若行单一局部MWA治疗,术后存在复发的潜在风险,不足以达到预期的治疗效果。一项生物实验表明[26],在MWA治疗不充分的条件下,通过调节肿瘤免疫微环境,与抗PD-L1阻断抗体相结合带来了明显的免疫协同效应,不仅阻止了局部肿瘤进展,还抑制了现有的转移。本研究中,CRC肝转移MWA术后1年无复发率为53.6%,结果稍低于全球CRC肝转移MWA术后无复发水平[7],但总体而言仍展现出较高复发的弊端,亟需一种策略来改变现状。CRC原发灶TIC的PD-L1表达是影响肝转移灶MWA术后复发的危险因素,以及与患者累积无复发生存时间相关。如此印证了本文前面所述,预先存在的免疫参数可能会影响患者的预后和生存,但CRC原发灶TIC的PD-L1表达和肝转移灶MWA术后复发的相关机制还需要进一步研究。
本研究由于MWA术后中位随访时间较短,仅观察到4例死亡,故未进行患者生存时间分析。且为小样本量的回顾性研究,故仍需更多的研究数据进一步证实。
综合本研究,CRC肝转移患者原发灶TIC的PD-L1表达与肝转移瘤的进展有关,可能增加肝转移MWA术后复发的风险。提示局部热消融联合PD-1/PD-L1免疫检查点抑制治疗的策略可能具有一定的应用价值。因此,可以对CRC肝转移患者将局部热消融与PD-L1的抗体阻断治疗予以合理结合,以期最大限度提高治疗效果,从而改善患者预后。
Competing interests: The authors declare that they have no competing interests.作者贡献:任建伟:收集数据、撰写论文周祖邦、马雯娟:指导论文写作与修改杨大雄、任医群、张芝、牛彦强、曹雷:文献查阅与整理 -
表 1 CRC肝转移患者原发灶TC和TIC中PD-L1的表达与临床特征的关系(n=28)
Table 1 Relation between PD-L1 expression in TCs and TICs of primary loci and clinical features of patients with CRC liver metastasis (n=28)

表 2 影响CRC肝转移患者MWA术后复发的多因素分析
Table 2 Multivariate analysis of recurrence after MWA in patients with CRC liver

-
[1] Sung H, Ferlay J, Siegel R L, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] Siegel RL, Miller KD, Sauer AG, et al. Colorectal cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(3): 145-164. doi: 10.3322/caac.21601
[3] Giannis D, Sideris G, Kakos CD, et al. The role of liver transplantation for colorectal liver metastases: A systematic review and pooled analysis[J]. Transplant Rev (Orlando), 2020, 34(4): 100570. doi: 10.1016/j.trre.2020.100570
[4] 朱德祥, 任黎, 许剑民. 中国结直肠癌肝转移诊断和综合治疗指南(2020版)[J]. 中国实用外科杂志, 2021, 41(1): 1-11. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWK202101001.htm Zhu DX, Ren L, Xu JM. China Guideline for Diagnosis and Comprehensive Treatment of Colorectal Liver Metastases (2020 edition)[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2021, 41(1): 1-11. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWK202101001.htm
[5] Chen XS, Moon JJ, Cheon J. New Opportunities in Cancer Immunotherapy and Theranostics[J]. Acc Chem Res, 2020, 53(12): 2763-2764. doi: 10.1021/acs.accounts.0c00724
[6] Poggio M, Hu T, Pai CC, et al. Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory[J]. Cell, 2019, 177(2): 414-427. doi: 10.1016/j.cell.2019.02.016
[7] Mimmo A, Pegoraro F, Rhaiem R, et al. Microwave Ablation for Colorectal Liver Metastases: A Systematic Review and Pooled Oncological Analyses[J]. Cancers (Basel), 2022, 14(5): 1305. doi: 10.3390/cancers14051305
[8] Petre EN, Sofocleous C. Thermal Ablation in the Management of Colorectal Cancer Patients with Oligometastatic Liver Disease[J]. Visc Med, 2017, 33(1): 62-68. doi: 10.1159/000454697
[9] Altman AM, Coughlan A, Shukla DM, et al. Minimally invasive microwave ablation provides excellent long-term outcomes for otherwise inaccessible hepatocellular cancer[J]. J Surg Oncol, 2020, 121(8): 1218-1224. doi: 10.1002/jso.25924
[10] Takasu C, Yamashita S, Morine Y, et al. The role of the immunoescape in colorectal cancer liver metastasis[J]. PLoS One, 2021, 16(11): e259940.
[11] Long L, Chen M, Yuan Y, et al. High expression of PKM2 synergizes with PD-L1 in tumor cells and immune cells to predict worse survival in human lung adenocarcinoma[J]. J Cancer, 2020, 11(15): 4442-4452. doi: 10.7150/jca.42610
[12] Bruni D, Angell HK, Galon J. The immune contexture and Immunoscore in cancer prognosis and therapeutic efficacy[J]. Nat Rev Cancer, 2020, 20(11): 662-680. doi: 10.1038/s41568-020-0285-7
[13] Yaghoubi N, Soltani A, Ghazvini K, et al. PD-1/PD-L1 blockade as a novel treatment for colorectal cancer[J]. Biomed Pharmacother, 2019, 110: 312-318. doi: 10.1016/j.biopha.2018.11.105
[14] Wang K, Wang C, Jiang H, et al. Combination of Ablation and Immunotherapy for Hepatocellular Carcinoma: Where We Are and Where to Go[J]. Front Immunol, 2021, 12: 792781. doi: 10.3389/fimmu.2021.792781
[15] Loffler MW, Nussbaum B, Jager G, et al. A Non-interventional Clinical Trial Assessing Immune Responses After Radiofrequency Ablation of Liver Metastases From Colorectal Cancer[J]. Front Immunol, 2019, 10: 2526. doi: 10.3389/fimmu.2019.02526
[16] Li P, Huang T, Zou Q, et al. FGFR2 Promotes Expression of PD-L1 in Colorectal Cancer via the JAK/STAT3 Signaling Pathway[J]. J Immunol, 2019, 202(10): 3065-3075. doi: 10.4049/jimmunol.1801199
[17] Chi D, Xu W, Tao X, et al. PD-L1 expression in colorectal cancer and its relationship with TLR-4 expression[J]. J BUON, 2020, 25(3): 1423-1429.
[18] 冯昌银, 郑巧灵, 黄建平, 等. 结直肠癌肿瘤原发灶与肝脏转移灶中PD-L1表达的差异性[J]. 临床与实验病理学杂志, 2018, 34(12): 1340-1344. https://www.cnki.com.cn/Article/CJFDTOTAL-LSBL201812012.htm Feng CY, Zheng QL, Huang JP, et al. Differential expression of PD-L1 between primary and hepatic metastases of colorectal cancer[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2018, 34(12): 1340-1344. https://www.cnki.com.cn/Article/CJFDTOTAL-LSBL201812012.htm
[19] Al-Jussani GN, Alsughayer A, Yousuf MS, et al. The clinicopathological features of programmed death ligand-1 expression in colorectal carcinoma[J]. Int J Biol Markers, 2022, 37(3): 322-327. doi: 10.1177/03936155221104122
[20] Wei XL, Luo X, Sheng H, et al. PD-L1 expression in liver metastasis: its clinical significance and discordance with primary tumor in colorectal cancer[J]. J Transl Med, 2020, 18(1): 475. doi: 10.1186/s12967-020-02636-x
[21] Hartley-Blossom Z, Alam M, Stone J, et al. Microwave Ablation in the Liver: An Update[J]. Surg Technol Int, 2020, 37: 72-78.
[22] Pillai K, Akhter J, Chua TC, et al. Heat sink effect on tumor ablation characteristics as observed in monopolar radiofrequency, bipolar radiofrequency, and microwave, using ex vivo calf liver model[J]. Medicine(Baltimore), 2015, 94(9): e580.
[23] Qin S, Liu G J, Huang M, et al. The local efficacy and influencing factors of ultrasound-guided percutaneous microwave ablation in colorectal liver metastases: a review of a 4-year experience at a single center[J]. Int J Hyperthermia, 2019, 36(1): 36-43. doi: 10.1080/02656736.2018.1528511
[24] Jones EL, Halpern AL, Carmichael H, et al. Hepatic Ablation Promotes Colon Cancer Metastases in an Immunocompetent Murine Model[J]. Ann Surg, 2019, 270(4): 675-680. doi: 10.1097/SLA.0000000000003474
[25] Hermida M, Cassinotto C, Piron L, et al. Multimodal Percutaneous Thermal Ablation of Small Hepatocellular Carcinoma: Predictive Factors of Recurrence and Survival in Western Patients[J]. Cancers (Basel), 2020, 12(2): 313. doi: 10.3390/cancers12020313
[26] Li S, Zhu C, Zhou X, et al. Engineering ROS-Responsive Bioscaffolds for Disrupting Myeloid Cell-Driven Immunosuppressive Niche to Enhance PD-L1 Blockade-Based Postablative Immunotherapy[J]. Adv Sci (Weinh), 2022: e2104619.




 下载:
下载: